染料木素-川芎嗪共晶在Caco-2细胞模型中的转运研究
2024-03-08张雨晴郝星慧刘梦歌赵兴华
张雨晴,郝星慧,王 飞,刘梦歌,赵兴华,何 欣
(河北农业大学动物医学院,河北保定 071000)
染料木素(genistein,GEN)是葛根、山豆根、大豆等植物中存在的一类异黄酮化合物[1],具有抗炎、抗氧化、改善脂肪累积等药理作用。蛋鸡日粮中添加GEN可提高饲料转化率和产蛋量,增强骨密度[2]。GEN还可提高蛋鸡的抗氧化能力和脂肪酸水平,减轻蛋鸡的代谢紊乱和炎症反应[3]。但GEN为生物药剂学分类系统(biopharmaceutics classification system,BCS)Ⅱ类药物,具有较低的溶解度(约0.81 μg/mL)和生物利用度[4-5],提高其溶解度意义重大。共晶是药物活性分子(active pharmaceutical ingredients,API)和共晶形成物(cocrystal formers,CCF)通过分子间氢键、离子键、π-π共轭和范德华力等非共价键的作用结合而成的超分子复合物[6]。可在不改变药物活性成分的情况下,通过调整药物晶格与晶胞中的原子排列方式,能有效提高溶解度、渗透性和生物利用度[7]。但共晶是以“API和CCF的物理混合物”发挥药理作用,还是以“基于弱作用力的新物质”来发挥药理作用尚不明确。本文建立Caco-2细胞模型,研究GEN、TMP、GEN-TMP及GEN和TMP的物理混合物(GEN+TMP)的转运特征,旨在从药物转运角度揭示共晶发挥药理作用的机制,为进一步了解共晶药物的转运特点提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞株 Caco-2细胞(15~20代)购自武汉普诺赛生物科技有限公司。
1.1.2 试验用药 GEN(纯度≥98%),西安瑞林生物科技有限公司产品;TMP(纯度≥98%),西安艾诺医药科技有限责任产品;染料木素标准品(纯度≥99.5%)、荧光素钠和盐酸维拉帕米(Ver),北京食品药品检定研究院产品;川芎嗪标准品(纯度≥98%),北京索莱宝科技有限公司产品;罗丹明123,Sigma公司产品;KO143,上海阿拉丁生化科技股份有限公司产品;MK571,上海陶术生物科技有限公司产品;MEM(含非必需氨基酸)完全培养基,武汉普诺赛生物科技有限公司产品。
1.1.3 主要仪器 TD-3700型X射线衍射仪,丹东通达科技有限公司产品;Q2000差式扫描量热仪,美国TA公司产品;二氧化碳细胞培养箱,美国赛默飞世尔公司产品;TH4-200倒置显微镜,日本奥林巴斯株式会社产品;SW-0J-2FD超净工作台,苏州安泰空气技术有限公司产品;EVOM2跨膜细胞电阻仪,美国密理博公司产品;K3多功能酶标仪,赛默飞世尔实验器材上海有限公司产品;高效液相色谱仪、检测器、色谱柱(SunFire C18,4.6 mm×250 mm,5 μm)均为Waters公司产品。
1.2 方法
1.2.1 共晶的制备与表征
1.2.1.1 共晶的制备 采用本实验室报道的方法制备染料木素-川芎嗪共晶[8]。精密称取染料木素99.207 mg(0.367 mmol)、川芎嗪50 mg(0.367 mmol)于聚碳酸酯塑料管中,加入1 mL乙醇,搅拌24 h后过滤,烘干,制得样品过100目筛。
1.2.1.2 粉末X射线衍射测定 测定条件:电压40 KV,电流40 mA,步长0.02°,测试速度0.1 s/step,铜靶,入射线波长0.15418 nm,扫描范围为5~35°。
1.2.1.3 差示量热扫描 将3~5 mg 样品置于DSC标准铝盘密封,铝盘盖扎孔,测定温度范围:自室温升温至400℃,升温速度为10 K/min,升温时使用氮气保护,氮气流速为50 mL/min。
1.2.2 高效液相色谱方法的建立 流动相为甲醇∶水=70∶30(v/v),GEN和TMP检测波长分别为261 nm和295 nm,进样量为20 μL,流速为1.0 mL/min,柱温为37℃。
1.2.2.1 标准曲线的建立 精密称取GEN和TMP标准品各5 mg,用色谱级甲醇溶解并定容,分别配制成含1 mg/mL GEN和TMP的标准母液。精密量取标准母液适量,用色谱级甲醇稀释得到浓度为0.05、0.1、0.2、0.4、0.625、1.25、2.5 μg/mL的溶液。0.22 μm的有机过滤器过滤后,两组储备液分别进入高效液相色谱(HPLC)系统进行测定。以浓度为横坐标,峰面积为纵坐标绘制GEN和TMP的标准曲线。
1.2.2.2 回收率与精密度试验 配制低、中、高(0.1、0.625、2.5 μg/mL)浓度的标准品溶液,1 d内进样6次,每个浓度连续6 d进样,考察日内和日间精密度RSD值。取对应浓度的GEN和TMP溶液进行测定,计算回收率。
1.2.3 Caco-2细胞模型的建立 将细胞以5×104个/mL的密度接种于12孔Transwell聚碳酸酯膜细胞培养板中。小室顶端侧(apical side,AP)加入0.5 mL细胞悬液,基底侧(basolateral ,BL)加入1.5 mL MEM(含NEAA)完全培养基,于37℃恒温培养箱中培养。前14 d隔天换液,后7 d 每天换液直至21 d。
1.2.3.1 细胞形态的检查 定期用倒置显微镜观察细胞形态及状态并适时拍照,记录细胞生长情况。
1.2.3.2 细胞完整性考察 用跨膜电阻仪于培养第3、5、7、11、14、17、21天测定Transwell板中各孔Caco-2细胞单层电阻值,每孔平行测量3次,记录并计算细胞层的跨膜电阻值[9]。
TEER(Ω·cm2)=(ΔΩ测定-ΔΩ空白)×A(cm2)
(1)
公式(1)中 (ΔΩ测定)是接种细胞孔的电阻值,(ΔΩ空白)是无细胞孔的电阻值,A是小室膜面积(1.12 cm2)。
1.2.3.3 标志物渗漏检查 将荧光素钠标准品粉末溶于HBSS液中,得到浓度为100 μg/mL的母液。将其稀释为0、0.125、0.25、0.5、1、2.5、5、10、20 μg/mL的荧光素钠储备溶液。于490 nm处测定各浓度吸光度(OD)值,以浓度(mg/mL)为横坐标,OD值为纵坐标,绘制荧光素钠的标准曲线。
培养板顶端侧加入20 μg/mL的HBSS配制的荧光素钠溶液0.5 mL[10],基底侧加入1.5 mL空白HBSS液,置于CO2细胞培养箱中培养,分别于30、60、90、120 min在BL侧收集样品200 μL,同时补充同体积空白HBSS液。用多功能酶标仪于490 nm处检测待测液OD值,代入标准曲线计算浓度,计算表观渗透率系数值(Papp)[11]。
(2)
其中Q是累积转运量,即接收侧的药物总量(μg);dQ/dt是单位时间内药物通过Caco-2细胞单层的转运量(μg/s);A为小室膜面积(cm2)(1.12 cm2);C0为顶端侧药物初始浓度(μg/mL)。
1.2.3.4 功能性验证 配制浓度为20 μmol/L的罗丹明123标准品母液溶液[16],将其稀释成梯度浓度的储备液,以浓度(mg/mL)为横坐标,OD值为纵坐标,绘制罗丹明123的标准曲线。
取培养成功的细胞板分别进行AP→BL与BL→AP的双向转运试验,定期于接收侧收集样品,测定OD值,代入罗丹明123的标准曲线,计算Papp与外排率(ER)[12],每孔重复3次。
ER=Papp(BL→AP)/Papp(AP→BL)
(3)
1.2.4 细胞毒试验
1.2.4.1 CCK-8法测定染料木素的安全浓度 将浓度为1×105个/mL的细胞悬液接种于96孔培养板中,另加入100 μL质量浓度分别为10、20、30、40、50、60 μg /mL的GEN溶液,孵育24 h,用PBS缓冲液清洗细胞,每孔加入10 μL CCK-8溶液。避光孵育2 h后,用酶标仪于450 nm处测定吸光度(OD),计算不同药物浓度下的细胞存活率(%)[13]。
细胞存活率(%)=(OD试验孔-OD空白孔/OD对照孔-OD空白孔)×100%
(4)
1.2.4.2 川芎嗪、物理混合物与共晶药物的细胞存活率的测定 按照1.2.4.1项下确定的GEN的安全浓度,根据GEN与TMP形成共晶的摩尔比(1∶1)进行计算,确定TMP的浓度,其中PM与GEN-TMP药物浓度均一致,用“1.2.4.1”方法进行试验,计算在此浓度下3组药物的细胞存活率。
1.2.5 药物跨膜转运试验
1.2.5.1 药物的配制 精密称取GEN、TMP、GEN-TMP共晶和GEN+TMP(其中GEN和TMP均保持相同浓度),用细胞级DMSO完全溶解后,以HBSS液将母液稀释至“1.2.4.2”中的安全浓度,得到4组药物储备液,其中DMSO均不超过体系的0.1%。
1.2.5.2 药物的双向转运试验 取验证建立成功后的细胞培养板,在AP侧向BL侧的转运试验中,AP侧加药物储备液0.5 mL,BL侧加空白HBSS液1.5 mL;在BL侧向AP侧的转运试验中,BL侧加药物储备液1.5 mL,AP侧加空白HBSS液0.5 mL。置于37℃细胞培养箱中,分别于30、45、60、90、120 min于接收侧收集样品200 μL,并补充等体积的HBSS液,每个药物和转运方向平行3孔。取出的样品用封口膜封口,置-20℃冰箱冷冻保存,待测。
1.2.5.3 不同外排抑制剂对药物转运的影响 取验证成功的细胞培养板,上、下层分别加入提前配制好的MK-571、KO-143和Ver 3种外排蛋白抑制剂药物溶液,对细胞单层进行1 h的预处理。在双向转运的30、45、60、90、120 min时间点收集空白侧转运液,同时补充同体积预热至37℃的HBSS溶液,样品使用HPLC进行含量测定,计算Papp和ER值,每个待测物重复3孔。
2 结果
2.1 共晶的固态表征
2.1.1 粉末X射线衍射检测结果 GEN、TMP、混悬法制得的样品、GEN+TMP以及文献中GEN-TMP共晶的粉末X射线衍射图谱见图1。GEN+TMP的X射线衍射(XRD)图中既有GEN的晶体衍射特征峰,也有TMP的晶体特征峰。制备的样品与文献中GEN-TMP共晶的XRD的特征峰相一致[8],表明成功制备了GEN-TMP共晶。
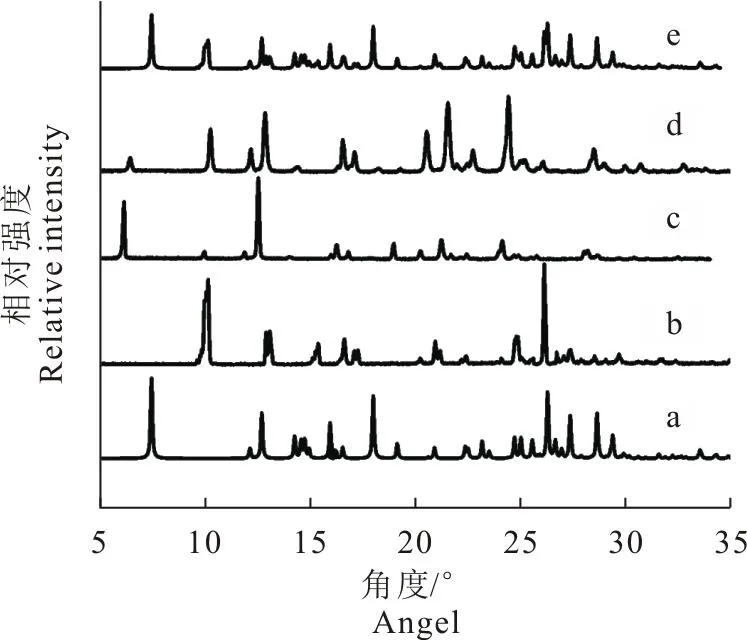
图1 GEN (a),TMP (b),文献中GEN-TMP 共晶 (c),制备的样品 (d)和GEN+TMP (e)的X射线衍射图
2.1.2 差示量热扫描结果 制备的共晶曲线第1个吸热峰在201℃,为该共晶的熔点峰,第2个吸热峰304℃,为共晶到达熔点分解后TMP升华,剩下的GEN的熔点峰,与文献报道一致[8],结合PXRD结果表明成功制备了GEN-TMP共晶(图2)。
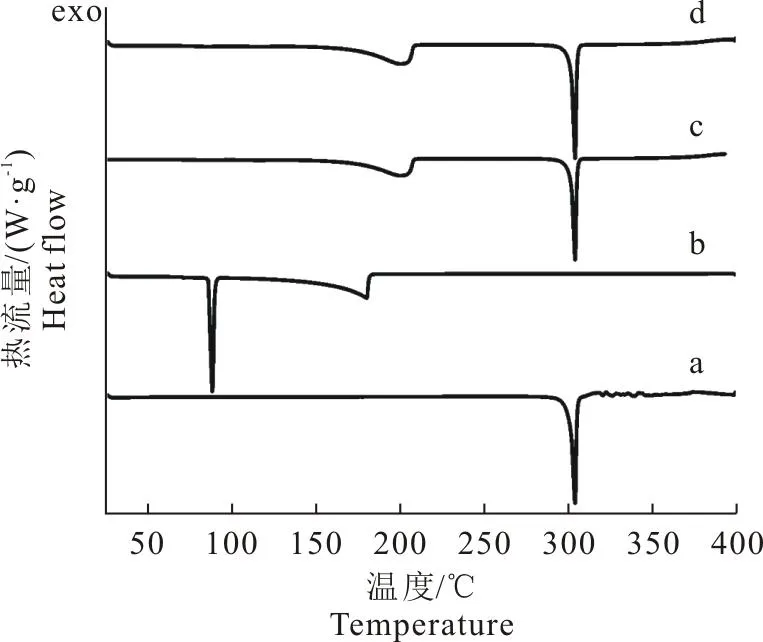
图2 GEN (a),TMP (b),文献中GEN-TMP共晶 (c),制备的样品 (d)的DSC图

图3 Transwell培养板上的Caco-2细胞形态图
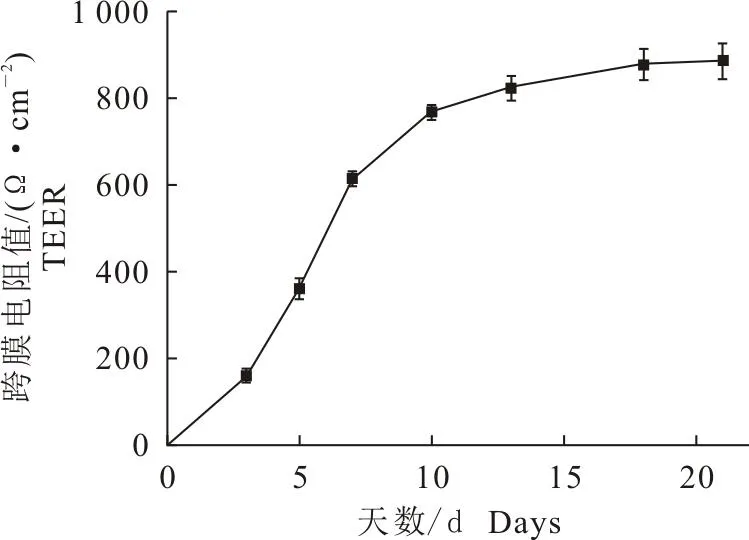
图4 Caco-2细胞不同时间点TEER值的变化图
2.2 标准曲线和方法学验证
用高效液相色谱分别对GEN和TMP的待测液进行进样测定,GEN标准品在6.334 min左右出现样品峰,TMP在4.736 min左右出现样品峰。GEN的回归方程y=90 391.652x+1 306.872,R2=0.999 3;TMP回归方程y=57 230.546x+148.086,R2=0.999 97。表明GEN和TMP均在0.025~2.5 μg/mL内线性关系良好。
染料木素的低、中、高3个浓度的日内精密度RSD值分别为1.62%、1.57%和0.86%,日间精密度的RSD值分别为1.05%、1.78%和1.13%;川芎嗪的日内精密度RSD值分别为1.56%、1.93%和1.72%,日间精密度的RSD值分别为1.00%、0.65%和1.49%,均小于2%。染料木素和川芎嗪的加样回收率均在95%~105%之间。
2.3 Caco-2细胞模型的建立与验证
2.3.1 细胞形态学观察 在细胞模型21 d的培养过程中,细胞逐渐达到融合,形成的细胞层致密且均匀,边界清晰,状态良好,呈铺路石状。
2.3.2 跨膜电阻值的测定 细胞单层的跨膜电阻值稳定增长,接种后3~7 d内TEER值迅速增加,7~13 d时TEER值增长速度减缓,13 d后趋于稳定,21 d时TEER值大约为820 Ω·cm2,此时细胞层变得逐渐致密,形成微绒毛,TEER也达到平台期,可开始进行转运试验。
2.3.3 标志物渗漏检查 细胞渗漏检查的标志性药物荧光素钠的验证结果见表1。随着转运时间的延长,荧光素钠的Papp值不断增加,转运2 h时的Papp值为(0.463±0.079)×10-6cm/s,表明Caco-2单层细胞紧密性良好。

表1 荧光素钠透过细胞模型的表观渗透系数
2.3.4 功能性药物验证 罗丹明123跨细胞转运试验结果见表2,经计算外排标志性药物罗丹明123的ER值为4.81。当ER值>2时,细胞单层的外排功能良好[14],可用于后续试验。

表2 罗丹明123透过细胞模型的转运参数
2.4 药物的安全浓度
在6个不同浓度下细胞存活率分别为(103.18±3.61)%、(100.42±0.52)%、(99.55±1.06)%、(90.06±5.18)%、(85.6±3.11)%和(78.39±7.03)%。随着药物浓度的增加,细胞存活率逐渐降低,细胞增殖被抑制(图5)。当染料木素质量浓度在10~50 μg/mL时,细胞存活率均在80%以上,为安全浓度范围[15]。后续试验选取GEN浓度为40 μg/mL,TMP浓度参照共晶的摩尔比计算,TMP的试验浓度为20 μg/mL。试验浓度下细胞存活率结果见图6,TMP、GEN-TMP和GEN+TMP的细胞存活率分别为(84.21±8.29)%、(89.37±3.09)%、(97.60±4.06)%,均高于80%。

图5 不同浓度下染料木素对Caco-2细胞存活率的影响
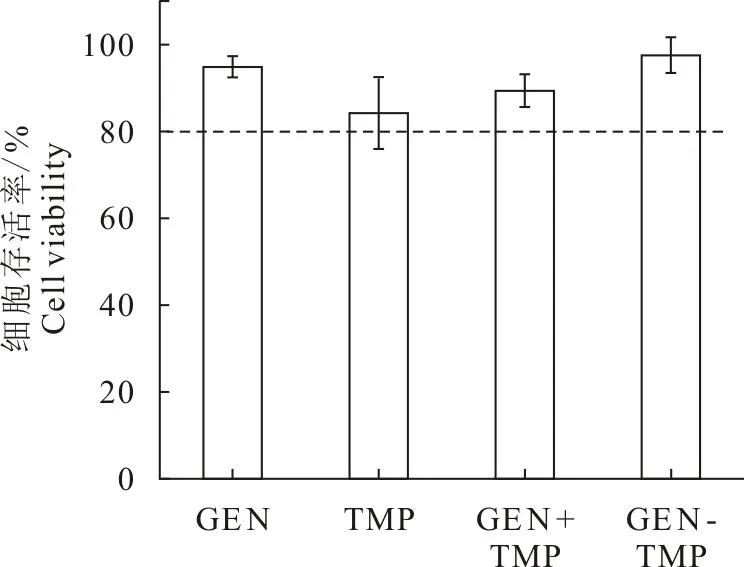
图6 川芎嗪、物理混合物及共晶药物对Caco-2细胞存活率的影响(n=6)
2.5 药物的跨膜转运试验结果
2.5.1 药物的双向转运试验 GEN、TMP、GEN-TMP和GEN+TMP中的药物在Caco-2单层细胞模型上的转运时间越长,药物的累积转运量和Papp数值越高。转运120 min时,GEN、GEN-TMP和GEN+TMP中GEN的累积转运量分别为(1.92±0.15)μg、(2.78±0.11)μg和(1.84±0.05)μg;Papp值分别(5.96±0.47)×10-6cm/s、(8.61±0.33)×10-6cm/s和(5.71±0.15)×10-6cm/s,共晶药物的Papp值显著高于GEN和GEN+TMP中的GEN(P<0.01);ER值分别为1.17、0.99和1.09(表3、图7~图8)。转运120 min时,TMP以及GEN-TMP、GEN+TMP中TMP的累积转运量分别为(3.01±0.04)μg、(3.15±0.14)μg和(2.53±0.18)μg;Papp值分别(18.55±0.23)×10-6cm/s、(19.46±0.89)×10-6cm/s和(15.60±1.12)×10-6cm/s;ER值分别为1.04、0.96和1.06。
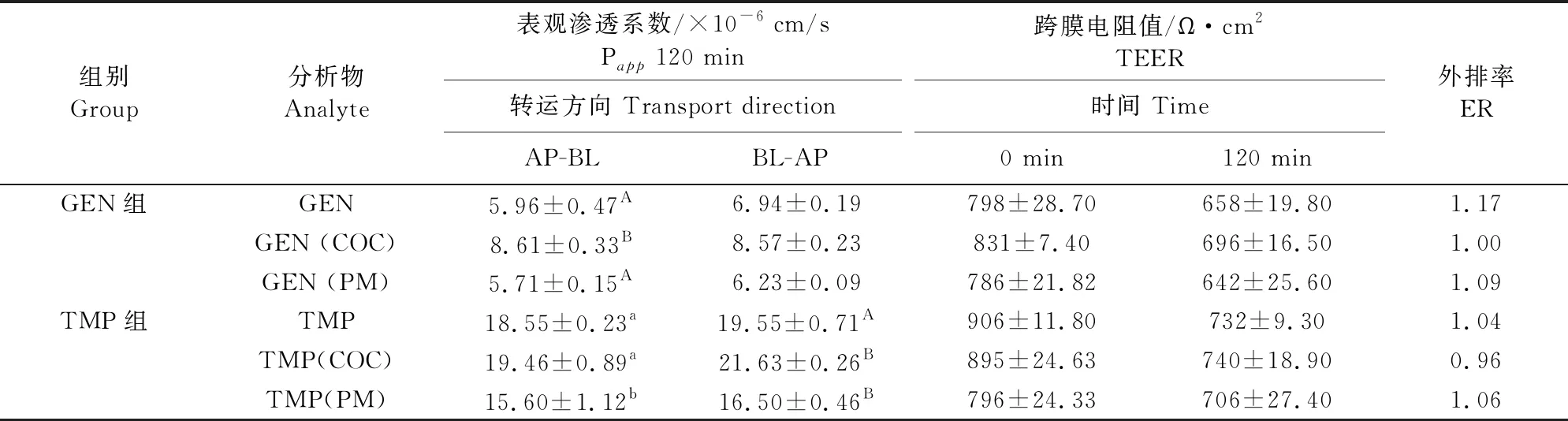
表3 Caco-2细胞模型上药物的转运结果
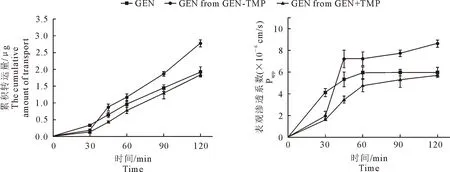
图7 原料药、物理混合物与共晶药物中染料木素的表观渗透系数与累积转运量
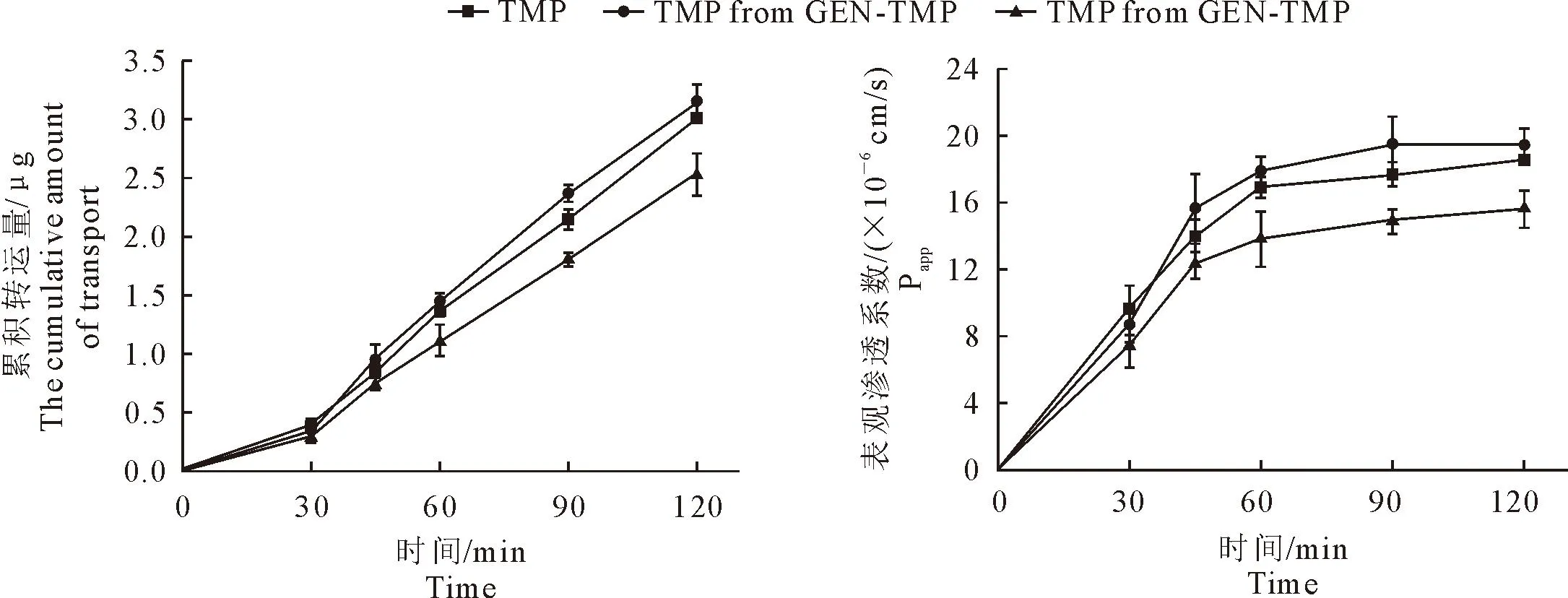
图8 原料药、物理混合物与共晶药物中川芎嗪的表观渗透系数与累积转运量
2.5.2 不同外排抑制剂对药物转运的影响 GEN与GEN+TMP中GEN在BCRP抑制剂KO143作用于细胞单层后ER值由1.17和1.09分别降为0.81和0.88,外排作用减弱,显示其受到BCRP抑制剂的影响,表明GEN与GEN+TMP中GEN均为BCRP的底物;加入P-gp抑制剂Ver与MRP2抑制剂MK-571后,其Papp值与ER值均无显著变化,显示外排作用不变,提示GEN与GEN+TMP中GEN不是P-gp与MRP2的底物。GEN-TMP中GEN在加入Ver和KO143后ER值均由1.00降低为0.73和0.86,其外排功能受到抑制,表明制备成共晶后GEN是P-gp和BCRP的底物;加入MK-571后,受外排作用无显著变化,因此不是MRP2的底物。当MK-571作用于细胞单层后,TMP、GEN-TMP和GEN+TMP中TMP的Papp值增大,ER值显著降低,分别由1.04、0.96和1.06降低至0.86、0.88和0.57,显示出均受MRP2的外排作用;当Ver和KO-143作用于细胞单层后ER值无显著变化,表明其在转运过程中可能不是P-gp和BCRP的底物。
3 讨论
通过模拟小肠的体外模型预测肠道吸收是药物开发过程中进行早期选择的工具[16]。Caco-2细胞单层模型是一个基于细胞培养的兼具简单性和相关性的体外模型,被广泛用来模拟药物在小肠上皮的吸收[17]。巴戟天中的有效成分水晶兰苷、去乙酰车叶草苷酸和耐斯糖在Caco-2单层模型中的吸收特性研究结果显示[18],在转运过程中的90 min时测定的Papp均大于1×10-6cm/s,表示其吸收情况均良好;设置了低、中、高3组药物浓度进行转运,3组活性成分药物低质量浓度的Papp数值均高于中和高组的,证明了巴戟天中3个特征性成分在跨膜转运过程中均以被动转运为主,且3个成分都存在自身质量浓度抑制现象。Caco-2模型的建立需进行单层完整性和外排功能性的验证。当TEER值>500 Ω/cm2时细胞单层紧密性良好[19];荧光素钠的Papp小于0.5×10-6cm/s,同时 Papp处于10-6cm/s 的数量级时细胞模型的完整性良好[10];罗丹明123的ER值大于2时,细胞单层有明显的外排现象,说明其外排功能性良好[14],可用于后续转运试验。本试验经过21 d的细胞培养,建立了TEER值约为820 Ω·cm2、荧光素钠的Papp值为(0.463±0.079)×10-6cm/s、罗丹明123的ER值为4.81的兼具完整性和良好功能性的细胞模型,表明可以将此Caco-2细胞单层模型用于体外药物在肠道的吸收、代谢及转运等评价。
药物通过肠上皮细胞的运输可能通过4种不同途径中的一种或多种进行,即被动扩散、载体介导的主动运输的跨细胞膜转运、细胞旁转运以及胞吞作用[20]。药物进入肠道上皮细胞后,会被P-gp、MRP2和BCRP等外排蛋白排出体外,从而限制了药物经肠道吸收,降低了其生物利用度[21]。如果能在研发早期了解化合物的肠道吸收机制,可以提高研发效率和节约成本[22]。制备ADD和硬脂酸共晶[23],通过建立Caco-2细胞单层模型验证了硬脂酸可以作为P-gp抑制剂从而抑制P-gp介导的转运来增加ADD的渗透性。本实验室制备的染料木素-川芎嗪共晶提高了GEN的体外溶出度与大鼠体内生物利用度,提高了TMP的稳定性,但其肠道吸收机制尚不阐明[8]。本研究采用细胞培养技术,建立了单层完整且功能性良好的Caco-2细胞模型。双向转运试验显示,GEN和TMP均是吸收程度良好的药物,其运输方式主要是被动扩散;GEN是BCRP的底物,TMP是MRP2的底物,以上结果均与文献报道一致[24]。制备成共晶后GEN的累积转运量和Papp分别GEN提高了44.79%和44.46%,提高了GEN的转运量和吸收程度,与文献中共晶药物提高了其在大鼠体内的口服生物利用度的结果一致[8]。
共晶可在不改变API药理作用的前提下提高其溶解度、稳定性和生物利用度等,从而提高药效[25]。美国食品与药品管理局(FDA)和欧洲药品管理局(EMA)对共晶应该定义为物理混合物还是新的化学实体有不同的立场[26],但有文献表明共晶会表现出与物理混合物不同的生物学行为[27]。制备3种吲哚美辛共晶(CCF分别为2-羟基-4-甲基吡啶、2-甲氧基-5-硝基苯胺和糖精),比较吲哚美辛、3种共晶以及3种物理混合物在NCM460细胞的渗透能力,结果显示,吲哚美辛-2-羟基-4-甲基吡啶的Papp值提高为API的2倍[28];吲哚美辛-糖精的物理混合物使细胞单层TEER值急剧下降,而共晶对细胞单层完整性无影响,显示出不同共晶和其物理混合物对细胞单层的渗透能力和细胞屏障破坏能力存有差异,证明了共晶及其物理混合物对生物系统的不同影响。制备以10种羧酸为CCF的氧化白藜芦醇共晶,用Caco-2细胞单层模型研究共晶及其物理混合物的渗透性[29]。其中氧化白藜芦醇-柠檬酸共晶中氧化白藜芦醇的Papp值为(3.68±0.21)×10-6cm/s显著大于PM的(0.30±0.01)×10-6cm/s,提高了渗透性从而使氧化白藜芦醇的口服生物利用度也得到提高。本研究结果显示,GEN-TMP中的GEN的累积转运量比GEN+TMP中的GEN提高了50.34%,Papp提高了50.79%,表明共晶的形成促进了GEN的吸收,且吸收程度强于物理混合物;GEN-TMP受到P-gp和BCRP两种外排蛋白的外排作用,而GEN+TMP中GEN只受BCRP的外排作用,表明共晶形成后在一定程度上改变了GEN 的转运机制。
本研究建立了完整性和功能性良好的Caco-2细胞模型,从细胞水平研究了染料木素、川芎嗪、二者制备的共晶药物和物理混合物的转运特点,证实该共晶可增强染料木素的吸收能力,并证实该共晶的转运机制不同于物理混合物,为共晶的转运特点研究提供了参考。
