β2-肾上腺素能受体与神经丝在山羊脾中的分布和共定位研究
2024-03-08李晓萌窦体馨李志伟叶守冲杨松桦徐永平武永杰
李晓萌,窦体馨,李志伟,叶守冲,杨松桦,徐永平,武永杰
(西北农林科技大学动物医学院,陕西杨凌 712100)
淋巴器官中脾、胸腺和淋巴结中均存在神经纤维。在大鼠去神经支配脾内淋巴细胞丝/苏氨酸(ERK)表达变化研究中,建立去神经支配脾的大鼠模型,研究大鼠脾在无交感神经支配下脾内淋巴细胞ERK的变化,发现在去除交感神经支配后,脾中淋巴细胞增殖活动明显减弱,证实神经与免疫联系密切[1]。神经系统与免疫系统的相互调控关系是神经免疫学的研究热点,神经系统通过内分泌系统实现间接调控免疫系统,还能通过神经纤维实现免疫调控功能。肾上腺素(adrenaline,AD)是哺乳动物肾上腺髓质所分泌的重要激素,参与细胞的各种调控,肾上腺素能受体是G蛋白偶联受体的一种,通过G蛋白实现对细胞新陈代谢及功能调控[2]。激素与G蛋白相偶联后,通过环磷酸腺苷(cAMP)信号通路介导细胞外信号传递至细胞内,实现对细胞的调节。肾上腺素能受体还有α和β受体,α受体亚型为α1和α2,β受体亚型为β1、β2、β3。α受体分布在大脑皮质、海马以及泌尿生殖器官中。β受体在机体的广泛部位所分布,其中β1受体在心脏富集,其占总β肾上腺素能受体的75%~80%,而肺、肝、肾、脾、外周血管和子宫等部位存在着大量的β2受体。
神经丝是由4个亚基单位所组成的杂聚物,根据分子质量的不同可分为轻链神经丝、中间神经丝、重链神经丝和外周蛋白。神经丝可作为多种淋巴器官中神经纤维的标识物,可以跨越多种物种,如人和大鼠[3]。本文用免疫组织化学染色研究β2-AR(β2-adrenergic receptor,β2-AR)与神经丝(neurofilaments,NFs)在山羊脾中表达分布和形态,用免疫荧光双重标记染色技术研究β2-AR与NFs山羊脾中的分布特点及共定位,以探讨神经纤维作用于脾淋巴细胞的机制,为阐明神经免疫调控提供形态学基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 健康成年山羊6只,雌、雄各半,均购自杨凌某羊场,依照动物福利在实验室饲养至少1周后开展试验。
1.1.2 主要试剂 β2-AR多克隆抗体、NF多克隆抗体,美国Invitrogen公司产品;驴抗小鼠IgG H&L(FITC)、驴抗兔IgG H&L(TRITC)预吸附二抗,美国Abcam公司产品;即用型快捷免疫组化MaxVisionTMHRP试剂盒(兔、鼠)和粉剂型抗原修复液,福州迈新生物技术开发公司产品;DAB(四盐酸3,3-二氨基联苯胺)显色试剂盒,武汉博士德生物公司产品;免疫染色一抗和二抗稀释液、DAPI,上海碧云天生物技术公司产品;30%过氧化氢,广州光华科技有限公司产品;TritonX-100,北京Solarbio公司产品;驴血清封闭液,美国Jackson公司产品;DAKO抗荧光淬灭封片剂,美国DAKO公司产品。
1.1.3 主要仪器 CM2235轮转式切片机、CM-1905型冰冻切片机,德国Leica公司产品; 0.5 μL-1000 μL微量加样器,德国Eppendorf公司产品;正置显微镜、激光共聚焦显微镜,日本尼康公司产品。
1.2 方法
对6只山羊肌肉注射0.2 mL/kg陆眠宁Ⅱ,待其完全麻醉后,仰卧固定于手术台上,放血处死,迅速取出脾,用生理盐水冲洗后放置于4%多聚甲醛液中固定24 h,用于免疫组织化学SP法染色和免疫荧光染色。
1.2.1 免疫组化SP法染色 将固定好的脾流水冲洗12 h,取出后依次经过梯度酒精脱水、二甲苯透明、浸蜡、包埋等常规操作处理后,制片,切片厚度为6 μm。切片分6套,第1套进行β2-AR免疫组织化学SP法染色:切片脱蜡复水。柠檬酸盐抗原热修复8 min,修复之后冷却至室温。3%H2O2过氧化物酶清除10 min,0.3% TritonX-100室温孵育10 min。驴血清封闭液室温孵育40 min,之后滴加兔抗β2-AR多克隆抗体(1∶100稀释),4℃过夜,滴加二抗即用型快捷免疫组化试剂盒(兔)孵育30 min、每步完成之后均用0.01 mol/L PBS漂洗3次,每次5 min,将驴血清轻轻甩去。DAB显色,显微镜下观察控制显色反应时间,蒸馏水终止反应;苏木精复染、梯度酒精脱水、透明和封片。第2套SP法染色后未经苏木精复染。第3套为阴性对照,用0.01 mol/L PBS替代兔抗β2-AR抗体,其他步骤同SP法染色。第4套切片用于NF免疫组织化学SP法染色:除一抗和二抗不同,其余步骤同第1套切片,一抗用鼠抗NF多克隆抗体(1∶100稀释),二抗用即用型快捷免疫组化试剂盒(鼠)。第5套切片未苏木精复染,其余步骤同第4套。第6套切片为阴性对照,用0.01 mol/L PBS替代鼠抗NF抗体,其他步骤同第4套切片。
1.2.2 免疫荧光染色 将固定好的脾组织流水冲洗12 h,取出后依次经过15%和30%的蔗糖溶液脱水。冰冻切片机进行包埋与切片:冰冻切片机使用之前预冷,待箱体和冻头温度降低至-20℃时可用,将脱水后组织修剪成合适大小后,直立放置于冻头上,快速滴加冰冻切片包埋剂,待包埋剂将整块组织块覆盖后,将冻头放入箱体,待覆盖有组织块的包埋剂呈固体后,进行冰冻切片,切片厚度10 μm。切片分2套。第1套切片进行免疫荧光染色:冰冻切片抗原修复液进行抗原修复,室温孵育5 min,3 mL/L TritonX-100室温孵育10 min,每步完成之后均用0.01 mol/L PBS漂洗3次,每次5 min。非免疫驴血清封闭1 h,甩去血清后,滴加混合一抗(β2-肾上腺素受体多克隆抗体、神经丝多克隆抗体,单个抗体工作浓度为1∶200),4℃过夜。复温15 min后,用0.01 mol/L PBS漂洗3次,每次5 min,滴加混合二抗(单个抗体工作浓度1∶200)孵育2 h,滴加荧光二抗之后的步骤在避光条件下完成。0.01 mol/L PBS漂洗3次,每次5 min,滴加浓度为4 μg/mL的DAPI的染色液,孵育10 min。用0.01 mol/L PBS漂洗3次,每次5 min,抗荧光淬灭封片剂封片。第2套切片0.01 mol/L PBS代替混合一抗,其余步骤与第1套切片同。
1.2.3 图像分析 将同批次染色的切片置于显微镜下观察,相同条件下显微拍照。图像用IamgeJ分析标注。进行图像半定量分析,检测每张图片的平均光密度值(average optical density,AOD),计算总AOD平均值。通过软件GraphPad Prism对数据差异分析和作图,P<0.05为差异显著,P<0.01表示差异极显著。经过荧光染色的切片在激光共聚焦显微镜下观察并拍照,用NIS-Elements Analysis软件进行分析。
2 结果
2.1 山羊脾β2-AR免疫组织化学SP法染色结果
脾中不同部位染色强度不一对照组切片(图1E)可见脾组织中无β2-AR免疫反应产物,细胞核为蓝色。试验组切片(图1A、图1B、图1C)组织内可见棕褐色、棕黄色或淡黄色的β2-AR免疫反应产物。如在白髓(图1B),细胞核呈现蓝色,表明β2-AR的免疫反应产物主要分布在细胞膜,呈点状或者圆形状分布(图1)。胞核为阴性,SP免疫组织化学染色没有非特异性着色。试验组SP染色结果显示,β2-AR免疫阳性产物在山羊脾中分布广泛,白髓、边缘区、红髓、小梁和血管等结构均呈不同程度着色。其中在含淋巴细胞的白髓中β2-AR免疫组化显色最强,为棕褐色,胞核为空泡,为阴性无着色(图1D)。苏木精复染之后(图1A、图1B、图1C),可见蓝色细胞核。在平滑肌组成的小梁(图1A)、血管(图1B)(中央动脉)、在含血红髓(图1A)和边缘区(图1C)中β2-AR中有棕黄色阳性颗粒分布。免疫组化AOD统计分析,脾中两两组织间比较发现,白髓中免疫组化染色阳性相对表达量极显著高于红髓(P<0.01),极极显著高于边缘区和被膜(P<0.001);红髓中免疫组化染色阳性相对表达量极显著高于边缘区和被膜(P<0.01)。
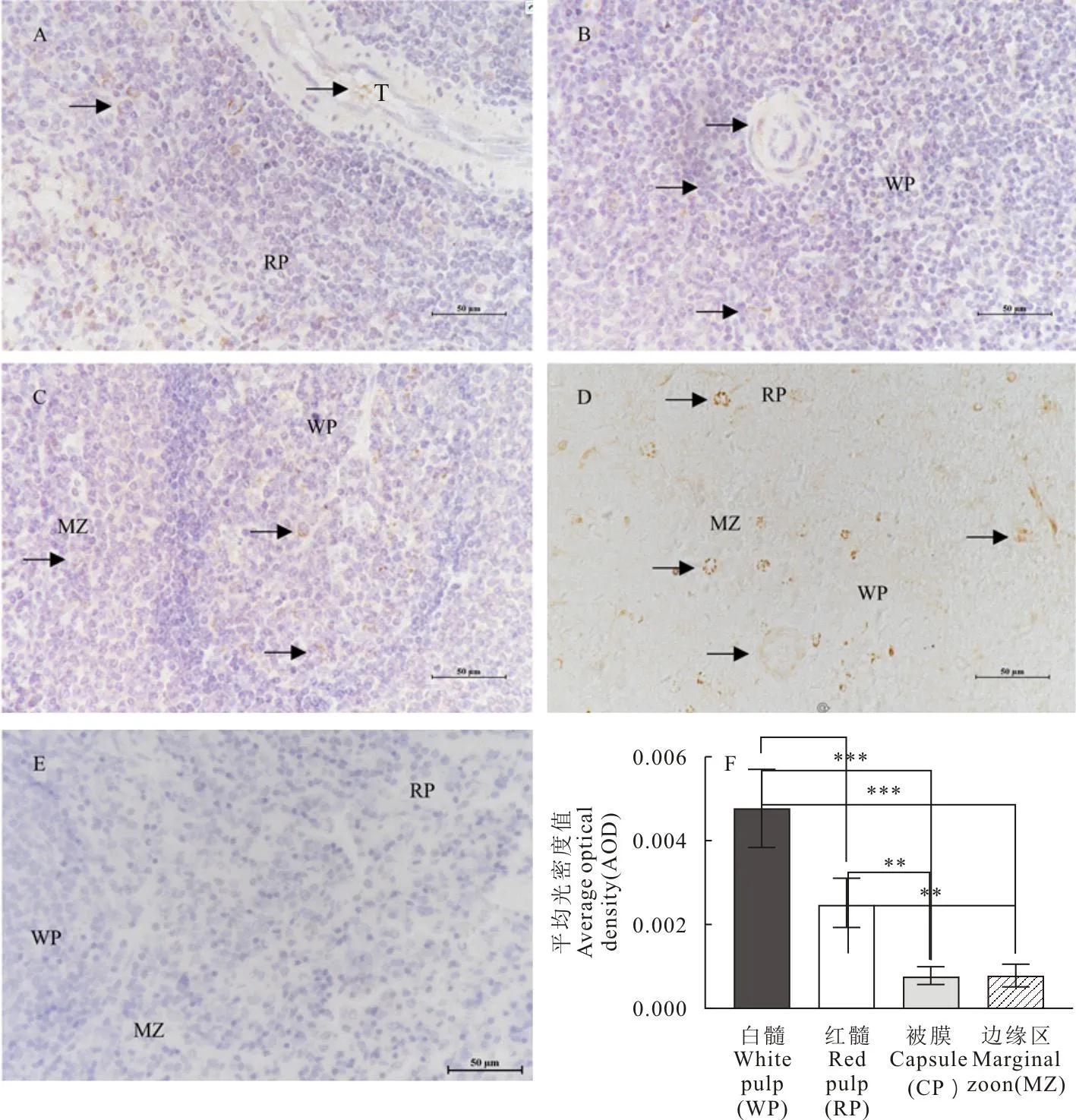
A~C.SP法染色(苏木精复染);D.SP法染色(苏木精未复染);E.阴性对照;F.β2-AR在脾各组织的相对表达量;WP.白髓;RP.红髓;MZ.边缘区;CP.被膜;黑色箭头为β2-AR的阳性信号;*P<0.05,**P<0.01,***P<0.001
2.2 山羊脾NFs免疫组织化学SP法染色结果
脾中不同部位的染色强度不一,对照组切片(图2E)经苏木精复染后,可见脾中无NFs免疫反应产物,细胞核为蓝色。试验组切片经苏木精复染后(图2A、图2B、图2C)组织内可见棕黄色的NFs免疫反应产物。试验组SP染色结果显示,NFs在免疫组织化学中阳性信号为点状、丝状或串珠丝状。其中被膜及小梁内,有棕褐色的免疫阳性反应产物的存在,阳性产物呈丝状和串珠样排列(图2A),在红髓、白髓以及边缘区呈现点状阳性颗粒。免疫组化AOD统计分析,红髓中免疫组化染色阳性相对表达量显著高于白髓(P<0.05),极显著高于边缘区(P<0.01);被膜中免疫组化染色阳性相对表达量极显著高于边缘区和白髓(P<0.01)。
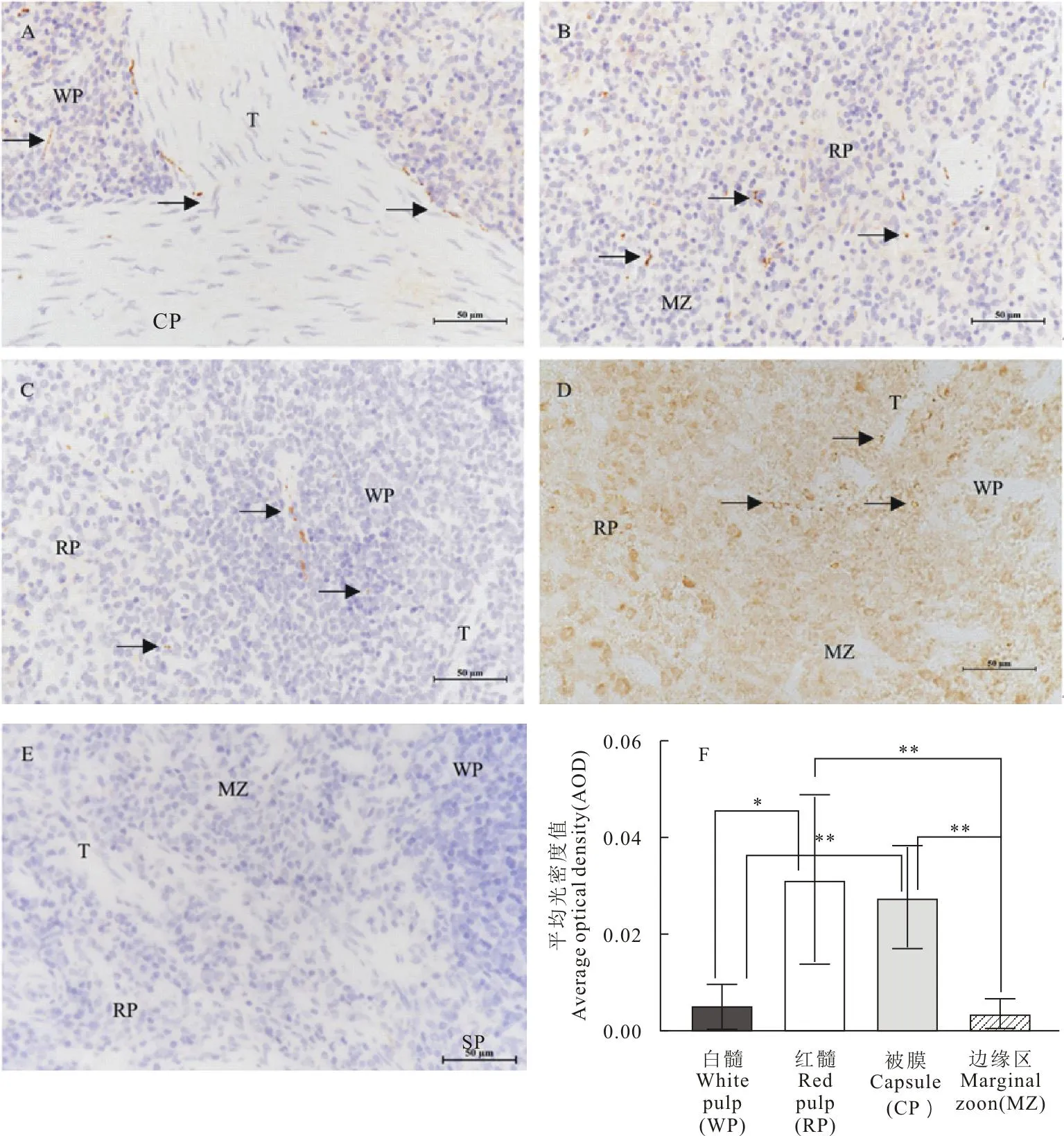
A~C.SP法染色(苏木精复染);D.SP法染色(苏木精未复染);E.阴性对照;F.NFs在脾组织中的相对表达量;WP.白髓;RP.红髓;T.小梁;MZ.边缘区;CP.被膜;黑色箭头为NFs的阳性信号;*P<0.05,**P<0.01,***P<0.001
2.3 山羊脾β2-AR与NFs的共存结果
染色后组织切片经激光共聚焦显微镜扫描成像,经绿色、红色和蓝色3种免疫荧光染色,红色标记的是β2-AR,绿色标记的是NFs,蓝色标记的是细胞核。2种受体共存的判断标准是细胞的胞质或全细胞为黄色或者橙色。3种荧光图像经NIS-Viewer 5.21.00作图像合成处理,根据图像重叠情况分析2种受体的组织或细胞内共定位情况(图3)。在激光共聚焦显微镜观察,红色荧光标记的 β2-AR主要分布于白髓和红髓,在边缘区和被膜中也有少量分布;绿色荧光标记的NFs主要分布于红髓和被膜,在白髓和边缘区中也有少量分布,与免疫组化染色结果一致。2种不同的荧光标记受体染色叠加后呈黄色,2种受体主要在红髓、白髓内共存,在被膜和边缘区内也有一定量细胞双标阳性着色(图3A、图3B)。
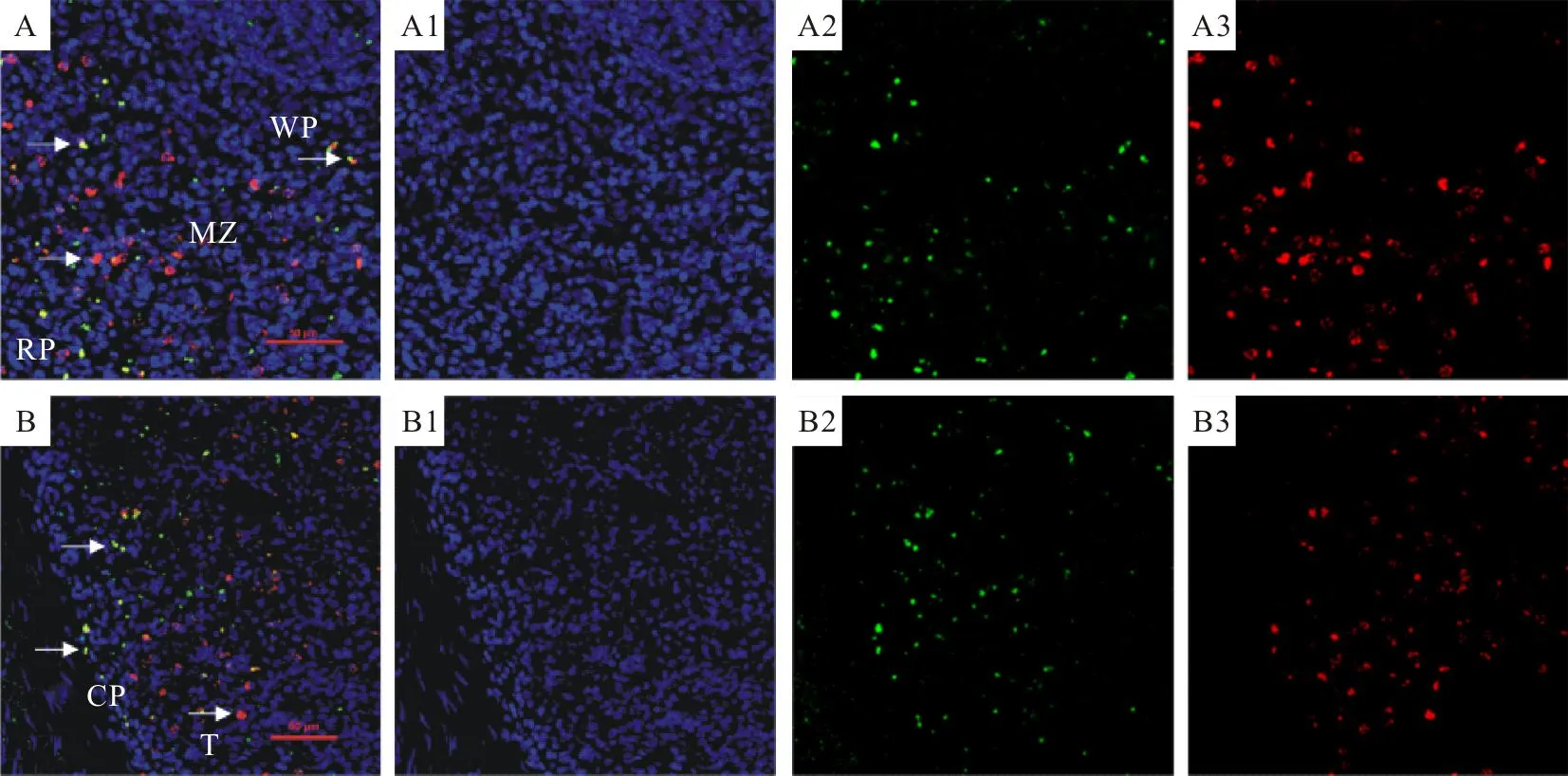
A~B.β2-AR,NFs和细胞核的荧光三标;A1~B1.细胞核的荧光单标;A2~B2.NFs的荧光单标;A3~B3.β2-AR荧光单标;白色箭头表示β2-AR和NFs的荧光双标;WP.白髓;MZ.边缘区;RP.红髓;SP.被膜;T.小梁
3 讨论
肾上腺素是一种激素和神经传递体,由肾上腺释放,可参与调节心脏收缩[4]。肾上腺素受体分为α和β,α受体亚型为α1和α2,β受体亚型为β1、β2、β3。β1、β2、β3受体同源性为65%~70%,分别在心脏、气道平滑肌和脂肪组织中被鉴定。β-AR是交感神经的重要组成部分,属于G蛋白偶联受体,其信号通路受到内源性儿茶酚胺、去甲肾上腺素以及肾上腺素的调控[5]。肾上腺素能受体在单核巨噬细胞中广泛存在,可作用于单核巨噬细胞表面的受体产生免疫活性,β-AR的活化可促炎因子表达减少,抗炎因子表达增加。脾组织原位检测淋巴细胞的肾上腺素能受体mRNA的研究,从基因水平证明免疫细胞表面存在β-AR。分布位置主要是白髓,与本试验结果一致。淋巴细胞主要表达β2-AR,淋巴细胞表面存在β2-AR,几种淋巴细胞分别表达不同的β2-AR。β2-AR是交感神经纤维支配脾免疫功能和实现神经系统与内分泌系统的信息交流的桥梁。
高分子质量神经丝蛋白(neurofilament H,NF-H)抗体被用作标记脾组织内神经纤维,能特异性识别NF-H。为了验证该抗体,进行小鼠组织(脑、皮肤、小肠和肝)NFs的免疫荧光染色,观察到明亮的染色纤维。NFs是神经细胞内的细胞骨架蛋白,是一种组织特异性中间丝,在轴突中含量特别丰富,在轴突发育过程中,对轴突径向生长、轴突口径的维持和电脉沿轴突的传递很重要。它是由4个亚基单位所组成的杂聚物,根据分子质量的不同可分为轻链神经丝、中间神经丝、重链神经丝和外周蛋白。在小鼠脾白髓血管周围和被膜下区域可观察到神经丝蛋白的阳性信号[6],根据体内研究,在小鼠脾中观察到少量神经标志阳性产物。平滑肌受自主神经支配,是周围神经的靶细胞,受中枢神经系统支配,研究表明[7],传入神经纤维沿着小梁在脾中广泛分布,并与含平滑肌血管(如中央动脉及其分支动脉、其他小血管)分布密切相关。因此,在平滑肌丰富的被膜和小梁上广泛分布有NFs,神经纤维调控平滑肌细胞,实现脾神经支配被膜及小梁平滑肌和血管平滑肌,达到对脾血流量的控制,神经纤维对脾血流量和血管通透性的调控可能会影响免疫细胞的后续状态以及导致血液携带外来抗原的清除。本研究中NFs存在于脾淋巴细胞中,在白髓的动脉周围淋巴鞘与边缘区的点状神经丝分布最为显著。神经纤维是一种与血管相对静止的结构,而机体内的免疫细胞是组织或者器官内的游走性细胞[8],所以,这种可以形成神经-免疫细胞通过神经递质受体接触或者结合可以称为神经免疫细胞单位或者是神经免疫突触[9],它是一种动态的结构,受机体免疫水平的调节。有研究探索了一种支配淋巴器官的新方法——神经免疫交叉对话的“桥梁细胞”,在神经系统向免疫系统传递信号方面发挥着重要作用[10-11]。研究表明[3],来自腹腔神经丛、左侧腹腔神经节和右侧迷走神经的分支形成脾内的神经丛。本研究结果显示,NFs广泛分布于白髓与小梁中,脾作为淋巴系统器官,受丰富的交感神经支配,脾动脉分支的神经丛经脾的被膜,经小梁深入白髓,调控脾淋巴细胞。这与文献[3]报道一致,肾上腺素能神经纤维末梢释放肾上腺素神经递质,通过直接的神经递质-受体方式进行信息交流与免疫调控,但其具体机制还有待进一步研究。
β2-AR免疫阳性产物在脾的白髓、红髓、血管、被膜和小梁均有不同程度的着色,且主要存在于白髓和红髓淋巴细胞的细胞膜表面,被膜、小梁、血管和边缘区也有少量分布。NFs阳性产物主要分布在脾中红髓、被膜和小梁中,白髓和边缘区有少量分布。共定位染色揭示:脾受到交感-肾上腺素能神经的调控,交感神经纤维通过释放神经递质-去甲肾上腺素,作用于脾上的肾上腺素能受体实现功能调控。神经纤维释放神经递质作用于平滑肌细胞上的受体,影响脾的血流调节以及调控血液对外来异物的清除;白髓和红髓中的淋巴细胞与交感神经纤维形成神经免疫细胞或者神经免疫突触,神经纤维末梢释放神经递质通过直接的神经递质-受体方式进行信息交流与免疫调控,有助于进一步从形态学上揭示脾中的神经-免疫细胞间的信息通讯机制。
