猪肺炎支原体和猪鼻支原体TaqMan双重荧光PCR检测方法的建立及应用
2024-03-08覃国喜梁龙华陈忠伟卢冰霞秦毅斌林昌华张胜斌段群棚胡庭俊
周 颖,赵 硕,覃国喜,梁龙华,肖 婷,陈忠伟,卢冰霞,秦毅斌,林昌华,张胜斌,段群棚,胡庭俊*,何 颖*
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室/农业农村部中国(广西)-东盟跨境动物疫病防控重点实验室,广西南宁 530001;3.广西农垦永新畜牧集团金光公司,广西南宁 530042;4.广西农垦永新畜牧集团西江公司,广西贵港 537100)
猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)是引起猪支原体肺炎(Mycoplasmal pneumonia of swine,MPS)的主要病原体[1]。MPS在全球范围内流行,该病具有地方性[2]、慢性消耗、平均日增重减少[3]、饲料转化率差等特点。Mhp可以引起猪呼吸道综合征(Porcine respiratory complex,PRDC),并引起猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒(PCV)等继发感染[4]。猪鼻支原体(Mycoplasmahyorhinis,Mhr)是猪上呼吸道的一种常见病原体,相较于哺乳仔猪,育肥猪和种猪的检出率更高[5]。Mhr可引起猪肺炎、关节炎、浆膜炎、结膜炎等临床症状[6-7]。猪鼻支原体可加快猪圆环病毒2型(Porcine circovirus type 2,PCV2)在猪体内增殖和传播,PCV2也可以加重猪鼻支原体感染引起的临床症状和病理变化[8]。猪鼻支原体还是细胞培养过程中很常见的污染物,且一旦污染很难根除[9]。Mhp和Mhr的检测主要靠病原分离培养、血清学检测及分子水平检测[10-11]。虽然Mhp的分离培养被称为Mhp检测的金标准,但由于其培养条件及其苛刻、培养时间长且无法与Mhr分别培养,给Mhp的分离鉴别造成了巨大挑战。荧光定量PCR因其敏感度高、特异性强、定量精准、快速等优点,已成为病原检测的最优选择。本研究建立了一种可在1 h内完成同时检测Mhp和Mhr的双重荧光定量PCR方法,给临床Mhp和Mhr的检测提供了方便,同时也为实验室鉴定Mhp提供了技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株、毒株及临床样品 Mhp(J株)由江苏省农业科学院兽医研究所邵国青老师团队惠赠。Mhr、鸡毒支原体(Mycoplasmagallisepticum,MG)、猪流感病毒(Swine influenza virus,SIV)、 PCV2、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)、副猪嗜血杆菌(Haemophilusparasuis,HPS)、猪细小病毒病(Porcine parvovirus infection,PPI)、金黄色葡萄球菌(Staphylococcusaureus,SA)、大肠埃希氏菌(E.coli)及屠宰场采集的猪肺脏样品均由广西壮族自治区兽医研究所病毒室于-80℃保存。
1.1.2 主要试剂 大肠埃希氏菌DH5α感受态细胞、pMD18-T Vector、2×TaqMan Fast qPCR预混液,生工生物工程(上海)股份有限公司产品;核酸提取试剂盒(磁珠法),中元汇吉生物技术股份有限公司产品;pMD-18T载体、DNA Marker DL 2 000,Takara生物技术有限公司产品;胶回收试剂盒、质粒提取试剂盒,OMEGA广州飞扬生物工程有限公司产品;其他试剂均为分析纯级别试剂。
1.1.3 主要仪器 EXM 3000全自动核酸提取仪,中元汇吉生物技术股份有限公司产品;Bio-Rad凝胶成像系统、CFX Opus 96实时荧光定量PCR仪、T100TMThermal Cycler PCR仪,美国Bio-Rad公司产品;DYY-6C型电泳仪,北京六一生物科技有限公司产品;D-37520 Osterode am Harz 台式高速离心机,德国Sigma公司产品。
1.2 方法
1.2.1 引物和探针合成 根据GenBank收录的Mhp的183基因(Mhp-183)和Mhr的p37基因(Mhr-P37)序列,应用Primer-BLAST针对保守区设计特异性引物及探针(表1)。引物及探针均由生工生物工程(上海)股份有限公司合成。
1.2.2 标准品模板的制备 根据GenBank收录的Mhp-183和Mhr-P37的基因序列,用Promer-Blast对保守区进行普通PCR引物设计并扩增。Mhp-183(F:5′-CGGTCATCATTGGGTGGCTA-3′ R:5′-GAAGGCAAAAATGAGGCGCA-3′),Mhr-P37(F:5′-GTAGTCAAGCAAGAGGATGT-3′ R:5′-GCGCTTCTGTCTTCATTTAG-3′)。反应条件:94℃ 2 min;94℃ 30 s;57℃ 30 s;72℃ 1 min;30个循环,72℃终延伸7 min。琼脂糖凝胶电泳验证条带大小正确后,将产物胶回收进行纯化,连接pMD18-T载体并转化到感受态细胞大肠埃希氏菌DH5α,用含氨苄平板培养后,挑选菌落进行单克隆,筛选阳性重组质粒并测序。测序正确的阳性重组质粒为标准品,分别命名为pMD18-T-Mhp-183(4.52×1011copies/μL)、pMD18-T-Mhr-P37(2.97×1010copies/μL),于-20℃保存备用。
1.2.3 双重荧光定量PCR反应条件的优化 为筛选双重TaqMan 荧光定量PCR最优反应体系和反应条件,采用矩阵法优化引物、探针终浓度,上、下游引物(10 μmol/L)各0.4、0.5、0.6、0.7、0.8 μL,探针(10 μmol/L)各0.2、0.3、0.4、0.5、0.6 μL。用优化好的反应体系进行退火温度的优化,退火温度优化范围为55~62℃。
1.2.4TaqMan荧光定量PCR标准曲线的建立 将pMD18-T-Mhp-183和pMD18-T-Mhr-P37分别用DEPC水做10倍梯度稀释,选取8个稀释度标准品为模板,每个稀释度设置3个技术重复,进行荧光定量扩增、分析并建立标准曲线。
1.2.5 特异性试验 以MG、SIV、PCV2、PRRSV、APP、HPS、PPI、SA、E.coli的核酸为模板,以pMD18-T-Mhp-183和pMD18-T-Mhr-P37为阳性对照,ddH2O为阴性对照,应用优化后的双重荧光定量PCR方法进行特异性试验。
1.2.6 敏感性试验 将pMD18-T-Mhp-183和pMD18-T-Mhr-P37分别用DEPC水做10倍梯度稀释,分别选取拷贝数为4.52×101~4.52×108copies/μL和2.97×101~2.97×108copies/μL的标准品为模板,ddH2O为阴性对照,应用优化后的双重荧光定量PCR方法进行灵敏度试验。
1.2.7 重复性试验 分别选取pMD18-T-Mhp-183的4.52×103~4.52×107copies/μL和pMD18-T-Mhr-P37的2.97×103~2.97×107copies/μL 5个稀释浓度标准品混合后作为模板。应用优化后的双重荧光定量PCR方法进行重复性试验,每个浓度进行3个平行试验,进行批间和批内重复性分析,计算变异系数(CV),评估该方法的重复性。
1.2.8 临床样品检测 用建立的双重荧光定量PCR检测方法和普通PCR方法对本实验室收集的145份猪肺脏样本和9份支原体分离培养物进行Mhp及Mhr检测,设置pMD18-T-Mhp-183和pMD18-T-Mhr-P37为阳性对照,ddH2O为阴性对照,计算两种方法的符合率。
2 结果
2.1 双重荧光定量PCR反应条件的优化
经过优化试验,确定该方法的最优体系(20μL)为2×TaqMan Fast qPCR预混液10 μL,Mhp-183-F(10 μmol/L)0.4 μL,Mhp-183-R(10 μmol/L)0.4 μL,Mhp-183-P(10 μmol/L)0.3 μL,Mhr-P37-F(10 μmol/L)0.4 μL,Mhr-P37-R(10 μmol/L)0.4 μL,Mhr-P37-P(10 μmol/L)0.3 μL,模板2 μL,ddH2O补足至20 μL。优化后反应条件为:94℃ 3 min;94℃ 15 s,57℃ 30 s,40个循环。
2.2 TaqMan荧光定量PCR标准曲线的建立
将4.52×101~4.52×108copies/μL的pMD18-T-Mhp-183和2.97×101~2.97×108copies/μL的pMD18-T-Mhr-P37为模板进行荧光定量PCR扩增。以重组质粒浓度对数值为横坐标,对应的Ct值为纵坐标,得到相应的标准曲线(图1);所得的Mhp标准曲线的斜率为-3.306 7,线性相关系数R2为0.999 6;Mhr标准曲线的斜率为-3.322 5,线性相关系数R2为0.999 4;扩增产物的Ct值与浓度之间存在良好的线性关系。

A.pMD18-T-Mhp-183(4.52×101~4.52×108 copies/μL)标准曲线;B.pMD18-T-Mhr-P37(2.97×101~2.97×108 copies/μL)标准曲线
2.3 特异性试验结果
用本研究建立的双重TaqMan荧光定量PCR方法对MG、SIV、PCV2、PRRSV、APP、HPS、PPI、SA、E.coli阳性样本的核酸进行扩增。结果显示,Mhp及Mhr核酸均出现特异性扩增曲线(图2),其余病原核酸和阴性对照未出现扩增曲线,表明该方法特异性强。

图2 荧光定量PCR体系特异性试验
2.4 敏感性试验结果
敏感性试验结果显示(图3和图4),本研究建立的方法Mhp和Mhr的最低检出量分别为45.2 copies/μL和29.7 copies/μL,与常规PCR相比敏感性分别提高了10 000倍和1 000倍,表明该方法敏感性高。
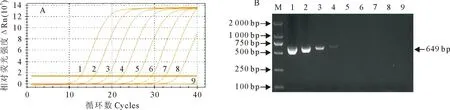
A.荧光定量PCR的Mhp敏感性试验,1~8. 4.52×101~4.52×108 copies/μL;9.阴性对照;B.普通PCR的Mhp敏感性试验,1~8. 4.52×101~4.52×108 copies/μL;9.阴性对照;M.DNA 标准 DL 2 000
2.5 重复性试验结果
将4.52×103~4.52×107copies/μL不同浓度的pMD18-T-Mhp-183和2.97×103~2.97×107copies/μL 不同浓度的pMD18-T-Mhr-P37混合作为模板,进行3次批内和批间的平行试验,计算CV,评价该方法的重复性。结果显示(表2),该方法所得批间和批内试验的变异系数均小于2%。

表2 荧光定量PCR的批内和批间检测结果
2.6 临床样本检测结果
对145份临床猪肺脏组织样品和8份支原体分离培养物进行Mhp和Mhr检测。结果显示(图5和表3),145份临床猪肺脏组织样品中,共检出Mhp阳性82份,阳性率为57%(82/145),Mhr阳性9份,阳性率为6%(9/145),其中Mhp和Mhr混合感染阳性样品7份,共感染率为5%(7/145)。普通PCR检出的阳性样品,荧光PCR检出也均为阳性,并且荧光PCR检出率远高于普通PCR。8份支原体分离培养物中,有3分培养物同时存在Mhp和Mhr,剩余5份培养物均只存在Mhr。
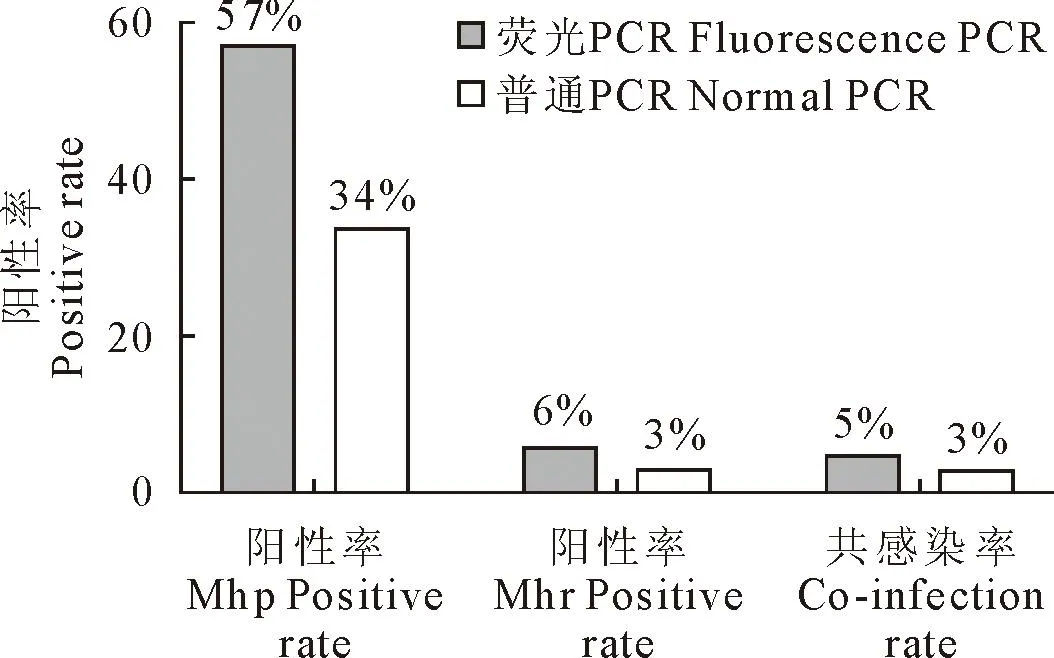
图5 临床检测样品的荧光PCR和普通PCR结果图
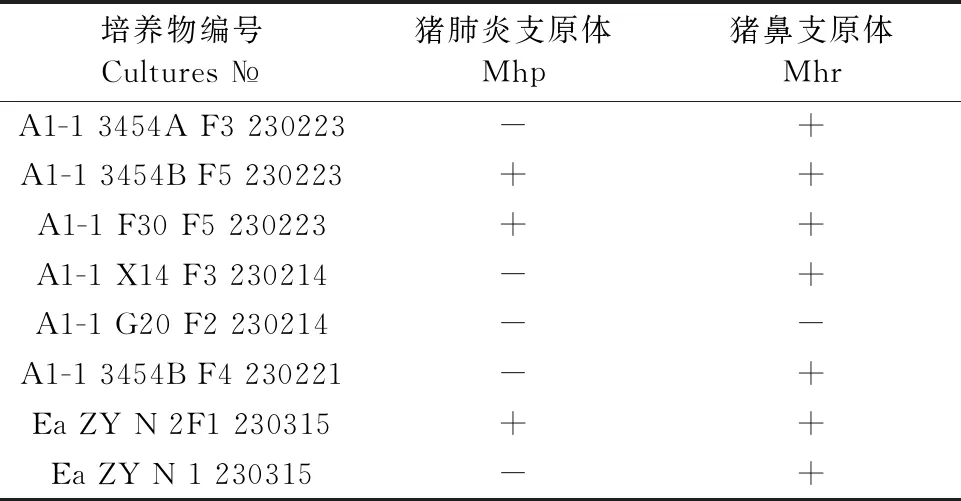
表3 荧光定量PCR检测8份支原体分离培养物结果
3 讨论
Mhp是规模化养猪中造成MPS的一个重要原因,猪群在Mhp感染时常伴随有Mhr感染,导致猪群饲料转化率低、生长迟缓、炎症反应和免疫抑制等,给养猪业造成巨大经济损失。Mhp分离培养对基层兽医单位和人员的要求较高,Mhp体外培养时易混入生长速度更快而成为优势菌株的Mhr,导致Mhp鉴别难度加大,分离错误率增高;病料运输、储存及操作不当会导致Mhp菌株失活;Mhp血清抗体由阴性转为阳性往往在病原自然感染宿主一段时间后才能检出,且Mhp与Mhr之间存在一定的交叉反应,限制了血清学抗体检测在Mhp诊断上的应用。Mhp的核酸检测在该病的临床检测诊断中起到了重要的作用,在不同诊断鉴别方法中又以荧光定量PCR灵敏性好,耗时少和特异性高而受青睐。
本研究针对Mhp-183和Mhr-P37的保守区间进行特异性引物、探针的设计,并且探针5′端标记的发光基团分别选用相互影响较小的FAM和ROX信号,3′端淬灭集团选择BHQ,具有更高的信噪比,提高了检测的敏感性和准确性。本研究建立的方法可在1 h内同时检测Mhp和Mhr,最低检测限比普通PCR方法提高了103~104倍。双重荧光定量PCR检测Mhp和Mhr的标准曲线的相关系数分别达到0.999 6和0.999 4,呈现良好的线性关系,表明该方法具有较高的准确性和稳定性。
本试验建立的方法对收集的145份临床猪肺脏组织样本进行Mhp和Mhr检测,发现Mhp的感染率超过50%,远高于Mhr 的阳性率,可能由于本试验中的临床样本是猪的肺脏组织,与Mhr通常在鼻拭子中的检出率较高有关[12],Mhp和Mhr双重感染率高对临床上Mhp的分离培养是一大挑战。本试验针对8份支原体分离培养物进行了Mhp和Mhr的PCR核酸鉴定,发现其中3份同时含有Mhp和Mhr,下一步将及时进行Mhp的纯化,有效避免由于Mhr快速增殖成为优势毒株而导致Mhp毒株丢失,增加Mhp的分离率。
本研究建立了一种TaqMan双重荧光定量PCR检测方法,该方法可以对组织样本或血液、环境等样品进行Mhp和Mhr的实时定量PCR检测,该方法特异性强、准确性好,方便快捷,可为临床上用于猪群Mhp的早期诊断与监测提供可靠的技术支撑。
