乳粉中沙门氏菌和单核细胞增生李斯特氏菌检验能力验证结果和关键控制点分析
2024-03-05贺强廖娜陈丹
贺强 廖娜 陈丹
(1.咸宁市公共检验检测中心 湖北咸宁 437100;2.湖北省桂花产品质量检验检测中心)
0 引言
作为常见的食源性致病菌,沙门氏菌广泛存在于鸡肉、鱼类、蛋类、奶类及其制品中,食用被沙门氏菌污染的食物可导致肠胃炎、败血症等,严重危害人类健康[1]。单核细胞增生李斯特氏菌是李斯特氏菌属中唯一的一种人畜共患病病原菌,人、畜及禽类均可被该病原菌感染而引起李斯特氏菌病[2],该病原菌可在4℃条件下生长繁殖,可存在于常温食品及冷藏食品中[3]。
近年来,食源性致病菌引起的食品安全问题已成为备受关注的公共卫生问题,作为检验检测机构,通过参加实验室的能力验证活动,可以不断提高对致病菌的检验检测鉴别能力,从而守好食品安全关口[4]。GB 29921《食品安全国家标准 预包装食品中致病菌限量》中规定,沙门氏菌和单核细胞增生李斯特氏菌在各类食品中均不得检出[5],其检测已作为食品检测的常规项目。
实验室间比对是评价实验室检验检测水平能力的重要方式,有助于实验室管理者及时发现问题并实施改进措施[6-7]。为保证检测质量,本实验室参加了由中国检验检疫科学研究院测试评价中心组织的《ACAS-PT1368 乳粉中沙门氏菌、单核细胞增生李斯特氏菌的检测能力验证》,本文对能力验证实验的过程与结果进行分析讨论,总结沙门氏菌及单核细胞增生李斯特氏菌能力验证实验和日常检验的注意事项,以期为相关人员提供参考。
1 材料与方法
1.1 样品来源
样品均由中国检验检疫科学研究院测试评价中心提供,编号22-E810 和22-R286(以下简称“E810”“R286”)为沙门氏菌定性样品,编号22-C159 和22-M336(以下简称“C159”“M336”)为单核细胞增生李斯特氏菌定性样品,样品均采用真空西林瓶密闭包装。
1.2 主要培养基和试剂
脑心浸出液肉汤(BHI)、缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿增菌液(TTB)、亚硒酸盐胱氨酸增菌液(SC)、亚硫酸铋琼脂(BS)、木糖赖氨酸脱氧胆盐琼脂(XLD)、沙门氏菌显色培养基(SA)、营养琼脂(NA)、三糖铁琼脂(TSI)、沙门氏菌干制生化鉴定试剂盒、李氏增菌肉汤(LB1、LB2)、PALCAM 琼脂、李斯特显色培养基、含0.6%酵母膏的胰酪胨大豆琼脂(TSA-YE)、血琼脂平板、革兰氏染色液、SIM 动力培养基、脑心浸出液肉汤(BrainHeart Infusion Broth,BHI)(北京陆桥);沙门氏菌属诊断血清(宁波天润);显色培养基(科玛嘉);VITEK 2 革兰阳性菌鉴定卡(法国生物梅里埃);沙门氏菌核酸测定试剂盒、单核细胞增生李斯特氏菌试剂盒(卓诚惠生)。
1.3 标准菌株
鼠伤寒沙门氏菌标准菌株(ATCC 14028)、单核细胞增生李斯特氏菌(Listeria monocytogenes,ATCC 19115)、英诺克李斯特氏菌(Listeria innocua,ATCC 33090)、伊氏李斯特氏菌(Listeria ivanovii,ATCC 19119)、斯氏李斯特氏菌(Listeria seeligeri,ATCC 35967)(广东省食品微生物安全工程技术研究开发中心)。
1.4 主要仪器
蒸汽高压灭菌器(SX-700,日本Tomy Digital Biology 公司);生物安全柜(HF safe1200 LC A2,力新仪器上海有限公司);生化培养箱(SPX-250B-Z,上海博讯实业有限公司医疗设备厂);电子分析天平(JY5002,上海舜宇恒平科学仪器有限公司);生物显微镜(Axiolab5,蔡司科技苏州有限公司);VITEK 2 COMPACT 全自动细菌鉴定系统、Densicheck 电子比浊计(法国生物梅里埃公司);实时荧光定量PCR仪(Bio-RAD/IQ-Check,伯乐生命医学)。
1.5 方法
参照能力验证作业指导书以及GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[8]和GB 4789.30—2016 《食品安全国家标准食品微生物学检验 单核细胞增生李斯特氏菌检验》[9]进行试验。
1.5.1 样品前处理
按照作业指导书的要求,在生物安全柜中将西林瓶开启后,立即加入5 mL 稀释液进行再水化,待溶解后,吸出放入无菌瓶中,再反复用余下的55 mL稀释液清洗西林瓶内壁2~3 次,共回收清洗液60 mL置于上述无菌瓶中,此溶液即为待测样品原液。
1.5.2 增菌
吸取待检样品E810 和R286,分别移至225 mL缓冲蛋白胨水(BPW)中,混匀,36℃培养24 h,吸取1 mL,转种于10 mL TTB 内,于42℃培养24 h,同时,另取1mL,转种于10mL SC 中,于36℃培养24 h;吸取待测样品C159、M336 分别移至盛有225 mL LB1中,混匀,30℃培养24 h 后,移取0.1 mL,转种于10 mL LB2增菌液中,30℃培养24 h。
1.5.3 分离和鉴定
取E810 和R286 增菌液分别划线接种至BS 平板、XLD 平板以及沙门氏菌显色培养基平板中,36℃培养24 h,挑取可疑菌落进行生化反应及血清学鉴定;同时取C159、M336 在LB2中的二次增菌液划线接种于PALCAM 琼脂平板和李斯特氏菌显色培养基中,36℃培养48 h,挑取可疑菌落进行生化反应鉴定。
1.5.4 实时荧光定量PCR 法
根据沙门氏菌以及单核细胞增生李斯特氏菌核酸测定试剂盒的说明书,取菌液(样品的前增菌液和增菌液)各1 mL 于1.5 mL 离心管,13 000 r/min 离心2 min;弃上清液,在沉淀中直接加入100 μL DNA 提取液充分混匀,沸水浴10 min。13 000 r/min离心5 min,取上清液备用。PCR 扩增反应程序应按照说明书进行设置,检测结束后,根据扩增曲线和Cq 平均值判定结果。
2 结果与分析
2.1 微生物学检测法检测结果
2.1.1 选择性平板分离
E810 和R286 待测样品通过前增菌和选择性增菌培养后,根据样品在选择性琼脂平板上的菌落形态找出可疑沙门氏菌,结果见表1。E810、R286、阳性对照在BS、XLD、显色平板上均有可疑或典型菌落见图1。
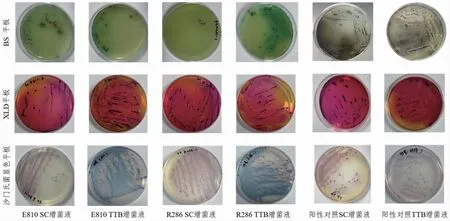
图1 E810 和R286 菌株在平板上的菌落形态直观图Fig.1 Visual diagram of colony morphology of E810 and R286 strains on the plate
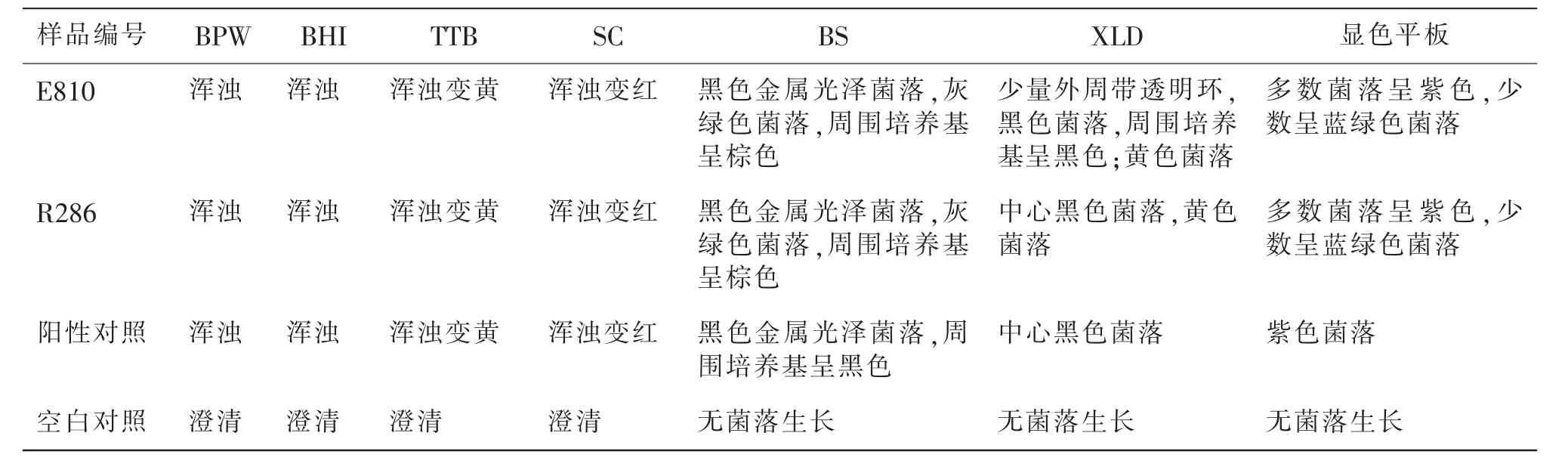
表1 E810 和R286 增菌结果及选择性分离平板生化特征Table1 Enrichment results of E810 and R286 and biochemical characteristics of selective separation plate
C159 和M336 待测样品经过2 次增菌后,在PALCAM 平板上生长良好,结果见表2。其形态一致,均为圆形灰绿色菌落,中间呈黑色凹陷状,见图2。C159、M336 以及阳性对照在PALCAM、显色平板上均有可疑或典型菌落。

图2 C159 和M336 增菌株在平板上的菌落形态直观图Fig.2 Visual diagram of colony morphology of C159 and M336 strains on the plate

表2 C159 和M336 增菌结果及选择性分离平板生化特征Table 2 Enrichment results of C159 and M336 and biochemical characteristics of selective separation plate
2.1.2 生化鉴定试验结果
从E810 和R286 选择性琼脂平板上分别挑取10 个典型或可疑菌落进行三糖铁琼脂、赖氨酸脱羧酶等一系列生化鉴定实验,并从纯化板上挑取单菌落进行VITEK 生化鉴定试验,结果见表3。因国家标准中血清学分型为选做项目,故本次试验不作具体分型。
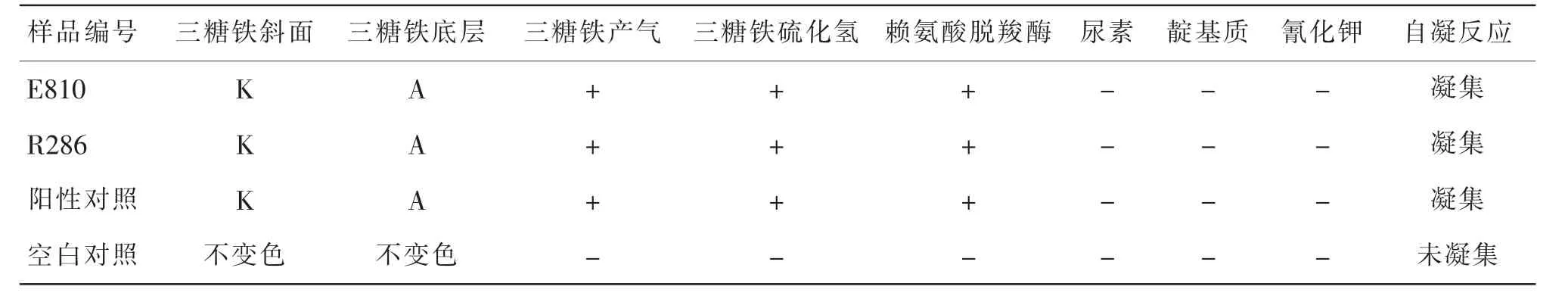
表3 E810 和R286 生化反应及血清学鉴定Table 3 Biochemical reaction and serological identification of E810 and R286
从选择性琼脂平板上分别挑取5 个典型或可疑的C159 和M336 菌落进行木糖、鼠李糖发酵实验,结果见表4。根据VITEK 2 鉴定结果(表5),本次试验补充溶血试验(图3)及协同溶血试验(图4)。

图3 C159 和M336 的溶血试验Fig.3 Hemolysis test of C159 and M336
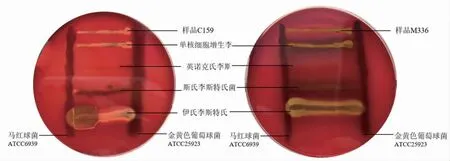
图4 C159 和M336 的协同溶血试验Fig.4 Synergistic hemolysis test of C159 and M336

表4 C159 和M336 生化鉴定结果Table 4 Biochemical identification results of C159 and M336
表5 C159 和M336 的VITEK 2 鉴定结果Table 5 VITEK 2 identification results of C159 and M336
2.2 实时荧光定量PCR 法检测结果
根据E810 和R286 的扩增曲线和Cq 平均值判定结果,Cq 值<35,判为检出。结果如图5 所示,样品E810 的Cq 值为11.92,检测结果为阳性。样品R286的Cq 值为13.96,检测结果为阴性。表6 检测结果表明,样品E810 和R286 为典型的含沙门氏菌属的样品。
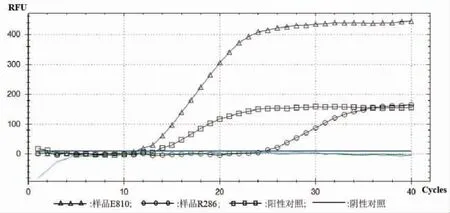
图5 样品E810 和R286 实时荧光定量PCR 曲线图Fig.5 Real time PCR curves of samples E810 and R286

表6 样品的实时荧光定量PCR 鉴定结果Table 6 Real time fluorescent quantitative PCR identification results of samples
另外,C159 和M336 的扩增曲线(见图6)和Cq值结果表明(见表6),样品C159 和M336 为典型的含单核细胞增生李斯特氏菌菌属的样品。
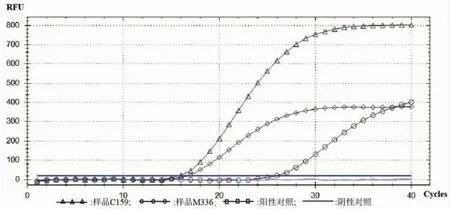
图6 样品C159 和M336 实时荧光定量PCR 曲线图Fig.6 Real time PCR curves of samples C159 andM336
3 结论与讨论
试验结果显示,E810 和R286 在BS、XLD、显色平板上均有典型的可疑菌落生长,生化反应与阳性对照菌结果一致,均为典型的含沙门氏菌属的样品;C159 和M336 在PALCAM、单增显色平板上均有典型的可疑菌落生长,且生化反应、溶血性试验、协同溶血试验与阳性对照菌株一致,均为典型的含单核细胞增生李斯特氏菌的样品,同时,实时荧光定量PCR 的检测结果也证实了以上结果。
结合上述能力验证结果,本文重点对此次能力验证检测过程中的注意事项及质量控制要求进行分析讨论:
(1)在试验前期准备中,需要与能力验证组织方确认好待测样品的发送时间,并预估收样时间,确保在规定的7 天内收到样品,以避免时间延误对样品产生影响。同时,还需要对待测样品进行检查,以确保样品的完整性,避免漏气或破损等问题,若发现样品有问题,应及时与能力验证组织方进行沟通,样品验收无误后,应及时将样品存放于2℃~6℃的冰箱中,并在规定的时间内对样品进行测试。
(2)为确保试验结果的准确性和可靠性,仪器设备和试验环境应符合要求,培养基和试剂应符合GB 4789.28 质量要求,并进行现配现用[10]。根据作业指导书和采用的国家标准检验方法,制定能力验证试验方案,及时记录试验情况。
(3)试验须在二级生物安全实验室中进行,特别是在检出疑似菌后进行生化鉴定及血清学鉴定时,必须在生物安全柜中进行无菌操作,避免人员和环境对试验结果产生影响[11]。
(4)沙门氏菌进行三糖铁实验时,需挑取纯化后的单个菌落进行实验,该过程需用接种针进行接种,而不能使用接种环,否则会使琼脂破裂而破坏厌氧环境,误判产气结果。通常的接种顺序先在斜面划线,再于底层穿刺,并且最好先穿刺底层,再于斜面划线,以防止在培养基底层漏种。接种完成后,不应完全密封瓶口,以免影响斜面氧气的供应和葡萄糖的有氧代谢。观察结果时,由于H2S 的大量产生,三糖铁琼脂底层全部变黑,无法观察到底层糖发酵的结果。有研究表明,在三糖铁琼脂上产H2S 的细菌,同时也发酵糖产酸产气[12]。因此,为便于穿刺,在培养基底层接种时,可把接种针穿刺至试管底部,若三糖铁琼脂底层全部变黑,可直接判定为底层产酸。
(5)单核细胞增生李斯特氏菌进行分离试验时,PALCAM 琼脂无法对李斯特氏菌属内的菌再区分,要同时划线显色培养基[13]。单增李斯特氏菌显色培养基是根据单增李斯特氏菌特有葡萄糖苷酶和酯酶,在培养基中加入相应的酶显色底物,从而产生特有的菌落形态[14]。但绵羊李斯特氏菌可能显现同单增李斯特氏菌相同的菌落形态,但该菌在食品检测中极少见报道[15]。本次能力验证采用常规生化反应试剂盒进行生化鉴定,同时运用全自动生化鉴定仪进行全自动生化反应,但由于单增李斯特氏菌和英诺克李斯特氏菌的反应类型非常相似,只有少数反应有差别,导致系统鉴定的可疑菌落中的单增李斯特氏菌有可能被误判为英诺克李斯特氏菌,而且误判的可信度可能达到可接受水平,严重影响了检测人员对结果的判定,其他检验检测机构也遇到了类似情况[16],因此不建议直接采信生化鉴定仪的分析结果,应当根据生化鉴定试剂条以及其他生化反应综合判定。
能力验证是检验检测质量控制的关键环节,能够准确反映实验室检测过程的可靠性和检测结果的准确性,参加能力验证活动可以有效监测检验检测实验室的运行情况,提高实验室人员的检测能力和水平[17-18],通过分析组织方发布的能力验证结果报告,可以发现易被忽视的关键风险点,以采取相应措施进行质量控制。本次试验使本实验室的检验检测能力得到了有效验证,有助于本实验室检测水平的提升。
