镉与聚苯乙烯微塑料复合胁迫对小油菜生长发育、生理特征及冠层温度影响效应研究
2024-03-02丰晨晨郭冰林李岚涛
林 迪,丰晨晨,陈 悦,郭冰林,李岚涛
(1.河南农业大学林学院,河南 郑州 450046;2.河南农业大学资源与环境学院,河南 郑州 450046)
镉(Cd)具有降解难、隐蔽性高和毒性强等特点[1-2]。研究表明,Cd胁迫可显著抑制植物正常生长发育,使植株矮小、叶色乏绿、根尖变黄、关键酶失活、氧化还原系统功能失衡等,严重时可造成植物死亡[3]。微塑料(MPs)是指粒径大于100 nm且小于5 mm的塑料颗粒和碎片,作为一类新型环境污染物,其在土壤中富集来源广泛[4]。研究显示,MPs对植物生长发育、生理特征均有较大影响,如氧化应激响应、细胞毒性、营养与品质构建等[5]。此外,MPs对植物光合作用、叶片叶绿素和可溶性蛋白质含量等参数的抑制效应同样明显[6-7]。前人对黑藻和黄瓜的研究结果表明,外源添加MPs胁迫后其株高和干重与对照株相比显著降低[8-9]。
聚苯乙烯微塑料(PS-MPs)是较为常见的MPs之一,具有稳定性高、可塑性强、耐腐蚀等特点,在生活中应用广泛[10]。目前,巨大的PS-MPs使用量增加了农田土壤环境污染风险。前人研究认为,低浓度MPs对植物生长发育具有促进作用,可激发植物对MPs的刺激效应,增强植物对环境变化的耐受性[11];高浓度MPs则会对植物发育产生负面效应,如造成植物DNA受损、氧化损伤、降低植物光合作用、恶化营养品质等[12]。此外, MPs进入土壤环境后可与土壤重金属Cd产生协同污染效应或相互阻抑效应。王晓晶等[13]研究显示,添加PS-MPs可显著降低Cd的生物有效性。与此相反, 宁瑞艳等[14]研究表明,MPs的添加促进了东南景天和叶芽鼠耳芥对Cd的吸收,增强了Cd对东南景天生长的抑制作用。LIAN等[15]研究发现,Cd和PS-MPs联合暴露并未显著激活小麦叶片抗氧化酶活性,但可有效提高小麦叶片有机自由基含量。WANG等[16]研究表明,MPs可以在一定程度上降低Cd的生物利用度,减缓其负向胁迫效应。
作为新型环境污染物,PS-MPs不仅自身对植物生长发育具有显著影响,同时也可作为其他污染物的载体,两者双向复合后往往会对植物系统产生“1+1>2”的影响效应[17]。目前, 我国农田Cd污染面积高达20万 km2。西南地区土壤团聚体调查结果显示,MPs平均丰度为18 760 kg-1[18]。研究表明,河北地区土壤中塑料地膜平均残留量高达100 kg·hm-2以上[19]。城市化、工业化快速发展以及农膜、农药包装等塑料制品的大量使用,使Cd和MPs复合污染问题逐渐引起人们广泛关注和重视。MPs可以作为Cd载体共同进入植物体,对其生长发育、生理特征产生负面效应[20]。目前有关重金属Cd与PS-MPs复合影响的研究相对较少,Cd和PS-MPs在植物体内的复合效应及机制仍不明晰。
小油菜(Brassicachinensis)是广受人们喜爱的广谱蔬菜,在国内外多地均有种植。如何减少小油菜等蔬菜产品中重金属Cd和MPs污染物含量,控制Cd和MPs污染物向食物链迁移,继而保障农产品质量安全成为一个重要的科学问题,也是一个亟待解决的技术难题。有关小油菜等蔬菜中Cd与PS-MPs复合胁迫的报道相对较少,其响应Cd与PS-MPs胁迫的生理机制仍不明晰。因此,系统研究Cd与PS-MPs对小油菜生长发育及生理特征的影响效应,对保护生态环境及人体健康安全意义重大。基于此,以小油菜为研究对象,采用室内水培实验,以Cd和PS-MPs为外源胁迫因子,系统探究Cd和2种粒径(100 nm和1 000 nm)PS-MPs复合胁迫对小油菜生长发育、光合生理、抗氧化酶活性、叶片解剖结构、营养品质、冠层温度等生理特征的影响,以期为阐明小油菜在Cd和PS-MPs共存胁迫下的毒理学应激响应机制、环境风险评估以及Cd与MPs污染治理提供理论参考和科学依据。
1 材料与方法
1.1 供试材料与方法
供试小油菜为目前市场上广泛种植的常规品种“五月慢”(购自上海申耕农业发展有限公司)。该品种全生育期150 d左右,适应性强,品质好,株型高大,在全国范围均可种植。氯化镉(CdCl2,分析纯)购自福晨(天津)化学试剂有限公司,其纯度w高于99%。聚苯乙烯微塑料(PS-MPs)购于上海辉质生物科技有限公司,PS-MPs颗粒的粒径分别为100和1 000 nm。
水培实验于河南农业大学水培实验室进行。选取籽粒饱满、大小均一的小油菜种子,先用w=15%的H2O2浸泡15 min,再用蒸馏水洗净后放入30 ℃左右的温水中浸泡20 min,最后放入装有少量水的专用育苗盘内,置于25 ℃恒温培养箱暗培养120 h后转入人工气候室。待小油菜长至两叶一心时,选取长势一致的幼苗移植到1/8 Hoagland′s营养液的黑色塑料盒中进行培养。随小油菜幼苗长势增大,每隔3 d逐步将营养液浓度调整为1/4、1/2和全量Hoagland′s浓度。水培试验均在人工气候室进行,昼夜时间为16 h∶8 h, 昼夜温度均保持在20 ℃,相对湿度为55%~65%。
1.2 实验设计
根据课题组前期预实验及相关研究结果,确定小油菜中等和高Cd胁迫浓度范围分别为10~30和150~250 μmol·L-1;中等和高PS-MPs胁迫浓度范围则分别为0.5~1.5和15~25 mg·L-1。基于此,将Cd和PS-MPs胁迫梯度分别设为0、20、200 μmol·L-1(分别记为Cd0、Cd20、Cd200)和0、1、20 mg·L-1(分别记为MPs0、MPs1、MPs20)。待小油菜第3片心叶完全展开时,浇灌添加Cd和2种粒径PS-MPs复合胁迫处理的Hogland′s营养液。共设置9个处理, 分别为Cd0-MPs0(CK)、Cd0-MPs1、Cd0-MPs20、Cd20-MPs0、Cd20-MPs1、Cd20-MPs20、Cd200-MPs0、Cd200-MPs1、Cd200-MPs20。每3 d更换1次营养液,同时控制营养液的pH值在6.0左右。每个处理设5次重复。

表1 Cd和PS-MPs复合胁迫下小油菜生长发育响应特征
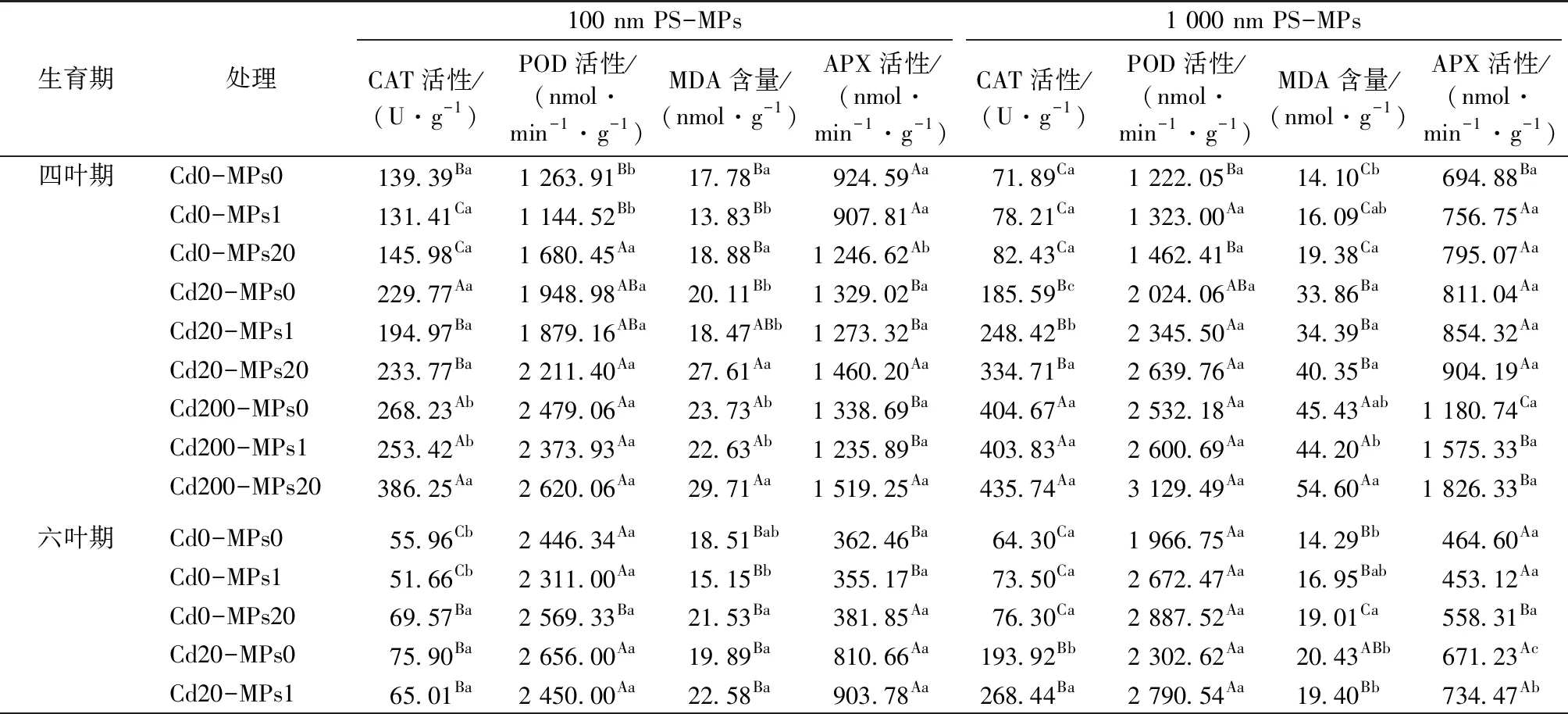
表3 Cd和PS-MPs复合胁迫下小油菜叶片抗氧化酶活性
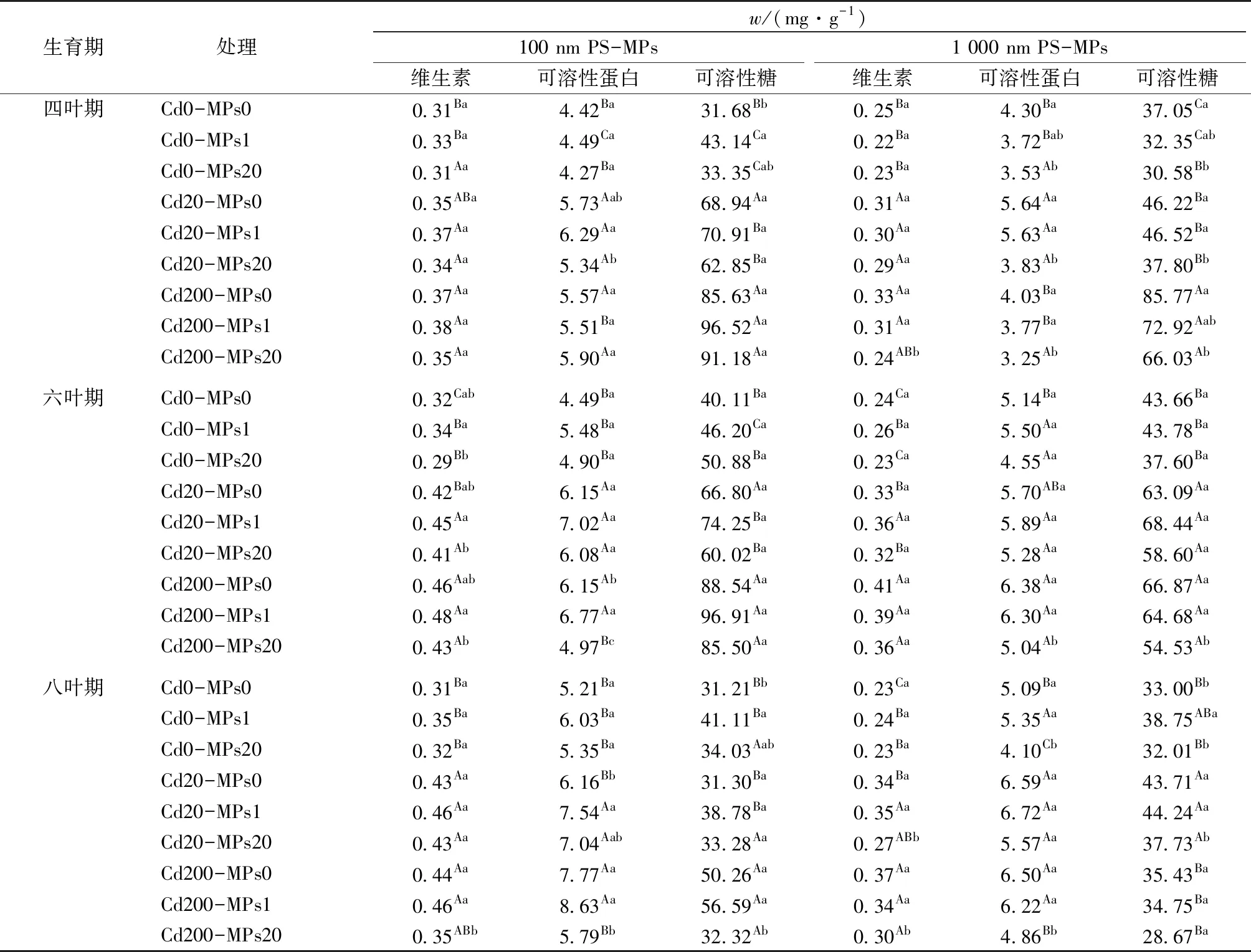
表4 Cd和PS-MPs复合胁迫条件下小油菜叶片品质特征

表5 Cd和PS-MPs复合胁迫条件下小油菜叶片解剖结构的特征
1.3 指标测定
1.3.1表型生长指标测定
分别于小油菜四叶期、六叶期和八叶期,使用直尺(精确到0.1 cm)测量小油菜株高,采用数码相机拍照法无损测试叶面积。将小油菜地上部和根称重后,置于105 ℃烘箱中杀青30 min,然后降温至70 ℃烘干至恒重,称其干重。
1.3.2叶片叶绿素含量测定
分别于上述小油菜生育期,各处理选取第3片完全展开叶(自上而下),采用丙酮浸提、分光光度法测试叶片叶绿素〔Chl-a、Chl-b和Car(类胡萝卜素〕含量[21]24-26。
1.3.3抗氧化酶活性测定
分别采用碘量法测定过氧化氢酶(CAT)活性,愈创木酚法测定过氧化物酶(POD)活性,硫代巴比妥酸法测定丙二醛(MDA)含量,抗坏血酸过氧化物酶(APX)活性参考侯福林[21]30-32的方法测定。CAT酶活性用1 g鲜重样品1 min内分解H2O2的质量表示。POD酶活性以1 min氧化1 nmol愈创木酚定义为1个酶活力单位。APX活性以1 min氧化1 nmol抗坏血酸定义为1个酶活力单位。
1.3.4品质指标测定
采用蒽酮比色法测试小油菜叶片可溶性糖含量,考马斯亮蓝法测定叶片可溶性蛋白含量,2,6-二氯酚靛酚滴定法测定叶片维生素C含量[21]54-56。
1.3.5叶片解剖结构测定
于各生育期选取小油菜第1片完全展开叶,在距离主叶脉0.5 cm左右处剪取1 cm×3 cm大小叶片,采用石蜡树脂包埋、甲苯胺蓝染色法制作切片。在OLYMPUS BH2型植物显微成像分析系统中选取5个视野清晰的位置拍摄,拍摄倍数为200倍。利用Image-Pro Plus 6.0专业图像分析软件测定叶片解剖结构指标。
1.3.6植物热成像指标测定
采用Fluke TiX650型红外热成像仪测定小油菜冠层温度。将红外相机固定在小油菜植株上方约1.0 m高度,45°观察角俯视拍摄。每次重复拍摄4张照片, 采用SmartView软件对小油菜冠层温度进行分析。
1.3.7Cd浓度和积累量测定
称取烘干并磨碎的植物样10.0 mg置于消煮管中,采用HNO3-HClO4(体积比3∶1)混合液浸提,原子吸收光谱仪测定小油菜根和叶片Cd含量,并计算各部位Cd积累量。
1.4 数据分析
采用Excel 2007软件进行基础数据输入和分析,采用SPSS 25.0软件进行方差分析,利用Origin 2018软件作图。
2 结果与讨论
2.1 Cd与PS-MPs复合胁迫对小油菜生长发育的影响
植株生长发育受其体内化学过程控制,故其能够在外界胁迫时作出敏感反应[22]。实验结果(表1)显示,Cd胁迫显著抑制小油菜生长发育,低PS-MPs浓度(1 mg·L-1)可有效缓解Cd胁迫毒害效应,而高PS-MPs浓度(20 mg·L-1)则加剧Cd胁迫效应(表1)。20 和200 μmol·L-1Cd与不同粒径PS-MPs共存对小油菜各生育期胁迫效应表现为:低浓度PS-MPs(1 mg·L-1)下小油菜株高、叶面积、根干重和叶干重显著增加,Cd胁迫毒害效应降低;高浓度PS-MPs(20 mg·L-1)下小油菜上述生长发育指标与对照(MPs0)相比整体呈降低趋势。已有研究表明,MPs对植物生长不仅具有直接危害,同时也可作为重金属载体对植物产生间接毒性,导致重金属Cd与MPs联合污染产生协同效应[17, 23],影响植物正常生长发育[24-26]。WANG等[27]研究认为,聚乳酸微塑料(PLA-MPs)可增强Cd的生物毒性,激活氧化还原系统,抑制玉米生长。该实验结果与上述结论不尽一致,即PS-MPs与Cd互作呈“低促高抑”的变化趋势,表明MPs对Cd毒性的影响因MPs类型、粒径和浓度等而异。
2.2 Cd与PS-MPs复合胁迫对小油菜Cd积累效应的影响
在Cd浓度为20 μmol·L-1时,小油菜单株根和叶Cd积累量均随PS-MPs浓度增加呈先升高后降低的变化趋势;在Cd浓度为200 μmol·L-1时,小油菜单株根和叶Cd积累量均随PS-MPs浓度增加呈降低趋势(图1)。研究表明,MPs可吸附众多微量元素,如Cd、Al、Cu等,其中Cd因其污染范围广、移动性大等特点极易和MPs形成Cd-MPs复合体[28]。Cd-MPs复合体可显著提高Cd的生物积累,并增强Cd对生物体的毒性。宁瑞艳等[14]研究显示,MPs的添加促进了东南景天和叶芽鼠耳芥对Cd的吸收,增强了Cd对东南景天生长的抑制作用,但当MPs质量浓度为500 mg·L-1时Cd对叶芽鼠耳芥的毒害作用有所减弱。笔者研究同样表明,低浓度PS-MPs可缓解Cd对小油菜的毒害作用,高浓度PS-MPs则与此相反,主要原因可能是PS-MPs吸附了溶液中的Cd2+,导致Cd2+浓度降低,进而降低了小油菜幼苗根部对Cd2+的吸收[29]。

Cd0、Cd20、Cd200分别表示Cd浓度为0、20、200 μmol·L-1;MPs0、MPs1、MPs20分别表示PS-MPs质量浓度为0、1和20 mg·L-1。同一列数据后小写字母不同表示相同Cd浓度下不同PS-MPs处理之间某指标差异显著(P<0.05), 大写字母不同表示相同PS-MPs浓度下不同Cd处理之间某指标差异显著(P<0.05)。
2.3 Cd与PS-MPs复合胁迫对小油菜叶绿素含量的影响
叶绿素是植物进行光合作用的主要色素,为生命活动提供能量来源。由表2可知,2种粒径PS-MPs与Cd的复合胁迫效应均表现为随Cd浓度增加, 小油菜Chl-a、Chl-b和类胡萝卜素含量逐步下降;外源添加低浓度(1 mg·L-1)PS-MPs可有效缓解Cd毒害效应,提高叶绿素含量。随PS-MPs浓度升高(20 mg·L-1),其与Cd复合胁迫呈协同趋势变化,即进一步加剧毒害胁迫,降低叶绿素含量。研究表明,环境胁迫可引起植物叶片叶绿体中色素蛋白脂质复合物的弱化甚至解体,或是与叶绿素分子合成有关的蛋白酶受到限制,进而导致叶绿素含量降低[30]。目前,Cd和MPs复合胁迫对植物生长表现出2种效应。一是协同效应,即MPs胁迫增强Cd对植物生长的抑制效应。MPs吸附Cd后聚集在根系表面,较大粒径的MPs容易造成根细胞孔堵塞,影响根对水分及营养物质的吸收,同时也增加根系与Cd的接触,便于更多的Cd进入植物根部,加重对植物生长的抑制作用。二是拮抗效应,MPs较多的吸附位点无法直接进入植物体内,使营养液中Cd含量减少,导致Cd生物利用性降低,同时较高浓度MPs相互吸附发生团聚,产生浓度聚集效应,导致粒径变大,吸附位点增加,从而降低Cd的生物利用性。
2.4 Cd与PS-MPs复合胁迫对小油菜抗氧化酶活性的影响
抗氧化防御体系是植物调节细胞代谢平衡的重要屏障[31]。当植物受到环境胁迫时,细胞内可产生大量的ROS,如超氧阴离子(O2-)、过氧化氢(H2O2)和羟基(OH-)等,破坏植物细胞膜、蛋白质和DNA,造成细胞损伤[32-33]。研究表明,少量ROS作为信号分子可诱导植物对外界胁迫产生应激响应,使其体内抗氧化酶活性增强,SOD将O2-歧化为H2O2,POD、CAT和APX则将H2O2还原为H2O和O2[34]。表3显示,20 μmol·L-1Cd与不同粒径PS-MPs胁迫下小油菜呈现较低的胁迫效应,当PS-MPs质量浓度为1 mg·L-1时POD、APX和CAT酶活性显著降低;20 μmol·L-1Cd与高浓度(20 mg·L-1)PS-MPs共存时,CAT、POD和APX酶活性显著高于对照,进一步表明低浓度PE-MPs可缓解Cd毒害效应,高浓度PE-MPs则加剧Cd毒害程度。
2.5 Cd与PS-MPs复合胁迫对小油菜品质的影响
由表4可知,Cd和PS-MPs复合胁迫对小油菜叶片维生素、可溶性糖和可溶性蛋白含量产生先升后降的胁迫效应。四叶期,Cd(20 μmol·L-1)和PS-MPs(1 mg·L-1)共存时小油菜叶片可溶性糖、可溶性蛋白、维生素含量皆高于Cd单一处理,分别为0.37、6.29、70.91 mg·g-1(100 nm PS-MPs)和0.30、5.63、46.52 mg·g-1(1 000 nm PS-MPs)。
当PS-MPs质量浓度达20 mg·L-1时,叶片可溶性糖、可溶性蛋白、维生素含量低于Cd单一处理,即低浓度(1 mg·L-1)PS-MPs提升了小油菜品质,而高浓度(20 mg·L-1)PS-MPs对叶片上述指标产生负面效应,表现为“低促高抑”现象。
2.6 Cd与PS-MPs复合胁迫对小油菜叶片解剖结构的影响
外源胁迫会导致植物叶片结构、形态和功能产生改变。Cd进入植物体会导致叶片叶绿素分解、细胞膜破损、细胞质流失、细胞核空心化、叶片栅海比异常以及叶片变厚[35-36]。赵素贞等[37]研究表明,Cd胁迫下叶片变薄,栅栏组织产生明显应激反应,排列更为紧密,细胞间隙缩小。表5显示,当Cd浓度分别为0、20和200 μmol·L-1时,随PS-MPs浓度增加,小油菜叶片叶厚、栅栏组织、海绵组织厚度呈先升高后降低的变化趋势。即低浓度PS-MPs(1 mg·L-1)可有效缓解Cd对小油菜的毒害效应,提高叶片厚度;而Cd与高浓度PS-MPs(20 mg·L-1)复合胁迫呈协同叠加抑制效应。高浓度PS-MPs与Cd复合胁迫导致叶片抗性增加,在一定程度上会加剧消耗海绵体内水分,降低光合效能。
2.7 Cd与PS-MPs复合胁迫对小油菜冠层温度的影响
叶片温度反映作物生长的生理过程和能量交换,是作物生长发育及响应胁迫效应的重要指标。研究表明,作物群体温度与其光合作用密切相关。作物受外界胁迫效应较弱时,生长发育较好,叶片叶绿素含量升高,光合作用增强,呈现出明显的蒸腾吸热现象,使群体温度降低;反之,则温度升高[38]。图2表明,小油菜植株群体温度受Cd及PS-MPs复合胁迫影响显著,其变化趋势与生长发育、理化指标变化趋势一致。徐小龙[39]研究发现,患病黄瓜叶片和对照相比有1 ℃的温差,感病番茄叶片温度比正常叶片低0.5~1.2 ℃,表明植株在受到外界胁迫时温度呈降低趋势。笔者研究中,与对照相比,小油菜受Cd与PS-MPs复合胁迫后,生长发育延缓,光合色素含量减少,叶片产生应激反应,气孔关闭,水分蒸发减少,导致植株冠层温度升高。
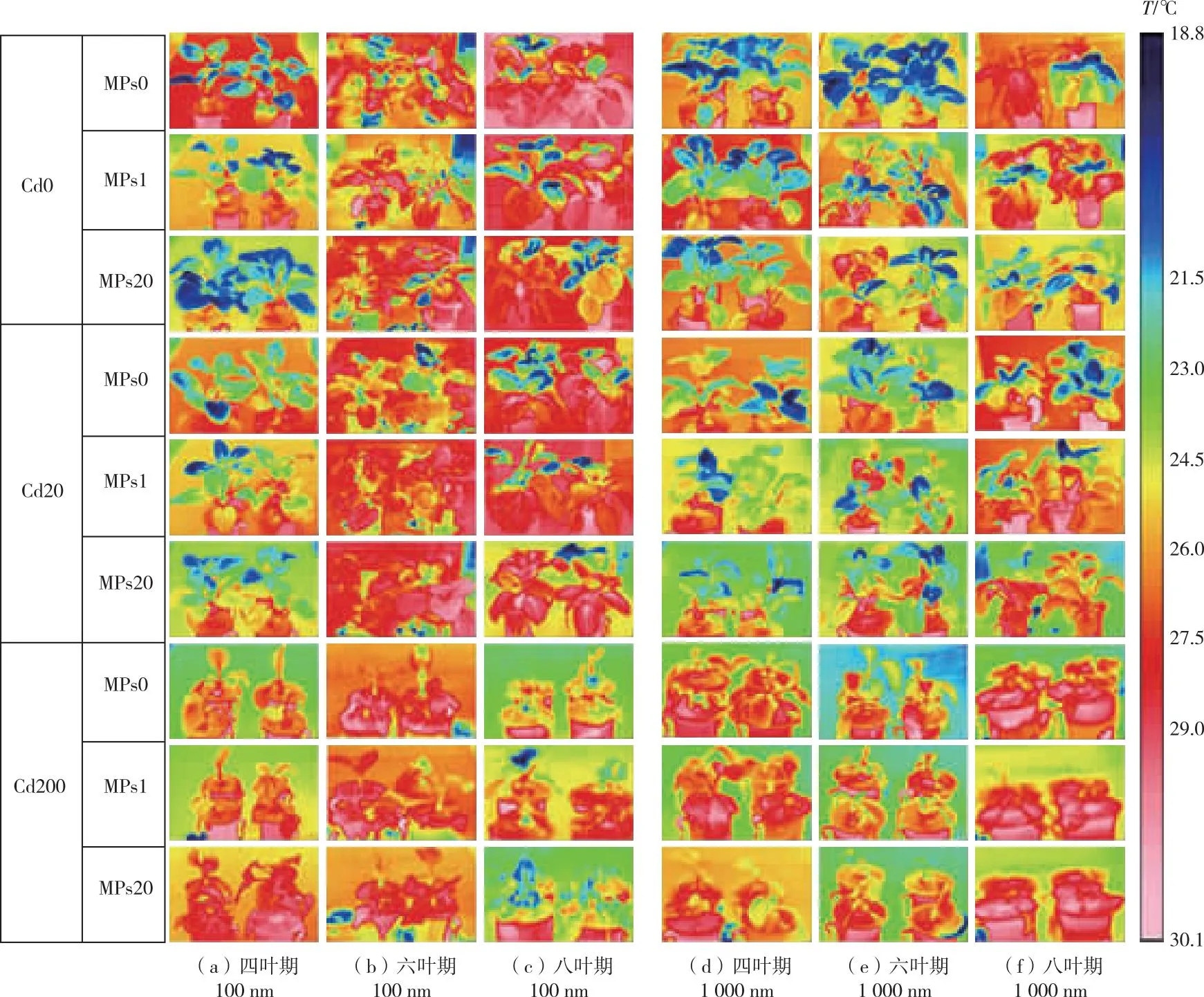
Cd0、Cd20、Cd200分别表示Cd浓度为0、20、200 μmol·L-1;MPs0、MPs1、MPs20分别表示PS-MPs质量浓度为0、1和20 mg·L-1。
3 结论
低浓度PS-MPs (1 mg·L-1)可有效缓解小油菜Cd毒害效应,促进小油菜生长发育,增加叶片光合色素、品质和叶片厚度等生理特征,降低抗氧化酶活性和冠层温度。与此相反, Cd与高浓度PS-MPs (20 mg·L-1)复合胁迫则加剧小油菜毒害效应,两者呈协同叠加的抑制作用。总体而言,Cd与PS-MPs复合胁迫对小油菜生长的影响呈“低促高抑”的变化趋势。研究结果可为小油菜Cd与MPs污染治理提供重要实验参考和理论支撑。
