激素调控植物分枝/分蘖的研究进展
2024-02-23陈奋奇张金青马晖玲
陈奋奇,张金青,马晖玲
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
植物株型是许多作物产量的决定因素之一,其由分枝数量、分枝角度及株高决定。因此,分枝是植物株型的一个重要特征,也是腋芽起始和芽生长的结果,对经济作物的种子产量以及牧草产量均具有决定性作用[1]。分蘖是禾本科植物特有的分枝。分枝/分蘖主要影响植物叶面积的展开和分布,决定了植物生长发育过程中光合作用碳固定量和能量供给[2]。同时,分枝/分蘖也会通过影响作物与杂草的竞争、害虫的传播等控制产量[3]。如向日葵(Helianthus annuus)和玉米(Zea mays)需要通过减少分枝/分蘖来改良地上结构,提高其经济效益[4]。而在水稻(Oryza sativa)[5]、小麦(Triticum aestivum)[6]等粮食作物,以及假俭草(Eremochloa ophiuroides)[7]、蒺藜苜蓿(Medicago truncatula)[8]等牧草中,需要增加有效分蘖或分枝提高种子产量、草产量及裸地覆盖率。此外,分枝状况也与作物的栽培密度及营养分配密切相关[9]。因此,挖掘作物理想株型是提高其产量的有效措施之一。
植物分枝起源于腋生分生组织(axillary meristem,AM),AM 的数量和侧芽活性是决定植物分枝状况的主要因素[10]。AM 经分化形成与主枝呈一定角度的侧枝或分枝[11]。分枝/分蘖的发育一般经历3 个阶段,即AM 起始阶段、AM 带叶发育阶段和AM 生长阶段[12]。因此,找到3 个阶段的调控因子,如EXB1[13]、TB1[14]、BRC1[15-16]和D53[17]等基因,并利用现代基因编辑技术和工具对这些基因进行靶向操纵获得理想株型,便可以实现作物产量的提高和经济收益的增加。除了遗传调控因子外,外界环境和内源激素水平也在植物分枝过程中发挥重要作用。
植物侧芽形成后既可直接分化为侧枝,也可进入过渡生长期,形成休眠芽[18]。解除休眠后,侧芽继续发育为侧枝[19]。因此,AM 形成后是否能够发育成侧枝主要取决于外界因素及激素水平[20]。植物激素的生理效应复杂且多样,目前应用较多的激素主要有生长素(indole-3-acetic acid,IAA)、赤霉素(gibberellin,GA)、细胞分裂素(cytokinin,CK)、脱落酸(abscisic acid,ABA)、独脚金内酯(strigolactone,SL)、乙烯(ethylene,ETH)、水杨酸(salicylic acid,SA)、油菜素甾醇(brassinosterol,BR)和茉莉酸(jasmonic acid,JA)等。植物分枝过程中,环境因子可改变植物激素含量,促使其达到动态平衡,进而激发相关基因表达[15,21]。可见,环境因素是通过改变植物激素含量及其平衡来调控分枝的。近年来,关于激素调控植物分枝的研究已经取得重大进展。已报道IAA、CK 和SL是作用明确和清晰的3 种激素,其中IAA 和SL 抑制侧芽生长,CK 则促进侧芽生长[22],其余激素对分枝的调控作用也有相关报道(表1)。本研究立足于当前植物分枝/分蘖的研究进展,力图总结控制该性状的激素调控机制,以期为开展相关研究提供参考,也为培育理想株型高产新作物品种奠定基础。
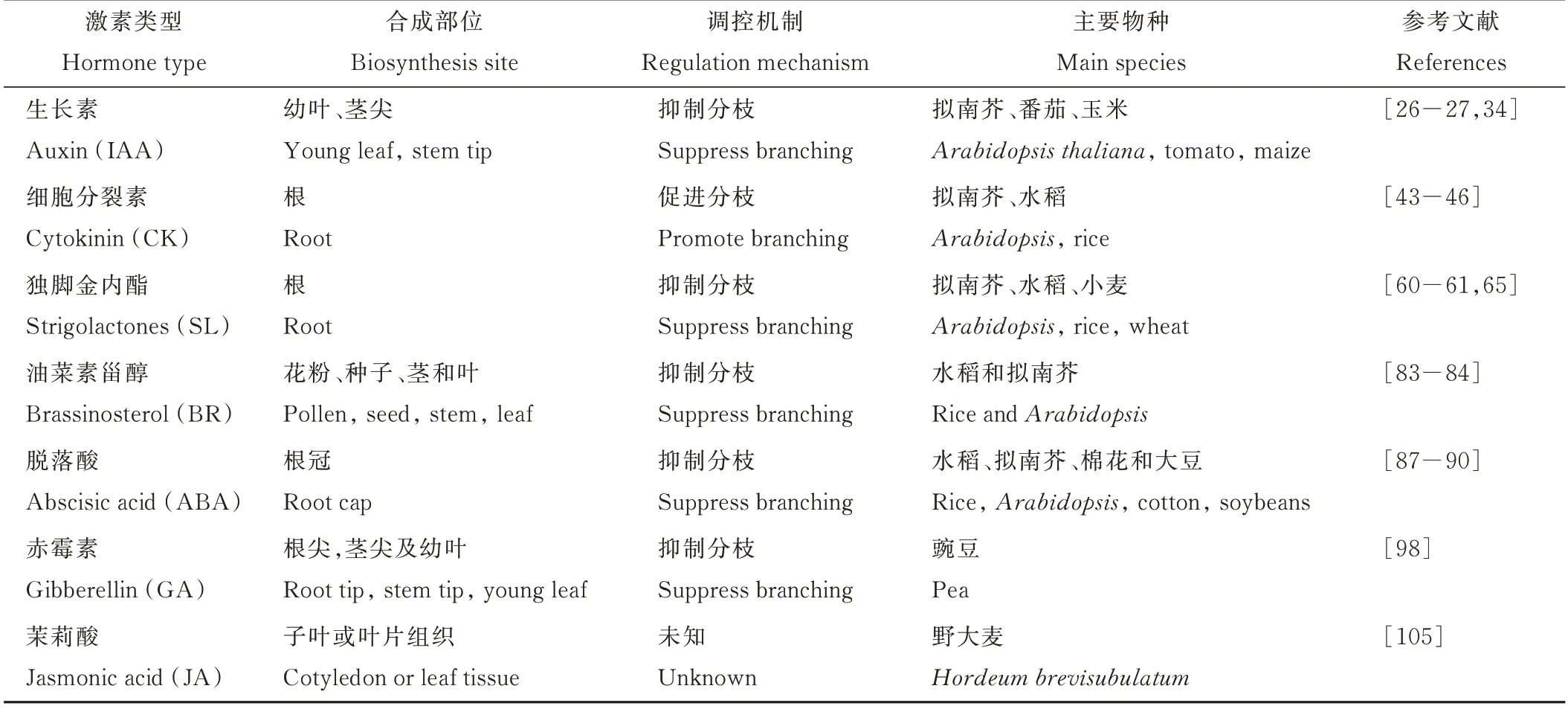
表1 参与调控植物分枝/分蘖的主要激素类型Table 1 Main hormone types involved in regulating plant branching/tillering
1 植物激素对植物分枝/分蘖的调控机制
1.1 IAA 对植物分枝/分蘖的调控机制
IAA 主要在植物幼叶和茎尖合成,是最早发现的调控植物分枝的激素[23]。IAA 从茎顶端向基部的运输过程称为极性运输(polar auxin transport,PAT),IAA 输出载体(PIN 和ABCB/PGP)参与调节该过程[24]。PIN 主要参与IAA 运输而对侧枝起调控作用,而生长素抗体/类生长素抗体(auxin resistant/like auxin resistant,AUX/LAX)作为IAA 输入协同转运因子通过叶的分化调控分枝[25]。
研究发现,IAA 含量降低或外流是AM 形成所必需的[26-27]。IAA 调控植物分枝的主要假说是顶端优势,故生产中通常使用去除植物顶端组织的方式降低IAA 含量,达到促进分枝的目的[19]。然而,直接在腋芽处用外源IAA 处理并不能抑制腋芽生长。同时,植物顶端产生的IAA 也无法转运到腋芽发挥作用[28]。可见,IAA 并不是以直接作用的方式抑制侧芽发育[18]。综上所述,Waldie 等[29]推测,IAA 调控侧枝发育的原因可能是控制腋芽自我建立PAT 的能力,也可能是通过第二信使间接发挥作用的。
除顶端优势外,IAA 对分枝的调控也与IAA 运输假说有关。这一假说指出,无论是顶端分生还是腋生分生组织,只有在主动输出IAA 的基本状态下才能生长,即所谓的IAA 极性运输流(polar auxin transport stream,PATS)。同时,芽必须将IAA 输出到主茎的PATS 中,才开始生长。Bennett 等[25]扩展了这一概念,认为拟南芥(Arabidopsis thaliana)多分枝(more axillary growth,MAX)途径通过调节IAA 运输来控制PIN表达,进而调控顶端优势。Ferguson 等[30]认为,在表现出完全顶端优势的植物中,PATS 以最大能力发挥作用,或以某种方式限制IAA 运输特性,因此PIN无法转运从芽进入的额外IAA。因此,在番茄(Solanum lycopersicum)叶腋处施加IAA可以有效抑制AM 形成,同时极性IAA 转运突变体中IAA 信号抑制可以恢复其分枝缺陷[26]。相关抑制是另一概念,可以将上述IAA 运输假设应用于生长芽之间的竞争,该假说指出,根据每个芽中IAA 运输的程度,两个生长芽之间相互抑制[31]。
IAA 含量由许多基因调控,如下调OsPIN1可以弱化顶端优势,引起水稻分蘖增加[32]。研究表明,AM 在IAA含量低的叶肉细胞中形成,且已知DII表达水平与IAA 含量呈负相关,而DR5正向调节IAA 信号转导[10],表明上调DII或者下调DR5均可减少IAA 含量或降低其信号转导,进而增加植物分枝。YUC是IAA 合成关键基因,它缺失会导致IAA 合成减少,最终增加植物分枝[33]。相反,YUC上调则会抑制植物分枝。另外,IAA 外排载体抑制剂萘草胺(N-1-naphthylphthalamic acid,NPA)的应用也会抑制玉米花序中AM 的启动,同时影响小穗发育[34]。这可能为利用IAA 途径同时调控禾本科植物分蘖和穗发育,进而增加粮食产量提供了新的思路。
1.2 CK 对植物分枝/分蘖的调控机制
CK 合成于根中,在植物失去顶端优势后,在茎中也有合成,受外源IAA 抑制,并通过蒸腾作用从木质部向上运输[35],其在腋芽激活及植物生长发育的各个方面扮演重要角色[36]。大量研究表明,CK 可以促进休眠芽生长,且芽中或芽附近的CK 水平与芽的命运紧密相关[37]。遗传学分析也表明,CK 的接收和信号转导对AM 的形成是必需的[27]。如施加CK,能够直接促进腋芽生长,并增加CK 含量,且具有剂量依赖性[38]。在叶腋处过量合成CK 可以部分恢复rax突变体AM 减少的表型,且叶腋中产生过量的CK 可挽救AM 启动缺陷的突变体[27]。施加部位除了腋芽和叶腋外,在维管束上或侧芽邻近的茎上施加外源CK 也可促进侧芽生长。有研究报道,CK 作用于完整植株的侧芽生长,对去顶植物的侧芽生长没有调控作用,表明CK 调控侧芽生长的方式是促进其减弱顶端优势[39]。
CK 也可以促进AM 起始和侧芽形成以及侧枝伸长,拟南芥sps多分枝突变体由于CK 水平增加导致莲座叶和茎生叶的叶腋形成多个AM,增加了分枝数[40]。CK 相关基因的特异性表达也会直接影响植物侧芽生长[41-42]。如CK 合成关键基因IPT高表达可促进侧芽活化,进而增加拟南芥分枝[43]。WUS及其在水稻中的同源基因MOC3/TAB1是AM 形成必需的[44-46],CK 在叶腋处可诱导WUS的表达[47],如Type-B 类ARRs(CK 下游的转录激活因子)可直接结合WUS并激活其表达[46]。Wang 等[46]研究表明WUS和CK 的结合与增加的组蛋白乙酰化及转录激活相关的甲基化标记相关,且CK 调控WUS表达需要特定的表观遗传环境将其限制在高度定义的分生组织中[48-49],这表明调控分枝的CK 途径不仅与表观遗传相关,而且只在特定组织中发挥作用。
1.3 SL 对植物分枝/分蘖的调控机制
SL 是由类胡萝卜素代谢产生,合成于根部的一种新型植物激素,由形态学下端向上端运输,抑制芽的生长[50]。2008 年,2 篇发表在Nature 的研究论文均指出SL 能够调节植物地上部结构,而且SL 或其下游代谢产物被认为是一种新型的分枝抑制剂[51-52]。SL 的生物合成及其抑制植物分枝/分蘖的信号通路如图1 所示。大多数研究SL 控制植物地上结构的报道都是通过多分枝突变体进行的,如豌豆(Pisum sativum)rms[53]、拟南芥max[54]以及水稻d10和htd1[55]。相关学者发现,从这些矮化多分枝/分蘖突变体中筛选的突变基因,在SL 生物合成和信号转导中行使功能,进一步验证了SL 作为新的植物激素抑制侧芽生长[56-57]。
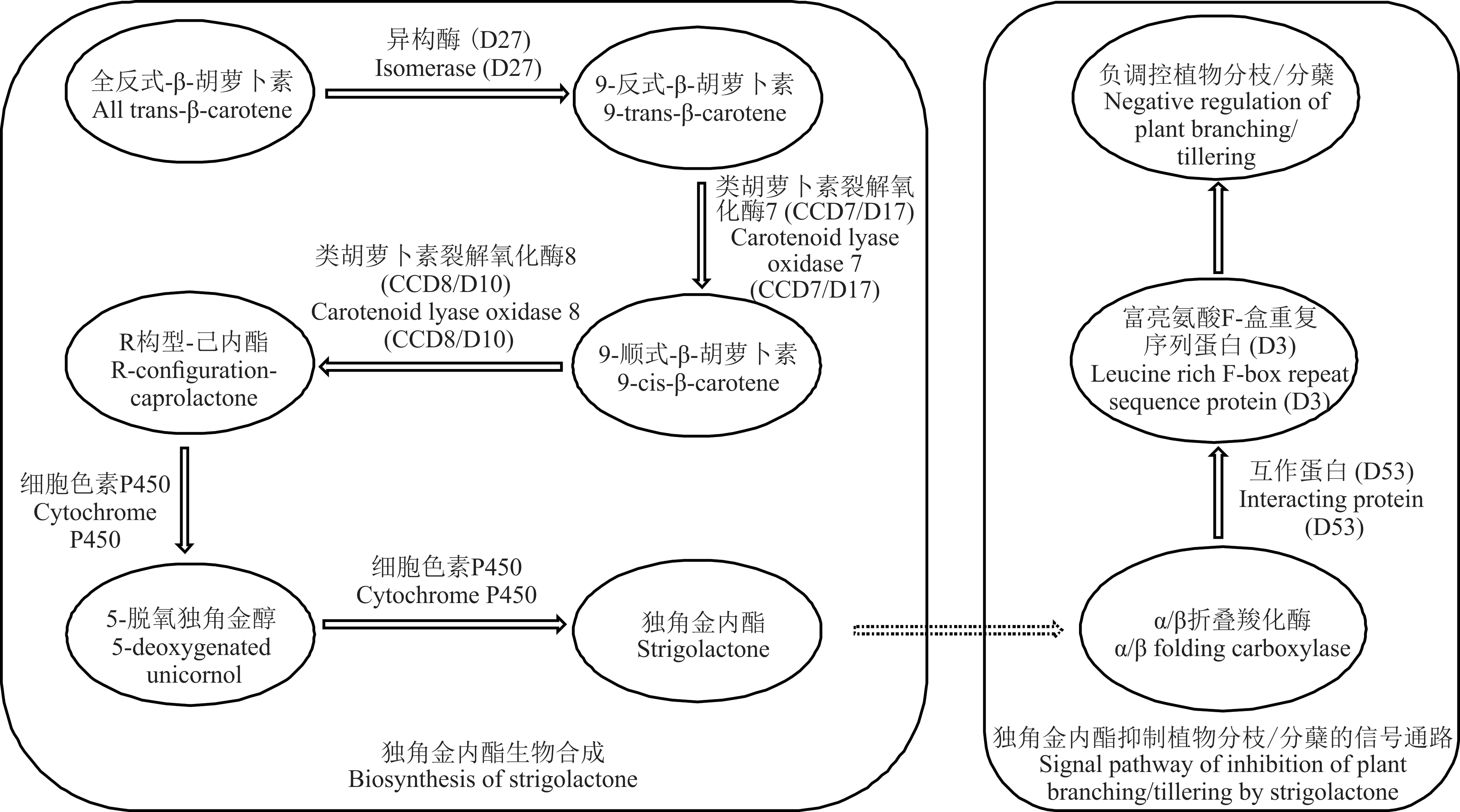
图1 SL 的生物合成及其抑制植物分枝/分蘖的信号通路Fig.1 Biosynthesis of SL and its signaling pathways inhibiting plant branching/tillering
SL 还可以通过下游信号分子来调控侧枝发育,如水稻d3、d10、d14、d17和d27突变体具有植株矮小、分枝增多的表型,与突变体fc1相似,已证明fc1作用于SL 下游抑制侧枝[58]。双重突变体(brc1和SL 生物合成或信号转导突变体)表现出更多的分枝表型[21,54,59],且对去除顶端、外源CK 和环境因素表现出一定的响应[15,38,54],其中,BRC1是分枝负调节因子[21]。BRC1在拟南芥max突变体中表达降低,且max/brc1双突变体与单突变体表现出的多分枝相同,表明BRC1与MAX利用同一途径发挥作用,而SL 可能正调控MAX/BRC1[54]。相关学者重新揭示了水稻和拟南芥的SL 信号通路中核心的保守转录级联,该信号通路直接调节茎分枝[60-61]。与拟南芥同源基因BES1一样,SL 通过促进OsBZR1降解抑制水稻分蘖,这一过程与受体复合物D14-D3 相关[60]。因此,OsBZR1/BES1和D53/SMXLs作为侧芽分枝的正调节器,在D14/AtD14-D3/MAX2下游负转导SL 信号[62]。此外,这两项研究还表明,水稻基因FC1及其拟南芥同源基因BRC1作为芽生长的局部关键开关,与OsBZR1/BES1和D53/SMXLs具有上位性。OsBZR1/BES1和D53/SMXLs在基因上相互依赖,以抑制FC1/BRC1表达,控制分枝[60-61]。
植物对SL 的感知需要α/β 水解酶D14,D14具有保守的催化三联体(Ser-His-Asp),SL 水解和信号转导过程中必须有Ser-His-Asp 的参与,故D14是SL 降解和信号转导必需的[63]。除D14之外,D3、D10、D17、D27、D53均介导了SL 的生物合成和信号转导,且这些基因相互影响,形成复杂的分子网络调控植物分枝[50,64]。如TaD27-B通过参与SL 的生物合成,调控小麦分蘖数[65]。D53是位于D14和D3下游的SL 信号关键负调节因子,具有转录抑制活性[66]。拟南芥D53同源蛋白SMXL6/7/8 对其分枝具有调节作用[64,67],如过表达D53或SMXL6/7/8可增强植物分枝,并对SL 处理不敏感[68]。同时,D53可以抑制自身的表达以及下游基因BRC1、TCP1和PAP1的表达,分别调控突变体的分蘖、叶型和花青素含量[66]。给水稻突变体d3、d10和d17外施GR24 发现,d3未恢复野生株系表型,而d10和d17均已恢复[52],表明SL 在调控植物分蘖方面的作用十分复杂。
重要的是,通过SL 人工合成类似物GR24 处理,可以外源诱导抑制芽分枝,且SL 不会单独运行,而是与其他植物激素协同起作用。Xu 等[69]研究发现,在水稻根部施加2 μmol·L-1的GR24 能显著抑制水稻分蘖,与对照相比,分蘖发生率下降高达95%以上,同时其他器官的生长未受影响。然而,大量研究报道,外源GR24 处理会抑制芽分枝[70],刺激节间生长[71],加速叶片衰老[72],增强根毛伸长和初级根的生长[73],抑制腋芽生长[58],抑制不定根和侧根形成[74-75],增加茎厚度和诱导次生生长以及其他形态变化[76]。此外,SL 生物合成基因HTD1的等位基因D17,可以增加水稻的分蘖数并提高谷物产量,自绿色革命以来,已被广泛利用并与半矮秆1(SD1)共同选择[77]。
目前研究植物分枝的主要基因有MOC1、MOC3/TABL1/SRT1、LAX1、LAX2/GNP4,其诱导侧芽开始并调节分枝数量[44,78-79]。除此之外,主要是参与SL 途径的基因,D3、D10、D14/HTD2、D53/SMXL6/7/8等通过影响腋芽的生长来调节分蘖[80-81]。总体而言,SL 对植物分枝的调控机制研究已经十分广泛。
1.4 BR 对植物分枝/分蘖的调控机制
BR 是一类重要植物激素,参与调控植物生长发育的许多过程如种子萌发、生殖生长和衰老等[82]。截至目前,已分别在水稻和拟南芥中建立了由D53/SMXLs-OsBZR1/BES1所介导的SL 调控分枝发育的保守转录调控机制,同时揭示了由OsBZR1/BES1所介导的BR 信号通路在单、双子叶中调控植物分枝发育的独特分子机制[60-61]。BES1是BR 信号通路的正调节因子,拟南芥的BES1功能获得型突变体分枝增加,而BES1的RNA 沉默株系分枝减少[83],表明BR 信号通路参与了分枝的调控过程。OsBZR1和BES1在BR 信号转导中发挥关键作用,BES1最初被鉴定为BR 信号通路的一个组成部分[84],而BR 信号调控芽分枝便是通过OsBZR1/BES1实现的。BR 信号主要控制BES1的磷酸化状态,只有非磷酸化的BES1才能触发下游BR 相关转录网络[84]。Hu 等[61]进一步证明,BES1的磷酸化和非磷酸化形式都与SMXLs 相互作用,进而调节分枝,然而BR 并不影响BES1与BRC1启动子结合的能力,因此不会调节BRC1表达。这可能是BES1上游的BR 信号对芽分枝或BRC1表达没有影响的原因[61,85]。
与此相反的是,水稻中,BR 信号通过调节OsBZR1的稳定性来控制分蘖[60]。Fang 等[60]进行全面的遗传和生化分析后指出,SL 和BR 信号通路通过调节D53-OsBZR1 模块的稳定性,拮抗性地调控水稻分蘖,表明SL 和BR在植物分枝/分蘖调控方面具有拮抗作用。BES1和其同源物BZR1、BEH2和BEH3转录水平降低的BES1-RNAi 株系均显示出分枝减少的表型[85],且OsBZR1和BES1在腋芽中高度表达[60-61]。由此可知,BR 调控植物分枝/分蘖主要与SL 有关。实际上,Xia 等[22]的研究结果表明,BR 信号转导整合了控制枝条分枝的多种途径,并提出了一个模型,其中BR 信号整合了其他激素和糖信号来控制植物分枝。因此,腋芽中的局部BR 信号是塑造植物结构的潜在目标。
1.5 ABA 和GA 对植物分枝/分蘖的调控机制
目前,植物分枝的激素调控机制研究方面取得重要突破的主要是IAA、CK、SL 和BR[11,86],除此之外,GA 和ABA 对植物分枝也具有重要调控作用。ABA 与侧芽休眠关系密切,GA 类激素通过诱发IAA 的合成或抑制IAA的分解而间接影响顶端优势。
一直以来,ABA 被认为在植物分枝过程中起作用,其是拟南芥侧芽发育的负调控因子,主要抑制较低位置腋芽的生长[87]。研究发现,在腋芽中,IAA 合成酶TAA1和转运蛋白PIN1,以及细胞周期蛋白CYCDD22和增殖细胞核抗原PCNA1基因都被ABA 下调,表明ABA 可能结合IAA 并通过对细胞周期运行的某些环节抑制而发挥对腋芽发育的抑制作用[87]。先前研究表明,ABA 对水稻[88]、拟南芥[15,87]、棉花(Gossypium herbaceum)[89]和大豆(Glycine max)[90]的分蘖/分枝起负调控作用,ABA 含量升高可致使分蘖停止[91]。相关学者提出,ABA 可能不是水稻分蘖芽生长的主要调节因子,其含量随着分蘖芽生长而变化,其可能受IAA 影响而调控分蘖[92],故Cline 等[90]认为,ABA 作为第二信使受IAA 诱导进而抑制侧芽生长。然而,与此相反的是,有报道发现IAA 抑制侧芽生长与ABA 无关,利用突变体rms1、max4和dad1等研究发现,调控侧枝发育的是新抑制信号SL[93],其与IAA 互作抑制植物分枝。与SL 一样,ABA 的合成前体也是类胡萝卜素,且在植物顶部施用ABA 对侧芽生长没有影响,而在基部施用显著抑制侧芽生长,相关学者认为,这恰好是证明ABA 在顶端优势中发挥作用的间接证据[90]。
ABA 抑制植物分枝主要通过调控相关基因实现,分枝抑制因子BRC1可结合并激活HB21、HB40和HB53,这3 个转录因子可促进ABA 合成基因NCED3表达,增加ABA 含量,增强侧芽休眠[15],该研究在BRC1和ABA之间建立了联系。随后,Confraria 等[94]报道,BRC1更广泛地参与ABA 信号通路,如调控ABA 合成、转运、感知、代谢和信号转导。Dong 等[95]克隆了分蘖调控新基因TN1,且发现tn1突变体的茎基部和分蘖芽中ABA 合成关键基因的转录水平及ABA 含量均显著增加;同时,TN1与ABA 受体TaPYL存在互作,且能够显著抑制TaPYL与其下游ABA 信号转导蛋白TaPP2C 之间的互作,表明TN1通过影响ABA 合成和信号转导途径促进小麦分蘖芽伸长。
GA 主要作用是促进植物节间伸长,调控植物从营养期到生殖期的转换和种子萌发。GA 与植物侧芽发育也有一定关系,如水稻GA 缺失突变体呈现多分枝表型,相反地,GA 信号负调控因子della突变体分枝减少[96],拟南芥della五重突变体腋芽数目也减少[97],表明GA 负调节植物分枝。豌豆中,GA 和SL 双缺失突变体比各自的单突变体表现出更多的分枝,表明GA 可能独立于SL 来调控分枝发育。然而,水稻中,DELLA 蛋白通过与D14 相互作用发挥功能[98],这表明GA 对不同植物的分枝调控具有特异性,其与SL 的具体关系及作用机理还需要进一步实验的证明与补充。
BRC1的表达受多种因素调控,其中就包括GA 处理[38,54,58,99]。已有研究证实,水稻分蘖基因MOC1与GA 信号转导有关,高水平的GA 可以激活APC/CTE,促进AM 的MOC1降解,从而抑制水稻分蘖[100],也可以通过触发SLR1的降解,导致MOC1降解并抑制腋芽形成[101]。另外,外施ABA 和GA3均能抑制分蘖发生,且GA3的抑制效应大于ABA[102]。同时,提高内源GA 含量也可抑制植物分蘖[103]。
1.6 其他激素对植物分枝/分蘖的调控
除了以上6 类激素外,目前常见的其他激素种类在调节植物分枝方面的报道极其有限。仅已知,ETH 与侧枝生长有关[104]。另外,有关JA 与分枝的关系,仅报道了外源施用JA 浓度为0.01 和0.1 μmol·L-1时,可显著提高野大麦分蘖数[105]。研究者推测,JA 可能与IAA 互作调控植物分枝[33]。然而,有关ETH、JA 和SA 对植物分枝/分蘖的调控机制依然是完全未知的。
2 激素间的互作对植物分枝/分蘖的调控机制
研究表明,植物分枝是多种激素平衡作用的结果[15,21]。IAA、CK 和SL 是调节分枝和分蘖数量的3 个重要的激素调节因子,且部分通过调节分枝/分蘖基因BRC1/TB1的表达起作用[16,61,106-109]。
2.1 IAA 与SL 互作对植物分枝/分蘖的调控
在顶端合成并在主茎中运输的IAA 能够促进SL 合成基因的表达[18,110],说明SL 参与IAA 调控植物分枝[111]。实际上,IAA 抑制分枝需要SL 的参与,因为在去顶后的SL 合成缺陷突变体中,施加外源IAA 不能完全抑制其多分枝的表型[55],相反的是,施加外源SL 能抑制IAA 相关突变体的多分枝表型,表明IAA 至少部分通过SL 发挥作用。IAA 通常会促进SL 合成基因CCD7、CCD8和D27上调表达,进而增加SL 含量[112]。IAA 和SL 互作会诱导腋芽中BRC1的表达,进而抑制芽分枝[16]。另一方面,SL 被认为通过控制侧芽中IAA 的向外运输调控侧芽生长[107]。事实上,SL 能诱发IAA 外排转运体PIN 的胞吞[18,113],并抑制IAA 的合成[114]。IAA 运输独立于BRC1,在控制SL 介导的芽分枝中发挥重要作用[109],表明IAA 和SL 在调节分枝方面存在协同作用。
然而,在SL 缺陷突变体rms1中,阻断IAA 外排运输后,施加SL 可继续抑制侧芽外生[53],表明SL 抑制侧芽生长还有其他机制。去顶后主茎中IAA 含量的减少会降低SL 含量,同时在去顶植株以及IAA 信号响应axr1突变体的腋芽处涂抹GR24,均能抑制侧芽生长[115],从而论证了SL 抑制侧枝生长并不需要IAA 信号参与,同时证明了IAA 促进SL 合成是其抑制植物分枝的原因之一。关于SL 和IAA 对芽的抑制作用还存在另一种模式,即SL 通过调控IAA 极性运输来调节分枝[25,116]。这种模式下,IAA 不需要第二信使移动到腋芽部位来行使功能,SL 也不仅仅在腋芽处具有作用[117]。用IAA 运输抑制剂处理SL 突变体,多分枝表型会恢复至野生型。由此推测,SL 可能抑制了PIN 的积累和IAA 运输流,进而抑制侧芽生长[113,116]。
SL 和IAA 互作调控植物分枝主要有IAA 运输管道形成假说和第二信使假说。前者指出,腋芽活化必须外输IAA,而SL 通过阻止IAA 外输抑制腋芽生长[117]。第二信使假说指出,SL 受IAA 正向调控,同时运输至腋芽中直接参与腋芽生长[115]。有趣的是,Liang 等[118]的研究结果显示,2 个腋芽时,基部施加SL 仅抑制一个腋芽生长,另一个腋芽的发育未受影响,表明SL 通过增加两个腋芽的竞争作用而达到抑制效果,并非阻止IAA 外输起作用。这一假说与IAA 相关抑制假说很相似,一定程度上说明SL 和IAA 对植物分枝的调控具有相似性。
2.2 CK 与SL 互作对植物分枝/分蘖的调控
侧芽生长与CK 和SL 相关基因的表达关系密切,表明侧芽可能是SL 和CK 行使功能的场所[42,119]。腋芽生长因子BRC1在SL 处理时上调,CK 处理时下调,表明SL 促进BRC1表达而CK 抑制其表达[38],说明SL 和CK 调控植物分枝时,至少有1 个共同基因BRC1。然而,CK 也有另外的路径调控植物分枝,如CK 可促进brc1突变体的分枝[54],也可抑制豌豆腋芽和水稻茎尖BRC1的表达[38,54,58]。
SL 和CK 间拮抗作用的潜在机制直到现在仍不清楚,据报道,SL 可以诱导CK 降解基因OsCKX9表达,导致内源性CK 含量降低[120],且OsCKX9已被鉴定为CK 降解和水稻分蘖所需的SL 通路的必需基因[5]。IAA 可能作为SL 和CK 信号通路的整合者,通过诱导SL 生物合成和/或抑制CK 生物合成来抑制芽生长[16,107]。SL 合成缺失突变体rms1和信号缺失突变体rms4中,CK 合成基因PsIPT1上调表达,其含量升高。然而,多分枝的SL 突变体中,CK 含量显著低于野生型,表明SL 可能反馈调节CK 合成,但具体机制尚不明确。当对rms1和rms4同时施加GR24 和6-BA 时发现,GR24 降低了6-BA 对芽生长的促进作用,rms1中表现更明显,表明SL 主要通过影响CK 信号实现对植物分枝的调控[38]。
2.3 CK 与IAA 互作对植物分枝/分蘖的调控
SL 和CK 被认为是通过控制侧芽中IAA 的向外运输来调控侧芽生长[107,121]。IAA 外输转运体在CK 信号突变体中极性分布降低,表明CK 可通过IAA 外输转运体的极性分布调控侧芽生长[107]。IAA 通过控制CK 合成基因OsIPT的表达调控水稻分蘖生长[32]。除了通过调节CK 合成基因IPT外,IAA 还可以调节CK 降解基因CKX及信号转导基因RR等调控分枝[41]。反过来,CK 可促进IAA 转运体PIN3、PIN4 和PIN7 的积累,进而调节分蘖[10]。CK 合成和信号转导突变体的分枝数与主茎IAA 运输及PIN3/7 的积累相关,表明CK 调控侧芽生长与IAA 运输有关[107]。与brc1类似,应用外施CK 处理pin3/4/7突变体,能促进突变体分枝,表明CK 调节芽分枝的机制并不仅仅只通过PIN 蛋白积累[122]。
2.4 BR 与SL 的互作对分枝/分蘖的调控
BR 和SL 在调控分枝方面存在拮抗作用。SL 和BR 信号通路都通过调节D53和OsBZR1-RLA1-DLT 转录复合物的稳定性来控制水稻分蘖[11]。拟南芥BR 信号因子BES1的功能获得型bes1-D突变体表现出多分枝,及对SL 信号不敏感的特征[85]。深入研究发现,SL 信号因子MAX2可诱导BES1泛素化及其在植物中的降解,从而与BR 互作共同调控植物分枝。然而,BR 和SL 下游的作用因子以及进一步的作用机制仍不明确。
2.5 其他激素互作对植物分枝/分蘖的调控
理想株型1(ideal plant architecture 1,IPA1)编码转录因子OsSPL14,IPA1 对分蘖和穗的控制主要通过直接激活TB1、D53和DEP1的表达实现[14,123]。虽然IPA1 主要参与SL 途径,但也可以调节GA 稳态。GA 信号转导触发NGR5 降解,以释放H3K27me3 修饰对IPA1 转录的抑制,从而促进腋芽的形成和生长[124]。相关学者鉴定到一个高分蘖突变体20(t20),其可以通过用GR24 处理恢复为野生型;T20编码叶绿体z-胡萝卜素异构酶(z-ISO),其参与类胡萝卜素及其代谢产物SL 和ABA 的生物合成。t20突变体同时降低了SL 和ABA,而GR24 刺激了T20的表达,并增强了所有反式胡萝卜素的生物合成;重要的是,GR24 还通过诱导OsHOX12刺激OsNCED1的表达,促进茎基ABA 的生物合成。另一方面,ABA 处理显著抑制SL 生物合成,降低了t20和野生型植株的基部分蘖数,而ABA 生物合成突变体显示SL 生物合成升高;尽管ABA 缺乏突变体aba1和aba2具有与野生型相同的分蘖数,但它们在成熟时具有更多的非生产性分蘖[88]。CK 信号转导来自IAA、SL 和糖的信息以促进BR 的产生,BR 激活BZR1转录因子以抑制芽生长抑制剂BRANCHED1的表达。目前,已经报道了大量参与调控植物分枝的激素相关基因(表2),还有部分激素的作用并不十分明确,依然有待进一步研究。综合分析表明,激素信号对植物分枝的控制不是独立的,而是多种激素信号相互作用形成复杂的调控网络共同决定植物分枝。
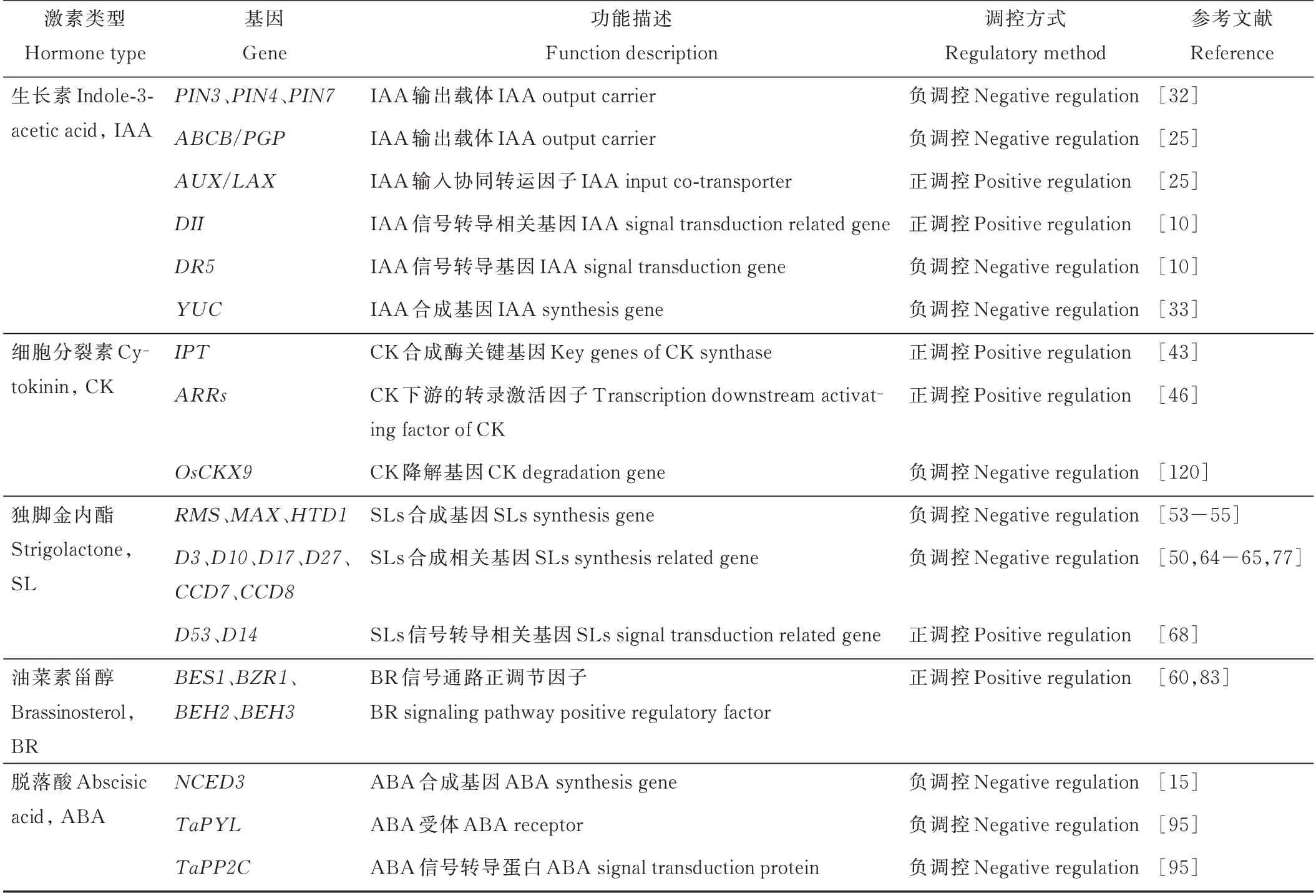
表2 参与调控植物分枝/分蘖的主要激素相关基因Table 2 Major hormone-related genes involved in the regulation of plant branching/tillering
3 现存问题及展望
截至目前,已从不同物种中鉴定出多个家族的转录因子参与调控AM 的形成。然而,植物激素如何调控这些转录因子间的关系及其下游基因仍然是未知的。另外,已有大量研究证实植物分枝受到表观遗传调控[10],植物激素是否参与表观遗传路径,依然有待进一步探索。基于这些问题,对植物分枝的激素调控方面,本研究做出以下展望:
1)除了激素,影响植物分枝的另一重要条件是外界环境如温度、水分、光照和营养。然而,外界环境如何结合激素共同调控植物分枝依然是未知的。因此,未来可以从这个方面进一步研究以揭示激素与环境互作对植物分枝的调控机理。
2)植物中很多重要转录因子的表达受表观遗传调控,转录因子对植物分枝具有重要的调控作用。参与调控植物分枝的表观遗传主要包括DNA 甲基化、组蛋白修饰和染色质重塑等。后期应选择适宜的材料和实验手段将植物激素和表观遗传结合起来,进一步解析表观遗传调控植物分枝时,植物激素是如何行使其功能的。
3)随着研究技术和手段的发展,已经了解到影响植物分枝的激素有许多,但还存在许多未知,如SA、JA 和多胺等激素与分枝的关系尚不明确。后期的研究应多从以下方面入手:研究外源施用这些激素或者激素类似物对植物分枝的影响;分析这些激素的合成、降解及信号转导相关基因的表达对植物分枝的调控;筛选这些激素的缺失突变体,明确其分枝特征;确定这些激素是否参与调控植物分枝主要因子的表达;明晰这些激素与其他植物分枝相关激素的互作作用。
4)近年来,已明确了多种激素对植物分枝的调控机制,故利用化学调控的方法来控制植物分枝的发生是较为有效的方法。如外源施用IAA、SL、GA、ABA、BR 等可以减少分枝,CK 抑制剂处理亦可减少分枝,而外源CK 处理可以增加植物分枝。然而,如常用的GR24 价格昂贵,成本极高。因此,未来的研究重点在于探索出能够大批量生产有活性的激素控蘖剂的方法,以降低其生产成本。另外,相关激素的最佳施用浓度、施加次数、施加时间和施加部位均需要具体的试验才能确定。
