低氮胁迫下不同皮燕麦品种早期的响应研究及耐低氮性综合评价
2024-02-23罗颖李聪王沛田莉华汪辉周青平雷映霞
罗颖,李聪,王沛,田莉华,汪辉,周青平,雷映霞
(西南民族大学四川若尔盖高寒湿地生态系统国家野外科学观测研究站,四川 成都 610041)
氮素是植物生长、发育过程中各组织、器官中核酸、氨基酸、蛋白质等的主要组成元素,也是植物抵抗逆境时初级和次生代谢物合成的重要因子[1]。在自然界中,氮素存在的形式可分为有机氮和无机氮,而植物的氮素来源主要为无机氮,无机氮以硝态氮和铵态氮为主。有研究表明,硝态氮是土壤中氮素资源的主要形式,且可以被多数作物所吸收[2]。当作物吸收硝态氮之后会通过一系列氮代谢途径将其转化为自身可利用的氮素形式,并参与到作物体内基本的生理代谢,如氮素同化、蛋白质合成等重要过程,而这一系列氮代谢过程会对作物的产量和品质起决定性作用[3]。因此,在农业生产上,为使作物增产,我国大量施用化肥,使化肥的需求量出现大幅增长,1980 至2014 年间,就从1269.4 万t 上升到了5995.9 万t,增长了3.7 倍,年均增长高达4.67%,我国也成为世界上最大的化肥使用国[4-5]。然而,在自然条件下,氮肥的利用率非常低,据统计,我国氮肥利用率约为35%,低于世界40%~60%的水平[6]。由此,相当一部分未被利用的氮肥一方面会通过淋溶、挥发释放到大气中导致大气污染,另一方面,在土壤及水域中残存的氮素,则会引起土壤酸化和水体富营养化,对土壤环境造成破坏。同时,过量施用氮肥也大大增加了农业生产中的成本支出[7]。因此,提高作物的氮利用效率,降低氮肥的使用量,减少环境污染成了亟待解决的问题。对此,我国在2015 年提出了化肥“零增长”行动,并在“十三五”规划中提出了“药肥双减”的政策。因此,为响应国家政策,选育耐低氮作物,减少农业生产中的氮肥投入就显得尤为重要,迫在眉睫[8]。
燕麦(Avena sativa)是禾本科(Gramineae)燕麦属(Avena)一年生草本植物,在世界禾本科作物生产中排名第四位,仅次于小麦(Triticum aestivum)、水稻(Oryza sativa)和玉米(Zea mays)[9]。根据外稃特征,燕麦可以分为皮燕麦和裸燕麦(Avena nuda)。皮燕麦其籽粒被一层坚硬的外稃所包被,即使成熟时也不易脱落,是世界主栽类型[10]。皮燕麦起源于地中海沿岸,主要分布在以俄罗斯、芬兰等为中心的欧洲国家和北美国家这两大板块[11-12]。我国种植的皮燕麦大多是从其他国家引进,主要种植于我国西北、西南、东北以及青藏高原等地[13]。皮燕麦主要作为饲草作物种植,其鲜草的适口性好、营养价值高,可直接饲喂牛、羊。同时,皮燕麦加工调制的青干草和青贮饲料,含有较多的粗蛋白、粗脂肪,较低的纤维,是农牧区主要的牧草品种。不仅如此,皮燕麦籽粒蛋白含量高,具有丰富的膳食纤维,能加速人体新陈代谢,可作为粗粮或保健食品[14]。除此之外,皮燕麦具有耐寒抗旱、耐贫瘠、耐适度盐碱等特点。因此,在实际生产应用中,皮燕麦无论以饲草或者作为收获籽粒为种植目标,都是农牧区首选的优良种质资源[15]。
然而,目前对燕麦抗逆方面的研究,主要集中于盐胁迫、干旱胁迫、低温胁迫以及重金属胁迫等,对于皮燕麦在低氮胁迫下的研究较少[16-19]。为此,本试验采用水培方式对18 份皮燕麦品种进行研究,对皮燕麦在低氮环境中的形态及生理变化进行探讨,为高原地区筛选出耐低氮燕麦品种,以期减少氮肥的使用量,降低环境污染,建立可持续发展农牧业模式。同时,探讨低氮环境下燕麦的生理响应机制,为后期燕麦耐低氮性的机制研究提供理论依据,也为选育耐低氮的牧草种质提供科学基础。
1 材料与方法
1.1 试验材料
本研究采用18 份不同皮燕麦品种为试验材料,如表1 所示。
1.2 试验方法
试验采用水培法[20],于2021 年12 月在西南民族大学青藏高原研究院实验室进行。育苗阶段选取籽粒饱满、健康的种子,用0.1%的次氯酸钠消毒5 min 后,用蒸馏水冲洗3 次,后采用纸上发芽法。当幼苗萌发长至三叶期时,选取长势一致的幼苗定植于水培箱中(70 cm×70 cm×35 cm),并设全氮和低氮2 个氮浓度处理。每份燕麦品种分别在2 个氮浓度处理中各定植3 孔,每孔定植10 株,设3 组生物学重复,此为第1 组试验材料,用于测定形态、生物量以及部分光合等指标。第1 组试验材料种下的2 d 后,种植第2 组试验材料,18 份燕麦品种同样在2 个氮浓度处理中各定植3 孔,每孔定植10 株,用于后续光合指标的测定和展开生理指标的取样工作。
使用霍格兰营养液(海博生物技术有限公司)水培,其中含有的NO3-浓度分别是全氮(4 mmol·L-1,CK),低氮(0.4 mmol·L-1,LN)。本试验用Ca(NO3)2·4H2O 作为氮补充来源,在低氮处理中,用CaCl2补充缺失的Ca2+,每7 d 更换一次营养液,增氧泵通气。在22 ℃,相对湿度65%,光照16 h/黑暗8 h 的温室中胁迫处理21 d 后进行各指标的测定。
每组试验材料胁迫21 d 后,剪取燕麦新鲜叶片0.1 g,每0.1 g 为一次生物学重复,每个处理取3 次生物学重复。叶片用锡纸包裹放入液氮中进行冷冻,后转移至-80 ℃超低温冰箱中保存。保存的样品用于硝态氮(NO3--N)、谷氨酰胺合成酶(glutamine synthetase,GS)、谷氨酸合成酶(glutamate synthase,GOGAT)、谷氨酸脱氢酶(glutamate dehydrogenase,GDH)、活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、渗透调节物质等指标的测定,硝酸还原酶(nitrate reductase,NR)使用新鲜叶片测定。
1.3 测定指标及方法
1.3.1 农艺性状指标 将燕麦从水培箱中完整取出,取3 株单株,设3 个生物学重复。用卷尺测量其株高(plant height,PH)、根长(root length,RL),随后从茎基部剪开,再进行地上部分鲜重(shoot fresh weight,SFW)和地下部分鲜重(root fresh weight,RFW)测定,而后将植株鲜样放入105 ℃的烘箱中杀青0.5 h,再在65 ℃的环境中烘干至恒重。取出测定地上部分干重(shoot dry weight,SDW)和地下部分干重(root dry weight,RDW),并计算根冠比(root-shoot ratio,RSR)(根冠比=地下部分干重/地上部分干重)。
1.3.2 生理指标 在光合有效辐射为1200 μmol·m-2·s-1,大气CO2浓度为400 μmol·m-1,叶片温度为22 ℃的条件下,于上午9:00~12:00,下午14:00~17:00 用美国 LI-COR 公司生产的Li-6800 光合作用全自动测量系统测定叶片中部的光合指标,包括净光合速率(photosynthesis rate,Pn)、蒸腾速率(transpiration rate,Tr)、胞间CO2浓度(internal CO2concentration,Ci)、气孔导度(stomatal conductance,Gs)的测定。
氮代谢相关酶活性测定:硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)、谷氨酸脱氢酶(GDH)均参照微量法试剂盒(苏州科铭生物技术有限公司)测定,待各指标样品处理后,NR、GOGAT、GDH 在340 nm 波长下进行吸光度读值,GS 在540 nm 下进行吸光度读值。
活性氧(ROS)含量测定:超氧阴离子(O2·-)含量和过氧化氢(H2O2)含量的测定均参照微量法试剂盒(苏州科铭生物技术有限公司),超氧阴离子含量吸取处理液后上清液于530 nm 处测定吸光度值。H2O2含量在415 nm 处测定吸光度值并进行计算。
以下指标测定参考张志良等[21]的试验方法。硝态氮(NO3--N)含量测定采用水杨酸比色法;丙二醛(MDA)含量采用硫代巴比妥酸法测定;可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝法测定;可溶性糖(soluble sugar,SS)含量采用蒽酮比色法测定。
1.4 耐低氮性综合评价
首先对低氮胁迫下皮燕麦的21 项指标的耐低氮系数进行相关性分析,比较各指标间的相关性。而后将18 份燕麦材料的21 个指标进行主成分降维分析并提取出耐低氮综合因子,最后采用隶属函数法和系统聚类法进行耐低氮性综合评价。
1.4.1 各材料综合指标耐低氮系数 耐低氮系数=低氮胁迫下指标的均值/对照指标的均值。
1.4.2 各材料综合指标隶属函数值
式中:Xj表示第j个综合指标;Xmin表示第j个综合指标最小值;Xmax表示第j个综合指标最大值。
1.4.3 各材料综合指标权重
式中:Wj表示第j个综合指标在所有综合指标中的重要程度即权重;Pj为各基因型第j个综合指标贡献率。
1.4.4 各材料耐低氮性综合评价
式中:D值为各基因型在低氮胁迫条件下由综合指标评价所得的耐低氮性综合评价值。
1.5 数据处理
采用Excel 对数据进行整理,运用SPSS 完成试验数据统计分析,各指标数据进行T-test 检验,而后计算出耐低氮系数并进行Pearson 相关性分析、主成分分析(principal component analysis,PCA)、隶属函数分析,使用Origin 进行各指标相关性热力图、聚类热力图的绘制,其中聚类热力图是基于最长距离和欧式平方距离法进行的层次聚类。
2 结果与分析
2.1 低氮胁迫下皮燕麦农艺性状的变化
低氮胁迫下,各品种的株高均呈下降趋势,其中甜燕2 号下降的最多(27.36%),其次是枪手(21.19%),并且甜燕2 号和枪手在低氮胁迫下的株高与全氮处理下的株高均呈显著性差异(P<0.05),下降最少的是太阳神(0.42%),差异性不显著(P>0.05)。18 个品种中,边锋、莫妮卡、甜燕70、青海444、青海甜燕麦的根长有不同程度的上升,其中青海444 上升最多(43.94%),青海甜燕麦上升了42.32%;其余13 份品种的根长均呈下降趋势,甜燕2 号下降最多(55.93%),青燕2 号下降了54.78%。根冠比中,除青引1 号、枪手、燕王、青燕2 号、青燕1 号这5 个品种外,其余品种的根冠比均上升,青海444 的根冠比上升的最多,上升了1.5 倍,其次领袖上升了85.71%,枪手的降幅最大(36.36%),其次是青燕2 号(33.33%)。另外,植物的干物质量可反映植物的氮利用效率,在低氮胁迫下,皮燕麦的地上部分鲜重、干重均下降,地下部鲜、干重变化趋势不一致,边锋、青海444、魅力、领袖、青海甜燕麦、牧王的地下部生物量均上升,其余品种的地下部生物量均受到抑制(表2)。
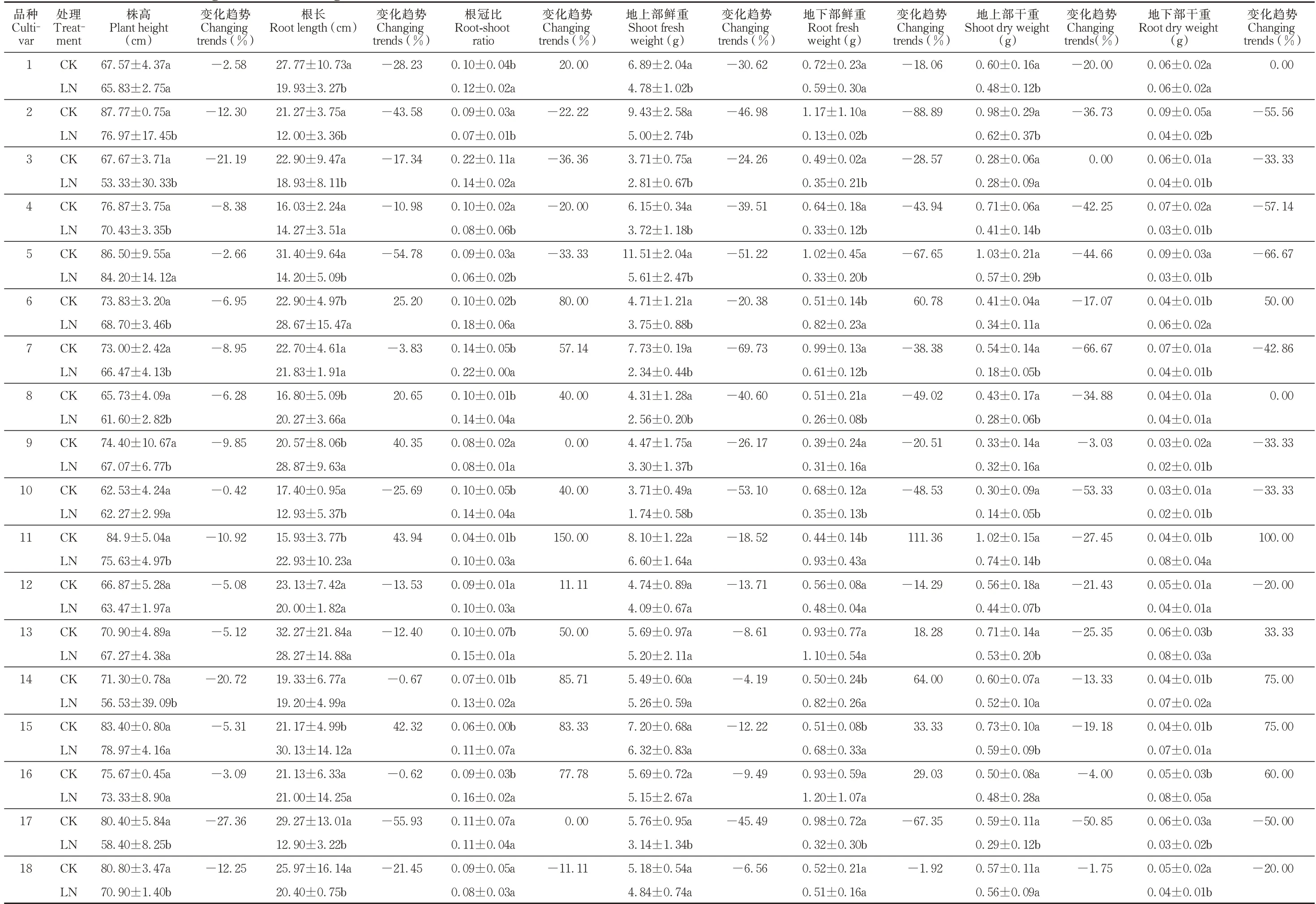
表2 低氮胁迫下各皮燕麦品种的生长变化Table 2 Effects of low nitrogen stress on the growth of different oat cultivars
2.2 低氮胁迫下皮燕麦光合作用的变化
所有供试皮燕麦的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)在低氮胁迫下均呈下降趋势(表3)。其中牧王的Pn下降幅度最大(64.52%),并且牧王在低氮胁迫下的Pn与全氮处理下的Pn呈显著性差异(P<0.05),青燕1 号的Pn下降的最少(3.32%),其试验前后的Pn差异性不显著(P>0.05);牧王的Tr降幅同样最大(77.61%),美达的降幅最小(17.14%);供试皮燕麦的Ci降幅不明显,下降最多的是青燕1 号(18.27%);莫妮卡的Gs降幅最大(76.47%),其次是牧王(75.00%),燕王下降的最少(7.69%)。
2.3 低氮胁迫下皮燕麦硝态氮的变化
低氮胁迫下,不同皮燕麦品种的硝态氮含量均处于下降状态,下降幅度不尽相同,对照组和处理组变化呈极显著差异(P<0.01)(图1)。其中下降较多的3 个品种为青引1 号(76.12%)、骏马(74.24%)、青海444(71.41%)。魅力下降的最少(19.12%),蒙燕1 号下降了32.84%,其他品种的变化趋于一致。且对照组中青燕1号的硝态氮含量最多,青燕2 号的硝态氮含量最少,低氮处理后除蒙燕1 号、枪手、魅力的硝态氮含量稍高,其余品种的硝态氮含量基本在同一水平。
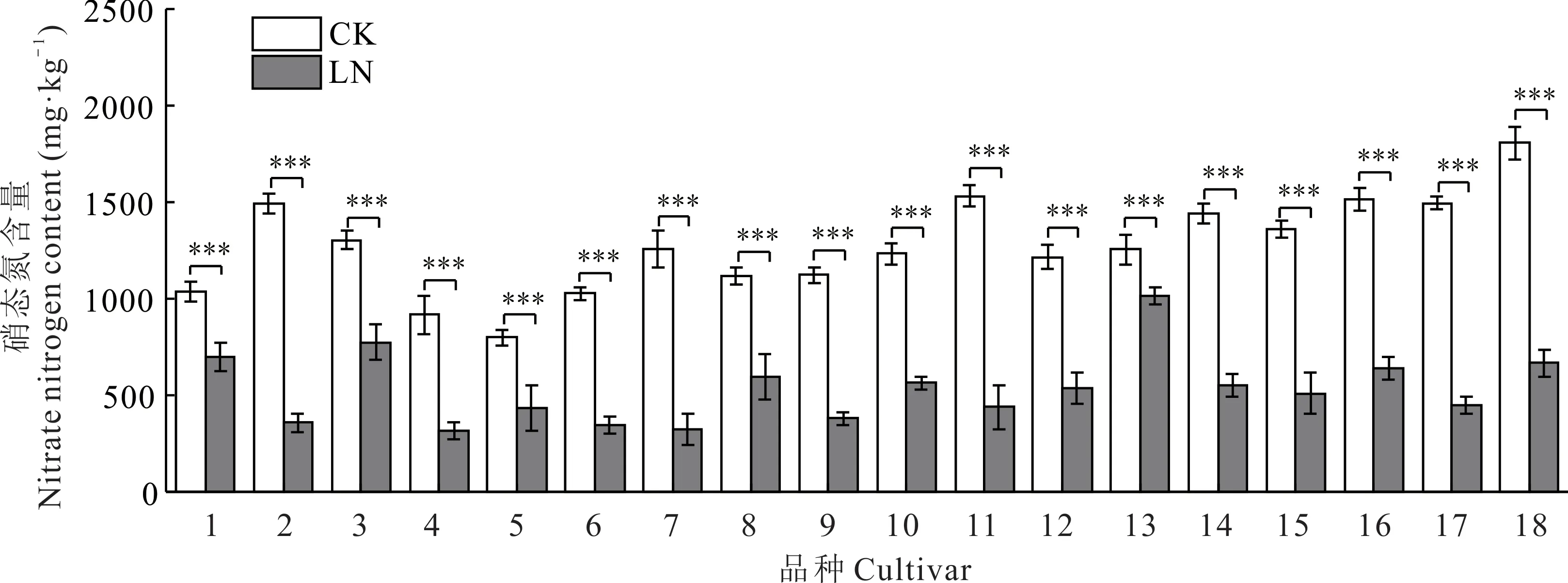
图1 不同皮燕麦品种的硝态氮含量在低氮胁迫下的变化Fig.1 Changes of nitrate nitrogen content in different oat cultivars under low-nitrogen stress
2.4 低氮胁迫下皮燕麦氮代谢相关酶的变化
在低氮胁迫下,供试皮燕麦品种的硝酸还原酶(NR)活性呈不同程度的下降趋势,且差异显著(P<0.05)(图2)。其中太阳神的NR 活性下降的最多(63.46%),蒙燕1 号下降了59.73%。青燕2 号下降的最少(16.48%),其次是青引1 号下降了16.65%。对照组的18 份皮燕麦中,牧王、骏马自身的NR 活性高于其他皮燕麦品种;且在低氮处理后,牧王和骏马的NR 活性在所试皮燕麦品种中依然能维持较高水平。
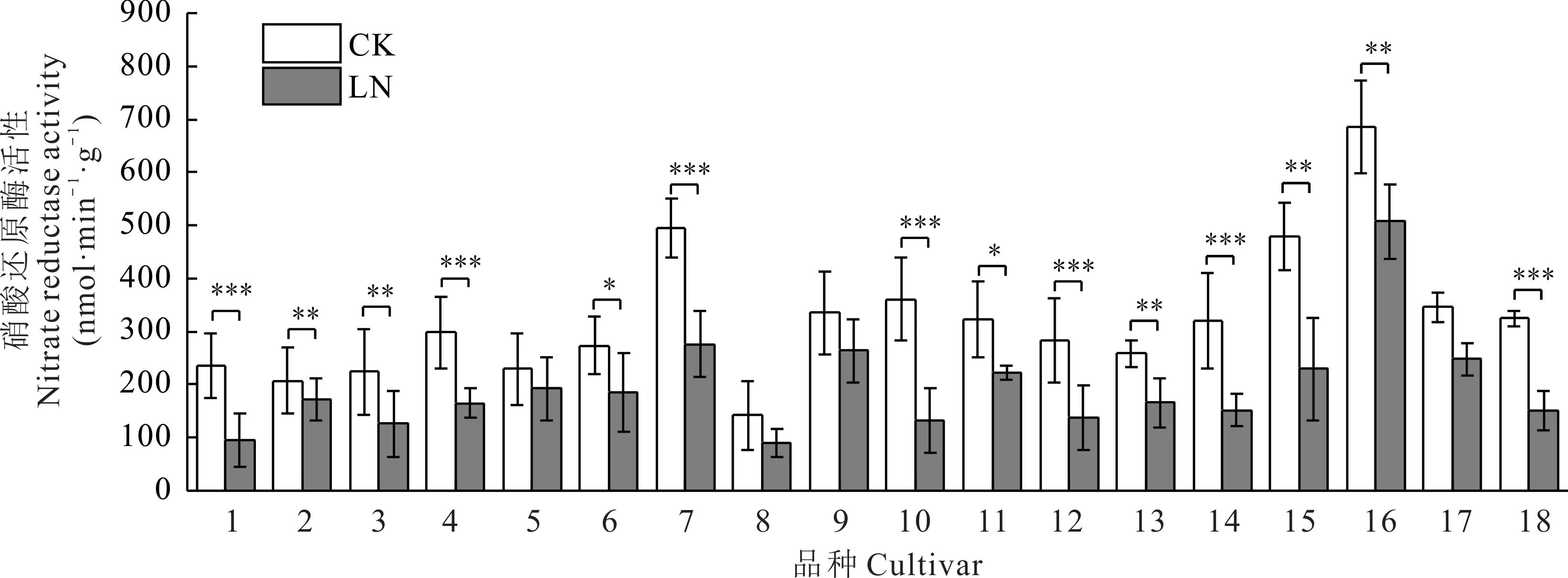
图2 不同皮燕麦品种的硝酸还原酶活性在低氮胁迫下的变化Fig.2 Changes of nitrate reductase activity of different oat cultivars under low-nitrogen stress
低氮处理下,除燕王的谷氨酰胺合成酶(GS)活性有所上升外,其余皮燕麦的GS 活性均有不同程度的下降;骏马下降的最多(92.72%),青海444 下降的最少(3.47%),美达也仅下降了8.48%(图3)。说明青海444 和美达在低氮胁迫下同化氨的能力下降的最少。
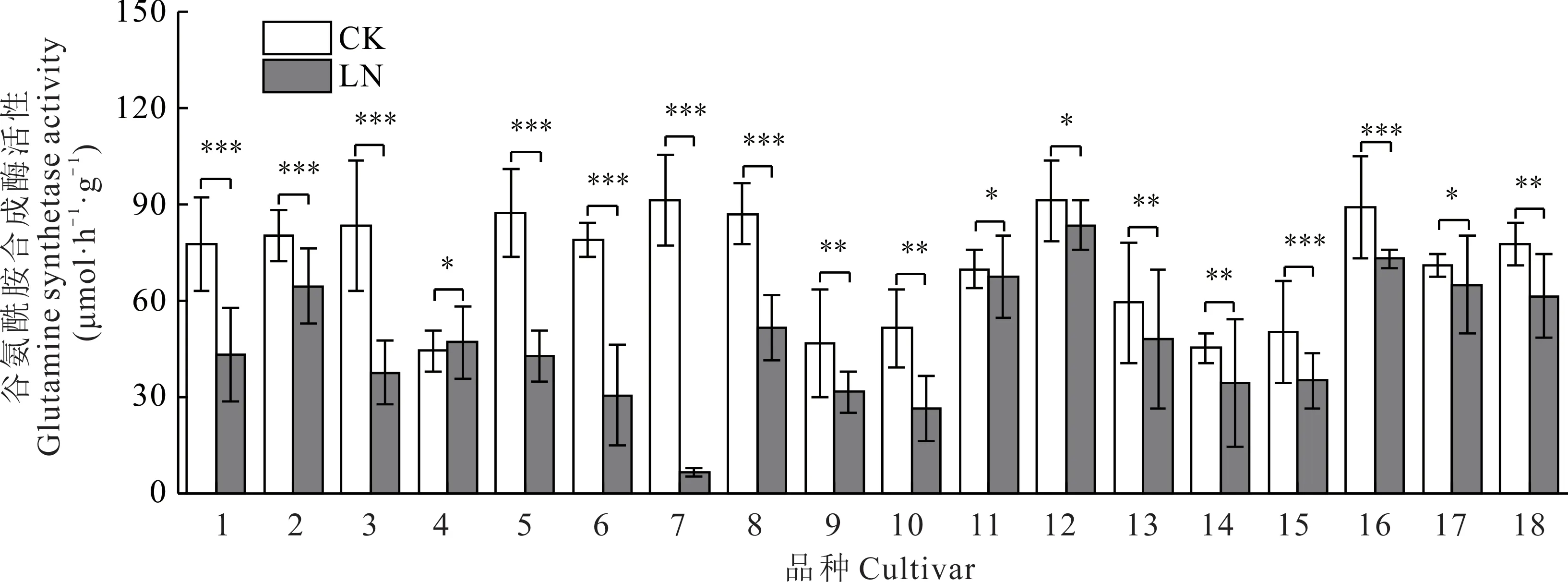
图3 不同皮燕麦品种的谷氨酰胺合成酶活性在低氮胁迫下的变化Fig.3 Changes of glutamine synthetase activity of different oat cultivars under low-nitrogen stress
低氮胁迫处理组谷氨酸合成酶(GOGAT)活性与对照组相比均有不同程度的升高,呈显著性差异(P<0.05)。低氮处理后青燕1 号的GOGAT 活性上升得最多,上升了3.6 倍,其次是青引1 号,上升了约2 倍,青燕2号、骏马、甜燕70、领袖、牧王均上升了自身的一倍多。太阳神上升得最少(24.20%),甜燕2 号上升了25.23%,其余品种的变化趋于一致(图4)。
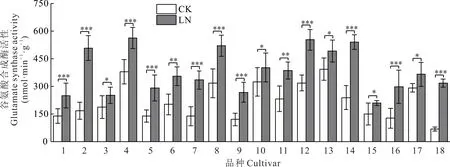
图4 不同皮燕麦品种的谷氨酸合成酶活性在低氮胁迫下的变化Fig.4 Changes of glutamate synthase activity of different oat cultivars under low-nitrogen stress
谷氨酸脱氢酶(GDH)在低氮胁迫下呈下降趋势,下降幅度较大的3 个品种为骏马>青海甜燕麦>莫妮卡(76.80%>72.04%>54.58%),下降幅度最小的是燕王(5.29%),其次是美达(5.58%)(图5)。通过对照组与试验组的对比可以发现,燕王在未受到胁迫时,其自身的GDH 活性就相对较高,低氮胁迫后,燕王的GDH 活性为低氮组中最高的。

图5 不同皮燕麦品种的谷氨酸脱氢酶活性在低氮胁迫下的变化Fig.5 Changes of glutamate dehydrogenase activity of different oat cultivars under low-nitrogen stress
2.5 低氮胁迫下皮燕麦活性氧、丙二醛的变化
在低氮胁迫下,所有试验品种的超氧阴离子(O2·-)含量均呈上升趋势,其中甜燕70 的上升幅度最大(120.98%),其次是青海甜燕麦(89.87%),青引1 号(88.30%),青燕1 号变化最小(2.34%)。试验品种的过氧化氢(H2O2)含量变化整体呈上升趋势,且差异显著(P<0.05),上升幅度最为明显的是青海甜燕麦(140.12%),美达上升了100%,蒙燕1 号和青引1 号变化不明显,分别上升了4.79%、4.94%(图6)。
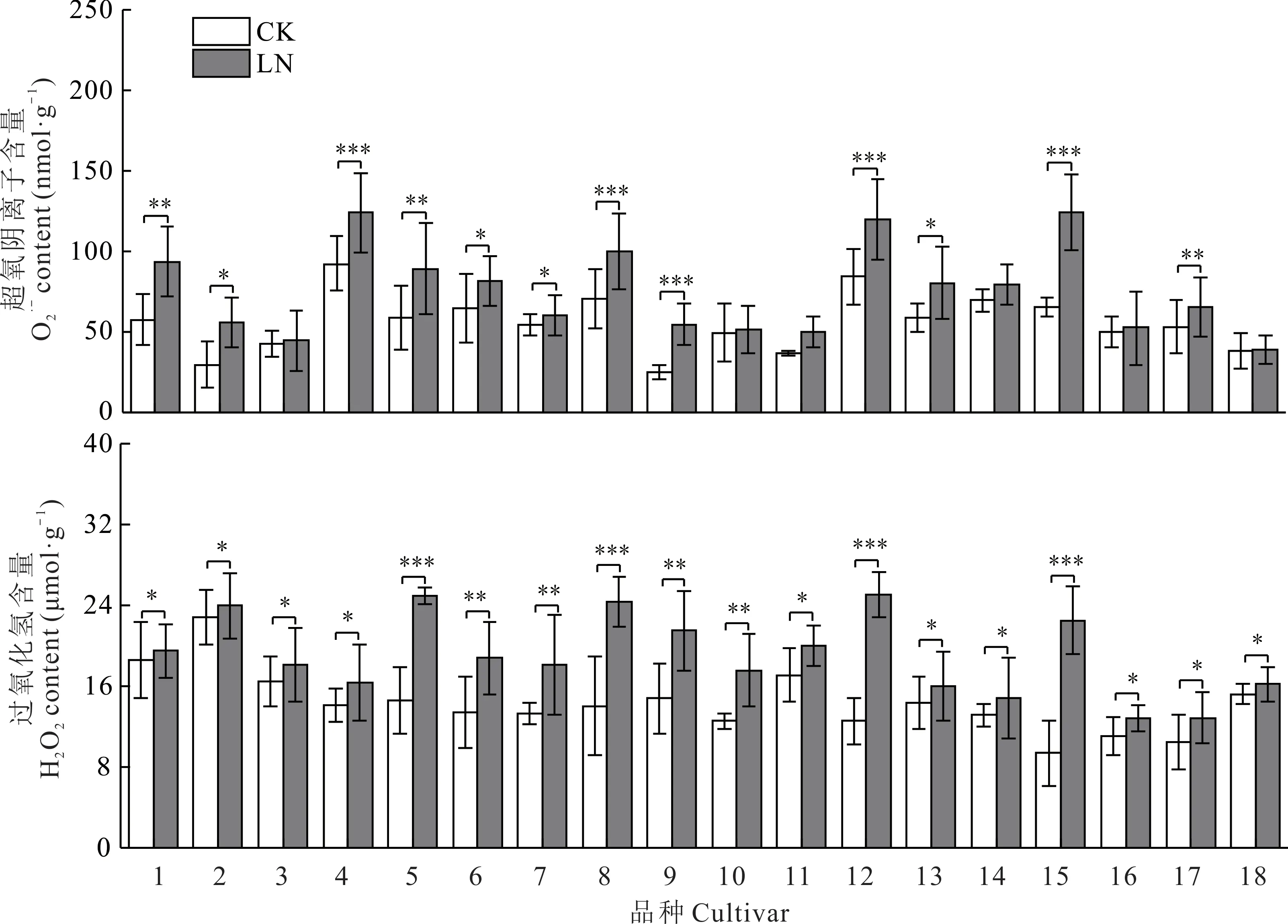
图6 不同皮燕麦品种的活性氧含量在低氮胁迫下的变化Fig.6 Changes of active oxygen content of different oat cultivars under low-nitrogen stress
所有试验品种的丙二醛(MDA)含量在低氮胁迫下也均有不同程度地升高(图7),上升幅度最大的是青燕2号(64.62%),其次是魅力(60.65%)和甜燕2 号(51.84%),青海444 上升的最少(1.69%)。
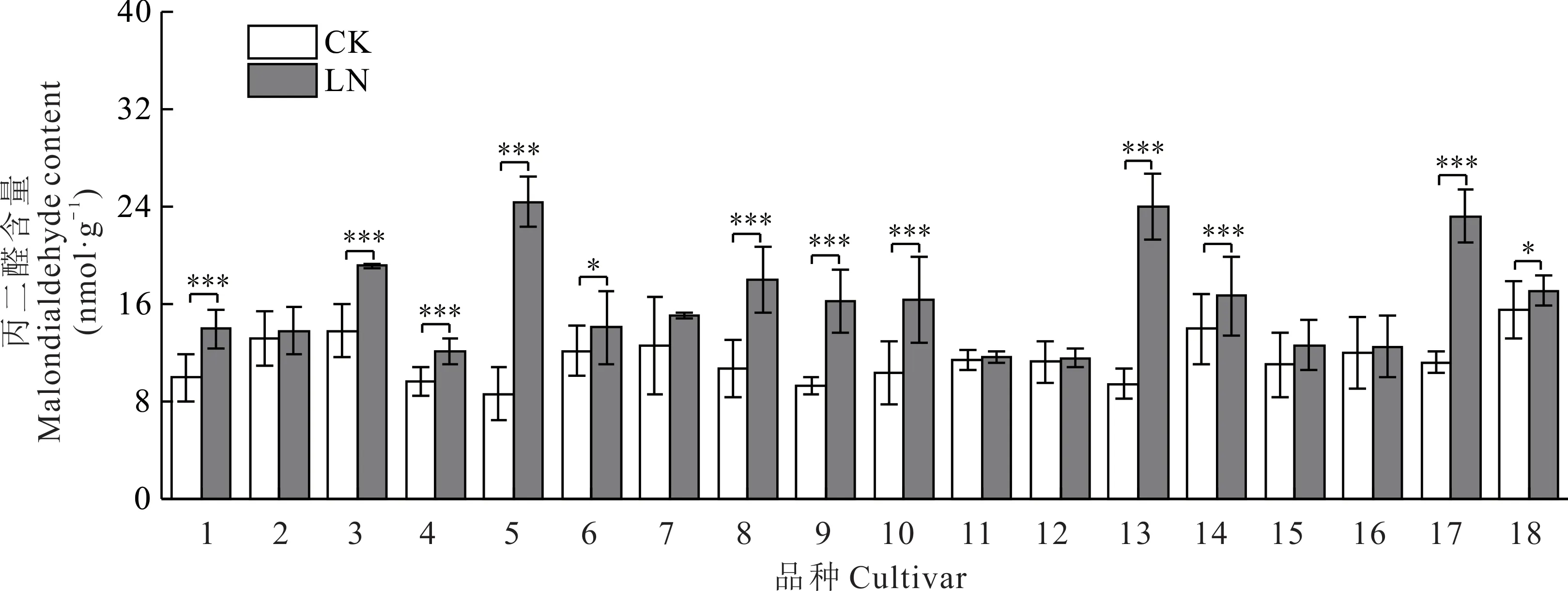
图7 不同皮燕麦品种的丙二醛含量在低氮胁迫下的变化Fig.7 Changes of MDA content of different oat cultivars under low-nitrogen stress
2.6 低氮胁迫下皮燕麦渗透调节物质的变化
低氮胁迫下,试验品种的可溶性蛋白(SP)含量均下降。甜燕2 号的下降幅度最大(70.78%),青燕1 号下降了62.44%,美达下降了59.78%,骏马下降的最少(1.69%),青引1 号下降了6.59%。与此同时,可溶性糖(SS)含量也呈下降趋势。边锋下降了59.07%,骏马和青燕2 号分别下降了54.25%、51.68%,二者的降幅较一致;枪手变化最小(6.17%),青海甜燕麦下降6.98%,其余品种的降幅趋于一致(图8)。
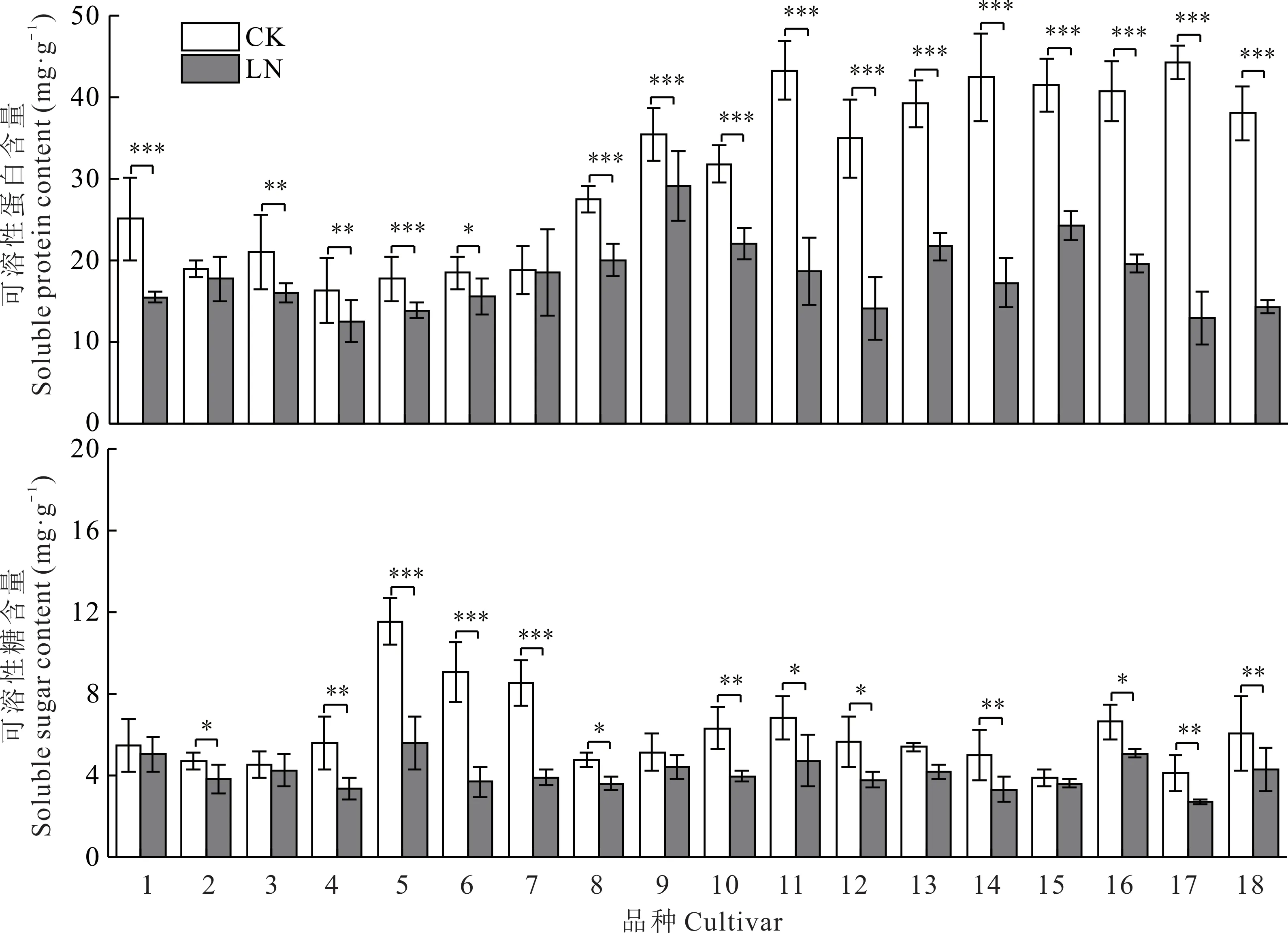
图8 不同皮燕麦品种的渗透调节物质在低氮胁迫下的变化Fig.8 Changes of osmotic adjustment substances of different oat cultivars under low nitrogen stress
2.7 各指标耐低氮系数相关性分析
对植物在逆境胁迫下的耐性评价,通常采用耐性系数,耐性系数越高代表植物耐受能力就越强,反之就越弱。本试验中皮燕麦各形态、生理指标变化趋势不尽相同,为避免皮燕麦自身的固有差异,运用1.4.1 中的公式计算了能准确反映皮燕麦各指标变化的耐低氮系数(表4)。所试皮燕麦的株高、地上部鲜重、净光合速率、蒸腾速率、胞间CO2浓度、气孔导度、硝态氮含量、硝酸还原酶活性、谷氨酸脱氢酶活性、可溶性蛋白、可溶性糖含量的耐低氮系数均小于1,超氧阴离子、过氧化氢、丙二醛等指标的耐低氮系数均大于1。基于以上,对18 份试验材料的7 项形态指标和14 项生理指标进行相关性分析(图9),结果表明有16 对指标间存在相关性,其中12 对指标呈极显著相关(P<0.01)。地下部干重(RDW)与地下部鲜重(RFW)、地上部鲜重(SFW)、根冠比(RSR)、根长(RL)均呈极显著正相关(P<0.01),其中根冠比(RSR)与地下部干重(RDW)的相关系数最高,为0.89,地上部鲜重(SFW)与可溶性蛋白(SP)、谷氨酸合成酶(GOGAT)与胞间CO2浓度(Ci)、谷氨酰胺合成酶(GS)与可溶性蛋白(SP)均呈极显著负相关(P<0.01),其中GS 与SP 的相关系数最低,为-0.63。

表4 18 份皮燕麦材料各综合指标耐低氮系数Table 4 The comprehensive index of 18 oat cultivars is resistant to low nitrogen coefficient
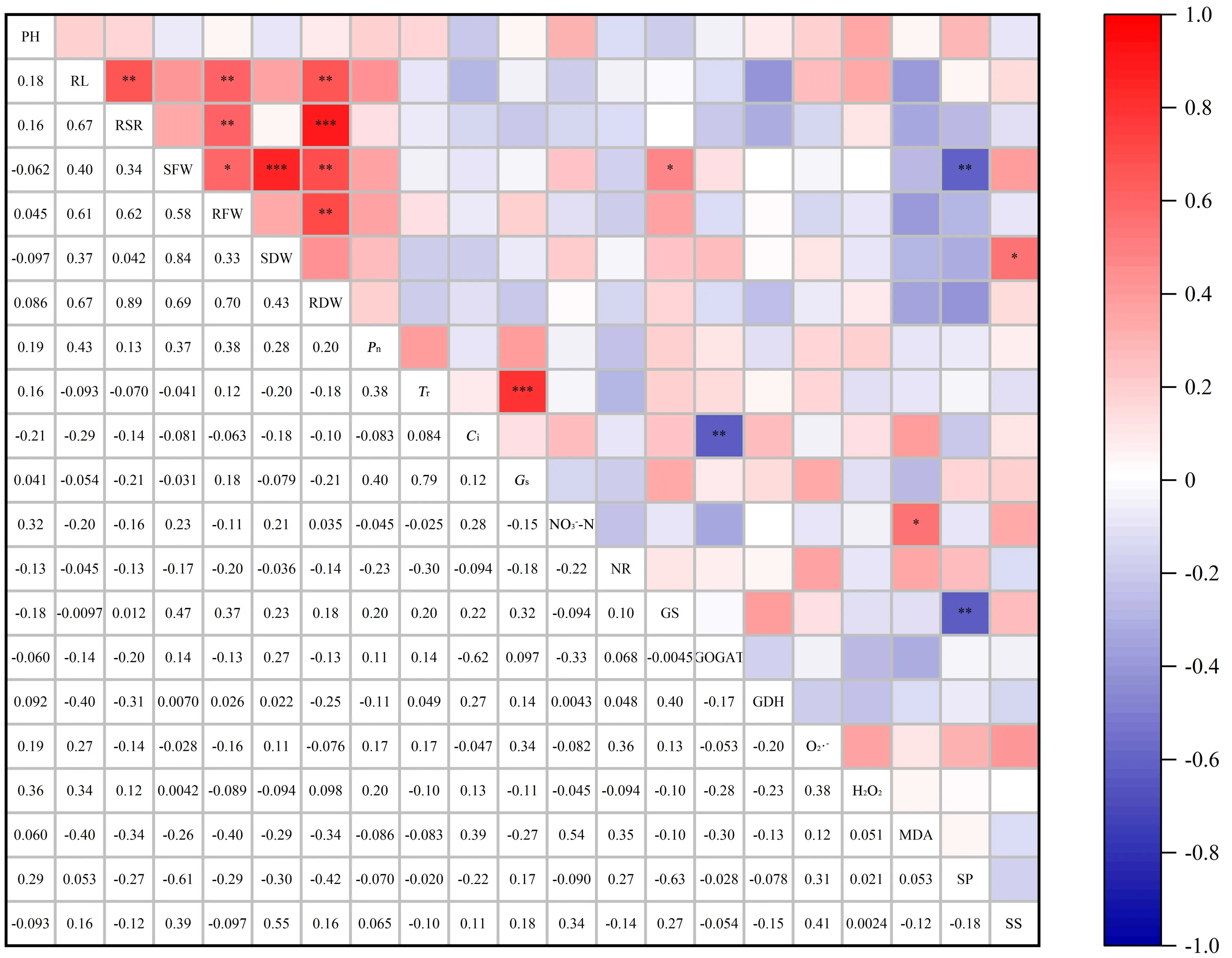
图9 18 份皮燕麦材料低氮胁迫下各指标耐低氮系数相关性分析Fig.9 Correlation analysis of low-nitrogen tolerance coefficient of each index under low nitrogen stress of 18 oat cultivars
2.8 皮燕麦各指标主成分分析
从相关性分析可以看出,虽然所测指标间存在一定联系但相关程度不一致,且大量信息重叠,影响耐低氮性评价效果。因此采用主成分降维的方法对18 份皮燕麦材料的21 项指标进行主成分分析。将累计方差贡献率大于80%且特征值≥1 作为判别条件,可提取7 项主成分因子(表5)。主成分1(PC1)的特征值为4.658,贡献率为22.181%;主成分2(PC2)的特征值为2.702,贡献率为12.869%;主成分3(PC3)的特征值为2.559,贡献率为12.187%;主成分4(PC4)的特征值为2.291,贡献率为10.907%;主成分5(PC5)的特征值为2.049,贡献率为9.755%;主成分6(PC6)的特征值为1.561,贡献率为7.433%;主成分7(PC7)的特征值为1.180,贡献率为5.620%。前7 个主成分累计贡献率达80.952%,具有较好的代表性,与燕麦苗期耐低氮性具有直接联系,可作为评价燕麦苗期耐低氮性的综合指标。
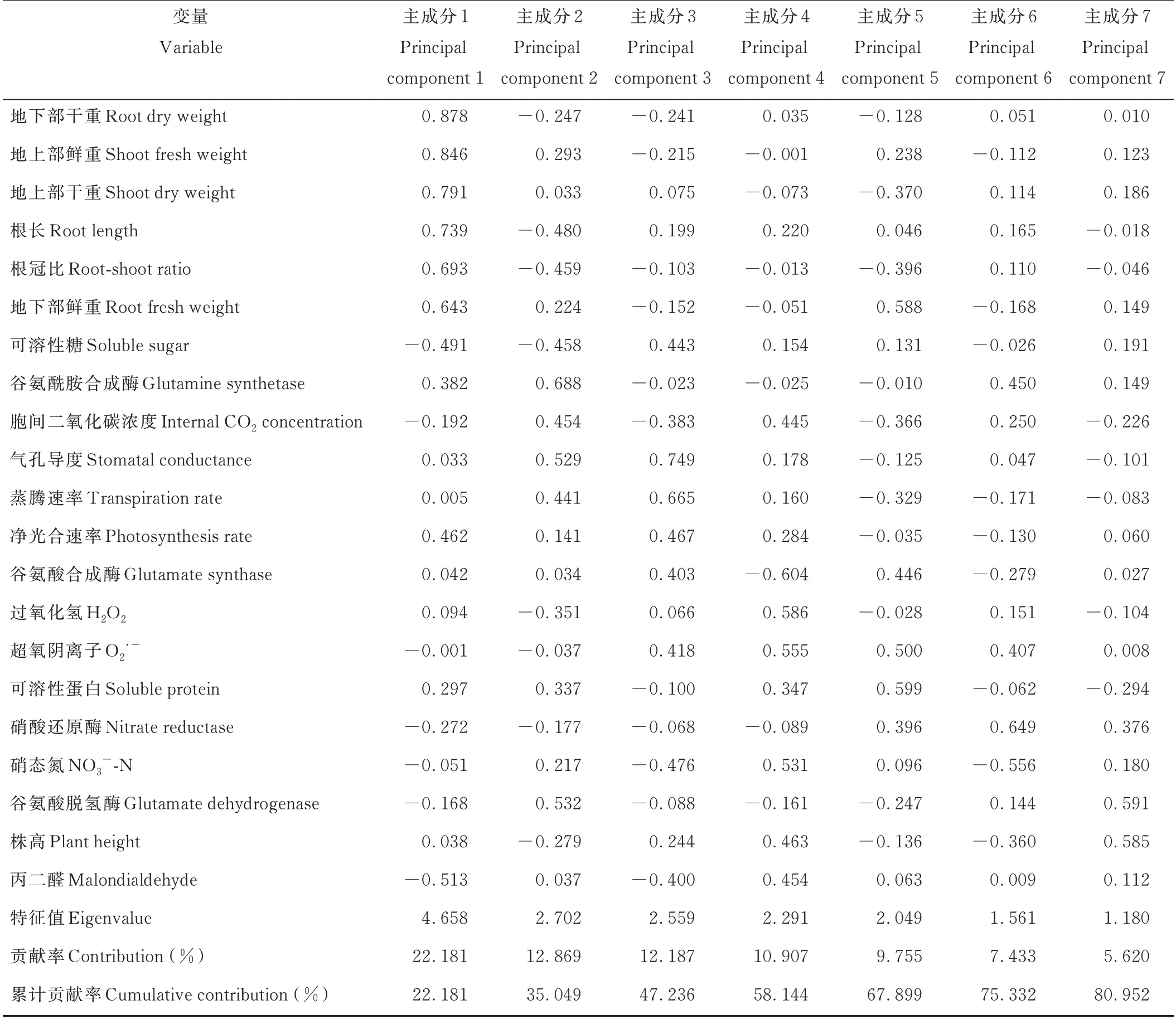
表5 各综合指标系数及贡献率Table 5 Coefficients and proportion rates of various comprehensive indicators
第1 主成分中贡献率较大的是地下部干重(RDW)和地上部分生物量,主要反映了低氮胁迫后燕麦的生物量变化,在低氮胁迫下维持较高的生物量水平能反映出品种的耐低氮性;第2 主成分中谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)的贡献率较高,GS 和GDH 活性反映了植物的氮代谢效率,低氮胁迫下燕麦幼苗的氮代谢能力越强,其耐低氮性也越强;第3 主成分中贡献率较大的是气孔导度(Gs)和蒸腾速率(Tr),在低氮胁迫下维持较高的光合水平也能反映品种的耐低氮性;第4 主成分中过氧化氢(H2O2)和超氧阴离子(O2·-)的贡献率较大,反映了燕麦的抗氧化能力,低氮环境下植物细胞内活性氧含量越低,表明其抗氧化能力越强,耐低氮性也就越强;第5 主成分中可溶性蛋白(SP)和地下部鲜重(RFW)的贡献率较大,反映了渗透调节能力以及积累有机物的能力,渗透调节物质可表明细胞受到胁迫后的调节能力,渗透调节能力越强,其耐低氮性越强;第6 主成分中硝酸还原酶(NR)和谷氨酰胺合成酶(GS)的贡献率较大,与第2 主成分反映的能力一致;第7 主成分中谷氨酸脱氢酶(GDH)和株高(PH)的贡献率较大,与第1、2 主成分反映的能力一致。综合7 个主成分分析结果,燕麦的生物量、氮代谢效率因子、光合因子、抗氧化能力因子、渗透调节因子可作为燕麦苗期耐低氮性评价的综合指标。
2.9 隶属函数分析及综合评价
采用隶属函数法对各指标进行综合评价,根据1.4.2 中的公式(1)计算出18 份材料分别在7 个主成分下的隶属函数值(表6)。对于综合指标主成分1 而言,青海444 的隶属函数值最大,为U(X1)=1.000,而青燕2 号的隶属函数值最小,为U(X1)=0.000;说明在主成分1 下,青海444 的耐低氮性最强,而青燕2 号的耐低氮性最弱。进一步结合7 个主成分的贡献率,根据1.4.3 中的公式(2)计算出7 个主成分的权重,分别为0.274、0.159、0.151、0.135、0.121、0.092、0.069。最后利用公式(3)计算出18 份材料耐低氮性的综合评价值(D)。从表6 可知,18 份燕麦材料耐低氮性按D值由大到小排序为:甜燕70>青海甜燕麦>青海444>美达>燕王>青引1 号>魅力>青燕1 号>蒙燕1 号>领袖>牧王>边锋>枪手>莫妮卡>太阳神>青燕2 号>甜燕2 号>骏马。
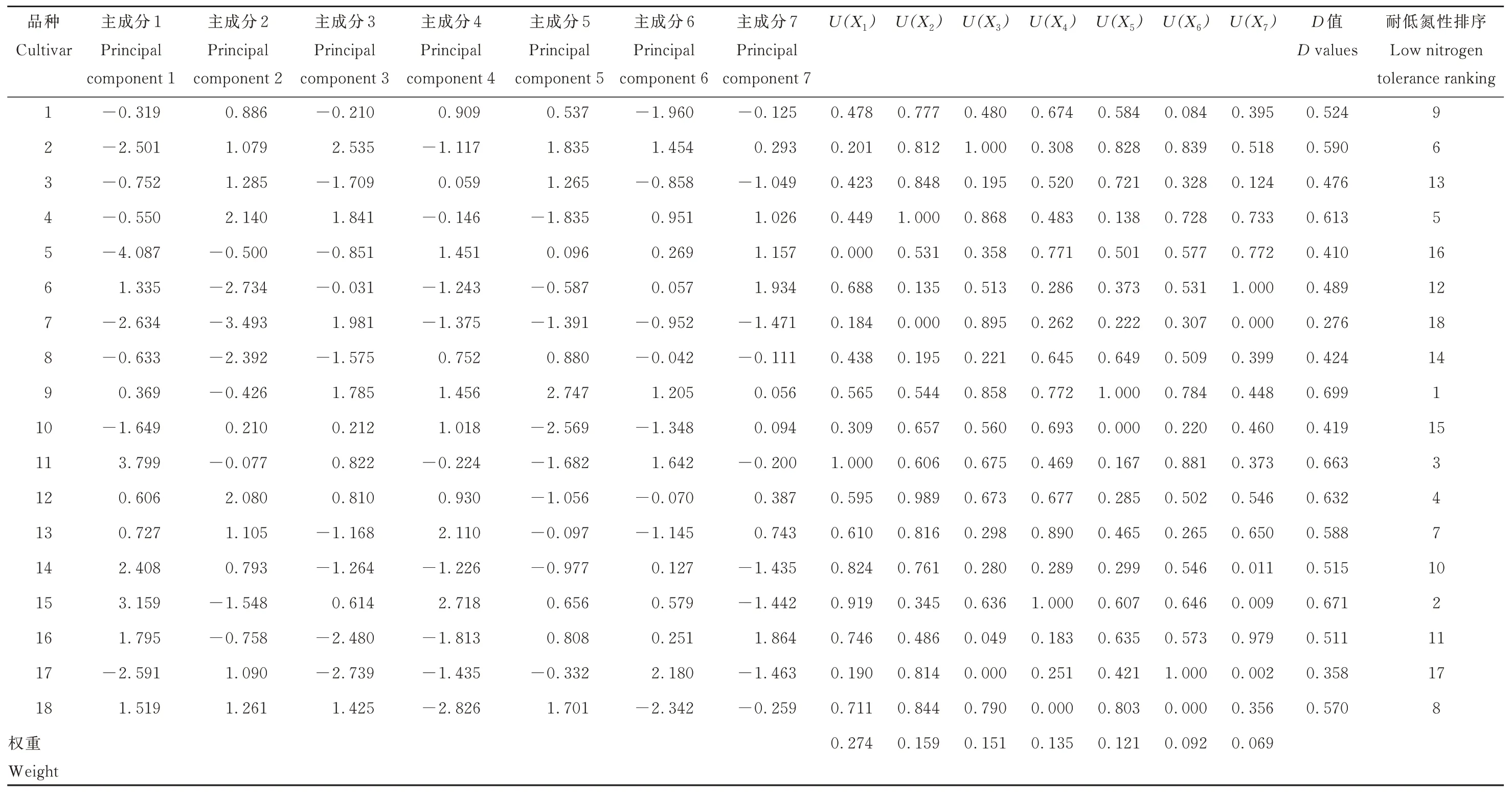
表6 18 份皮燕麦材料各综合指标值、权重、隶属函数值、D 值及综合评价Table 6 The comprehensive indicator values,index weight,membership function value,D values and comprehensive evaluation of 18 oat cultivars
2.10 耐低氮性聚类分析
对不同耐低氮性指标进行R 型聚类分析,结果显示21 个耐低氮性指标可分为3 类,第一类包含了株高(PH)、根长(RL)、根冠比(RSR)、地下部干重(RDW)、地下部鲜重(RFW)、胞间CO2浓度(C)i等指标,主要以地下部相关指标为主,可归纳为根系因子;第二类包含地上部鲜重(SFW)、可溶性糖(SS)、可溶性蛋白(SP)、硝态氮(NO3--N)、硝酸还原酶(NR)、谷氨酸脱氢酶(GDH)、净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)等指标,可归纳为氮代谢效率因子、渗透调节因子以及光合因子,并且这一类因子总体水平较低;第三类包含谷氨酸合成酶(GOGAT)、超氧阴离子(O2·-)、过氧化氢(H2O2)、丙二醛(MDA)等指标,可归纳为抗氧化能力因子(图10)。对18 份材料进行Q 型聚类分析,结果显示,这些材料可分为两类(Ⅰ和Ⅱ),第Ⅰ类包括青海甜燕麦、美达、青海444、牧王、领袖、边锋;第Ⅱ类材料又可分为两个亚组:Ⅱ-a(魅力、太阳神、莫妮卡、甜燕2 号、青燕2 号、枪手)和Ⅱ-b(燕王、青燕1 号、青引1 号、骏马、甜燕70、蒙燕1 号)。第Ⅰ类皮燕麦品种中的MDA 这一指标相较于第Ⅱ类皮燕麦品种偏低,说明第Ⅰ类皮燕麦品种受到的氧化损伤较轻,其抗低氮能力更强,且第Ⅰ类品种的地下部生物量较高,说明此类材料对低氮胁迫的耐受性较高,可将这6 份皮燕麦品种划分为耐低氮型品种。Ⅱ-a 组品种的MDA含量较高,GOGAT 活性较低,说明Ⅱ-a 中品种的抗氧化能力和氮代谢能力都相对较低,可将Ⅱ-a 的品种划分为氮敏感品种;Ⅱ-b 中MDA 含量属于中等,表明此类材料受到的氧化胁迫程度为中度,因此可划分为中等耐低氮性品种。
3 讨论
3.1 低氮胁迫下皮燕麦农艺性状的变化
植物的形态特征和干物质变化是植物对营养胁迫反应最直观的指标,植物缺氮时,地上部干物质重量通常会呈现下降趋势,而适当的低氮胁迫会促进根的生长发育,呈现根冠比和根干重上升的趋势[22]。姜琳琳等[23]研究表明较低的氮浓度一定程度上对玉米的根系生长有促进作用,而氮浓度的进一步上升,会抑制根系的生长;陈莹等[24]也发现低氮胁迫下苗期高羊茅(Festuca arundinacea)的株高、地上部生物量显著降低。在本试验中,所试品种的株高、地上部生物量均下降,与前人研究一致;而根长和地下部生物量整体呈下降趋势,根冠比整体呈上升趋势,但也有少数品种的根长和地上部生物量呈上升趋势。造成这一现象的原因可能是皮燕麦为维持自身生长,增加吸收氮的面积,从而刺激根生长。低氮胁迫会影响植物地上部分和地下部分的生长情况,但是具体的变化跟植物种类和耐低氮性有关。
3.2 低氮胁迫下皮燕麦的光合变化
通过对前人的研究总结发现,评价光合性能机制一般是从气孔因素和非气孔因素两方面来进行[25],限制光合作用的气孔因素主要包括气孔数量和气孔导度,非气孔因素包括PEP 羧化酶或Rubisco 的羧化能力、电子传递能力和叶绿素含量等[26]。当气孔导度(Gs)、胞间CO2浓度(Ci)和净光合速率(Pn)都呈下降趋势时,可认为是气孔因素导致了Pn的下降;当Pn和Gs减小,而Ci增加时,则将Pn下降的原因归结为非气孔因素[27-28]。在本试验中,燕麦的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)均呈下降趋势(表3),但Ci下降趋势不明显,这一结果与李从锋等[29]对玉米在低氮环境下的研究结果一致。因此推测早期皮燕麦在低氮胁迫下Pn下降可能是由于气孔闭合导致的。
3.3 低氮胁迫下皮燕麦的氮代谢响应
目前的农业模式中,作为植物氮肥来源的主要是硝酸盐中的硝酸根(NO3-),因此对植物体内的硝态氮含量的测定,可以直观地看到周围环境的氮水平变化及植物自身吸收氮的效率[2,30]。前人研究表明,在低氮环境中的植物,当可吸收的外界氮素减少时,其体内的硝态氮含量也会随外界氮素浓度的下降而降低[31]。在本试验中发现低氮环境下,所有品种吸收的硝态氮都有不同程度的减少(图1);这与刘源[32]在大豆(Glycine max)的低氮胁迫研究中结果一致;范莲雪等[31]在关于黄瓜(Cucumis sativus)的低氮试验中也得出相似的结果,黄瓜的地上、地下部分硝态氮含量都低于正常氮处理。青引1 号的硝态氮含量降幅度最大,说明在供试的燕麦品种中,青引1 号的氮吸收能力最弱。
植物从土壤中吸收的NO3-无法直接利用,需要经过一系列氮代谢反应将NO3-还原、NH4+同化,以便生成含氮有机物来维持植物生长发育,这也就涉及各种氮代谢相关酶[33]。氮代谢相关酶活性展现了植物的氮代谢能力,硝酸还原酶(NR)作为植物进行氮代谢的第一限速酶,是研究低氮胁迫的关键指标,其主要作用是将植物吸收的NO3-还原成NH4+[34]。谷氨酰胺合成酶(GS)是植物同化氨的关键酶之一,相关研究表明,低氮环境下,GS 活性与氮效率呈正相关,GS 高表达能增加植物的氮代谢效率[35]。植物的氮代谢过程中,GS/GOGAT 途径是十分关键的一步,是氮代谢过程的重要枢纽,被NR 还原后的NH4+在GS 的催化作用下生成谷氨酰胺(glutamine,Gln),并在GOGAT 的作用下再次转化为谷氨酸(glutamic acid,Glu)[36-37]。GDH 对作物的氮利用率同样有重要的调控作用,有研究报道,当NH4+浓度增加时,会引起植物体内GDH 的活性升高,从而催化谷氨酸(Glu)的合成,来抵抗NH4+中毒[36];同时,GDH 活性升高还会促使脯氨酸的含量增加,增强植物的抗逆性[38-39]。在本试验中,所有皮燕麦品种的NR、GS、GDH 活性均表现为下降趋势,这与谢孟林等[40]在低氮胁迫下玉米苗期氮代谢相关酶活性的研究结果一致;并且骏马、边锋的GS 活性下降得十分明显,说明这两个品种在低氮的环境下,其氨转化能力最容易受到影响。另外本试验中GOGAT 呈上升趋势,也可能是因为皮燕麦GOGAT 的高表达将谷氨酰胺(Gln)转化成了谷氨酸(Glu),消耗了大量NH4+,维持了自身生长需求,从而使皮燕麦植株体内的NH4+没有堆积对自身造成毒害,也因此没有高浓度的NH4+来刺激GDH 活性升高。这可能就是皮燕麦在低氮胁迫下相关氮代谢酶的动态变化理论。
3.4 低氮胁迫下皮燕麦的抗氧化能力
当植物处于逆境环境中时,植物细胞内活性氧(ROS)的产生和清除动态平衡就会被打破,从而导致ROS 含量增加[41]。ROS 又主要包括超氧阴离子(O2·-)和过氧化氢(H2O2)等,过多的ROS 会使细胞膜的膜脂系统受到损伤[42]。与此同时,植物在受到胁迫后细胞膜脂过氧化会明显加剧,丙二醛(MDA)作为膜脂过氧化的重要产物,对植物的蛋白质、核酸和酶都有很强的破坏性,因此MDA 含量高低能反映植物受伤害程度的大小[43]。本试验发现,低氮处理下,所试皮燕麦材料的ROS 均大量累积(图6),不同品种的累积情况不同,这与王峰[34]在低氮胁迫下不同耐低氮性作物的ROS 变化研究结果一致。并且在低氮胁迫下,所有皮燕麦的 ROS 含量上升的同时,皮燕麦MDA 含量较正常氮情况下均上升(图7),这与叶宇波等[44]对杉木(Cunninghamia lanceolata)幼苗在低氮胁迫下的MDA 变化趋势一致。本试验中的ROS 与MDA 含量的显著上升结果表明,低氮胁迫会对皮燕麦的膜脂系统造成损伤,导致皮燕麦体内的自由基变多,从而使皮燕麦受到氧化损伤;另外皮燕麦在低氮胁迫下的氧化反应,也表明皮燕麦的抗氧化能力变弱,这可能与抗氧化酶活性有关。
3.5 低氮胁迫下皮燕麦的渗透调节能力
相关研究表明,当植物受到逆境胁迫时,会通过调节自身一系列生理生化反应来适应逆境,其中渗透调节物质的含量可作为评价植物的抗性指标之一,可溶性糖(SSC)和可溶性蛋白(SP)等有机物质含量的增加,可以维持植物叶片的水分吸收能力并延缓叶片的衰老[45]。而低氮胁迫中,因外界氮素的缺失,从而导致自身吸收合成的氮化物过少,可合成的蛋白质减少,氮素的缺失会使植物自身的渗透调节物质发生改变[34]。陈莹等[24]在高羊茅的相关研究中发现,低氮胁迫使高羊茅的SP 显著下降,指出SP 的合成受到了低氮胁迫的影响;李强等[46]在玉米苗研究中发现,低氮胁迫下的SP 呈下降趋势,且耐低氮型玉米的下降幅度要小于氮敏感型玉米,同时指出耐低氮品种在低氮胁迫下更能维持自身的渗透调节能力;张楚等[47]在对苦荞(Fagopyrum tataricum)的低氮胁迫中同样发现,低氮胁迫下苦荞的SP 显著下降;以及王宁等[48]在对玉米的低氮胁迫研究中发现SSC 含量下降,并且发现SSC 降低的幅度与生物量降低幅度一致。在本研究中发现,低氮胁迫会造成皮燕麦SSC、SP 含量显著降低(P<0.05),基于以上,可以看出低氮环境会导致皮燕麦自身合成的氮化物减少,从而影响皮燕麦SSC 和SP 的合成,降低皮燕麦自身水分吸收能力与渗透调节能力,诱导早期皮燕麦叶片衰老。并且,耐低氮品种(青引1 号)的渗透调节物质的降幅小于氮敏感品种(骏马、边锋、太阳神),因此可以认为,耐低氮型皮燕麦可以保持相对较高的渗透调节能力从而增强自身的抗逆性,其延缓叶片衰老的能力也更强,这可能就是皮燕麦耐低氮胁迫的重要生理机制之一。
3.6 耐低氮品种筛选
氮胁迫是影响作物产量的重要因素之一,且不同品种对氮胁迫也会有不同程度的响应,而幼苗期作物的形态指标、农艺性状、生理指标都可作为评判耐性的主要依据[46-47]。植物的形态指标可直观地反映品种在胁迫下的耐性,植物的生理生化特性是植物在内部机理上对低氮胁迫产生的响应,进而影响了其形态特征及产量等指标[49-50],形态和生理指标可分别反映植物外部及内部的抗性。因此,综合形态与生理指标来评价植物可以更全面地反映材料的耐低氮性。同时,鉴于各品种的固有差异,采用耐低氮系数来科学评价各品种的相对变化。并且,基于各指标间相关性差异,运用主成分分析和隶属函数分析可以实现降维分析,能全面地分析各个指标的数据及其相关性[51]。综上,为了更准确地对皮燕麦抗性进行评价,本试验采用燕麦的形态指标、光合指标、氮代谢相关酶活性、硝态氮含量、活性氧含量及渗透调节物质含量等21 个指标的耐低氮系数,通过相关性分析、主成分分析、隶属函数分析、聚类分析相结合的方式来综合评价18 份皮燕麦的耐低氮性。本研究首先采用隶属函数与主成分分析相结合的方法,计算耐低氮综合值(D)来评价皮燕麦的耐低氮性,尽可能减少单一方法的片面性。结果发现在低氮胁迫中,所试验的品种里,耐低氮性较强的品种是甜燕70、青海甜燕麦和青海444,较弱的是骏马、甜燕2 号和青燕2 号,其余材料耐低氮性居中。聚类分析将青海甜燕麦、美达、青海444、牧王、领袖、边锋划分为耐低氮品种;将魅力、太阳神、莫妮卡、甜燕2 号、青燕2 号、枪手划分为氮敏感品种;其余品种均为中等耐低氮品种。结合隶属函数综合评价与聚类分析所得结果来看,青海甜燕麦、青海444 在以上分析结果中均属于耐低氮型品种,而甜燕2号、青燕2 号这两份品种均属于氮敏感型品种,所得结果还需大田试验进行验证。对于所筛选出来的耐低氮型品种青海甜燕麦,发现其在低氮胁迫下的活性氧含量大幅增加,但它的丙二醛(MDA)含量却没有大幅变化,这可能与其交替呼吸途径强弱有关,因此推测青海甜燕麦的抗氧化胁迫能力较强,但还需后续试验进行验证。
4 结论
1)低氮胁迫对皮燕麦早期的形态及生理生化有显著影响,早期燕麦的株高、地上部生物量在低氮胁迫下均呈显著下降趋势,根长变化以及地下部生物量变化不尽相同;同时净光合速率、硝酸还原酶、谷氨酰胺合成酶、谷氨酸脱氢酶等活性、可溶性蛋白与可溶性糖含量在受到低氮胁迫时均下降,而胁迫后的谷氨酸合成酶活性、活性氧含量与丙二醛含量会上升。
2)不同皮燕麦的耐低氮性不同,18 份材料中,耐低氮性较强的品种是青海甜燕麦、青海444,较弱的是甜燕2号和青燕2 号。
