植物遗传转化中体细胞再生的分子机制及应用研究进展
2024-02-23李玉珠余江弟丁菲菲苗佳敏白小明师尚礼
李玉珠,余江弟,丁菲菲,苗佳敏,白小明,师尚礼
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
转基因技术可将目的基因或基因编辑产物插入受体植物的基因组,获得的再生植株为进一步研究基因功能并开展新品种选育工作奠定基础。转化产物的再生能力是决定遗传转化成功与否的关键因子,也是限制转基因及基因编辑技术在植物上广泛应用的主要瓶颈。植物再生的基础是植物细胞的全能性,即单个分化的体细胞或分生组织细胞再生成完整植株的能力[1]。尽管植物细胞具有全能性,但自然界中的37 万多种高等植物中,只有不到0.1%的植物可进行转基因操作[2]。对于已建立遗传转化体系的植物,基于农杆菌侵染和基因枪轰击的转化技术通常需要花费大量的时间和精力通过组织培养获得再生植株。经愈伤组织形成的再生芽发生(de novoshoot organogenesis)和体胚发生(somatic embryogenesis,SE)是许多植物产生稳定转基因系的标准程序。随着对愈伤组织形成和再生分子机制研究的不断深入,与生长素和细胞分裂素(cytokinin,CK)生物合成、感应和信号转导相关的生长调节基因和发育调节基因在调控植物体外再生中的功能被鉴定,这些基因在遗传转化中的应用能显著提高再生效率和转化效率,缩短转化时间,实现在更广泛的物种和基因型上开展转基因和基因编辑技术。本研究在总结遗传转化过程中植物体细胞再生完整植株的不同途径和方式基础上,以再生芽发生和体胚发生的间接再生途径为主,阐释了影响再生的因素和分子机制及再生促进基因(生长调节基因和发育调节基因)在提高遗传转化效率方面的应用,并提出了今后开展研究的方向及前景。
1 转化细胞的再生方式
植物遗传转化研究中的外植体取材广泛,根据体细胞来源不同可分为两种类型,一种是存在于茎分生组织中的未分化细胞,即干细胞(stem cell,SC),另一种是已分化的体细胞。SC 是植物体所有地上器官的来源,但数量稀少且难以直接进行遗传操作,目前仅在大豆(Glycine max)[3-5]、黄羽扇豆(Lupinus luteus)[6]和小麦(Triticum aestivum)[7]上有成功被用于遗传转化并再生植株的报道。利用已分化的体细胞作为外植体时,这些体细胞需经过重编程,重获多能性或全能性后再生完整植株。根据再生方式和再生产物的不同,已分化体细胞的再生可分为器官发生途径和体胚发生途径,这两个途径都有直接发生方式和间接发生方式。间接发生方式中,外植体首先形成愈伤组织,通过愈伤组织的增殖和分化,以再生茎发生方式或体胚发生方式再生。直接发生方式中,外植体绕过愈伤组织诱导阶段,直接发育成体胚或茎等营养器官。因此,植物遗传转化过程中被转化体细胞的再生方式共有5 种,分别是依赖分生组织的器官发生、依赖愈伤组织形成的器官发生或体胚发生以及绕过愈伤组织形成的器官发生或体胚发生。器官发生的间接途径(即外植体—愈伤组织—再生茎发生或体胚发生)是大多数植物在遗传转化中实现体外再生的方式。在此过程中,愈伤组织的诱导、具备多能性或全能性细胞的获得以及芽再生或体胚再生是实现遗传转化与植株再生的重要环节和关键步骤。
2 愈伤组织诱导和再生分子机制的研究进展
外源植物激素诱导愈伤组织形成和再生的过程可分为4 个阶段,依次是外植体身份特征的消除、根特性的重新建立、茎特性的重新建立以及器官发生或体胚发生方式再生完整植株[8]。许多遗传和环境因子都会影响这个过程,其中,创伤、表观遗传修饰、生长素和细胞分裂素的作用最为重要。
2.1 早期创伤反应和信号转导
创伤是诱导愈伤组织形成的外部因素,它引起外植体发生一系列物理和化学变化,这些变化始于对创伤引起的相关分子模式的感知,并触发胞质钙信号和活性氧簇的爆发。局部创伤信号被翻译成长距离信号后,进一步诱导表观遗传修饰发生、生长素和CK 的合成与积累以及生长和发育调节基因的转录上调[9-10]。创伤诱导转录上调表达的基因包括染色质重塑调节基因POLYCOMB REPRESSIVE COMPLEX2(PRC2),细胞周期基因CYCLINs(CYCs)和CYCLINDEPENDENT KINASES(CDKs),细胞分裂素合成基因ISOPENTENYL TRANSFERASE(IPT),生长素合成基因YUCCA5(YUC5),创伤反应中心调节因子WOUND-INDUCED DEDIFFERENTIATION1-4(WIND1-4)和芽再生增强因子ENHANCER OF SHOOT REGENERATION1(ESR1)等[10-11]。其中,CYCs和CDKs的表达可重新激活细胞周期,从而使细胞重获增殖能力,这是愈伤组织形成的中心机制[12],而WINDs通过直接与ESR1启动子结合并上调其表达促进愈伤组织诱导[13]。没有创伤处理时,拟南芥(Arabidopsis thaliana)的根在愈伤组织诱导培养基(callus induction media,CIM)和茎诱导培养基(shoot induction media,SIM)上只能长出侧根而不能再生茎,说明创伤是从根到茎的细胞命运转变所必需的[14]。CIM 上的根因剪切造成伤口后可显著提高体胚发生效率,也证实了创伤应激和激素诱导的再生之间存在紧密关系[15]。
2.2 表观遗传修饰
染色质结构的表观遗传修饰会引起与愈伤组织诱导有关的基因表达发生全基因组水平的变化[16-17]。组蛋白H3 第27 位赖氨酸的三甲基化修饰(H3K27me3)是一类重要的转录抑制性翻译后修饰(post-translational modification,PTM),在植物生长发育的各个进程中发挥作用,也是叶片外植体转化为愈伤组织的关键因子。PRC2是H3K27me3 建立和维持的关键基因,该基因既可沉默叶片发育调节基因的表达,也可去除生长素合成基因YUC4和生长素/吲哚-3-乙酸基因auxin/INDOLE-3-ACETIC ACID2(AUX/IAA2)以及根发育调控基因WOX5(WUSCHEL-RELATED HOMEOBOX5)和SHORT-ROOT(SHR)上的抑制性甲基标记,直接参与叶片身份的消除[18]。此外,PRC2 介导的抑制性组蛋白修饰也控制创伤响应基因WIND的表达[19],WIND通过上调B型反应调节因子ARR-B(type-B ARABIDOPSIS RESPONSE REGULATOR)的表达水平激活CK 生物合成途径,促进愈伤组织诱导[20]。染色质重塑蛋白PICKLE(PKL)可结合在H3K27me3 靶基因的启动子区直接影响H3K27me3 水平[21],并通过组蛋白去乙酰化抑制CK 响应,其突变体中因H3K37me3 水平的降低而形成愈伤组织[22]。染色质修饰基因ARABIDIPSIS TRITHORAX4(ATX4)的表达在愈伤组织诱导期间被抑制,当茎身份基因KNOTTED1-LIKE HOMEOBOX GENE 4(KNAT4)和YABBY 5(YAB5)上的H3K4me3 甲基基团被去除后,该基因被重新激活并促进器官发生途径的再生[23]。此外,表观遗传重编程也引起愈伤组织诱导和再生过程中关键基因,即发育调节基因表观遗传状态的局部变化。这些关键基因包括WIND3,BABY BOOM(BBM),LEAFY COTYLEDON1(LEC1),LEC2和WOX5/11等[16]。因此,染色质结构的整体和局部修饰参与了愈伤组织形成和再生的所有过程,不同的表观遗传修饰组合和发生的时序性塑造了愈伤组织中不同细胞后续发育命运的复杂性。
2.3 生长素促进愈伤组织形成和细胞多能性的获得
细胞增殖能力的重新获得是愈伤组织诱导的主要特征。CIM 上愈伤组织的形成类似侧根原基发生过程,启动木质部中柱鞘细胞分裂的激素是生长素[24]。生长素通过ARF(AUXIN RESPONSE FACTOR)转录因子ARF7 和ARF19 介导的侧根形成相关基因LBD(LATERAL ORGAN BOUNDARIES DOMAIN)的激活诱导愈伤组织形成,实现将生长素信号通过侧根形成基因转化为细胞周期再激活的模式[25]。过表达调控侧根形成的基因(LBD16、LBD17、LBD18和LBD29)可在无外源激素的情况下诱导愈伤组织的形成[26]。除了激活调控细胞周期的关键基因,生长素还可下调编码细胞周期蛋白依赖激酶CDKs 的抑制基因KIP-RELATED PROTEN(KRP)以及生长素调节组蛋白乙酰化所需的编码转录接头蛋白基因PROPORZ1(PRZ1,也称为At-ADA2b)[27],将生长素信号转变为细胞周期重激活模式。CIM 上培养的愈伤组织经细胞增殖可获得多能性。生长素通过两个不同的途径促进细胞多能性的获得。一个途径由WOX11和LBD16介导,LBD16被WOX11激活后在CIM 上形成的愈伤组织中特异表达,并促进细胞多能性获得。一旦WOX11-LBD16途径被阻断会导致愈伤组织丧失多能性,在SIM 上无法再生茎[28]。另一个途径涉及根分生组织发育调节基因PLT1和PLT2。生长素通过PLT3、PLT5 和PLT7 激活PLT1和PLT2的表达,赋予细胞多能性[29-30]。PLT3、PLT5 和PLT7 也能调节芽再生促进基因CUC2(CUP-SHAPED COTYLEDON2)的表达[31],使SIM 上具备多能性的细胞再生完整茎[29]。因此,组织培养中芽再生过程包括两个不同的步骤,分别是CIM 上多能细胞的形成以及SIM 上多能细胞再生茎。芽再生过程中生长素的作用尚不明确,但YUC1和YUC4可在SIM 上被诱导,芽再生需要YUC 介导的生长素合成[32]。
2.4 细胞分裂素诱导愈伤组织形成和芽再生
CK 诱导愈伤组织形成的关键组分是B 型ARRs。B 型ARRs 促进细胞周期重启的靶蛋白是CYCD3(一种D型细胞周期蛋白),在缺乏外源CK 时,过表达CYCD3可诱导拟南芥愈伤组织的形成[33]。AP2/ERF 转录因子家族的成员ESR(ENHANCED SHOOT REGENERATION)参与CK 信号通路,可通过直接激活CYCD1;1的表达促进愈伤组织形成。在不含外源激素的培养基上过表达ESR1和其功能冗余同源基因ESR2可诱导拟南芥愈伤组织的形成[34]。ESR 也能上调缩短G1期持续时间的OBP1基因(OBF BINDING PROTEIN1),后者可直接与CYCD3;3和S 期特异转录因子基因DOF2;3(DOF TF OBF2;3)的启动子序列结合[35]。因此,CK 通过ESR 介导的细胞周期重新激活方式实现愈伤组织诱导,该过程受多个转录水平的调控以共同协调不同细胞周期基因的表达。CK 通过WOX5 和 B 型 ARR12 抑制ARRs-A表达,随着CIM 上诱导的愈伤组织对CK 响应敏感性的增强可使细胞获得多能性。CK 可诱导SIM 上获得多能性的细胞再生芽,涉及CK 响应和信号转导的基因调控该过程。CK 受体组氨酸激酶(histidine kinases,HKs)在芽再生中起主要作用[36],过表达CK 下游信号成分,如ARR1可在没有外源CK 的情况下再生芽[37]。CK 诱导芽再生的关键基因是WUSCHEL(WUS)。WUS表达水平的增加足以激活不定芽形成[38],WUS的功能缺失突变体则无法在SIM 上实现芽再生[39]。CK 是通过ARR(ARR1、ARR10 和ARR12)的介导激活了WUS的表达,促进茎顶端分生组织(shoot apical meristem,SAM)的形成[40-42]。该过程中,Ⅲ类同源结构域亮氨酸拉链(class Ⅲ homeodomain-leucine zipper,HD-Zip Ⅲ)转录因子PHABULOSA(PHB)、PHAVOLUTA(PHV)和REVOLOTA(REV)直接与B 型ARR 相互作用以激活WUS的表达,是CK 诱导WUS表达和随后芽再生不能缺少的关键调节因子[43]。
2.5 生长素诱导体胚发生
外源生长素2,4-D 用于诱导拟南芥体胚时,胚性愈伤组织表面或内部首先形成原胚团(proembryogenic masses,PEMs),增殖后的PEMs 被转移到无生长素的培养基上,PEMs 中的单个细胞或细胞团可进一步完成胚胎发育再生完整植株[44]。研究表明,体胚发生是胚胎调节基因通过调控生长素合成和信号转导途径实现的,内源性生长素的生物合成是细胞获得全能性的重要条件[45]。胚性愈伤组织转移到无生长素的培养基后,依赖PIN1 介导的极性生长素运输导致其表层细胞形成生长素最大值区域。同时,依赖YUC 的生长素从头合成使内源生长素水平逐渐增加[46]。生长素激活WUS表达,进而激活胚胎发育调节基因LEC1和LEC2[47-48],这两个基因与合子胚胎发生相关的转录因子BBM 和AGL15(AGAMOUS-LIKE 15)相互作用,形成包括多个正反馈通路的转录调控网络[49-51]。这些胚胎发育调节基因促进YCUs,TAA1和IAA30的表达,调节生长素合成和信号转导,促进体细胞胚胎发生[52-53]。
3 再生促进基因提高植物遗传转化效率的研究进展
生长素和CK 共同决定着植物组织和器官的再生方式和再生命运。添加外源生长素和CK 通过激活特定发育程序增强了体外再生反应。参与植物生长素和CK 生物合成、响应和信号转导的基因属于生长调节基因;控制细胞发育命运(全能性和多能性)的转录因子基因属于发育调节基因,也叫作形态发生基因[8]。它们在植物器官发生和体胚发生过程中存在紧密的调控关系,在分子水平上共同影响遗传转化和体外再生,统称为再生促进基因(表1)。
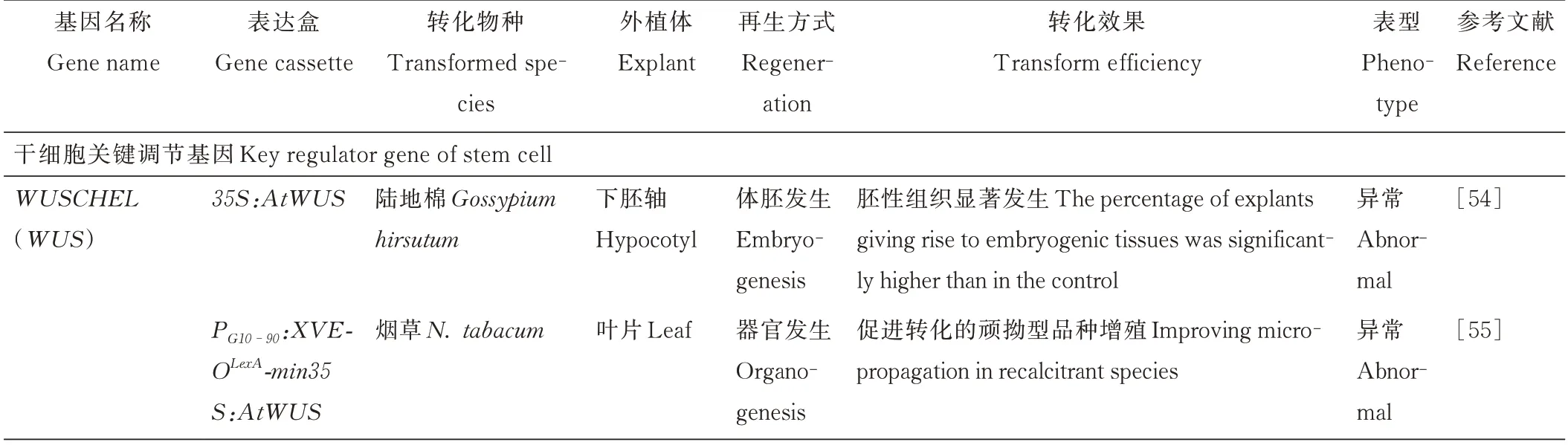
表1 植物再生促进基因在遗传转化中的应用Table 1 Application of regeneration-promoting genes in the improvement of plant transformation system
WUS是SAM 中维持干细胞生态位最重要的发育调节基因,也是生长素和CK 调控植物细胞重获多能性或全能性的关键基因。过表达WUS被用于促进植物遗传转化,转化细胞通过体胚发生[54-56]和器官发生方式再生[57-58]。由于生长素和CK 都能调节WUS表达,因此持续表达WUS的转基因植株常具有异常表型。通过分别构建ZmWUS2基因和选择标记基因的表达载体,再共同侵染玉米(Zea mays)未成熟胚的方法,可获得仅表达选择标记基因而不含ZmWUS2的T0代正常转基因玉米植株。该方法利用玉米磷脂转移酶启动子ZmPLTP 驱动ZmWUS2的表达,在WUS2T-DNA 不整合但选择性标记T-DNA 整合的细胞中,瞬时WUS2的表达刺激含有选择性标记的相邻细胞以体胚发生方式再生。研究者将这种利用形态发生基因瞬时表达刺激含靶基因的细胞发生再生的方法叫作“利他转化”[59]。
3.1 生长素相关的再生促进基因
AP2/ERF(APETALA2/ETHYLENE RESPONSIVE ELEMENT BINDING FACTOR)转录因子家族基因BBM通过生长素信号途径诱导植物胚胎发生和器官发生[60-61]。过表达BBM基因的欧洲油菜(Brassica napus)[60]、烟草(Nicotiana tabacum)[62]、可可(Theobroma cacao)[63-64]和辣椒(Capsicum annuum)[65]通过器官发生或体胚发生方式再生。但这些转基因植株的营养器官和生殖器官会出现不同程度的多效型表型。LEC1 和LEC2 是位于BBM 调控体胚发生途径下游的转录因子[49],过表达欧洲云杉(Picea abies)的LEC1 型基因PaHAP3A促进了其体胚分化[66]。LEC2 可直接激活AGL15的表达,过表达GmAGL15使大豆转化效率提高了2倍但转基因植物具有异常表型[67]。SAUR15(small auxin-upregulated RNA15)是胚性愈伤组织诱导中生长素诱导的负调控因子,敲除ZmSAUR15可通过提高玉米未成熟胚形成胚性愈伤组织的能力,将转化效率提高5 倍[68]。
共表达BBM与WUS实现了许多组培执拗型单子叶植物的遗传转化。Lowe 等[69]利用农杆菌胭脂碱合成酶启动子(Nos:ZmWUS2)低水平表达WUS2,结合玉米泛素启动子(ZmUbi:ZmBBM)高水平表达BBM成功获得了玉米,高粱(Sorghum bicolor),甘蔗(Saccharum officinarum)和水稻(Oryza sativa)经体胚发生途径再生的转基因植株。该方法使4 个执拗型玉米自交系的转化效率从0.0%~2.0%改变为25.3%~51.7%,且效果显著,并在33 个重要的商用‘先锋’玉米自交系中成功实现遗传转化。但BBM和WUS的持续表达会引起根的异常表型,且转基因植株矮小而不育。Mookkan 等[70-71]设计了一种干旱诱导的CRE/lox 剪切策略,环化重组酶CRE(cyclization recombinase)识别loxP(locus of X-over P1)位点并表达,将转化胚性愈伤组织中的Nos:ZmWUS2和ZmUbi:ZmBBM切除,获得了可育的T0代转基因植物。该方法在执拗型玉米品种‘B73’和高粱‘P898012’上实现了有效转化,但干燥诱导的剪切方法需要3 个月时间的愈伤组织诱导。为了缩短转化时间,Lowe 等[72]尝试使用不同的启动子驱动BBM和ZmWUS2的表达,Nos:ZmWUS2和ZmPLTP:ZmBBM的组合使未成熟玉米胚在一周内直接发生体胚,绕过愈伤组织形成阶段发育,长成健康的可育植株;ZmAxig1:ZmWUS2和ZmPLTP:ZmBBM的组合在7 个受试玉米基因型中同样可诱导以体胚直接发生方式再生转基因植株。Aregawi 等[73]利用两个农杆菌菌株同时转化高粱,一个菌株含有ZmPLTP:ZmWUS2和ZmPLTP:ZmBBM,另一个菌株含有选择标记基因,成功获得了仅表达选择标记基因而不含ZmWUS2和ZmBBM的T0代正常转基因植株,通过“利他转化”方法将高粱的转化时间缩短了近1/2,并使得之前几个不能转化的基因型成功得以转化。最近,Wang 等[74]利用Nos:ZmWUS2和3xEnhZmUbi:ZmBBM的组合在禾本科4 个不同亚科的8 个物种中成功获得了以叶片为外植体的胚性愈伤组织及再生植株,不仅显著提高了玉米和高粱的转化效率,而且获得了它们的基因编辑植株。
3.2 细胞分裂素相关的再生促进基因
KNOX(Knotted1-like homebox)同源域转录因子STM(SHOOTMERISTEMLESS)可激活CK 生物合成的重要限速酶异戊烯基转移酶7(isopentenyl-transferase 7,IPT7)进而促进CK 水平增加[85-86]。过表达玉米STM的同源基因Knotted1(ZmKn1)使甜橙转化效率显著增加3~15 倍[75]。过表达ZmKn1不仅使烟草转化效率增加3倍,而且转基因植株在没有抗生素和激素的培养基上通过器官发生途径再生,但转基因植株出现多叶丛生的异常表型[76]。过表达CUC1和CUC2可通过激活STM 表达而促进SAM 的形成,并使拟南芥转化效率提高10 倍,但产生的转基因植物表型异常[31]。雌二醇诱导ESR2过表达可通过直接调节CUC1转录水平促进拟南芥遗传转化[34]。转录因子MP(MONOPTEROS)是生长素响应基因和CK 信号转导及生物合成的调节基因[87]。当MP的调控结构域被移除时,可产生活跃表达且功能正常的MPΔ。过表达AtMPΔ通过上调AtWUS、AtSTM、AtESR1、AtCUC1和AtCUC2[77,87]并抑制A 型ARR5和ARR7的表达[88]提高具备异常表型的拟南芥转化效率。与上述过表达STM、CUC1/2、ESR2和MP等导致转基因植物具备异常表型相比,植物生长调节因子基因GRF(GROWTH-REGULATING FACTOR)和它的辅助因子GRF-INTERACTING FACTOR(GIF)的持续共表达不会引起转基因植物的表型异常[78-79]。受miR396 调控的GRF-FIF 二聚体通过招募SWITCH/SUCROSE NONFERMENTING(SWI/SNF)染色质重塑复合物调节其靶基因的表达,促进植物以器官发生途径再生[89-91]。‘哲引3 号’杨(Populus pseudo-simonii × Populus nigra‘Zheyin 3#’)的PpnGRF5-1 与PpnGIFs 形成的复合物,可通过抑制编码细胞分裂素氧化酶/脱氢酶1(cytokinin oxidase/dehydrogenase 1)基因PpnCKX1促进CK 积累和分生组织诱导[92]。Kong 等[78]发现过表达拟南芥AtGRF5或其同源基因不仅可以提高执拗型甜菜、欧洲油菜、大豆和向日葵的器官再生效率,也促进了玉米通过体胚再生的效率,获得的转基因植物均具有正常表型。Debernardi等[79]证明过表达GRF4-GIF1嵌合基因显著提高了小麦、水稻和柠檬等植物的转化效率,实现了顽拗型商用小麦品种的转化,并在不需要外源CK 的培养基上产生具有正常表型的可育小麦转基因植株。该研究中,过表达GRF4-GIF1嵌合体使小麦转化效率平均增加了7.8 倍,转基因小麦可在无抗生素选择标记基因的培养基(含生长素)上进行选择,转化周期从91 d 缩短到56 d。郭苏平等[93]将森林草莓(Fragaria vesca)基因组中鉴定出的FveGRF5和FveGRF10基因分别与FveGIF1构成GRF-GIF嵌合基因的过表达载体,发现2 对GRF-GIF嵌合基因均可提高森林草莓愈伤组织的芽再生率,其中,GRF5-GIF1的促进效果更明显,其芽再生率和遗传转化效率为对照的2.25 倍。
来自农杆菌Ti-质粒上的IPT催化CK 生物合成途径中的第一个中间产物异戊烯腺苷单磷酸盐(isopentenyladenosine-5’-monophosphate,isopentenyl-AMP)的形成[94-95]。过表达农杆菌IPT可使CK 水平增加23~300 倍,但获得的转基因植物具有明显的异常表型[80-81]。Ebinuma 等[82]开发了一种无须选择标记的烟草和杂交山杨转化体系,获得的半合子转基因体细胞可将含有35S:IPT表达盒的Ac 元件自动切除,最终产生0.5%∼1.0%表型正常的转基因植株。通过使用地塞米松诱导IPT的表达也获得了不需要抗生素标记的表型正常转基因烟草和莴苣,并使转化效率分别提高24.3 和6.6 倍[83]。ZmWUS2(Nos:ZmWUS2)的低表达结合农杆菌IPT(ZmUbi:IPT)或ZmUbi:AtSTM的高表达促进了拟南芥、本氏烟草(Nicotiana benthamiana)、番茄、马铃薯和葡萄等转基因植株的器官发生。当与Cas9/gRNA 质粒一起使用时,这个方法产生了直接再生茎而无须组织培养的基因编辑幼苗,该方法为缩短植物育种周期提供了巨大潜力[84]。
4 总结与展望
基因组学、转基因和基因编辑技术的发展为植物基础研究和作物品种改良提供了强大的平台。相对于基因组学和基因编辑技术的快速发展,转基因技术中再生体系的建立成为目前功能基因组学研究的瓶颈。近年来,随着对植物体外再生机制研究的不断深入,生长素和CK 诱导愈伤组织形成、增殖和再生的分子调控机理逐渐被探明。利用生长素和CK 生物合成、响应和信号转导通路中的再生促进基因,尤其是具有形态发生功能的发育调节基因,例如WUS和BBM,在促进单子叶植物顽拗基因型的遗传转化效率和再生能力方面取得了突破性进展。利用发育调节基因克服转基因障碍的方法也叫形态发生基因辅助转化方法(morphogene-assisted transformation,MAT)[73]。MAT 大大缩短了转化时间,扩大了可用于转基因操作的基因型和外植体类型,产生了非常高的转化率。但是,这些再生促进基因的应用往往会引起转基因植物表型异常。为克服这个负面影响,研究人员通过改变启动子类型调节再生促进基因的表达水平,或者利用时空诱导性基因表达策略获得不表达再生促进基因的转基因后代,还开发出将形态发生基因和靶基因置于不同农杆菌菌株再共同侵染的“利他转化”方法。这些方法的应用不仅获得了正常的转基因植株,而且产生了不需要激素、选择标记甚至组织培养的遗传转化。最近的研究发现,GRF-GIF的持续表达能获得再生效率高且表型正常的单子叶和双子叶转基因植株。需要注意的是,由于GRF-GIF 家族中有多个成员,并不是所有的GRFs 或GRF-GIF 配对在植物转化中都同样有效,因此,需要在目标植物上开展鉴定具有高转化效率的GRFs 或GRF-GIF 配对的研究。除本研究中介绍的再生促进基因外,其他能促 进SAM 形成,芽再生或体胚发生的基因,如PLTs(PLETHORAs),WINDs(WOUND-INDUCED DEDIFFERENTIATIONs),ARRs(ARABIDOPSIS RESPONSE REGULATORs)等在植物遗传转化和再生中的作用有待进一步研究。
组织培养既是转基因和基因编辑技术的重要工具也是限制这些技术在植物上高效且广泛应用的主要原因。为了避免组培造成的不利影响,研究人员开发了一种在体细胞中传递和测试基因编辑试剂的方法,称为Fast TrACC 方法(fast-treatedAgrobacteriumco-culture,快速处理农杆菌的共培养)。Fast TrACC 方法的原理是组合利用发育调节基因将已分化的体细胞快速重新编程为多能干细胞,直接产生转基因或基因编辑的芽,获得的基因编辑产物可稳定传递给下一代[84]。在本氏烟草、番茄、马铃薯、辣椒、茄子(Solanum melogena)和欧洲油菜等多个茄科植物上已被用于快速测试启动子活性和基因编辑试剂的有效性[96]。我国朱健康院士团队开发的CBD 递送转化系统(cut-dip-budding,切-浸-萌芽)可实现多个植物无须组织培养的快速有效的遗传转化,其原理是利用发根农杆菌(Agrobacterium rhizogene)侵染植物根茎交界处的切口,上部分茎产生转化根,再由转化根产生转化植株,该技术可应用于多个具有根蘖能力的植物,包括之前很难或不可能进行转基因的草本植物橡胶草(Taraxacum koksaghyz)和绣球小冠花(Coronilla varia)、块茎植物番薯(Ipomoea batatas)、木本植物臭椿(Ailanthus altissima)、楤木(Aralia elata)和重瓣臭茉莉(Clerodendrum chinense)等[2]。与Fast TrACC 方法相比,CBD 递送系统同样无须组织培养,也不需要无菌条件,仅通过对外植体的简单浸泡就能进行有效的转化或基因编辑。Fast TrACC 方法中再生效率最高的发育基因组合是ZmWUS2与AtSTM或IPT,这些组合在茄科以外的植物尤其是单子叶植物上仍需开展试验以验证该方法的有效性。CBD 递送转化系统技术背后有关植物根蘖发生能力的分子机理有待进一步研究,比如对根蘖发生调节基因的功能鉴定,以便使该系统在更多的植物品种和基因型上实现快速稳定的遗传转化。
