高寒草甸退化程度对优势物种根际土壤真菌群落和生态网络的影响
2024-02-23马源王晓丽马玉寿张德罡
马源,王晓丽,马玉寿,张德罡
(1.青海大学畜牧兽医科学院,三江源区高寒草地生态教育部重点实验室,青海省高寒草地适应性管理重点实验室,青海 西宁 810016;2.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃 兰州 730070)
高寒草甸作为全球范围内分布最广、面积最大的高寒生态系统之一,在维持地球生态系统稳定方面具有重要意义。我国高寒草甸主要分布在青藏高原,并占其总面积的2/3 左右,约为0.7×108hm2,在维持该区域生物多样性、调节气候、防止土壤侵蚀、固碳增汇和涵养水源等生态功能方面具有重要作用[1]。由于其特殊的下垫面构造和环境气候,高寒草甸本身的生态环境十分脆弱[2]。而近些年,由于全球性的气候变化和人为活动等因素的共同影响,致使高寒草甸生态系统出现了大规模、持续性和不可逆的退化现象[3],从而严重影响了草地的系统生产力、稳定性和可持续性,使青藏高原东缘的生态环境和生物多样性受到一定程度的威胁,严重制约了当地畜牧业的可持续、高质量发展。
作为土壤生态系统中重要的组成部分,土壤微生物在协同植物参与养分转化和循环方面发挥着主导作用[4]。土壤微生物具有对外界环境极为敏感的特点,其结构和功能可迅速响应草地植被种类和数量的改变,被认为是评价土壤健康的关键指标[5]。而真菌作为土壤微生物区系中重要的成员之一,在参与土壤养分循环、维持植物正常生长和营养平衡等方面具有重要作用,是草地生态系统中的核心驱动力[6]。当草地发生退化时地上植被群落、数量和优势物种将会发生根本性改变,影响植物的根系分泌物,使根系周围的微生物群落结构和功能发生改变,从而在“植物—土壤—微生物”的共同作用下形成复杂的微生境,产生了“根际效应”[7]。而根际作为植物、土壤和微生物三者的交互界面,其中根际微生物最为活跃,存在丰富的微生物多样性,是植物根系和土壤之间的营养调控枢纽[8]。因此,植物群落可以通过宿主-微生物的直接相互作用和根际效应来影响微生物群落。综上所述,草地发生退化时根际真菌群落结构、功能和多样性可被作为衡量草地生态系统稳定和健康的重要指标。
同样,了解草地退化过程中根际微生物群落聚集的生态过程对于预测生态系统对环境变化的反应至关重要。前期研究发现,土壤微生物群落能够通过竞争、共生和互惠形成复杂的共生网络,并且通过搭建分子生态网络模型能够更好地理解和揭示植物-微生物相互作用。因此,植物-土壤-微生物的交互作用能够增加其网络的复杂性和连通性,从而具备更大的生态位和相互作用潜力[9]。当草地发生退化时,土壤中微生物共生网络的紧密性和复杂性必然会受到土壤性质、植物群落和优势物种的影响。现阶段,高寒草甸退化对草地物种组成[10]、土壤理化性质[3]、土壤微生物群落和功能等的影响已被广泛研究[11]。然而,有关草地退化对根际真菌群落组成和功能的影响,以及草地退化过程是如何影响根际真菌群落搭配和组装的相关研究鲜有报道。因此,本研究以青藏高原东缘退化高寒草甸为研究对象,利用高通量测序技术对不同退化程度高寒草甸根际真菌群落和功能进行研究,同时结合分子生态网络分析方法,揭示关键根际真菌类群间的作用方式和组装机制,以期为高寒草甸区草地退化修复治理和生态适应策略提供一定的理论依据和参考价值。
1 材料与方法
1.1 研究区域概况
研究区域位于青藏高原东缘甘肃省武威市天祝藏族自治县抓喜秀龙乡(102°44′11″-102°46′17″ E,37°11′42″-37°13′05″ N,海拔2900 m 左右),属高原大陆性气候,草地类型为高山草甸类,主体海拔2900 m,太阳辐射强,昼夜温差较大,年平均气温0.1 ℃,年蒸发量1137~2581 mm,平均降水量400 mm,集中于7-9 月,平均相对湿度55%,全年≥0 ℃的积温为1360 ℃左右,无绝对无霜期。主要土壤类型是亚高山草甸土,山地黑钙土。主要植物以垂穗披碱草(Elymus dahuricus)、甘肃棘豆(Oxytropis kansuensis)、草地早熟禾(Poa pratensis)、扁蓿豆(Melissilus ruthenicus)、乳白香青(Anaphalis lactea)、火绒草(Leontopodium leontopodioides)、线叶嵩草(Kobresia capillifolia)、赖草(Leymus secalinus)、珠芽蓼(Polygonum viviparum)、矮生嵩草(Kobresia humilus)等为主。
1.2 采样点布设及根际土壤样品采集
试验于2020 年7 月正式开展,同时根据任继周[12]的草甸退化研究方法对试验区域进行实地调查,在研究区选取4 个样地,分别为轻度退化草地(light degraded grassland,LD)、中度退化草地(moderate degraded grassland,MD)、重度退化草地(severely degraded grassland,SD)以及对照样地未退化草地(non-degraded grassland,ND)。在每个样地中选取1 个大小为200 m×200 m 草地状况均一的采样区域,并且在每个采样区域内以S 型设6 个1 m×1 m 的调查样方,每个样方间距50 m 左右。用方格法[12]测定每个样方中植物高度(cm),植被盖度(%),植物种类以及植物数量,分别计算出不同退化草地的优势植物。同时在调查样方中布设1 个50 cm×50 cm 的小样方,挖取1 个0.2 m×0.2 m×0.3 m(土壤深度)的土块做好标记,用保鲜膜封装后放入干冰箱中尽快带回实验室在超净工作台下进行下一步土壤样品的处理。4 个退化样地共计24 个采样位点,研究区样地具体信息如表1。

表1 不同退化程度高寒草甸样地基本信息Table 1 Basic information of alpine meadow plots with different degrees of degradation
将带回实验室的土块放置于无菌工作台中,参考Chaudhary 等[13]的方法,采集4 个不同退化程度样地中优势植物的根际土壤(rhizosphere soil,RS)样品。一般而言,抖落之后仍粘在植物根系上的土壤为根际土壤(附着的根际土为<2 mm),采用人工手段将附着在根系上的土壤扫入无菌自封袋,保证每个退化样地的优势植物根际土充分混匀,共计24 个根际土壤样品。将根际土保存至-20 ℃超低温冰箱中,进行后续微生物高通量测序分析。
1.3 高通量测序分析
采用CTAB/SDS 方法[14]对24 个新鲜根际土样进行DNA 提取,使用1%琼脂凝胶电泳检测所提DNA 的浓度和纯度。采用ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTC TTCATCGATGC-3′)为引物,对真菌ITS 区进行扩增[14]。PCR 扩增反应体系为30 μL:高保真DNA 聚合酶预混液15 μL(New England Biolabs),10 ng 模板DNA 以及超纯水,上下游引物各0.2 μmmol·L-1。PCR 扩增顺序如下:98 ℃预变性1 min;98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,进行30 次循环;72 ℃ 5 min 最终延伸。将PCR 扩增产物用1×TAE 浓度2%的琼脂糖凝胶电泳检测,由北京诺禾致源生物信息科技有限公司进行后续的样品建库,并通过Ion S5TMXL(Thermofisher)平台,利用单端测序(single-end)方法进行高通量测序工作。
测序数据处理流程:首先利用Cutadapt(V1.9.1)[15]将原始数据进行拼接和过滤得到有效数据,同时采用UCHIME Algorithm(V4.2)对比数据库去除嵌合体序列,获得可被利用的测序数据;其次采用Uparse 软件(v7.0.1001)将相似性大于97%的序列聚类成为分类操作单元(operational taxonomic units,OTUs),并筛选出频数最高的OTUs 代表序列进行后续物种注释分析[16];再次基于Mothur 算法[17],采用Unite(7.2)数据库与代表性的OTUs 比对,并进行分类学注释,利用MUSCLE(V3.8.31)软件进行快速多序列比对,获得OTUs 序列的系统发生关系;最后将每个样品的数据进行标准化处理,以便后续进行真菌群落多样性分析。
1.4 分子生态网络分析
本研究以MENA 平台(http://ieg4.rccc.ou.edu/mena)构建分子生态网络(molecular ecological networks,MENs)[18],以获取相关网络参数,具体步骤如下:将测序获取的根际土壤样本OTUs 数据进行对数转化,并基于Spearman 相关系数,转化为相似性矩阵,并依据随机矩阵理论分析相关矩阵特征值的最近邻间距分布预测生态群落。为了计算真菌生态网络共现/互斥的统计显著性,通过迭代1000 次获取并计算边缘特定的排列和引导分数分布,并对所有数据进行重新归一化。最终按照Barberán 等[19]的方法描述网络拓扑特征,分子生态网络模型参数中聚类系数(即识别网络的模块化组织的度量)、度连接分布(连接到节点的边数)、中介中心性(反映该节点对其他节点的交互施加的控制量在网络中)和拓扑系数(网络中节点具有共享邻居的趋势)以及每个节点的连接度,正(共现)和负(互斥)边缘的数量,同时根据节点的模块内连通性(within-module connectivity,Zi)和模块间连通性(among-module connectivity,Pi)评估节点的拓扑角色,其中表述微生物群落网络的关键节点主要依据网络与模块中心点及连接节点。这些结构特性提供了对来自不同退化程度高寒草甸的复杂数据集进行快速和简单比较的潜力,以探索草地退化是如何确定根际土壤中真菌群落的组装。最后采用Gephi 0.9.2 对其网络进行可视化[20]。
1.5 数据统计与分析
采用Excel 2019 和SPSS 18.0 软件对数据进行整理和统计分析,通过单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05),图表中所有数据均表示为平均值±标准误(mean±standard error);根际真菌群落组成、Alpha 多样性(Coverage、Shannon-Weiner、ACE、Chao1 指数)和Beta 多样性的主坐标分析(principal co-ordinates analysis,PCoA)和非度量多维尺度分析(non-metric multi-dimensional scaling,NMDS)于诺禾致源云平台进行分析,采用线性判别分析效应大小(linear discriminant analysis Effect Size,LEfSe)进行分析,其中线性判别分析(linear discrimination analysis,LDA)的阈值设置为3.5 以判定显著差异物种,利用FunGuild 对真菌群落进行功能注释。运用GraphPrism 9.0 进行图表绘制。
2 结果与分析
2.1 不同退化程度高寒草甸根际土壤真菌DNA 测序分析
通过IonS5TMXL 测序平台,对4 个退化样地根际土壤样品进行了高通量测序分析,24 个样本共获得了81548条序列,经过质控优化后获得80214 条有效序列,并且在97%序列相似度水平上聚类共获得3375 个可分析的OTUs。对4 个退化程度高寒草甸根际土壤真菌进行稀释曲线分析发现,各样本曲线随测序深度的增加整体变化趋于平坦(图1A),同时结合各样地测序覆盖率99.7%的结果可知(表2),本研究取样方式合理、样本量充分,测序结果能够真实反映不同样地真菌群落数目。不同退化程度下共有根际真菌OTU 数为1236 个,并且根际土壤真菌OTU 分布数目表现为LD>ND>MD>SD(表2)。根据不同退化程度高寒草甸根际真菌的OTU 数量绘制韦恩图可知(图1B),ND 样地特有OTU 数为237 个;LD 样地特有OTU 数为172 个;MD 样地特有OTU 数为203个;SD 样地特有OTU 数为204 个。
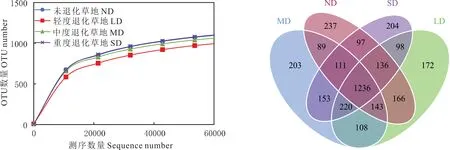
图1 不同退化程度高寒草甸优势物种根际土壤真菌稀释曲线(A)和韦恩图(B)Fig.1 Rarefaction curves(A)and Venn diagrams(B)of rhizosphere fungi of dominant species in degraded alpine meadows with different degrees

表2 不同退化程度高寒草甸优势物种根际土壤真菌多样性指数Table 2 The rhizosphere soil fungal diversity index of dominant species in degraded alpine meadows with different degrees
2.2 不同退化程度高寒草甸根际土壤真菌群落多样性变化
基于OTU 的分类水平对4 个退化样地根际土壤真菌的Alpha 多样性指数分析可知(表2),高寒草甸4 个退化程度样地中根际土壤真菌群落丰富度指数(Chao1 指数和ACE 指数)均表现为:LD>ND>MD>SD;根际土壤真菌Shannon-Weiner 指数和Simpson 指数分别表现为:ND>LD>MD>SD 和MD>SD>ND>LD。整体而言,4 个退化高寒草甸根际土壤真菌Alpha 多样性差异不显著。
基于Bray-Curtis 距离的主坐标分析(principal co-ordinates analysis,PCoA)结果可知(图2A),以主成分PC1(解释率21.88%)和PC2(解释率9.98%)为坐标轴构建的二维坐标系在OTU 水平上退化高寒草甸根际土壤真菌群落表现出一定差异,同时结合非参数检验方法(Anosim)进行组间差异检验发现,ND 与LD、MD 和SD 间根际土壤真菌群落结构组成差异显著(R=0.5315,P=0.004;R=0.4241,P=0.001;R=0.9648,P=0.004),LD 与MD 和SD 间根际土壤真菌群落结构组成差异显著(R=0.5741,P=0.007;R=0.4241,P=0.001),而MD 与SD间根际土壤真菌群落结构组成差异不显著(R=0.1519,P=0.101),在一定程度上解释了不同退化样地的远近差异和相似度。通过非度量多维尺度分析(non-metric multi-dimensional scaling,NMDS)发现(图2B),随退化程度加剧根际土壤真菌群落特征存在显著差异(P<0.05),并且4 个退化样地根际土壤真菌群落能够被很好地区分。
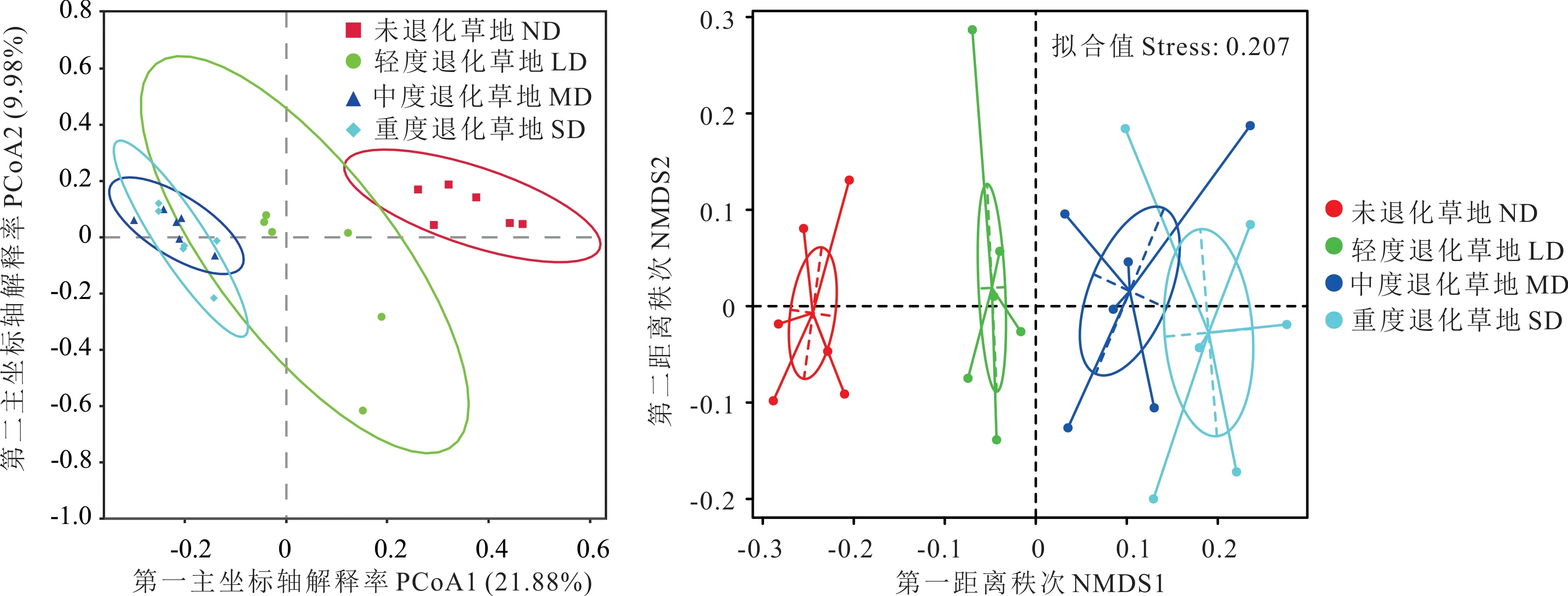
图2 不同退化程度高寒草甸根际土壤真菌OTU 水平下PCoA 和NMDS 分析Fig.2 Principal co-ordinates analysis(A)and non-metric multi-dimensional scaling analysis(B)based on OTU level of rhizosphere soil fungi in alpine meadows with different degradation degrees
2.3 不同退化程度高寒草甸根际土壤真菌群落组成与结构差异性分析
本研究在4 个退化高寒草甸根际土壤样本中共检测出13 个真菌门类。通过制作门水平上的群落相对丰度图发现,随退化程度加剧根际土壤真菌群落的组成结构及相对丰度比例出现明显变化趋势。如图3 所示,门水平上,4 个退化程度草地根际土壤真菌群落主要由担子菌门(Basidiomycota,相对丰度14.33%~43.20%,均值27.34%)、被孢霉门(Mortierellomycota,相对丰度9.29%~20.16%,均值14.43%)和子囊菌门(Ascomycota,相对丰度16.99%~25.32%,均值21.79%)组成,并且是相对丰度大于1%的真菌门类,而相对丰度低于1%的类群占28.14%~40.19%。4 个不同退化程度草地根际土壤真菌在门分类水平上表现出一定的变化趋势,其中担子菌门表现为LD>ND>MD>SD,被孢霉门表现为SD>MD>LD>ND,子囊菌门表现为SD>MD>ND>LD。
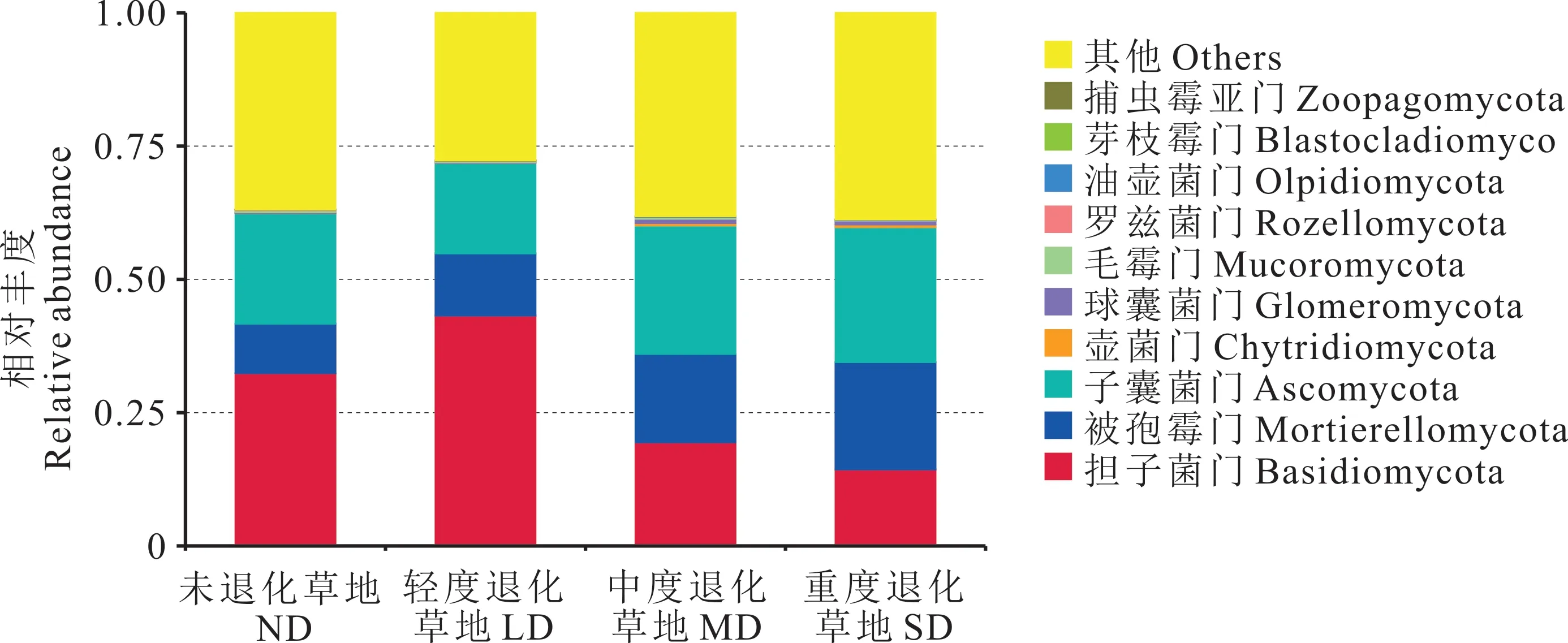
图3 不同退化程度高寒草甸根际土壤真菌群落门水平相对丰度Fig.3 Relative abundance of phylum levels of rhizosphere soil fungal communities in alpine meadows with different degrees of degradation
为明确高寒草甸退化过程中特定根际土壤真菌类群,本研究采用LEfSe 鉴定不同退化程度根际真菌群落丰度差异(图4),并利用线性判别分析(LDA)阈值判别具有显著差异的物种,构建群落进化分支图(图4),其中LDA 阈值为3.5。结果表明,门分类水平上,LD 样地中担子菌门(Basidiomycota)的相对丰度具有显著优势。纲分类水平上,ND 样地中伞菌纲(Agaricomycetes)、座囊菌纲(Dothideomycetes),MD 样地的锤舌菌纲(Leotiomycetes)和SD 样地的粪壳菌纲(Sordariomycetes)为各退化样地的显著优势纲。目分类水平上,ND 样地中伞菌目(Agaricales)、贝壳菌目(Mytilinidiales)、蜡壳耳目(Sebacinales),MD 样地的Thelebolales、肉座菌目(Hypocreales)和SD 样地的粪壳菌目(Sordariales)为各退化样地的显著优势目。科分类水平上,ND 样地中船壳菌科(Gloniaceae)、蜡壳耳科(Sebacinaceae)、丝膜菌科(Cortinariaceae),LD 样地的丝盖伞科(Inocybaceae)、珊瑚菌科(Clavariaceae)和MD 样地的假散囊菌科(Pseudeurotiaceae)、丛赤壳科(Nectriaceae)、口蘑科(Tricholomataceae)为各退化样地的显著优势科。属分类水平上,ND 样地空团菌属(Cenococcum)、丝膜菌属(Cortinarius)、蜡壳耳属(Sebacina),LD 样地的丝盖伞属(Inocybe)和MD 样地的Gymnostellatospora、Dactylonectria为各退化样地的显著优势属。种分类水平上,ND 样地的土生空团菌(Cenococcum_geophilum)、棕黑丝膜菌(Cortinarius_diasemospermus),MD 样地的Dactylonectria_hordeicola为各退化样地的显著优势种。
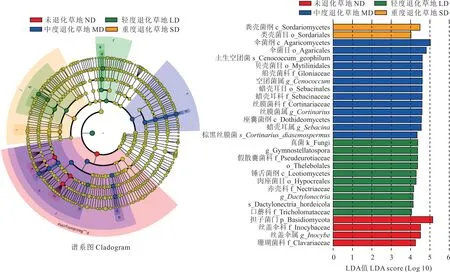
图4 不同退化程度高寒草甸根际土壤真菌线性判别分析Fig.4 Linear discriminant analysis effect size of rhizosphere soil fungal community in alpine meadows with different degradation degrees
2.4 不同退化程度高寒草甸根际土壤真菌的功能预测分析
本研究通过FUNGuild 数据库对4 个不同退化程度高寒草甸根际土壤真菌群落进行功能预测(图5),可被注释的草地根际真菌为32.31%~45.19%,表现为ND>SD>LD>MD。通过营养方式划分,退化草地根际土壤真菌主要以共生营养型、腐生营养型、病理营养型为主。根据Guilds 小类可知,高寒草甸根际土壤真菌主要由未定义的腐生真菌(undefined_saprotroph)、外生菌根真菌(ectomycorrhizal)和土壤腐生真菌(soil_saprotroph)等功能真菌群组成。其中未定义的腐生真菌在MD 和SD 根际样品中占比较高,分别为13.98%和14.93%;外生菌根真菌在ND 根际样品中占比最高,为13.74%,并且表现为随退化程度加剧逐渐降低的趋势;土壤腐生真菌在SD 根际样品中占比最高,为6.31%,表现出随退化程度加剧升高的趋势。在4 个不同退化程度样地中未被注释的根际土壤真菌相对较高,最高达67.62%。由此可知,高寒草甸根际土壤的功能真菌主要以共生营养型和腐生营养型为主,并且表现出随退化程度的加剧真菌功能由共生营养型向腐生营养型转变,因此,草地退化对于根际土壤真菌功能类群的结构产生了影响。
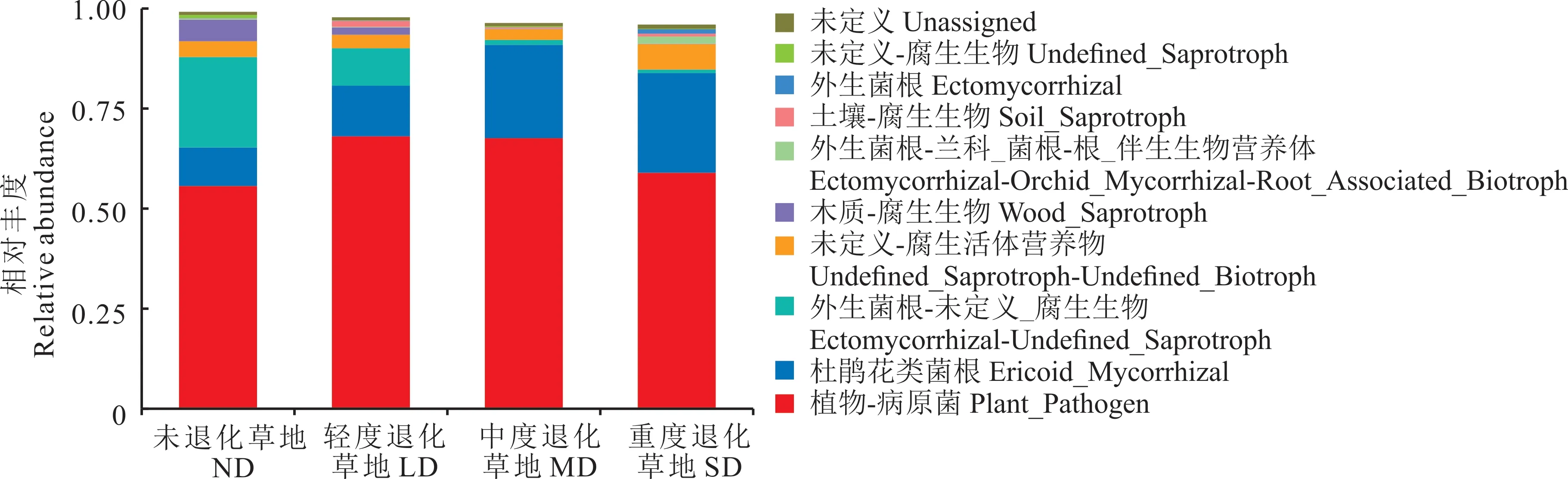
图5 不同退化程度高寒草甸根际土壤真菌营养功能类群Fig.5 Rhizosphere soil fungal nutritional function groups in different degraded alpine meadows
2.5 不同退化程度高寒草甸根际土壤真菌生态网络分析
由图6 和表3 可知,草地退化对根际土壤真菌OTU 分子生态网络的稳定性产生了显著影响。本研究对4 个不同退化程度草地根际土壤真菌网络进行搭建,基于随机矩阵理论,4 个退化程度高寒草甸根际真菌群落的阈值分别是ND(0.970)、LD(0.960)、MD(0.950)和SD(0.970),并结合其网络拓扑性质表明,LD 样地的网络结构相比于其他3 个样地更为复杂,其中ND、MD 和SD 的网络分别有839、971、768 个OTU 节点和6901、8445、5985 条边构成,远低于LD(1219 个节点和12929 条边),其大于1% 的模块性方面表现为LD(88.51%)>MD(83.56%)>SD(82.18%)>ND(78.14%);草地发生退化时,3 个退化样地[LD(62.19%)、MD(69.37%)和SD(73.92%)]其网络节点之间的负向关系高于ND(54.31%),从而表明根际真菌群落随草地退化的加剧呈竞争关系。本研究中4 个样地的网络连通幂律模型(R2值为0.712~0.806)吻合程度一般,但能够在一定程度上反映出网络的无标度(scale-free)性。同时随退化程度加剧,根际真菌群落中平均度(average degree)和平均聚集系数(average clustering coefficient)呈先升高后降低的趋势,均表现为LD>ND>MD>SD,平均路径长度(average path length)呈逐渐上升趋势,介数中心性(centralization of betweenness)表现出逐渐升高趋势,均表明草地退化导致真菌群落网络变得更加松散,以及网络复杂性逐渐降低。
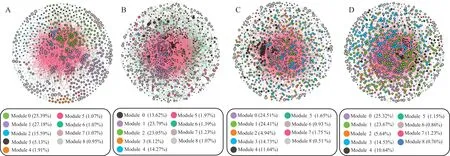
图6 不同退化程度高寒草甸根际土壤真菌群落分子生态网络Fig.6 Molecular ecological network of rhizosphere soil fungal communities alpine meadows with different degradation degrees
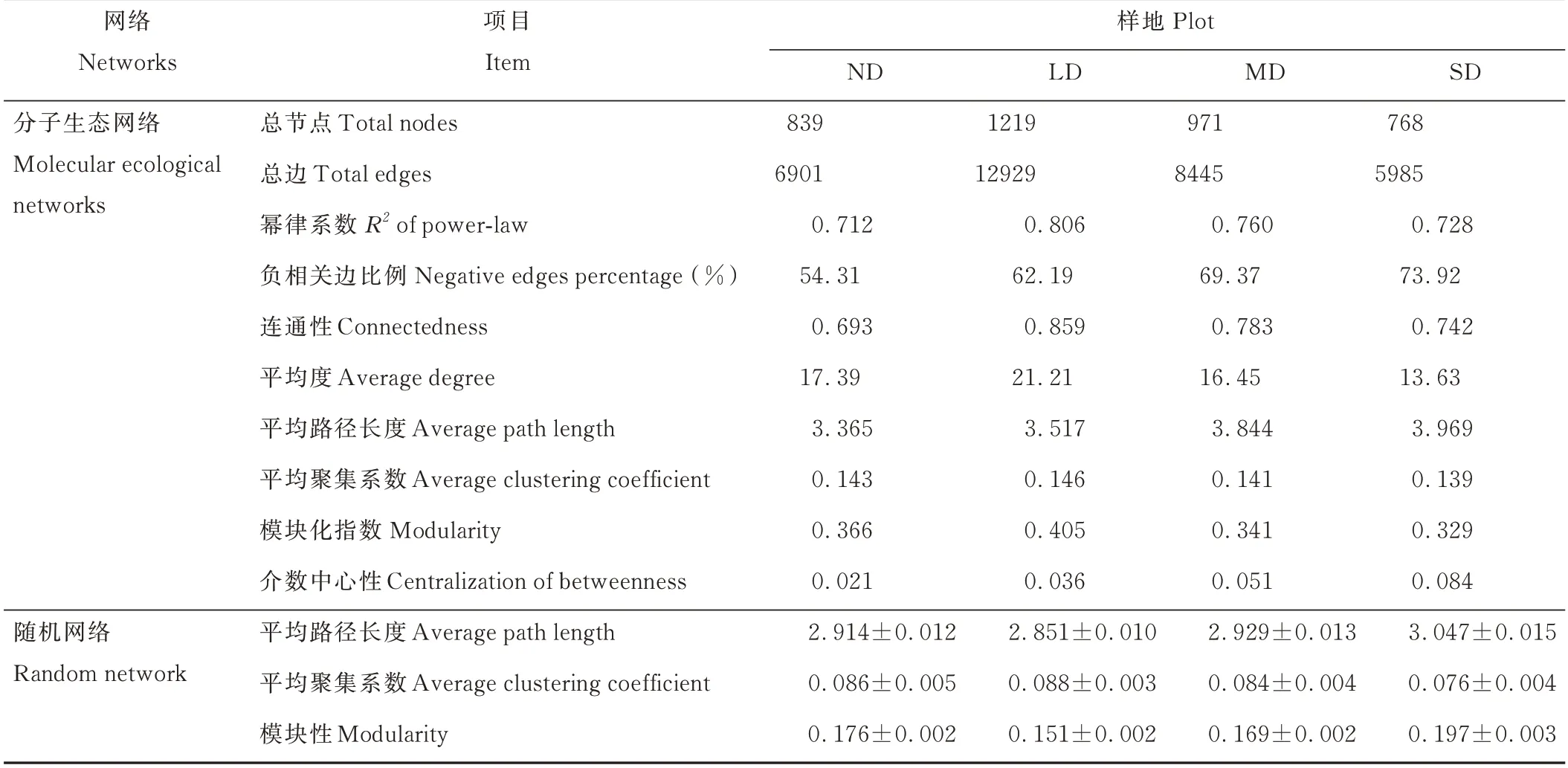
表3 不同退化程度高寒草甸根际土壤真菌网络拓扑参数Table 3 Rhizosphere soil fungal molecular ecological network characteristics of alpine meadow with different degradation degrees
本研究中4 个不同退化程度样地根际土壤真菌网络中均未发现网络中心点(Zi≥2.5 且Pi≥0.62)(图7)。整体而言,退化高寒草甸真菌网络中,绝大部分节点为外围节点(Zi<2.5 且Pi<0.62),大约占90%以上。一般而言,真菌网络中Zi≥2.5 或Pi≥0.62 的节点均可视为关键物种,本研究中根际土壤真菌物种表现为LD>ND>MD>SD,并且不同退化程度草地中生态网络的关键物种也明显不同。同样,本研究发现,草地退化后模块枢纽节点(Zi>2.5 且Pi<0.62)呈上升趋势,表现为SD 图7 不同退化程度高寒草甸根际土壤真菌OTUs 在网络中的位置Fig.7 Location of rhizosphere soil fungal OTUs in the network of alpine meadows with different degrees of degradation 高寒草甸退化能直接影响土壤中根际微生物群落结构和功能。本研究发现,随草地退化程度加剧,根际土壤中真菌群落Alpha 多样性整体呈降低趋势,但差异不显著。同样,Zhang 等[21]对亚高山地区演替过程中优势植物物种根部真菌群落和功能进行研究发现,根际真菌Alpha 多样性在3 个演替阶段无显著差异,本研究结果与其一致。这种现象可能归因于“根际效应”,其原因是草地退化过程中优势植物的改变会使植物根系分泌物的组成和数量发生变化(即碳水化合物、氨基酸、多元醇和有机酸等),从而为根际微生物提供丰富的碳源物质,使根际微生物丰富度提高,影响了真菌的Alpha 多样性[22-23]。采用PCoA 和NMDS 分析对本研究中4 个退化程度高寒草甸根际土壤真菌群落进行Beta 多样性分析发现,草地退化导致根际土壤真菌群落被区分开来,表明根际真菌群落结构受草地退化影响较为显著。进一步说明草地退化过程中根际土壤真菌群落的组成差异受草地优势物种的影响较为严重,这可能是由于受根际真菌可利用底物不同所引起的,Wagg 等[24]的研究中也有相似的结论。相比根际真菌多样性而言,高寒草甸根际土壤真菌优势种群和物种组成对草地退化程度响应较为敏感,这与前期土壤真菌群落响应草地退化的研究结果一致[25]。本研究中4 个退化草地根际土壤中主要优势真菌类群由担子菌门、被孢霉门和子囊菌门组成,且不同退化程度下根际真菌类群的相对丰度差异显著,表现为随退化程度加剧担子菌门整体呈降低趋势(LD>ND>MD>SD),子囊菌门和被孢霉门呈上升趋势(SD>MD>LD>ND),这与Gao 等[26]和尹亚丽等[27]的研究结论一致。这是由于担子菌门和子囊菌门均能作为分解动植物残体的主要真菌类群,但其中担子菌门多存在于土壤质量较好的区域[28],而子囊菌门由于具有较高的耐受性和高的周转率,能够更好地抵御环境压力从而提高其在退化严重草地中的优势地位[29]。被孢霉门多存在于有害生物(如线虫)中,可作为土壤健康状况的评价性指标[30],因此在预示高寒草甸植被和土壤的健康状态方面有很重要的作用。综上所述,高寒草甸退化导致根际土壤中真菌群落的分布出现差异性,但优势种群具有相似性,这可能与草地植物根系所分泌的物质不同有关,进而影响根际真菌群落结构发生变化。 为进一步探究草地退化过程中根际土壤真菌群落的差异性,本研究通过LEfSe 分析发现,ND 和LD 样地中担子菌门、伞菌纲和座囊菌纲为主要的差异物种,这表明退化不严重的高寒草甸土壤中,植物根际参与养分周转非常活跃,表现出植物与土壤间的交互能力为根际微生物的生存和繁衍提供栖息地[31]。而随着草地退化程度的不断加剧,MD 和SD 样地的根际土壤中锤舌菌纲和粪壳菌纲则成为主要的差异物种。大量研究报道指出,锤舌菌纲和粪壳菌纲多为植物有害病菌,能够通过繁殖大量子囊影响草地土壤的健康和植物正常生长,在一定程度上可以反映草地的生态功能[32],因此可作为检测草地退化的指示性微生物。同样本研究也发现蜡壳耳属、丝盖伞属、丝膜菌属等外生菌根真菌在退化草地的根际出现了富集,但随着退化程度的加剧则逐渐降低甚至消失,这也与前人的研究结论具有相似性[11]。这一现象既反映了根际真菌的宿主特异性和主动选择性,也进一步印证了草地退化过程中优势物种的变化对土壤真菌群落结构的影响[33]。与根际真菌群落结构的变化相似,不同退化阶段高寒草甸形成了不同的真菌功能群落。本研究基于FUNGuild 对4 个退化样地根际土壤真菌群落进行功能预测发现,退化草地根际真菌主要以共生营养型、腐生营养型、病理营养型为主,同时包含多种交叉营养型,并且以共生营养型和腐生营养型为主要响应功能群。研究发现,随退化程度加剧根际土壤真菌功能主要由共生营养型向腐生营养型转变,这可能受退化草地中土壤养分限制的因素,导致植物与共生型真菌之间关系减弱所引起的;或者是受到优势物种的改变所引起,因为不同优势植物根部所分泌的物质不同,所起到的驱动微生物聚集效应差异很大。前人研究也发现受过牧影响的温带草原土壤中共生营养型真菌群落显著降低,而腐生型真菌群落显著增长[34]。本研究还发现,腐生营养型占比在退化严重的样地中相对较高,这是由于退化严重的草场植物为了完成正常生活史,通过根系分泌物驱动根际微生物中的腐生营养型真菌的积累,提高分解土壤中动植物残体和草原生物粪便能力和效率所引起的,从而表现出重度退化区域植物根际腐生营养型真菌相对丰度增加的趋势。 生态网络分析作为阐明微生物间相互作用的重要手段,在探讨草地退化过程中根际微生物组装、搭建和稳定性方面具有重要意义。本研究发现,草地退化降低了根际土壤中真菌网络的复杂性,主要表现在平均度和平均聚集系数的降低,以及网络总节点、总边和连通度下降等方面。这与前期de Vries 等[35]和徐鹏等[36]分别在不同草地类型中真菌网络响应逆境胁迫方面的研究结果具有一致性。同时草地退化对真菌网络模块化特征有直接影响,本研究发现,随草地退化程度加剧根际真菌网络模块化指数呈降低趋势和介数中心性呈不断升高的趋势,这表明草地退化使根际真菌群落复杂性降低,结构更加松散。Mapelli 等[37]前期研究发现,土壤发育程度越高,其根际真菌群落结构的紧密性越强,本研究结果与其一致。导致草地退化过程中根际真菌群落复杂性降低和结构松散的原因可能受土壤养分资源限制或根际中真菌群落的竞争所影响。而本研究发现,退化高寒草甸中根际真菌群落以负相关关系为主,并且退化程度越剧烈负相关比例越高。这表明竞争关系在维持根际真菌群落稳定性方面占据主导作用[37]。同样,通过分子生态网络拓扑参数也能进一步解释根际真菌群落对于维持群落结构稳定性方面的作用[38],本研究发现,草地退化影响了根际真菌网络拓扑参数,并表现为随退化程度加剧根际真菌的关键物种互作性和连通率降低的趋势。这也进一步说明草地退化使优势植物发生改变,影响了根际真菌群落网络中关键的核心物种,最终导致高寒草甸退化降低了根际真菌相互作用的能力。 本研究发现,高寒草甸退化对根际土壤中真菌群落的Alpha 多样性影响不显著,但会显著改变根际土壤真菌群落的Beta 多样性;高寒草甸退化对根际土壤中担子菌门、被孢霉门和子囊菌门等优势种群影响不大,但对于根际土壤优势真菌的相对丰度影响较为剧烈;高寒草甸退化使根际土壤真菌群落的功能发生了显著变化,表现出随退化程度加剧由共生营养型向腐生营养型转变的趋势;高寒草甸退化使根际土壤真菌网络呈不稳定和松散的态势。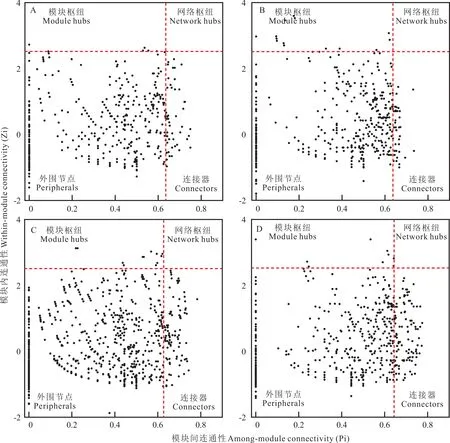
3 讨论
4 结论
