贮藏时间对皮、裸燕麦种子萌发及细胞学结构的影响
2024-02-23姚瑞瑞刘欢赵桂琴王敬龙王绮玉董凯张然
姚瑞瑞,刘欢*,赵桂琴,王敬龙,王绮玉,董凯,张然
(1.草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃 兰州 730070;2.西藏自治区农牧科学院草业科学研究所,西藏 拉萨 850000)
作为农业中最基本的生产资料,种子质量的高低直接影响到生产效益和种质资源的保存[1]。高活力的种子在种子萌发和幼苗建成等方面具有重要作用[2],当年收获的种子一般具有较高的活力,而种子在收获后通常要经过长时间的贮藏。短期内,种子在适宜的贮藏条件下活力基本变化不大,但随着贮藏时间的延长,种子活力会逐渐下降,直至种子丧失活力甚至死亡[3-4]。大量研究表明,种子活力随着贮藏年限的延长而明显降低甚至丧失[5-6],幼苗生长受到抑制[7];细胞膜完整性丧失、酶活性失调、呼吸作用减弱、贮藏物质含量和超微结构等均会随着贮藏时间的延长而受到不同程度的影响[8-10]。
燕麦(Avena sativa)是禾本科(Gramineae)燕麦属(Avena)一年生草本植物[11],以外部形态为分类依据,可分为皮燕麦和裸燕麦[12]。随着我国畜牧业的迅速发展、草地植被恢复面积的逐年扩增,以及人类对健康的日益重视,燕麦类产品的消费量不断增加。然而,贮藏时间严重制约着燕麦的种质保存和利用,优质的种子是农牧业可持续发展的基础,也是植物种质资源创新的重要原料及有效保存体[13]。燕麦种子在短时间内能够保持较高的内部活力,但随着贮藏时间的延长和贮藏环境的改变,种子的正常生理代谢功能和细胞结构便会遭受不同程度的损伤,导致不可逆且不可避免的老化[8];同时燕麦种子内油脂含量高,尤其是不饱和脂肪酸含量高[14],更容易导致种子发生劣变而不耐贮藏,从而降低其利用价值[15-16]。因此,明确皮、裸燕麦种子劣变过程及内在机制,为老化种子的修复提供依据,对于种质资源的长期保存具有重要意义。
功能和结构息息相关,种子活力变化的一个重要原因就是组织细胞结构的变化[17]。目前,关于燕麦种子的研究多集中在盐、碱胁迫对燕麦生理生化影响[18-20]以及自然老化和人工老化对种子遗传完整性[6,21-23]等方面,有关贮藏年限对皮、裸燕麦种子萌发和细胞学结构影响方面的研究还鲜见报道。因此本研究探讨皮、裸燕麦种子的种子活力、细胞解剖结构和种胚、线粒体超微结构随贮藏年限的变化规律,以探究老化过程中细胞程序性死亡在燕麦种子中发生的具体部位和时间进程,为燕麦种子自然老化的生理机制研究提供依据,并为燕麦的科学贮藏及其高效利用提供参考。
1 材料与方法
1.1 试验材料
应试材料为皮燕麦品种‘陇燕3 号’和裸燕麦品种‘白燕2 号’,燕麦种子由甘肃农业大学草业学院提供。2 个燕麦品种均种植于甘肃省通渭县华家岭镇,该地属温带季风气候,年平均气温3.7 ℃,年均降水量451.1 mm。种子密封贮藏于甘肃省兰州市甘肃农业大学牧草实训基地种子室(室内全年通风,贮藏期间年均温度为10 ℃),贮藏年限分别为2、4、6、8年(表1)。
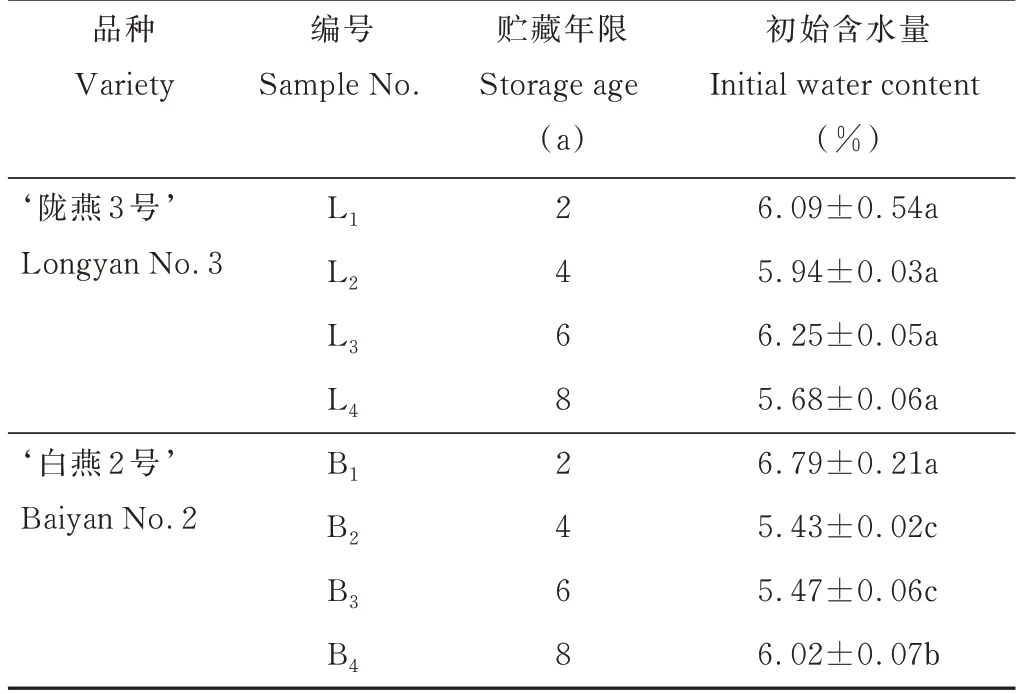
表1 皮燕麦、裸燕麦种子不同贮藏时间处理Table 1 Covered oat and naked oat seeds were treated with different storage time
试验于2022 年3 月在甘肃农业大学草业学院试验室进行。根据样品种子的初始含水量,采用饱和溶液法将样品种子含水量进行调整,获得含水量为10%的种子样品[9]。计算公式为:达到所需含水量的种子质量(W,g)=[(100-MC0)÷(100-MCr)]×W0,式中:MC0为种子初始含水量(%),MCr为种子需要达到的含水量(%),W0为种子初始质量(g)。称量干净饱满燕麦种子,将种子放入装有NaBr 饱和溶液的干燥器中平衡水分,频繁称量种子质量,达到所需的质量时立即将种子取出,迅速密封于10.0 cm×14.8 cm 铝箔袋中,保存于4 ℃冰箱内备用[24]测定各指标。
1.2 试验方法
1.2.1 种子萌发指标的测定 根据《种苗评定与种子活力测定方法手册》[25]规定的培养皿纸上法进行燕麦种子萌发试验,并逐日统计种子发芽数,每个处理4 次重复,每重复50 粒种子。
式中:Dt为发芽天数(d);Gt为Dt对应时间的发芽数;S为发芽10 d 幼苗的鲜重(g)。
幼苗芽长、根长:幼苗生长10 d 后,用游标卡尺测定每株幼苗从种子胚到最长叶叶尖和最长根根尖的长度,每皿随机测定5 株。
浸出液电导率的测定:随机取净种子50 粒放入150 mL 三角瓶中,向内加入100 mL 去离子水并摇晃瓶身至种子完全浸没。每个处理4 次重复,以未放种子的去离子水为空白对照。瓶口用封口膜封好,在25 ℃恒温培养箱中放置24 h(±15 min)后,立即测定溶液的电导率[25]。
1.2.2 燕麦种子解剖结构测定 采用常规石蜡切片法,参照陈阳等[26]的方法并进行了改良,具体步骤如下:取燕麦种子适量,放入蒸馏水中浸泡4 h 后转入FAA 混合固定液(福尔马林∶冰醋酸∶70%乙醇=1∶1∶18)中固定24 h。采用不同浓度的乙醇梯度脱水(30%乙醇、50%乙醇、70%乙醇、85%乙醇、95%乙醇、无水乙醇)。乙醇和二甲苯逐级透明,每级3/4 h[无水乙醇∶二甲苯(体积比2∶1)、无水乙醇∶二甲苯(1∶1)、无水乙醇∶二甲苯(1∶2)、二甲苯]。透明材料转入装有碎蜡的二甲苯中,浸蜡温度由37 ℃上升至56 ℃,逐渐置换为纯石蜡后于56 ℃恒温箱中过夜,浸蜡2 d,期间换蜡3 次。包埋后修块、切片(厚度为10 μm)、展片、45 ℃烘片。二甲苯中脱蜡,乙醇梯度复水后番红-固绿双重染色,中性树胶封片,放在40 ℃烘箱中烘片,之后永久保存。在显微镜下观察并拍照。每个处理重复5 次,每张样片选取5 个视野。
1.2.3 种胚及线粒体超微结构观察 采用透射电镜法,操作步骤如下:随机选取待测燕麦种子,在蒸馏水中浸泡4 h 后,用解剖针在体式显微镜下将其种胚取出,经3%戊二醛预固定后采用1%四氧化锇再固定。丙酮逐级脱水(30%,50%,70%,80%,90%,95%,100%),100%浓度的丙酮换3 次。Ep812 包埋,半薄切片用甲苯胺蓝染色作光学定位,在超薄切片机上用钻石刀切片,再经醋酸铀和枸橼酸铅室温下双重染色,用JEM-1400FLASH[日本电子(JEOL)]透射电镜观察样品切片,并拍摄细胞及线粒体照片[27]。
1.3 数据处理
采用Microsoft Excel 2010 软件整理试验数据并绘制图表,使用IBM SPSS Statistics 24.0 软件进行双因素方差分析与单因素ANOVA 检验,用Adobe Photoshop CC 2018 做拼图处理。
2 结果与分析
2.1 不同贮藏时间对皮、裸燕麦种子萌发的影响
如图1,‘陇燕3 号’在贮藏4 年时,发芽指数和活力指数均达到最大值,较贮藏2 年种子发芽指数和活力指数升高51.44%和58.89%,差异显著(P<0.05);贮藏6 年时,‘陇燕3 号’发芽指数和活力指数开始显著下降(P<0.05)。随着贮藏时间的增加,‘白燕2 号’发芽指数和活力指数整体均表现出逐渐下降的趋势,在贮藏6 和8 年时,种子发芽指数降至10.22%和4.66%,较贮藏2 年时各降低65.43%和84.24%,差异显著(P<0.05);活力指数降至41.14%和3.14%,较贮藏2 年时各降低81.69%和98.60%,差异显著(P<0.05)。
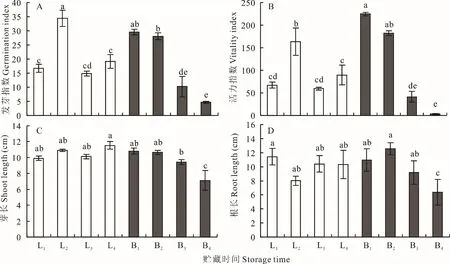
图1 贮藏时间对皮、裸燕麦种子萌发的影响Fig.1 Effect of storage time on seed germination of covered oats and naked oats
如图1,随着贮藏时间的增加,‘陇燕3 号’的芽长与根长无明显变化。而‘白燕2 号’的芽长则表现出逐渐降低的趋势,在贮藏8 年时‘白燕2 号’燕麦种子芽长较贮藏2 年显著降低34.28%(P<0.05);其根长表现出先升高后降低的趋势,贮藏4 年时,根长较贮藏2 年升高12.94%,差异不显著(P>0.05)。贮藏8 年时,根长较贮藏2 年降低41.74%,差异显著(P<0.05)。综上,‘陇燕3 号’和‘白燕2 号’相比,‘陇燕3 号’发芽指数、活力指数、芽长和根长变化更为稳定。
由表2 可知,不同品种间燕麦种子的发芽指数、活力指数、芽长、根长和电导率存在极显著差异(P<0.01)。不同贮藏年限下燕麦种子的发芽指数、活力指数和电导率存在极显著差异(P<0.01),而芽长与根长差异不显著。品种和贮藏时间交互作用下的发芽指数、活力指数、芽长和电导率存在极显著差异(P<0.01),表明贮藏时间对不同品种的各萌发指标影响较大,且存在交互作用。

表2 贮藏时间对皮、裸燕麦种子萌发和细胞膜透性的方差分析Table 2 Variance analysis of storage time on covered,naked oat seed germination and cell membrane permeability
如图2 所示,在贮藏4 年时,‘陇燕3 号’种子发芽率达到最大值,随后种子活力缓慢下降,但降幅不大;随着贮藏时间的增加,‘白燕2 号’燕麦种子发芽率逐渐下降,在贮藏6~8 年时,种子发芽率急剧下降,种子活力逐渐丧失。
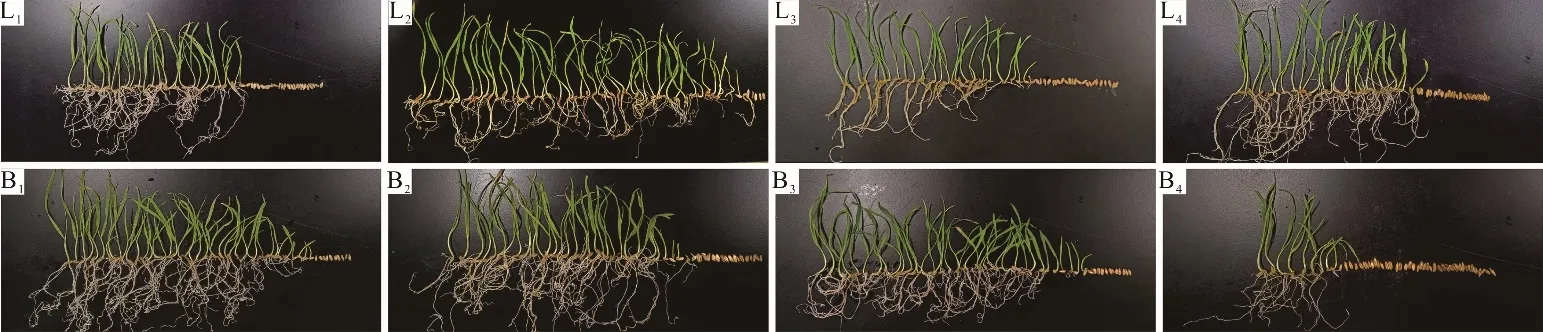
图2 贮藏时间对皮、裸燕麦种子活力的影响Fig.2 Effect of storage time on seed viability of covered and naked oat seeds
2.2 不同贮藏时间对皮、裸燕麦种子细胞膜透性的影响
如图3 所示,随着贮藏时间的增加,‘陇燕3 号’种子的电导率表现出逐渐升高的趋势。在贮藏4、6 和8年时,‘陇燕3 号’的电导率较贮藏2 年显著升高(P<0.05)。‘白燕2 号’的电导率表现出先降低后升高的趋势,在贮藏6 和8 年时,‘白燕2 号’的电导率较贮藏2年显著升高(P<0.05)。综上,两个不同燕麦种质相比,随着贮藏年限的增加,‘白燕2 号’的细胞膜透性受影响更大。
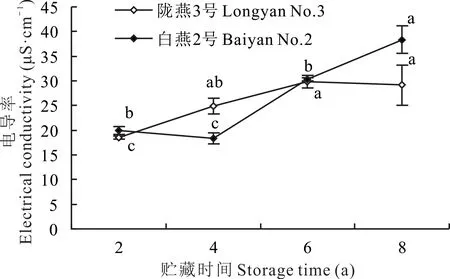
图3 贮藏时间对皮、裸燕麦种子电导率的影响Fig.3 Effect of storage time on electrical conductivity of covered and naked oat seeds
2.3 不同贮藏时间对皮、裸燕麦种子解剖结构的影响
随着贮藏年限的增加‘陇燕3 号’和‘白燕2 号’解剖结构发生变化。如图4 所示,贮藏2 年‘陇燕3 号’燕麦种子胚乳中内含物丰富,均匀的散布在胚乳中;种皮薄且经番红-固绿染色浅;糊粉层细胞排列整齐,细胞形状近似于长方形,有些细胞内部甚至可以清晰地看到细胞核;种子次级糊粉层细胞内部糊粉粒即蛋白贮藏液泡(protein storage vacuole,PSV)丰富,都集中在细胞内部(图4 A 和B)。贮藏8 年的‘陇燕3 号’燕麦种子胚乳细胞较贮藏2年种子无明显变化;而燕麦种子种皮经番红-固绿染色深且变厚,糊粉层细胞多达数层,细胞排列不整齐,形状不规则且部分细胞出现肿胀现象;一些细胞内部仍然可以看到细胞核,次级糊粉层细胞内部出现破碎化,细胞内部糊粉粒出现轻微降解现象(图4 C 和D)。
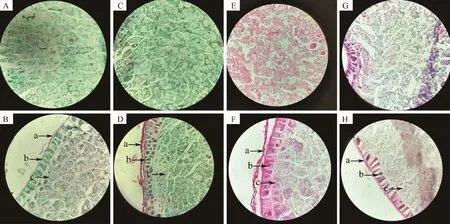
图4 贮藏时间对皮、裸燕麦种子解剖结构的影响(×400)Fig.4 Effects of storage time on the anatomy of covered and naked oat seeds(×400)
贮藏2 年‘白燕2 号’燕麦种子胚乳中内含物丰富,均匀的散布在胚乳中。贮藏8 年的燕麦种子胚乳内细胞排列疏松,细胞间隙变大,细胞内含物个体变小且数量变少(图4 E 和G)。贮藏2 年‘白燕2 号’燕麦种子糊粉层细胞排列整齐有序,细胞形状类似于长方形,种皮经番红-固绿染色浅,次级糊粉层细胞内部糊粉粒丰富,细胞与细胞之间有序排列;贮藏8 年糊粉层细胞较贮藏2 年燕麦种子糊粉层细胞狭长,且细胞内部出现质壁分离现象,细胞形状不规则,次级糊粉层细胞内部PSV 出现严重降解现象,细胞内部出现大量无结构液滴,细胞内部蛋白体数量变少(图4 F 和H)。综上,‘白燕2 号’较‘陇燕3 号’燕麦种子解剖结构受贮藏年限的影响更为明显。
2.4 不同贮藏时间对皮、裸燕麦种子种胚细胞及线粒体超微结构的影响
燕麦种子种胚超微结构的电子显微镜图片(图5)显示,贮藏2 年燕麦种胚细胞基本维持正常状态,细胞结构清晰、细胞器正常;细胞核结构完整,核仁致密与核质界限分明,核内常染色质分布均匀,核膜清晰可见,结构与功能状态良好;线粒体形状呈扁平或椭圆形,线粒体膜和核膜清晰可见,且线粒体基质稠密;‘白燕2 号’细胞膜出现褶皱现象,部分地方细胞间隙变大,且细胞内聚集大量脂肪体,‘陇燕3 号’细胞膜平滑正常,细胞壁与细胞膜紧密贴合,且细胞内含有大量的线粒体和内质网,细胞膜周围聚集少量脂肪体(图5 A、B、E、F)。
经过8 年的贮藏后,‘陇燕3 号’燕麦种胚细胞内遍布大量脂肪体,部分脂肪体出现溶解的现象;‘白燕2 号’燕麦种胚细胞形状维持正常状态,细胞结构清晰。细胞内脂肪体数量相较于贮藏2 年时变少,2 个燕麦种质种胚细胞内靠近细胞膜的脂肪体溶解,逐步被原液泡吞噬,形成大液泡;随着贮藏时间的增加,‘陇燕3 号’细胞核较贮藏2 年时染色质严重浓缩,核仁消失;细胞膜出现明显的褶皱现象,细胞间隙变大;‘白燕2 号’细胞核核膜溶解,染色质出现轻微浓缩现象,核边缘皱缩;随着贮藏年限的增加,两个燕麦种质内部少数线粒体出现肿胀现象,但大部分线粒体结构均能保持良好的完整性(图5 C、D、G、H)。
3 讨论
3.1 贮藏时间对皮、裸燕麦种子萌发特性的影响
植物完成其生活史的关键阶段就是种子萌发,种子的发芽率、发芽指数和活力指数等参数是衡量种子优劣的重要指标,也是反映种子活力变化最可靠和直接的指标[28],直接影响到种子的田间出苗率[29]。试验中随着贮藏时间的延长,燕麦种子逐渐老化,表现为种子发芽指数、活力指数逐渐降低。且不同皮、裸燕麦品种、贮藏时间及其交互作用下的种子发芽指数、活力指数、芽长、根长、电导率差异显著(P<0.05)。张雯静等[30]研究发现,随着贮藏年限的增加,大葱(Allium fistulosum)种子各项萌发指标也有类似变化规律。在贮藏初期,‘陇燕3 号’种子发芽指数和活力指数明显低于‘白燕2 号’种子,这可能是因为‘陇燕3 号’为皮燕麦,其外稃的机械约束作用在一定程度上延迟了种子的发芽时间[9,31]。贮藏时间也不同程度地影响着燕麦种子幼苗的生长。试验发现,‘白燕2 号’种子幼苗的芽长和根长随着贮藏时间的增加而降低,‘陇燕3 号’则无明显变化。种子萌发和幼苗生长方面的这些表现证明,在同等贮藏环境下,‘陇燕3 号’比‘白燕2 号’更耐贮藏。
电导率是常被用来判定种子活力的一个重要指标。随着种子贮藏时间的增加,2 个燕麦种质的种子浸提液的电导率都随着贮藏时间的增加而升高,表明种子细胞膜随贮藏时间的增加逐渐损坏和老化,电导率与种子的活力呈负相关,而种子活力下降的主要原因是细胞膜的降解及其作为半透膜能力的退化[32],种子内部会发生一系列生理生化反应,从而导致细胞膜结构改变,细胞膜完整性丧失,膜内脂蛋白变性,种子内可溶性物质渗漏,细胞内外渗透压的动态平衡被打破[33]。Xin 等[34]对大豆(Glycine max)种子进行人工老化研究时也有同样发现。
3.2 贮藏时间对皮、裸燕麦种子细胞解剖结构的影响
种子在生理成熟期活力达到最高,随后在贮藏过程中,种子活力开始下降[35],内部各功能、结构受到不同程度的损伤,且贮藏时间越久,受损程度也就越大,最终导致种子质量下降[36]。对燕麦种子解剖结构观察发现,与其他禾本科植物种子解剖结构基本相同[37],燕麦种子的结构由种皮、胚和胚乳构成,且胚藏于胚乳之中。有研究发现,正常种子在萌发过程中,糊粉层细胞会通过分解细胞内的糊粉粒与原球体来产生一系列水解酶、蛋白酶等,以分解胚乳中贮藏的营养物质[38],为胚的前期生长提供养分。本研究中‘陇燕3 号’种子在贮藏8 年后,糊粉层细胞出现轻微破碎化,‘白燕2 号’糊粉层细胞出现严重破损且细胞间隙变大,PSV 降解严重,细胞内部出现大量液滴状结构。这可能是由于在贮藏期间糊粉层细胞内的糊粉粒与原球体提前出现水解现象,因而在细胞学上观察到破碎化现象,另外当糊粉层细胞完成分泌功能后,发生细胞程序性死亡(programmed cell death,PCD),剩余部分相互融合并液泡化,最终成为无结构的液滴[39]。燕麦糊粉层细胞PCD 过程中最初较小的PSV 逐渐相互融合成为大的液泡,之后液泡破裂消失。其进程会直接影响到糊粉层PCD 的进程,抑制液泡融合阻缓了糊粉层PCD 进程,从而影响燕麦种子的萌发。这与郑岩等[40]在水稻(Oryza sativa)种子糊粉层液泡化进程的研究结果一致。皮燕麦外壳可以保护颖果免受各种生物和非生物胁迫,陶金等[41]在探究燕麦的耐盐萌发特性时发现,皮燕麦的耐盐性高于裸燕麦。塔娜等[42]对4 份皮燕麦和5 份裸燕麦材料的抗性进行了分析,结果表明皮燕麦的抗性比裸燕麦的强,特别是抗倒伏能力尤为突出。本研究中由于‘陇燕3 号’为皮燕麦,其外稃在一定程度上起到了保护作用,而‘白燕2 号’为裸燕麦,因而种子内部结构受影响较大。
3.3 贮藏时间对皮、裸燕麦种子种胚细胞及线粒体超微结构的影响
本研究中,短时间贮藏(2 年)的燕麦种子种胚细胞结构状态良好,随着贮藏时间的增加,燕麦种胚细胞内细胞核染色质凝聚,细胞内核酸代谢减弱,部分线粒体肿胀成球形且线粒体膜不清晰,脂肪体水解。线粒体作为细胞能量代谢的主体和自由基产生的主要部位[28],其结构的损伤将直接影响细胞的能量代谢和自由基水平。可见燕麦种子在贮藏过程中发生了脂质过氧化反应,使靠近活性氧(reactive oxygen species,ROS)产生位点的线粒体内膜发生过氧化,线粒体膜系统遭到严重破坏,胚细胞中的能量代谢、物质代谢已不能正常进行,燕麦种子胚细胞衰老严重。贮藏微环境下的小麦(Triticum aestivum)胚细胞超微结构变化也有近似的发现[43]。可见,种子发生劣变时,细胞学上的劣变现象也随之发生,尤其是线粒体超微结构的变化是对老化导致的氧化胁迫的应激反应,线粒体膜和脊受到损伤,线粒体的呼吸功能无法正常进行[44],进而影响呼吸链电子的正常传递,呼吸作用减弱,使燕麦种子萌发过程中ATP 供应不足,导致种子活力下降,萌发率降低,进而影响幼苗的形态建成。
4 结论
贮藏年限严重影响燕麦种子糊粉层细胞和线粒体结构与功能的完整性。在贮藏过程中,燕麦种子糊粉层细胞水解,细胞核边缘皱缩,染色质浓缩,核仁消失,且贮藏时间越久,细胞衰老越快。本研究中,随着贮藏时间的增加,‘陇燕3 号’和‘白燕2 号’燕麦种子解剖结构及种胚和线粒体超微结构受损严重,进而导致种子活力下降。
