植物生长调节剂与氮肥对盐胁迫下水稻幼苗生理特性的影响
2024-02-23王亚新冯乃杰赵黎明郑殿峰沈雪峰刘美玲杜有为
王亚新 冯乃杰, 赵黎明, 郑殿峰, 沈雪峰, 刘美玲 杜有为
(1广东海洋大学滨海农业学院,广东 湛江 524088;2国家耐盐碱水稻技术创新中心华南中心,广东 湛江 524088;3广东海洋大学深圳研究院,广东 深圳 518108)
水稻(OryzasativaL.)是全世界重要的粮食作物之一。近年来,气候变化导致海平面上升,从而导致土壤盐渍化,严重威胁水稻生长发育[1]。土壤盐渍化影响全球20%以上的耕地,其中灌溉区占其一半,这一比例在未来仍将继续增加[2]。中国有1 亿公顷盐碱地和234万公顷海滩,预计到2050年,50%以上的可耕地将盐碱化[3]。盐胁迫是农业生产的主要制约因素之一,它会阻碍作物生长和发育,降低作物产量,主要表现在形态和生理生化方面。盐胁迫对植物最直观的影响是抑制地上部和根系生长,最终导致植物生物量减少[4]。因此,提高作物耐盐性不仅可以提高盐碱地利用率,还是保护全球粮食安全的重要保障。相关研究表明,盐胁迫抑制水稻的光合作用和生长,从而导致生物量减少,最终导致产量下降[5-6]。因此,提高水稻耐盐性是增加水稻产量的重要途经之一。
化学调控作为预防或缓解非生物胁迫的重要措施之一,在农业生产中得到广泛应用。相关研究表明,叶面喷施5-氨基乙酰丙酸(5-aminolevulinicacid,5-ALA)具有克服不同作物应激环境有害影响的作用[7],能够通过增强番茄(SolanumtuberosumL.)幼苗抗氧化系统和在冷胁迫下清除活性氧(reactive oxygen species,ROS)来促进植物生长和光合作用[8],还可以通过减轻丹参(SalviamiltiorrhizaBunge)的氧化损伤来增强其耐盐性等[9]。乙酸二乙基氨基乙酯(2-diethylaminoethyl hexanoate,DTA-6)是一种促进性植物生长调节剂(plant growth regulators,PGRs),参与水稻作物的生理代谢反应[10-12]。前人研究表明,喷施DTA-6 可以提高决明子(CatsiatoraL.)的耐盐性[12]和番茄[13]、黑麦(SecalecerealeL.)[14]对镉胁迫的抗性,并通过促进盐胁迫下植物的光合作用来促进幼苗生长,缓解盐胁迫[12,15]。氮素作为作物必需营养元素之一,对水稻的生命活动和产量的形成具有重要意义。然而,过度施肥和施肥不当是我国农业集约化生产的一个严重问题[16]。有研究表明,施氮可以缓解盐胁迫,氮肥通过促进氮有机化合物的积累改善渗透调节、保护细胞结构和功能,从而缓解盐胁迫对植物的不利影响[17-18]。随着近年来农田氮肥的过量施用,对环境造成的污染也日益加重。近年来,利用调节剂提高氮素利用率已成为减施增效的有效措施,为解决环境问题提供了新途径。
目前,关于氮肥和植物生长调节剂对缓解水稻幼苗盐胁迫影响的对比研究较少,尽管有研究表明5-ALA、DTA-6 和氮肥在改善植物逆境方面具有积极作用[12,19-20],但有关盐胁迫下5-ALA、DTA-6 和氮肥提高水稻耐盐性的研究较少,且调节剂与氮肥在改善水稻盐胁迫中的差异效果仍然未知。基于此,本研究设置两个氮肥处理,在三叶一心期叶面喷施调节剂,研究其对水稻幼苗形态、膜损伤、抗氧化酶活性及抗氧化物质的影响,以期为氮肥和调节剂在水稻幼苗抗盐栽培中的应用提供理论依据。
1 材料与方法
1.1 试验材料
试验于2021—2022年在广东海洋大学滨海农业学院日光连栋温室中进行,采用盆栽试验,室内温度白天平均温度(33±2)℃,夜晚(30±2)℃,湿度控制在80%±5%。供试品种为黄华占,由广东省农业科学院水稻研究所选育,深圳隆平金谷种业有限公司提供。供试肥料分别为尿素、过磷酸钙、硫酸钾。供试调节剂为5-ALA(阿拉丁,北京)和DTA-6(郑州信联生化科技有限公司)。试验用土为砖红土与河沙3∶1混合均匀。土壤理化性质为:pH值7.02、有机质3.52 g·kg-1、碱解氮1.26 mg·kg-1、速效磷2.62 mg·kg-1、速效钾83.39 mg·kg-1。
1.2 试验方法
本试验为盆栽试验,每盆3 kg土,试验各处理详情见表1,即(1)N1(0.1 g N/盆);(2)N2(0.15 g N/盆);(3)N1A:N1+40 mg·L-15-氨基乙酰丙酸(5-ALA);(4)N1D:N1+30 mg·L-1乙酸二乙基氨基乙酯(DTA-6);(5)N1S:N1+0.3% NaCl;(6)N2S:N2+0.3% NaCl;(7)N1AS:N1+40 mg·L-15-ALA+0.3% NaCl;(8)N1DS:N1+30 mg·L-1DTA-6+0.3% NaCl。
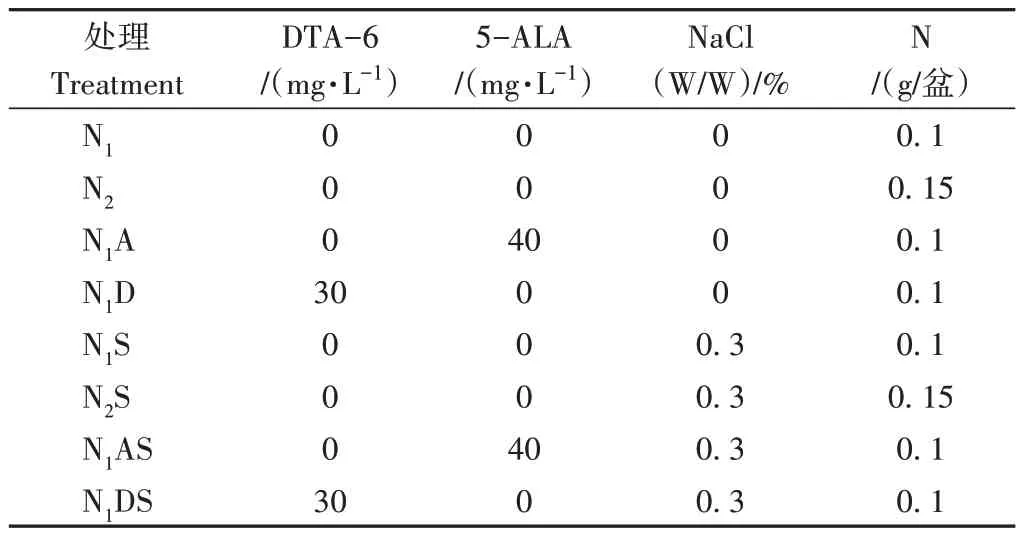
表1 不同处理调节剂、NaCl和N化肥养分用量Table 1 Different treatment regulators,NaCl and nitrogen fertilizer nutrient dosages
选择饱满完好的水稻种子,3%双氧水消毒15 min后,用蒸馏水冲洗5次,在30 ℃恒温箱中于黑暗条件下蒸馏水浸种和催芽各24 h。随后取露白一致的种子点播于无孔花盆中,盆的规格为上口径20 cm、下口径15 cm、高18 cm,每盆均匀播种69 粒,株距0.5 cm。于播前1 d 浇肥水,每盆施P2O50.48 g、K2O 0.32 g,氮肥(尿素)播前施用,按表1 施入。正常水分管理到幼苗三叶一心期时进行叶面喷施5-ALA和DTA-6,喷施时间为天黑后19:00左右,施用剂量分别为40和30 mg·L-1[21],清水做对照。调节剂处理24 h 后进行盐处理,即按土施加0.3%NaCl(W/W),将9 g盐溶于1 L清水中缓慢浇入盆中,模拟大田试验保留2 cm 的水层。每天用TR-6D 土壤盐度计(山东恒美科技有限公司)实时监测盐分,维持盐浓度。每处理3 次重复,每重复10 盆,共计每处理30 盆,采用完全随机摆放设计,盐处理后1、4、7、10、13 d进行取样用于各项指标的测定。
1.3 测定项目与方法
1.3.1 水稻地上部形态指标的测定 分取各个处理水稻幼苗,用水冲洗干净,从中选取具有普遍代表性幼苗20 株,地上和地下分开,分别用直尺、游标卡尺测量其苗高和茎基宽。地上部和地下部分样包装后放入烘箱于105 ℃杀青30 min、80 ℃烘干48 h 至恒重后,称量地上和地下干物质量,根据以下公式计算充实度和壮苗指数[22]:
1.3.2 膜 损 伤 指 数 的 测 定 丙 二 醛(malondialdehyde,MDA)含量参照许向阳等[23]的方法采用硫代巴比妥酸法测定。用0.75 mL 上清酶提取液和1.0 mL 硫代巴比妥酸(thiobarbituric acid,TBA)混合测定。将混合物在沸水浴中加热30 min,冷却至室温,10 000 r·min-1离心15 min,得到上清液。分别测定450、532 和600 处的吸光度OD450、OD532、OD600,每个处理3 次重复。根据以下公式计算叶片中丙二醛含量:
过氧化氢含量参照Jessup 等[24]的方法测定。取0.5 g 叶样品,加入 5 mL 0.1% 三氯乙酸(trichloroaceticacid,TCA)溶液,在液氮中研磨,并以10 000 r·min-1离心10 min。然后将0.5 mL 上清液加入0.5 mL 的10 mmol·L-1磷酸钠缓冲液(phosphate buffer saline,PBS)和1 mL 碘化钾(potassium iodide,KI)溶液中,并于28 ℃黑暗反应1 h,使用GENESYS 180 紫外可见光分光光度计(美国赛默飞公司)测定180 nm处的吸光度。
1.3.3 光合色素含量的测定 参考Xu 等[25]的方法,并略有改动。通过钻孔取样,并在室温为30~45 ℃的暗室中用乙醇提取24 h,直到叶片完全变白。然后测定提取液在470、649、665 nm 波长下的吸光度OD470、OD649、OD665,并根据以下公式计算叶绿素a(chlorophyll a,Chl a)、叶绿素b(chlorophyll b,Chl b)、总叶绿素和类胡萝卜素(carotenoid,Car)含量。每个处理3 次重复。
1.3.4 生理生化指标的测定 按照Lee 等[26]的方法提取粗酶,称取0.5 g 水稻鲜叶,用10 mL(pH 值7.8)PBS 均质,并在4 ℃下,10 000 r·min-1离心15 min 得到粗酶提取物,每个处理3 次重复。用Macadam 等[27]描述的硝基四唑(nitrotetrazolium blue chloride,NBT)法计算超氧化物歧化酶(superoxide dismutase,SOD)活性,根据Macadam等[27]描述的愈创木酚法测定过氧化物酶(peroxidase,POD)活性,根据Li 等[28]描述的过氧化氢法测定过氧化氢酶(catalase,CAT)活性,根据Nakano 等[29]描述的方法测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性。根据Ellman[30]描述的方法测定还原型谷胱甘肽(glutathione,GSH)含量,参考Bradford[31]的方法测定可溶性蛋白含量。
1.4 数据处理
采用Microsoft Excel 2010 进行数据处理,SPSS X9软件进行单因素或双因素方差分析(ANOVA),多重比较采用邓肯多重检验(Duncan’s Test),用Origin 2021软件绘制图表。
2 结果与分析
2.1 PGRs和施氮量对水稻幼苗形态的影响
2.1.1 PGRs 和施氮量对苗高、茎基宽和地上干重的影响 由表2 可知,调节因子(Re)主效应和盐浓度×调节因子(Sc×Re)互作均显著或极显著影响了苗高、茎基宽和地上干重。NaCl 胁迫整体降低了苗高、茎基宽和地上干重,其中NaCl 胁迫后1~13 d,苗高、茎基宽和地上干重表现为,N1S 处理较N1分别下降2.26%~7.92%、4.67%~15.96%和12.21%~25.12%,N2S 处理较N2处理分别下降1.24%~4.78%、2.88%~12.82%和5.69%~19.61%,说明盐胁迫抑制了水稻幼苗生长。从氮肥角度看,增施氮肥能够促进幼苗生长,尤其在NaCl 胁迫下,N2S 处理苗高、茎基宽和地上干重分别较N1S 处理提高3.23%~20.76%、7.94%~14.78% 和17.18%~39.30%,这说明增施氮肥能够缓解NaCl 胁迫对水稻幼苗生长的毒害作用。从PGRs 角度看,在盐胁迫后1~13 d,N1A 处理苗高和地上干重分别较N1显著增加6.29%~22.71% 和15.37%~41.02%,N1AS处理苗高、茎基宽和地上干重分别较N1S 处理显著提高12.61%~27.59%、19.61%~32.91% 和31.08%~78.95%,其次是N1DS 处理也显著提高了苗高、茎基宽和地上干重,说明喷施两种PGRs 不仅对幼苗形态生长有促进作用,还能够缓解盐胁迫带来的伤害。在NaCl 胁迫4 d 时,N1AS 和N1DS 处理各指标较N2S 处理增幅较大,苗高分别显著增加20.00%和24.00%、茎基宽分别显著增加19.43%和18.40%、地上干重分别显著增加36.82%和29.38%。两种PGRs 在促进水稻幼苗生长,特别是改善盐胁迫对水稻的损伤中均能达到增施定量氮肥效果。

表2 PGRs和施氮量对NaCl胁迫下水稻幼苗的影响Table 2 Effects of PGRs and nitrogen application on rice seedlings under NaCl stress
2.1.2 PGRs和施氮量对水稻幼苗充实度和壮苗指数的影响 由图1 可知,NaCl胁迫后1~13 d,充实度和壮苗指数表现为,N1S处理较N1分别下降7.35%~22.97%和10.53%~23.38%;N2S 处理较N2处理分别下降4.50%~18.20%和7.71%~12.14%。说明NaCl胁迫抑制了水稻生长。从氮肥角度看,增施氮肥能够促进幼苗生长,尤其在NaCl胁迫下,N2S处理充实度和壮苗指数较N1S 处理整体分别显著提高8.23%~25.76%和7.84%~44.71%,这说明增施氮肥能够缓解水稻NaCl胁迫。从PGRs角度看,在NaCl胁迫后4~13 d,N1A处理充实度和壮苗指数分别较N1处理显著提高10.77%~17.57%和29.17%~69.31%,N1AS、N1DS 处理充实度和壮苗指数分别较N1S 处理提高10.65%~40.26%和9.80%~66.47%、15.04%~33.98%和41.18%~75.23%,说明喷施两种PGRs 不仅对幼苗形态生长有促进作用,还能够缓解NaCl 胁迫带来的伤害。从综合角度看,在NaCl胁迫13 d 时,N1AS 和N1DS 处理壮苗指数较N2S 处理增幅较大,分别增加43.33%和36.93%。说明两种PGRs 改善NaCl胁迫下水稻生长效果均优于增施氮肥效果,以5-ALA效果最佳。
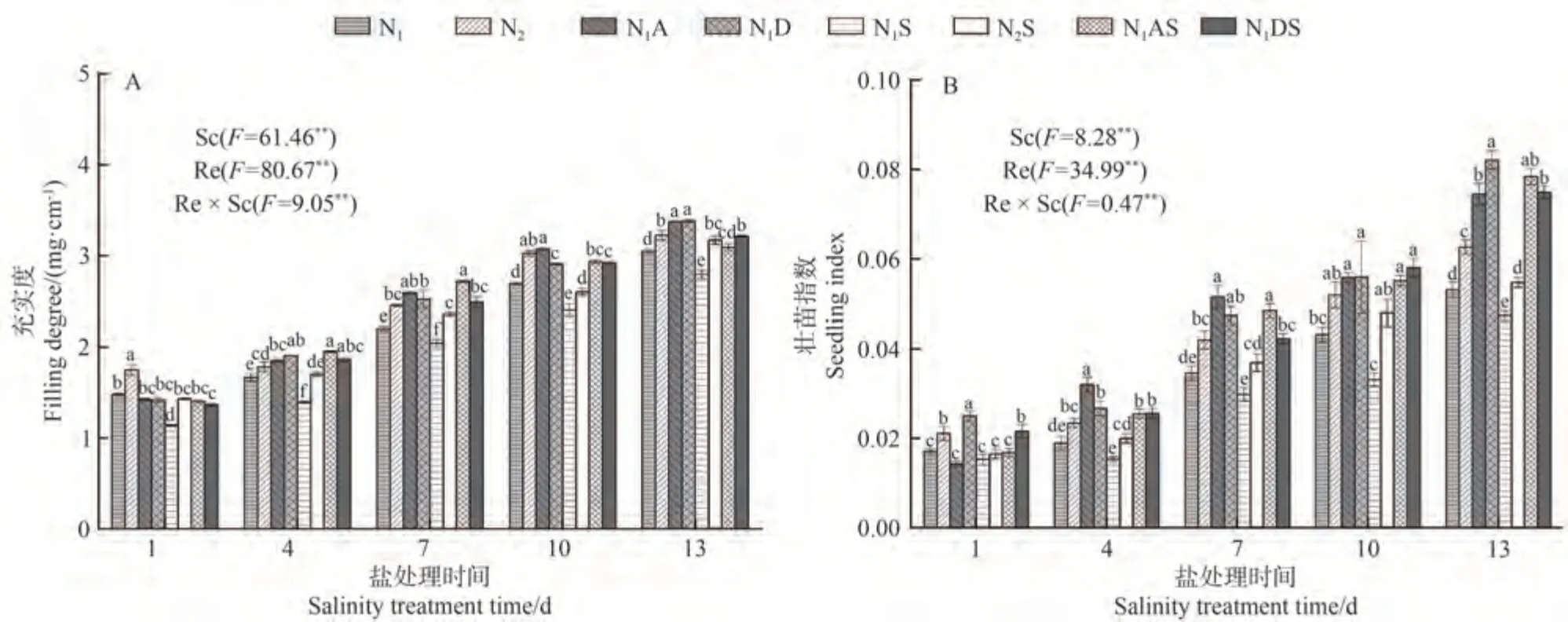
图1 PGRs和施氮量对水稻幼苗充实度和壮苗指数的影响Fig.1 Effects of PGRs and nitrogen application on filling degree and seedling index of rice seedlings
2.2 外源5-ALA、DTA-6 和氮肥对水稻幼苗光合色素含量的影响
由表3 可知,Sc、Re 主效应和Sc×Re 互作均极显著影响了水稻叶片叶绿素a、叶绿素b和总叶绿素含量(P<0.01)。首先,NaCl 胁迫影响幼苗的光合色素合成。NaCl 处理1~13 d,与N1相比,N1S 处理水稻叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别下降1.25%~25.50%、9.45%~27.29%、3.86%~25.45% 和5.67%~21.36%;NaCl处理1~10 d,与N2相比,N2S处理的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别下降2.70%~26.98%、4.79%~47.91%、9.09%~24.68%和7.48%~17.25%。说明NaCl 胁迫抑制了幼苗的光合色素合成。其次,在氮肥利用效率上,NaCl 胁迫处理1~13 d,N2S 处理的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别较N1S处理增加4.32%~29.41%、4.67%~34.39%、4.43%~29.34% 和4.01%~26.46%,这说明增施氮肥能够促进NaCl 胁迫下叶片光合色素合成。再次,从PGRs调控效果看,N1A处理的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别较N1处理增加4.21%~15.37%、6.05%~89.66%、9.90%~29.97%和1.66%~52.74%;N1AS 处理的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别较N1S 处理增加13.06%~35.31%、24.31%~197.63%、15.90%~69.35%和14.82%~44.24%,N1DS 处理叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量则分别增加18.42%~42.45%、2.76%~129.26%、15.11%~60.65%和4.19%~45.41%。说明5-ALA 和DTA-6 均能够缓解NaCl 胁迫对水稻幼苗叶片光合色素合成的抑制,以叶面喷施5-ALA 调控效果最佳。N1AS 和N1DS 处理总叶绿素含量较N2S 处理在NaCl 胁迫13 d 时的增幅较大,分别增加30.93%和24.21%。说明两种PGRs 在减小NaCl 胁迫下光合色素降解速度方面的效果均强于增施定量氮肥,这有利于逆境条件下水稻植株进行光合作用,减轻盐胁迫对水稻幼苗的伤害。

表3 PGRs和施氮量对水稻幼苗光合色素含量的影响Table 3 Effects of PGRs and nitrogen application on photosynthetic pigment content of rice seedlings
2.3 PGRs和施氮量对水稻幼苗膜损伤程度的影响
由表4 可知,Sc、Re 主效应和Sc×Re 互作均极显著影响了水稻叶片MDA 和H2O2含量(P<0.01)。NaCl 胁迫处理1~13 d,与N1相比,N1S 处理丙二醛和过氧化氢含量分别显著增加5.75%~22.11%和7.45%~16.39%;与N2相比,N2S 处理上述指标分别显著增加5.97%~19.54%和3.67%~11.62%,这说明NaCl 胁迫使叶片产生过量活性氧,引起膜脂过氧化物MDA 的积累,破坏细胞膜,阻碍水稻生长。而增施氮肥能够维持叶片活性氧的产生和清除的动态平衡,尤其在NaCl胁迫处理4~13 d,与N1S 处理相比,N2S 处理的丙二醛和过氧化氢含量分别显著降低17.93%~36.54%和10.11%~20.95%,这说明增施氮肥可以有效提高水稻抗逆性。
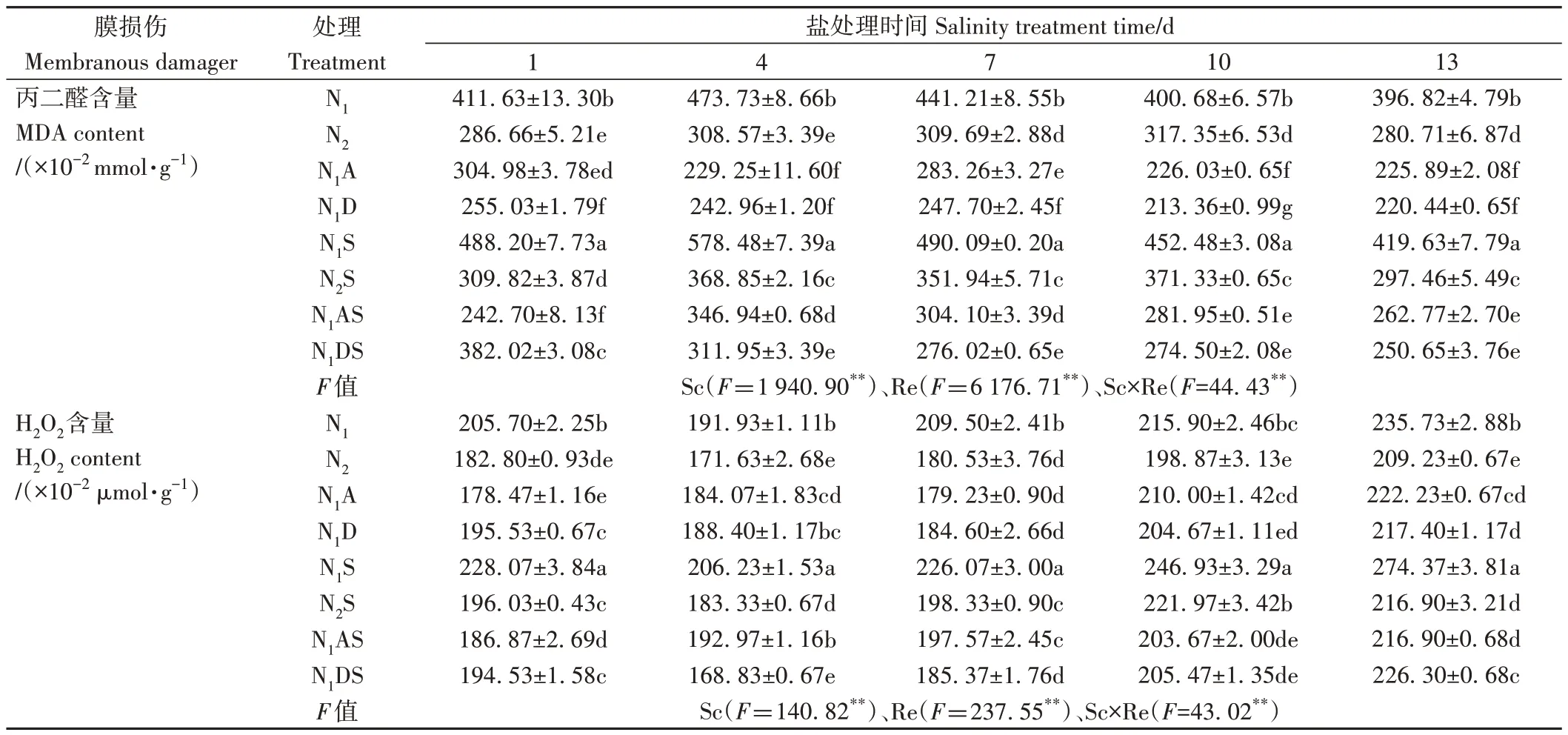
表4 PGRs和施氮量对水稻幼苗膜损伤程度的影响Table 4 Effects of PGRs and nitrogen application on the degree of membrane damage of rice seedlings
外源施加两种PGRs 对水稻幼苗有一定的调控效果。N1A 处理MDA 和过氧化氢含量整体分别较N1处理显著降低25.90%~51.61%和4.10%~14.45%,N1AS处理丙二醛和过氧化氢含量分别较N1S 处理显著降低37.38%~50.29%和6.43%~20.95%,N1DS 处理的丙二醛和过氧化氢较N1S 处理分别降低21.75%~46.07%和14.71%~18.14%,这说明外源施加两种PGRs 均可减少叶片ROS积累,维持细胞膜稳定性。在NaCl胁迫10 d时,N1AS和N1DS处理MDA含量较N2S处理降幅较大,分别降低24.07%和26.08%;H2O2含量则分别降低8.24%和7.43%。说明两种PGRs 在缓解水稻膜损伤方面的效果均优于增施定量氮肥。
2.4 PGRs和施氮量对水稻叶片抗氧化物质的影响
2.4.1 对水稻叶片SOD 活性的影响 由图2-A 可知,盐胁迫影响水稻叶片SOD 活性,调节因子可以改善盐胁迫对水稻的伤害。随NaCl 胁迫时间的延长,叶片SOD活性呈先上升后下降的趋势。NaCl胁迫处理第1、第4 和第7 天,N1S 处理SOD 活性分别较N1处理显著增加16.32%、12.65%和9.82%;N2S 处理上述指标分别较N2增加6.66%、6.63%和3.92%。NaCl 胁迫处理第13 天,与N1、N2处理相比,N1S、N2S 处理SOD 活性分别显著下降13.72%、6.09%。表明在NaCl 胁迫下,水稻先产生应激反应,SOD 活性增加。随着胁迫时间的增加,抗氧化系统遭到破坏,SOD活性降低。从氮肥角度看,增施氮肥可以增加SOD 活性,尤其在NaCl 胁迫处理4~13 d,N2S 处理SOD 活性较N1S 处理显著增加5.21%~17.18%,表明施加氮肥可以提高NaCl 胁迫下水稻叶片SOD 活性。从PGRs 角度看,N1A 和N1D 处理的SOD 活性分别较N1处理显著增加7.30%~21.11%和5.49%~28.68%,N1AS 处理和N1DS 处理分别较N1S处理增加15.59%~23.60%和6.24%~20.86%,说明两种PGRs 均可以提高NaCl 胁迫下水稻叶片的SOD 活性。从综合角度看,N1AS 和N1DS 处理SOD 活性较N2S处理在NaCl 胁迫13 d 时的增幅较大,分别增加11.01%和8.55%。说明两种PGRs 对NaCl 胁迫下水稻叶片SOD活性的提升效果优于增施定量氮肥。
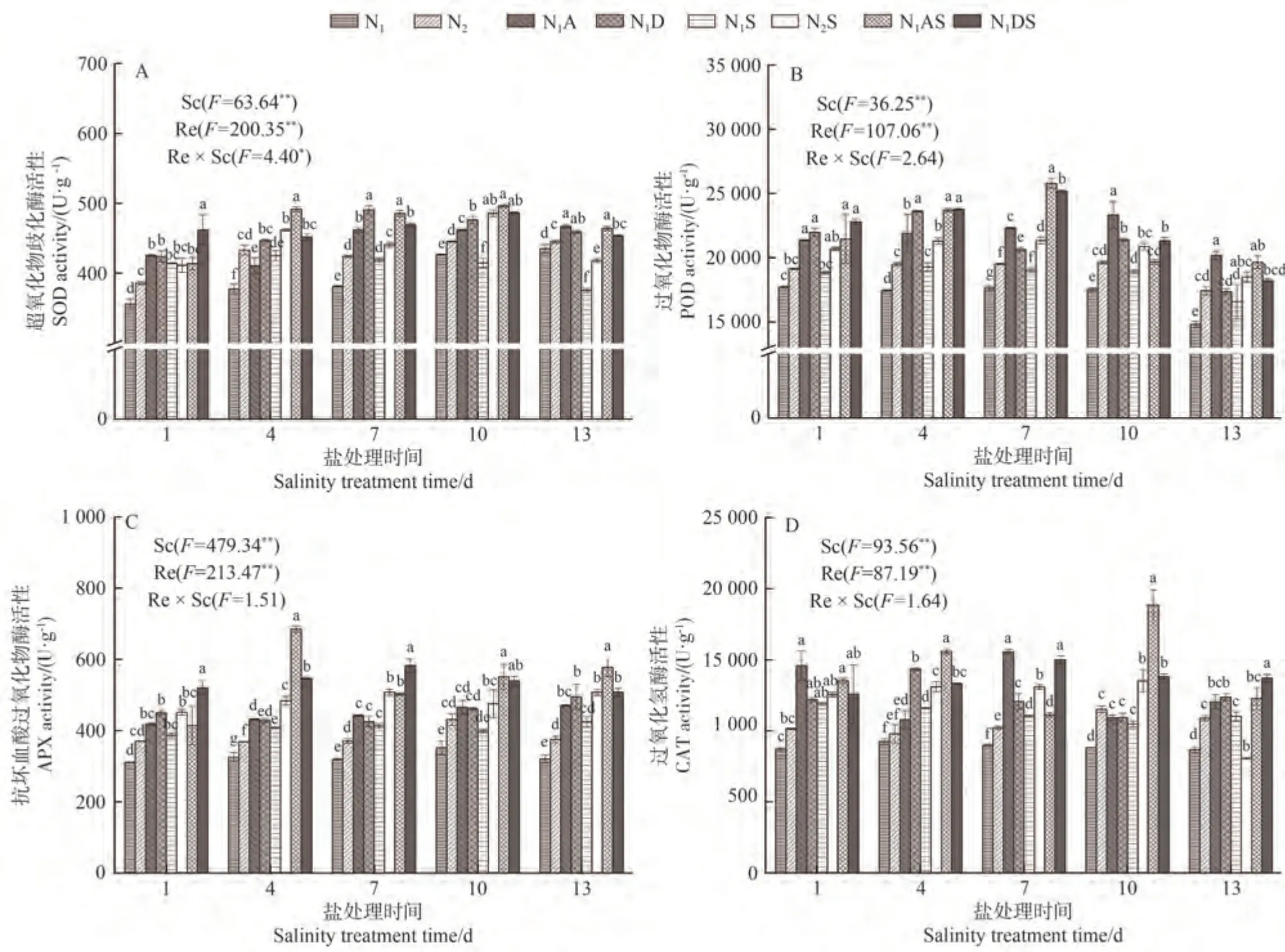
图2 PGRs和施氮量对水稻叶片抗氧化物质的影响Fig.2 Effects of PGRs and nitrogen application on antioxidant substances in rice leaves
2.4.2 对水稻叶片POD 活性的影响 由图2-B 可知,NaCl 胁迫使叶片POD 活性增加。NaCl 胁迫处理第1~第13 天,N1S 处理POD 活性较N1整体显著增加6.31%~11.94%;N2S 处理POD 活性较N2增加6.15%~9.39%。表明在NaCl 胁迫下,水稻先产生应激反应,POD 活性增加。增施氮肥可以增加POD 活性,尤其在NaCl胁迫处理4~13 d,N2S处理的POD 活性较N1S处理整体显著增加10.37%~12.25%,这说明施加氮肥可以提高NaCl 胁迫下水稻叶片的POD活性。从PGRs调控效果分析,N1A和N1D处理POD活性较N1处理分别显著增加20.63%~36.25%和17.04%~35.27%,N1AS和N1DS处理POD 活性较N1S 处理分别增加了4.07%~35.64%和9.81%~32.42%,说明两种PGRs 均可以提高NaCl胁迫下水稻叶片的POD 活性。N1AS 和N1DS 处理POD活性较N2S处理在NaCl胁迫7 d时的增幅较大,分别增加20.84%和17.97%。说明两种PGRs 提高NaCl 胁迫下水稻叶片POD活性的效果优于增施定量氮肥。
2.4.3 对水稻叶片APX活性的影响 由图2-C可知,NaCl 胁迫使叶片APX 活性增加。NaCl 胁迫处理第1~第13 天,N1S 处理的APX 活性较N1增加13.35%~32.34%;N2S 处理APX 活性较N2增加10.42%~35.25%。表明在NaCl 胁迫下,水稻先产生应激反应,APX 活性增加。从氮肥角度看,增施氮肥可以增加APX 活性,尤其在NaCl 胁迫处理4~13 d,N2S 处理APX活性较N1S 处理显著增加19.38%~22.85%,这说明施加氮肥可以提高NaCl 胁迫下叶片APX 活性。从PGRs角度看,N1A 和N1D 处理的APX 活性分别较N1处理显著增加32.40%~46.77%和31.07%~54.41%,N1AS 和N1DS处理APX活性分别较N1S 处理显著增加21.53%~68.06%和19.79%~40.99%,说明两种PGRs 均可以提高NaCl 胁迫下叶片的APX 活性,以5-ALA 效果最佳。从综合角度看,N1AS和N1DS处理APX 活性较N2S处理在NaCl 胁迫4 d 时的增幅较大,分别显著增加41.63%和13.01%。说明两种PGRs 对NaCl 胁迫下水稻叶片APX活性的提升效果优于增施定量氮肥。
2.4.4 对水稻叶片CAT 活性的影响 由图2-D 可知,NaCl胁迫下的CAT 活性有所增加。NaCl胁迫处理第1~第10 天,N1S 处理的CAT 活性较N1显著增加18.44%~36.15%;N2S 处理CAT 活性较N2显著增加17.33%~33.71%。表明在NaCl胁迫下,水稻产生应激反应,CAT 活性增加。氮肥方面,增施氮肥可以增加CAT 活性,尤其在NaCl 胁迫处理1~10 d,N2S 处理CAT活性较N1S处理增加5.70%~29.00%,这说明施加氮肥可以提高NaCl胁迫下叶片CAT 活性。PGRs方面,N1A和N1D处理CAT活性较N1处理分别显著增加16.60%~73.31%和23.72%~55.05%,N1AS和N1DS处理CAT 活性分别较N1S 处理增加0.95%~79.95% 和5.84%~31.94%,说明两种PGRs 均可提高NaCl 胁迫下叶片的APX 活性。整体来看,N1AS 和N1DS 处理CAT 活性较N2S 处理在NaCl 胁迫10 d 时的增幅较大,分别增加39.49%和2.27%。说明两种PGRs 对NaCl 胁迫下水稻叶片CAT活性的提升效果优于增施定量氮肥。
2.5 PGRs 和施氮量对水稻叶片可溶性蛋白和GSH含量的影响
由图3-A可知,Sc、Re主效应和Sc×Re交互作用均对叶片的可溶性蛋白含量有极显著影响(P<0.01)。NaCl 胁迫下,与N1和N2相比,N1S 和N2S 处理的可溶性蛋白含量均呈上升趋势。与N1相比,N1S 处理可溶性蛋白含量在NaCl 胁迫处理第1~第13 天增加1.82%~10.11%;在NaCl胁迫处理第1~第13天,N2S处理可溶性蛋白含量较N2增加2.16%~9.76%。表明NaCl 胁迫使水稻产生应激反应,可溶性蛋白含量增加。从氮肥角度看,增施氮肥可以增加可溶性蛋白含量,在NaCl胁迫处理1~13 d,N2S 处理较N1S 处理增加2.25%~4.38%。从PGRs角度看,N1A和N1D处理的可溶性蛋白含量较N1处理分别显著增加5.75%~13.24%和8.74%~10.66%,N1AS 和N1DS 处理可溶性蛋白含量较N1S 处理分别增加4.58%~7.61%和4.68%~8.09%,说明两种PGRs 均能促进叶片渗透调节物质的产生,维持细胞稳态。

图3 PGRs和施氮量对水稻叶片可溶性蛋白含量和GSH含量的影响Fig.3 Effects of PGRs and nitrogen application on soluble protein and GSH content of rice leaves
由图3-B可知,Sc、Re主效应和Sc×Re交互作用均对叶片的GSH 含量有极显著影响(P<0.01)。NaCl 胁迫下,与N1相比,N1S处理GSH 含量呈先增加再降低趋势。与N1和N2相比,N1S 和N2S 处理CSH 含量在NaCl胁迫处理第1~第7天分别相应增加26.47%~49.63%和18.10%~33.41%;与N1相比,N1S 处理CSH 含量在NaCl胁迫第10~第13天降低18.18%~28.81%。这表明NaCl 胁迫使水稻先产生应激反应,抗氧化剂GSH 含量增加,随着胁迫时间增加,胁迫程度加剧,GSH 含量降低。从氮肥角度看,增施氮肥可以促进GSH 合成,在NaCl胁迫处理1~13 d,N2S处理GSH 含量较N1S处理增加7.77%~58.14%。PGRs 调控效果显示,N1A 和N1D处理的GSH 含量较N1处理分别增加16.82%~65.44%和21.22%~76.68%,N1AS 和N1DS 处理较N1S 处理分别增加8.58%~86.42%和8.02%~76.52%,表明两种PGRs 均能提高水稻抗氧化胁迫能力。从综合角度分析,N1AS 和N1DS 处理GSH 含量较N2S 处理在NaCl 胁迫13 d 时的增幅较大,分别提高15.50%和11.62%。说明在NaCl 胁迫下,两种PGRs 对水稻叶片GSH 合成的促进效果均优于增施定量氮肥。
2.6 各指标间的相关性
本研究对17 个指标的相关性进行分析(图4),结果表明,水稻的形态指标(株高、茎基宽、地上干重、充实度及壮苗指数)均与叶绿素a、叶绿素b、可溶性蛋白和GSH含量呈显著或极显著正相关,与MDA含量呈显著或极显著负相关。GSH 含量与SOD、POD、APX 及CAT 活性呈极显著正相关,MDA 含量与POD 活性呈极显著负相关。

图4 所测指标间的相关性分析Fig.4 Correlation analysis between measured indicators
3 讨论
3.1 PGRs和施氮量对水稻幼苗建成的影响
NaCl 胁迫会抑制植物生长,降低植物生物量,在甜高粱[32]、小麦[33]和水稻[34-35]等多种作物中均有报道。本研究表明,随着NaCl 胁迫时间的延长,幼苗形态指标均呈现下降趋势,说明NaCl 胁迫抑制幼苗生长。在NaCl 胁迫下,氮肥和叶面喷施两种PGRs 均能提高幼苗的耐盐性,增加茎基宽、壮苗指数和地上干重,达到壮苗效果,一定程度上缓解NaCl 胁迫。这与前人研究氮肥、5-ALA 和DTA-6 均可促进逆境中植物生长的结果一致[36]。总体看来,在低氮基础上叶喷两种GPRs 对水稻幼苗形态的影响均达到在低氮基础上每盆增施0.05 g纯氮效果。
3.2 PGRs和施氮量对水稻幼苗光合色素含量的影响
NaCl 胁迫会破坏叶绿体结构,降低叶绿素含量,导致光合作用减弱,影响植物生命活动[32]。光合色素可以稳定类囊体膜以减少光氧化损伤[37]。本研究显示,在NaCl 胁迫下,水稻叶片的叶绿素和类胡萝卜素含量随着盐胁迫时间的延长呈下降趋势,这可能是因为NaCl胁迫减弱光合色素合成酶活性,损坏叶绿体结构,从而加速光合色素的分解。5-ALA、DTA-6和氮肥均调节了NaCl胁迫下光合色素的含量,维持叶片光合作用光反应过程,这与前人有关5-ALA、DTA-6 和氮肥提高叶绿素含量和光合能量转换效率的结果相一致[38-40]。本研究表明,NaCl 胁迫下,叶喷两种调节剂处理光合色素含量高于增施定量氮肥,其中5-ALA 效果优于DTA-6,这可能是因为DTA-6是通过提高δ-氨基乙酰丙酸(δ-aminolevulinic acid,ALA)向胆色素原(porphobilinogen,PBG)及PBG 向尿卟啉原Ⅲ的转化效率来促进叶绿素合成,而5-ALA 是所有卟啉化合物生物合成的共同前体,是植物体内的非蛋白型氨基酸,直接参与叶绿素合成,显著改善光合色素积累[41]。
3.3 PGRs和施氮量对水稻活性氧代谢的影响
NaCl 胁迫使植物体内活性氧增加,活性氧过度积累造成氧化损伤[42-43]。MDA 是膜脂过氧化的重要指标,其含量可以反映逆境条件下的膜损伤程度[44]。H2O2在植物代谢和信号通路中发挥重要作用,并影响作物生长发育[45]。NaCl 胁迫下,抗氧化系统通过清除植物体内过量ROS 来维持氧化还原稳态[45-46]。超氧化物歧化酶和过氧化物酶的活性常被作为衡量植物抗逆性的两大指标[47]。本研究发现,NaCl 胁迫下,盐处理使MDA和H2O2含量增加,SOD和CAT活性随着胁迫时间的延长先增加后减小,POD 和APX 活性则逐渐升高,与前人研究结果一致[38,48]。这可能是因为水稻幼苗主动调节自身保护酶活性来消除活性氧自由基带来的伤害。氮肥、5-ALA和DTA-6均能降低NaCl胁迫引起的超氧自由基积累,从而减轻幼苗氧化损伤,维持其正常生长。这与前人有关氮肥、5-ALA 和DTA-6 可以缓解逆境引起的膜损伤的结果一致[40]。其中DTA-6对膜损伤的缓解效果优于5-ALA,5-ALA 提高植物保护酶活性效果最佳,这可能是由于5-ALA 作为抗氧化酶活性的启动子[49],刺激抗氧化酶活性增加。
可溶性蛋白含量可以反映植物整体代谢水平,非生物胁迫对植物蛋白质合成影响较大[50]。NaCl 胁迫使MDA 和可溶性蛋白含量增加,说明NaCl 胁迫在损伤水稻叶片细胞膜的同时,提高了渗透调节物质的积累以适应NaCl 胁迫。原型谷胱甘肽是一种强非酶抗氧化剂[51],本研究表明,5-ALA、DTA-6 和氮肥均可促进水稻叶片GSH 合成。在NaCl 胁迫下,水稻叶片中GSH 含量随着NaCl 胁迫时间的延长呈先升高后降低趋势,可能是由于GSH 消耗降低了植物细胞中的ROS[52]。在NaCl 胁迫下,5-ALA、DTA-6 和氮肥均使GSH 含量增加且增幅相似,说明在氮肥减施的基础上叶喷两种PGRs 清除盐胁迫下水稻叶片细胞内自由基和过氧化物能力与增施氮肥相当。
相关性分析表明,POD 活性与MDA 含量呈显著负相关,推测NaCl 胁迫下,水稻本身的POD 不能清除过量的活性氧,需要靠调节因子的调控作用缓解氧化损伤。GSH含量与SOD、POD、APX及CAT活性呈极显著正相关,这可能是由于氮肥和PGRs 提高了抗氧化酶活性,调控GSH 的合成,保护NaCl 胁迫下水稻细胞膜结构的完整性,与前人研究报道中调节剂保护碱胁迫下烟草细胞膜结构完整性的结果相一致[53]。然而,砖红壤养分含量很低,本试验用土采用的是贫瘠的砖红壤与沙3∶1混合,土壤养分含量相对较低,虽然氮水平N2较N1增幅达50%,但有关进一步增加施氮量或改为其他养分含量较高的土壤是否有同样的试验效果还有待进一步探索。
4 结论
NaCl 胁迫抑制水稻生长和代谢过程。增施氮肥与叶面喷施5-ALA 和DTA-6 均可改善NaCl 胁迫期间水稻幼苗的形态变化,提高光合色素含量和抗氧化水平,从而减轻活性氧对幼苗的损伤。施用调节剂(5-ALA和DTA-6)对减轻幼苗在NaCl胁迫下受到的氧化应激损伤效果优于增施定量氮肥,以5-ALA 对NaCl胁迫下幼苗的形态和抗氧化酶活性改善效果较好,DTA-6 在缓解NaCl 胁迫下水稻幼苗膜损伤方面的效果较好。说明在缓解NaCl胁迫对水稻的损伤中,调节剂可以达到增施定量氮肥的效果,进而推测在低氮基础上外源施用两种PGRs可以减少水稻氮肥施用量。
