miR-127-3p靶向调节SETD8对胃癌细胞增殖、迁移和侵袭的影响
2024-02-22冯丽萍张辉洁欧雯婷余盈
冯丽萍 张辉洁 欧雯婷 余盈
(广东医科大学附属医院肿瘤科,广东 湛江 524000)
胃癌是最常见的消化道恶性肿瘤之一,中晚期患者预后较差,研究其相关机制具有重要意义,胃癌的发生发展涉及多基因、多分子参与,微小RNA(miR)是真核生物单链非编码RNA,通过对靶基因表达调控参与肿瘤的恶性进展,miR参与胃癌的发生发展。miR-127-3p在胃癌〔1〕、肝癌〔2〕、非小细胞肺癌〔3〕等肿瘤中低表达,其异常表达与肿瘤侵袭、迁移及耐药性有关。研究显示〔4〕,miR-127-3p通过靶向整合素亚基-α(ITGA)6抑制骨肉瘤细胞生长与侵袭。但是miR-127-3p在胃癌发生和发展中的潜在作用机制尚不清楚。含SET结构域赖氨酸甲基转移酶(SETD)8是一种单一的赖氨酸甲基转移酶,属于组蛋白赖氨酸甲基转移酶家族,参与细胞周期调控、DNA损伤修复、蛋白翻译修饰等过程〔5〕。研究显示,SETD8在胰腺癌、骨肉瘤中高表达,与肿瘤生成与发展有关,且在骨肉瘤细胞中过表达miR-127-3p可通过靶向抑制SETD8表达,抑制细胞增殖、迁移与侵袭〔6,7〕。miR-127-3p对胃癌细胞恶性行为的影响尚不清楚,本研究观察miR-127-3p对胃癌细胞恶性行为的影响及可能机制。
1 材料与方法
1.1标本来源 选择2014年1月1日至2019年1月1日经手术切除胃癌患者的术后病理组织(胃癌组织)标本及癌旁组织各150例,患者术前未经任何抗肿瘤治疗,qRT-聚合酶链反应(PCR)检测胃癌组织及癌旁组织中miR-127-3p表达水平。本研究经医院伦理委员会批准。
1.2动物与主要试剂 BALB/c雌性裸鼠〔4~6周龄,许可证号SCXK(闽)2018-0003〕购自厦门大学实验动物中心。人胃癌细胞(MGC-803、SGC7901、MKN-45、AGS)及人胃上皮细胞GES1购于中国科学院细胞库;胎牛血清、RPMI1640培养液(美国Gibco);Trizol试剂、噻唑蓝(MTT)试剂盒、双荧光素酶报告基因检测试剂盒(R110、M1020、D0010,Solarbio);miR-127-3p模拟物(miR-127-3p mimics)及对照(miR-NC)、过表达或抑制SETD8质粒(SETD8、si-SETD8)、空载质粒(pcDNA)及对照(si-NC)及相应引物(上海GenePharma);Lipo6000TM转染试剂、RIPA细胞裂解液、兔抗人SETD8多抗(C0526、P0013B、AF7971,Beyotime);兔抗人基质金属蛋白酶(MMP)-9单抗、MMP-2多抗(E-AB-70247、E-AB-32054,Elabscience)。
1.3细胞培养及转染 GES1、SGC7901、AGS、MKN-45、MGC-803细胞使用含有10%胎牛血清的RPMI1640培养基进行培养,培养48 h时检测细胞中miR-127-3p表达水平。取对数期SGC7901细胞接种于6孔板中,细胞融合度为75%左右进行质粒转染,转染质粒浓度为50 nmol/L,将SGC7901细胞分为Control组、miR-NC组、miR-127-3p mimics组、si-NC组、si-SETD8组、miR-127-3p mimics+pcDNA组和miR-127-3p mimics+SETD8组,Control组不做转染,其他组转染相应质粒,每组设置6个复孔,转染48 h,检测细胞中miR-127-3p及SETD8表达水平,检验是否转染成功。
1.4双荧光素酶报告基因检测实验 通过TargetScan数据库预测发现,miR-127-3p可与SETD8基因靶向结合。SGC7901细胞接种至6孔板中培养24 h,将野生型wt-SETD8 3′非翻译区(UTR,野生型)与mut-SETD8 3′UTR(突变型)质粒分别与miR-NC、miR-127-3p mimics共转染SGC7901细胞48 h,分别检测各组细胞荧光素酶活性。
1.5qRT-PCR实验检测miR-127-3p、SETD8 mRNA水平 Trizol法提取GC组织、癌旁组织及细胞中总RNA,参照逆转录试剂盒说明书合成cDNA,加入SYBR green染料进行qRT-PCR扩增,采用2-ΔΔCt法计算miR-127-3p、SETD8 mRNA相对表达量。引物序列(5′-3′):miR-127-3p上游引物:GGAAGATCTGTAGTCCTGTCTGTTGGTCAG,下游:CCCAAGCTTCCTGAAGAACTGCTTCCGCC;U6上游引物:CTCGCTTCGGCAGCACA,下游:CTCGCTTCGGCAGCACA;SETD8上游引物:GAAGAGAAAAGAAATGCTGGGAACG,下游:GGTGGAATCACAAGATGAGGGTGGA;β-actin上游引物:CTGCTATGTTGCTCTAGACTTCC,下游:ATGCCACAGGATTCCATACC。
1.6细胞增殖 将转染后各组细胞按照4×104个接种至96孔板中,MTT法分别检测24、48、72 h时的490 nm处吸光度(OD)值。
1.7细胞迁移 转染后,将SGC7901细胞在6孔板中培养,细胞融合至70%~80%时,使用20 μl移液管划痕,磷酸盐缓冲液(PBS)洗涤分离的细胞,培养24 h后,显微镜观察划痕愈合情况。
1.8细胞侵袭 基质胶使用无血清培养基稀释后,取100 μl加入Transwell小室(8.0 μm孔径)上室,待胶干后,上室加入无血清培养基稀释的SGC7901细胞悬液,下室添加配制好的完全培养基,培养24 h,结晶紫染色,显微镜观察侵袭细胞数。
1.9Western印迹实验 离心收集转染后各组SGC7901细胞,RIPA裂解液裂解,12 000 r/min离心收集蛋白,电泳后转膜,分别加入一抗、二抗孵育,电化学发光(ECL)放大显色,ImageJ 软件分析各蛋白表达。
1.10裸鼠移植瘤实验 将Control组及转染miR-NC、miR-127-3p mimics质粒的SGC7901细胞稀释成5×106个/ml的细胞悬液,于裸鼠右前肢腋下接种200 μl,每组6只,第21天脱颈处死小鼠,分离瘤体,测量体积并称质量,检测瘤体miR-127-3p、SETD8中表达。
1.11统计学方法 采用SPSS25.0及GraphPad Prism8.0软件进行t检验、方差分析、Pearson相关分析及SNK-q检验。检验水准α=0.05。
2 结 果
2.1miR-127-3p在胃癌组织与细胞中表达下调 qRT-PCR检测结果显示,胃癌组织中miR-127-3p表达水平显著低于癌旁组织,SETD8 mRNA表达水平显著高于癌旁组织(均P<0.05),见表1。经相关性分析显示,胃癌组织中miR-127-3p、SETD8 mRNA表达水平呈负相关(r=-0.553,P<0.05)。与GES1细胞(1.00±0.09)相比,miR-127-3p在胃癌细胞SGC7901、AGS、MKN-45、MGC-803表达(0.21±0.04、0.65±0.07、0.37±0.05、0.55±0.06)显著下调(均P<0.05),miR-127-3p在SGC7901细胞中表达水平最低,故选择SGC7901细胞。
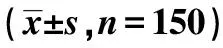
表1 miR-127-3p、SETD8 mRNA在胃癌组织中表达
2.2miR-127-3p与SETD8靶向验证 通过TargetScan数据库进行生物信息学分析,如图1所示,SETD8是miR-127-3p的潜在靶基因。双荧光素酶实验结果显示,wt-SETD8 3′UTR与miR-127-3p mimics共转染SGC7901细胞的相对荧光素酶活性(0.31±0.04)显著低于野生型wt-SETD8 3′UTR质粒与miR-NC共转染细胞(1.00±0.08,P<0.05)。

图1 miR-127-3p与SETD8靶向结合位点预测
2.3miR-127-3p上调表达抑制SGC7901细胞增殖、迁移、侵袭及SETD8表达 MTT检测显示,miR-127-3p mimics组较miR-NC组在24、48、72 h对SGC7901细胞增殖均有明显抑制作用(P<0.05);划痕愈合实验与Transwell小室结果显示,miR-127-3p mimics组较miR-NC组划痕愈合率、细胞侵袭数显著降低(P<0.05);Western印迹结果显示,miR-127-3p mimics组较miR-NC组SETD8、MMP-2、MMP-9蛋白表达水平显著降低(P<0.05)。与miR-NC组比较,miR-127-3p mimics组miR-127-3p表达水平显著升高,SETD8 mRNA表达水平显著降低(P<0.05)。见表2、图2、表3、图3。

表2 miR-127-3p上调抑制SGC7901细胞增殖

图2 miR-127-3p上调表达对SGC7901细胞侵袭、迁移的影响(结晶紫染色)

表3 miR-127-3p上调表达对SGC7901细胞增殖、迁移、侵袭及SETD8表达的影响
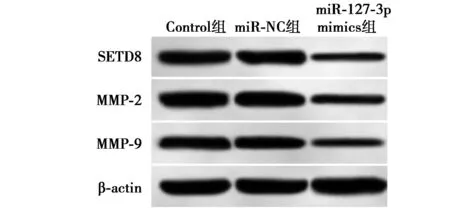
图3 miR-127-3p上调表达对SGC7901细胞SETD8、MMP-2、MMP-9蛋白表达的影响
2.4SETD8下调表达抑制SGC7901细胞增殖、迁移及侵袭 SGC7901细胞转染si-SETD8质粒后,MTT检测显示,si-SETD8组较si-NC组在24、48、72 h对SGC7901细胞增殖均有明显抑制作用(P<0.05);划痕愈合实验与Transwell小室结果显示,si-SETD8组较si-NC组划痕愈合率、细胞侵袭数显著降低(P<0.05);Western印迹结果显示,si-SETD8组较si-NC组SETD8、MMP-2、MMP-9蛋白表达水平显著降低(P<0.05),Control组和si-NC组上述指标差异不显著(P>0.05),见图4、图5、表4。

1~6:Control组、si-NC组、si-SETD8组、miR-127-3p mimics组、miR-127-3p mimics+pcDNA组、miR-127-3p mimics+SETD8组图4 SETD8下调或过表达对SGC7901细胞SETD8、MMP-2、MMP-9蛋白表达的影响
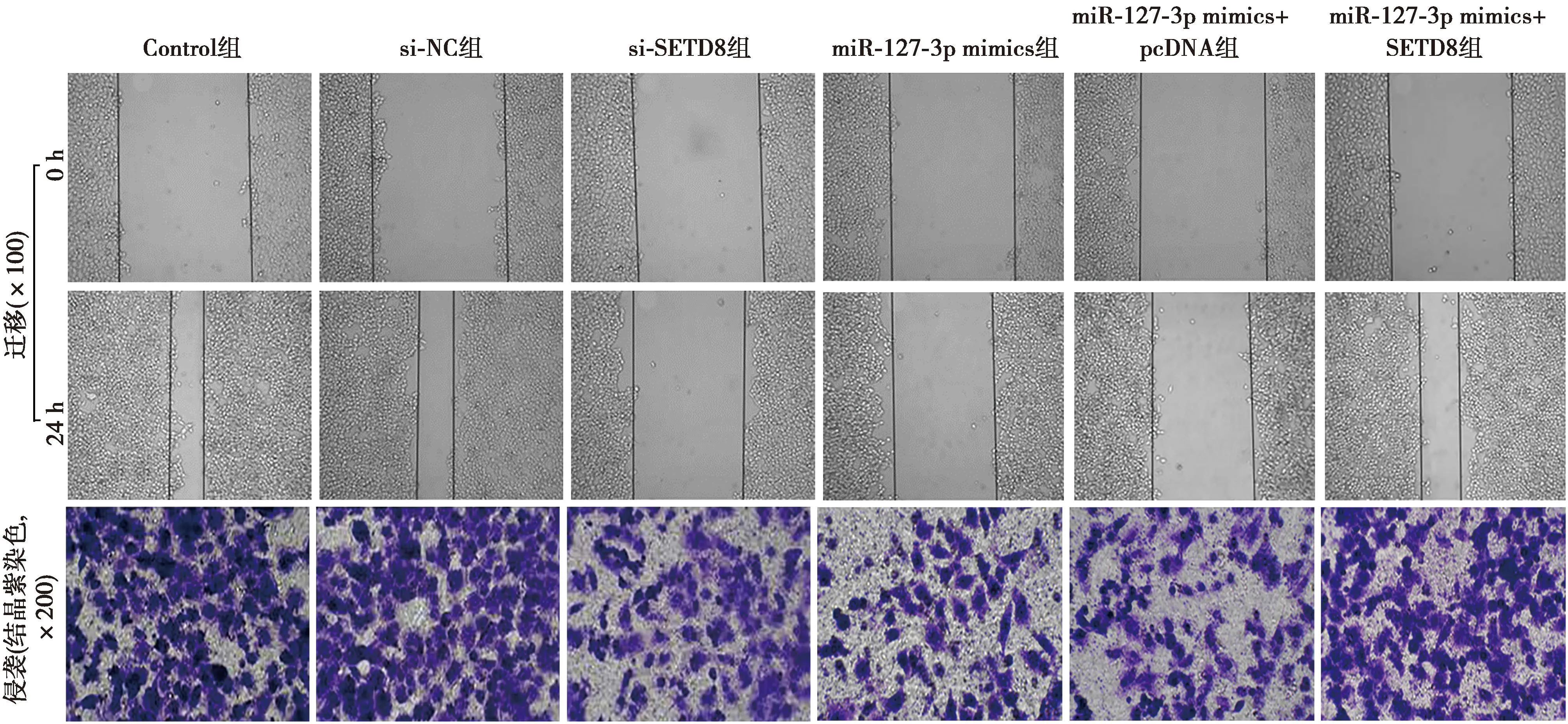
图5 SETD8下调或过表达对SGC7901细胞迁移、侵袭的影响

表4 SETD8下调表达抑制SGC7901细胞增殖、迁移及侵袭
2.5过表达SETD8与过表达miR-127-3p对SGC7901细胞的影响 MTT检测显示,miR-127-3p mimics+SETD8组较miR-127-3p mimics+pcDNA组在24、48、72 h的SGC7901细胞增殖活性显著增加(P<0.05);划痕愈合实验与Transwell小室结果显示,miR-127-3p mimics+SETD8组较miR-127-3p mimics+pcDNA组划痕愈合率、细胞侵袭数显著升高(P<0.05);Western印迹结果显示,miR-127-3p mimics+SETD8组较miR-127-3p mimics+pcDNA组SETD8、MMP-2、MMP-9蛋白表达水平显著升高(P<0.05),miR-127-3p mimics组和miR-127-3p mimics+pcDNA组上述指标差异不显著(P>0.05),见图4、图5、表5。

表5 过表达miR-127-3p与SETD8对SGC7901细胞、迁移及侵袭的影响
2.6miR-127-3p上调表达抑制裸鼠移植瘤生长 与miR-NC组比较,miR-127-3p mimics裸鼠移植瘤质量与瘤体体积显著降低,miR-127-3p表达水平显著升高,SETD8 mRNA及蛋白表达水平显著降低(P<0.05),见表6、图6。

表6 miR-127-3p上调表达对裸鼠移植瘤生长及miR-127-3p、SETD8表达的影响

图6 miR-127-3p上调表达对移植瘤SETD8表达的影响
3 讨 论
miRNAs可参与肿瘤细胞的多种生物学过程,如肿瘤的发生、转移或耐药性等过程,在肿瘤的恶性进展中发挥重要作用,miR-127-3p为与肿瘤密切相关的miRNAs分子之一,在肝癌、食管鳞状细胞癌、乳腺癌、肾癌等多数肿瘤中表达下调,参与调控肿瘤细胞的增殖、侵袭、迁移,发挥抑癌基因的作用〔8~10〕。研究显示〔11〕,miR-127-3p在口腔鳞状细胞癌(OSCC)中表达下调,上调miR-127-3p表达可靶向调控驱动蛋白家族成员(KIF)3B表达抑制OSCC细胞增殖与迁移。另有研究显示〔12〕,在葡萄膜黑色素瘤细胞中,上调miR-127-3p表达可通过调节相关通路抑制细胞的恶性生物学行为。本研究显示,在胃癌组织与细胞中miR-127-3p表达下调,与先前报道一致。MMP-2、MMP-9是参与细胞外基质代谢的最主要的蛋白水解酶类,与肿瘤的侵袭转移密切相关。本研究结果提示,miR-127-3p在胃癌发生发展中发挥抑癌作用。
SETD8(又称PR-SET7或KMT5a)是一种组蛋白甲基转移酶,参与细胞周期调控、侵袭和DNA损伤,SETD8还可通过甲基化调控基因表达与蛋白转录后修饰,研究显示,SETD8在肝癌、结肠癌、甲状腺癌、乳腺癌等肿瘤中表达上调,与肿瘤的发生发展密切相关〔13~15〕。上调miR-384可抑制SETD8表达显著抑制骨肉瘤细胞的增殖、迁移和侵袭〔16〕。研究显示〔17〕,SETD8在胃腺癌中上调表达,与淋巴结转移、肿瘤大小、临床分期、癌症干细胞相关基因有关。本研究结果表明,抑制SETD8表达可抑制SGC7901细胞恶性行为,而上调SETD8可部分逆转过表达miR-127-3p对SGC7901细胞恶性行为的影响。
综上,在胃癌组织与细胞中miR-127-3p表达下调,上调miR-127-3p表达抑制SETD8表达而抑制胃癌生长。二者的具体调控机制仍需结合动物模型进一步研究。
