lncRNA SNHG7通过miR-122-5p/CCND1轴调节胃癌细胞的增殖、凋亡及肿瘤免疫逃逸
2024-02-22闫丹措马颖才逯艳艳杨桂英东金花赵奕刘芝兰
闫丹措 马颖才 逯艳艳 杨桂英 东金花 赵奕 刘芝兰
(青海省人民医院消化内科,青海 西宁 810000)
胃癌作为人类常见的恶性消化道肿瘤,在全球肿瘤死亡率中居第二位,常采用手术结合放化疗的方式进行临床治疗,但中晚期患者疗效并不显著,其生活质量及生存率还不理想,因而积极改进胃癌治疗方法对提升患者预后具有重大价值〔1,2〕。长链非编码RNA(lncRNA)小核仁RNA宿主基因(SNHG)7已被证明是在包括食管癌、乳腺癌和胃癌等在内的人类肿瘤中发挥重要致癌作用的lncRNA,可通过调节细胞存活、凋亡、生长及迁移等多种生物学作用促进肿瘤的发生和进展〔3〕。SNHG7在胃癌中显著上调,与胃癌细胞的顺铂耐药、胃癌患者浸润深度和远处转移呈正相关;SNHG7可通过增强胃癌细胞迁移、侵袭和增殖活性而在胃癌中发挥致癌作用,可作为胃癌的潜在治疗靶点〔4,5〕。miR-122是在包括胃癌、卵巢癌在内的多种癌症中起到抑瘤作用的微小RNA,其中miR-122-5在胃癌细胞和组织中表达降低〔6〕,提高miR-122-5p表达水平可降低卵巢癌和胃癌细胞迁移、侵袭和增殖活力,并加速其凋亡〔6,7〕;而细胞周期蛋白(CCN)D1可通过调控细胞周期而促进肿瘤的发生,下调CCND1表达可阻滞胃癌细胞周期,抑制胃癌细胞增殖及胃癌的发生进展,以上显示miR-122-5p和CCND1均是有前景的胃癌治疗靶点〔8〕。研究显示,miR-122-5p可能通过调控CCND1介导乳腺癌患者的基线体质量指数,最终影响肿瘤的复发〔9〕,另外SNHG7可通过下调miR-122-5p促进肝癌细胞生长和转移〔10〕。因而预测lncRNA SNHG7可能通过miR-122-5p/CCND1轴调节胃癌细胞的增殖、凋亡及肿瘤免疫逃逸过程,本文通过敲低胃癌细胞MKN-45中lncRNA SNHG7的表达对以上假设进行研讨。
1 材料与方法
1.1试剂与仪器 lncRNA SNHG7 siRNA、miR-122-5p inhibitor阴性对照、miR-122-5p inhibitor、lncRNA SNHG7过表达质粒(pc-lncRNA SNHG7)、lncRNA SNHG7空载质粒(pc-NC)、突变型miR-122-5p 3′-非翻译区(UTR)报告质粒(mut-miR-122-5p)、3-磷酸甘油醛脱氢酶(GAPDH)与CCND1、U6、miR-122-5p、lncRNA SNHG7引物、野生型miR-122-5p 3′-UTR报告质粒(wt-miR-122-5p)均购自生工生物工程(上海)股份有限公司;胎牛血清(货号164210-500)、人胃黏膜上皮细胞(货号CP-H048)、人胃黏膜上皮细胞完全培养基(货号CM-H048)、人胃癌组织源细胞(货号CP-H139)、人胃癌组织源细胞完全培养基(货号CM-H139)、NCI-N87细胞(货号CL-0169)、SNU-1细胞(货号CL-0474)、MKN-45细胞(货号CL-0292)、RPMI1640培养基(货号PM150110)、青链霉素混合液(货号PB180120)均购自武汉普诺赛生命科技有限公司;人外周血CD8+T细胞购自北京汇智和源生物技术有限公司;总RNA提取试剂盒(货号R1200)、双荧光素酶报告基因检测试剂盒(货号D0010)、实时荧光定量聚合酶链反应(PCR)试剂盒(货号T2210)、Opti-MEM减血清培养基(货号31985070)、5-乙炔基-2′脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒(货号CA1170)均购自北京索莱宝科技有限公司;抗人CD3抗体(货号61347)、兔源抗大鼠细胞增殖核抗原(PCNA)一抗(货号13110)、兔源抗大鼠天冬氨酸特异性半胱氨酸蛋白酶(caspase)-3一抗(货号9662)、兔源抗大鼠CCND1一抗(货号55506)、膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(AnnexinV-FITC/PI)凋亡检测试剂盒(货号V13242)、兔源抗大鼠B细胞淋巴瘤-2相关X蛋白(Bax)一抗(货号PA5-11378)、抗人CD28抗体(货号91920)、人白细胞介素(IL)-2重组因子(货号31058)均购自美国Cell Singaling Technology公司;山羊抗兔IgG二抗(货号A0208)、蛋白裂解液(货号P0013K)、兔源抗大鼠β-tubulin一抗(货号AF1216)、二喹啉甲酸(BCA)试剂盒(货号P0011)、CCK-8试剂盒(货号C0037)均购自上海碧云天生物技术有限公司等。实时荧光定量PCR仪(型号IC5MCIer)、全自动酶标仪(型号iMark)均购自美国BIO-RAD公司;倒置荧光双目显微镜(型号FSX100)购自日本Olympus公司;流式细胞仪(型号Countstar Rigel)购自上海睿钰生物科技有限公司;稳压稳流电泳仪(型号EPS-600)购自上海天能科技有限公司;垂直电泳、印迹系统(miniVE)购自美国Cytiva公司等。
1.2实时荧光定量PCR检测各细胞中lncRNA SNHG7、miR-122-5p与CCND1表达 快速解冻购买的人胃黏膜上皮细胞、人胃癌组织源细胞及人胃癌细胞株MKN-45、SNU-1、NCI-N87,复苏后离心,以RPMI1640培养基洗涤各细胞沉淀后,以相应的完全培养基分别重悬人胃黏膜上皮细胞及人胃癌组织源细胞后混匀,以加入10%胎牛血清和1%青链霉素的RPMI1640培养基分别重悬人胃癌细胞NCI-N87、SNU-1、MKN-45后混匀,均放入恒温培养箱(37.5 ℃、5%CO2)中无菌培养,各细胞长满后进行传代并收集细胞沉淀。参照总RNA提取试剂盒说明书的指导步骤对各细胞中总RNA进行提取纯化,并参照一步法实时荧光定量PCR试剂盒说明书的指导步骤进行PCR,设定条件如下:50 ℃ 5 min,95 ℃ 3 min,95 ℃ 10 s,60 ℃ 30 s,循环数40,lncRNA SNHG7与CCND1的内参选用GAPDH,miR-122-5p的内参选用U6,通过2-ΔΔCt分析各基因循环阈值并量化其相对表达,引物序列:lncRNA SNHG7:上游引物5′-TTGCTGGCGTCTCGGTTAAT-3′、下游5′-GGAAGTCCATCACAGGCGAA-3′,CCND1:上游引物5′-CTGTGCATCTACACCGACAACT-3′、下游5′-GCATTTTGGAGAGGAAGTGTTC-3′,GAPDH:上游引物5′-AACGTGTCAGTGGTGGACCTG-3′、下游5′-AGTGGGTGTCGCTGTTGAAGT-3′,miR-122-5p:上游引物5′-TATTCGCACTGGATACGACACAAAC-3′、下游5′-GCCCGTGGAGTGTGACAATGGT-3′,U6:上游引物5′-GCTTCGGCAGCACATATACTAAAAT-3′、下游5′-CGCTTCAC-GAATTTGCGTGTCAT-3′。
1.3分组转染MKN-45细胞及收集标本 在一个无菌12孔板中接种传代MKN-45细胞,培养24 h后随机分为对照组、si-lncRNA SNHG7组、si-NC组、si-lncRNA SNHG7+miR-122-5p inhibitor组,将细胞完全培养基换成Opti-MEM减血清培养基,使用脂质体2000并遵照其指导操作说明对细胞分组进行转染,si-lncRNA SNHG7组、si-NC组细胞分别转染lncRNA SNHG7 siRNA及其阴性对照,si-lncRNA SNHG7+miR-122-5p inhibitor组细胞转染lncRNA SNHG7 siRNA和miR-122-5p inhibitor,6 h后将Opti-MEM减血清培养基换成新鲜完全培养基后继续培养24 h,收集各组细胞做后续检测。
1.4检测MKN-45细胞增殖情况 将1个无菌的96孔板的培养孔随即分为空白对照组、对照组、si-lncRNA SNHG7组、si-NC组、si-lncRNA SNHG7+miR-122-5p inhibitor组,每组设6个孔,除了空白对照组外其余各组接种传代的MKN-45细胞于恒温培养箱(37.5 ℃、5%CO2)中无菌培养12 h后,以上述1.3中的方法对除了空白对照组外的其余各组进行转染,24 h后加入10 μl CCK-8试剂孵育1.5 h后用酶标仪测出各组细胞在450 nm波长下的吸光度(A),然后算出其细胞活力,细胞活力(%)=(A转染组-A空白对照组)/(A对照组-A空白对照组)×100%。
在无菌的24孔板中接种传代MKN-45细胞,于恒温培养箱(37.5 ℃、5%CO2)中无菌培养12 h后以上述1.3中的方法对各组细胞进行转染,24 h后向各孔细胞中加入50 μmol/L EdU溶液,继续培养2 h后倒掉培养基,剩余贴壁的细胞经洗涤、固定后按照EdU细胞增殖检测试剂盒说明指导检测各组细胞增殖情况,采用ImageJ软件分析荧光显微镜下采集的图片,计算各组细胞EdU阳性率=EdU阳性细胞数/总细胞数×100%。
1.5检测MKN-45细胞凋亡情况 将1.3中收集的各组MKN-45细胞以磷酸盐缓冲液(PBS)洗涤、重悬,混匀后以10 μl AnnexinⅤ-FITC孵育后,以5 μl PI避光孵育,再次以PBS洗涤、重悬、混匀后上机检测,采用Muticycle AV软件分析流式细胞仪中数据获得各组细胞凋亡率。
1.6检测活化CD8+T细胞对各组MKN-45细胞的杀伤率 将购买的人外周血CD8+T细胞以1 μg/ml抗CD3抗体、1 μg/ml抗CD28抗体和10 ng/ml IL-2激活24 h后〔11〕,对其进行计数后以20∶1的比例与1.3中收集的各组细胞共同接种在96孔板中培养,同时在另一个96孔板中接种与共培养组数目相同的人外周血CD8+T细胞进行培养,以单独培养的MKN-45细胞作为对照靶细胞,各组细胞培养24 h后依照1.4中方法测出其A值后算出每组活化CD8+T细胞对各组MKN-45细胞的杀伤率,公式:杀伤率=〔1-(A共培养-A对照效应细胞)/A对照靶细胞〕×100%。
1.7检测MKN-45细胞miR-122-5p及CCND1、PCNA、Bax、caspase-3表达 以上述1.2中的方法通过实时荧光定量PCR实验检测各组MKN-45细胞中miR-122-5p表达。以蛋白裂解液裂解1.3中收集的各组MKN-45细胞,离心提取其中总蛋白后用BCA试剂盒并参照其说明书指导步骤测出其浓度,然后每组取出18 μg蛋白变性后上样,以垂直电泳、印迹系统通过电泳及湿转实验将蛋白分离后转至硝酸纤维素膜上,分别孵育CCND1(1∶2 000)、PCNA(1∶3 000)、Bax(1∶2 500)、caspase-3(1∶1 000)及β-tubulin(1∶2 000)一抗后孵育山羊抗兔二抗(1∶1 000),显色后拍照,以ImageJ软件定量所得图像中各蛋白灰度并量化其相对表达。
1.8检测MKN-45细胞中lncRNA SNHG7对miR-122-5p的靶向调控 在一个无菌的24孔板中接种传代MKN-45细胞,培养24 h后将pc-lncRNA SNHG7、pc-NC分别与mut-miR-122-5p、wt-miR-122-5p共同转染到MKN-45细胞中,24 h后用双荧光素酶报告基因检测试剂盒测定各组细胞双荧光素酶活性并算出其相对值,具体方法依照试剂盒说明书中所示。
1.9统计学方法 采用SPSS24.0软件进行方差分析,两两间比较采用LSD-t检验。
2 结 果
2.1人胃黏膜上皮细胞、人胃癌组织源细胞和人胃癌细胞株MKN-45、NCI-N87、SNU-1中lncRNA SNHG7、miR-122-5p与CCND1 mRNA的表达 与人胃黏膜上皮细胞相比,人胃癌组织源细胞和人胃癌细胞株MKN-45、SNU-1、NCI-N87中miR-122-5p表达显著降低,lncRNA SNHG7、CCND1 mRNA表达显著升高(均P<0.05)。见表1。

表1 各细胞中CCND1 mRNA与miR-122-5p、lncRNA SNHG7的相对表达水平
2.2lncRNA SNHG7对MKN-45细胞增殖的影响 与对照组相比,si-lncRNA SNHG7组细胞活力与EdU阳性率均显著降低(P<0.05),si-NC组细胞活力与EdU阳性率均无显著差异(P>0.05);与si-lncRNA SNHG7组相比,si-lncRNA SNHG7+miR-122-5p inhibitor组细胞活力与EdU阳性率均显著升高(P<0.05)。见图1、表2。
2.3lncRNA SNHG7对MKN-45细胞免疫逃逸的影响 与对照组相比,si-lncRNA SNHG7组活化CD8+T细胞对MKN-45细胞的杀伤率明显升高(P<0.05),si-NC组活化CD8+T细胞对MKN-45细胞的杀伤率无显著差异(P>0.05);与si-lncRNA SNHG7组相比,si-lncRNA SNHG7+miR-122-5p inhibitor组活化CD8+T细胞对MKN-45细胞的杀伤率明显降低(P<0.05)。见表2。
2.4lncRNA SNHG7对MKN-45细胞凋亡的影响 与对照组相比,si-lncRNA SNHG7组细胞凋亡率明显升高(P<0.05),si-NC组细胞凋亡率无显著差异(P>0.05);与si-lncRNA SNHG7组相比,si-lncRNA SNHG7+miR-122-5p inhibitor组细胞凋亡率明显降低(P<0.05)。见表2、图2。

1~4:对照组、si-lncRNA SNHG7组、si-NC组、si-lncRNA SNHG7+miR-122-5p inhibitor组;图2、3同图1 EdU染色检测各组MKN-45细胞增殖(×200)
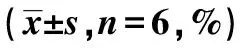
表2 各组MKN-45细胞活力、EdU阳性率、细胞凋亡率、杀伤率
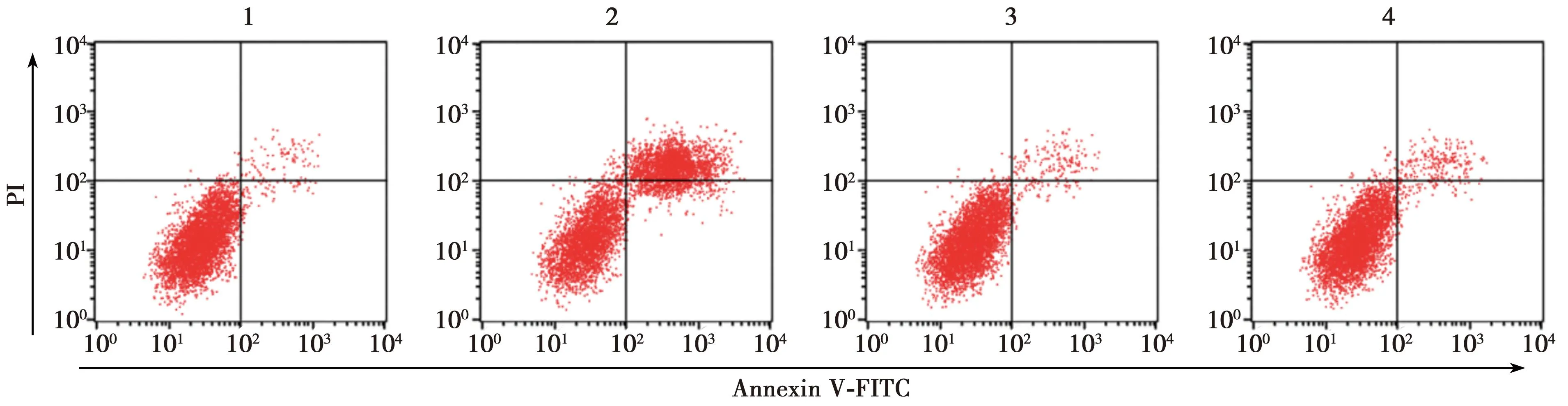
图2 流式细胞术检测各组MKN-45细胞凋亡
2.5lncRNA SNHG7对MKN-45细胞miR-122-5p、CCND1 mRNA及增殖、凋亡蛋白表达的影响 与对照组相比,si-lncRNA SNHG7组细胞miR-122-5p、caspase-3、Bax蛋白表达均明显升高,PCNA、CCND1蛋白表达均明显降低(均P<0.05);与si-lncRNA SNHG7组相比,si-lncRNA SNHG7+miR-122-5p inhibitor组细胞miR-122-5p、caspase-3、Bax蛋白表达均明显降低,PCNA、CCND1蛋白表达均明显升高(P<0.05)。见表3、图3。

表3 各组细胞miR-122-5p及caspase-3、Bax、PCNA、CCND1蛋白相对表达水平
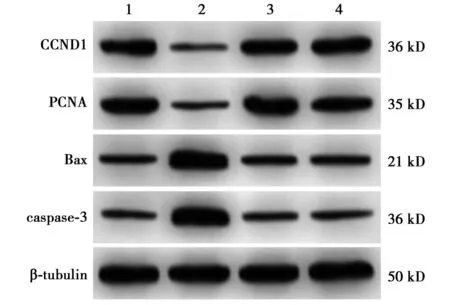
图3 Western印迹检测各组细胞增殖及凋亡蛋白表达
2.6MKN-45细胞中lncRNA SNHG7对miR-122-5p的靶向调节 通过TCGA数据库查询lncRNA SNHG7与miR-122-5p间的结合位点,见图4。与wt-miR-122-5p+pc-NC组(1.04±0.25)比较,wt-miR-122-5p+pc-lncRNA SNHG7组荧光素酶相对活性显著降低(0.35±0.07,P<0.05);mut-miR-122-5p+pc-NC组与mut-miR-122-5p+pc-lncRNA SNHG7组之间荧光素酶相对活性无显著差异(1.01±0.14 vs 0.98±0.23,P>0.05)。

图4 lncRNA SNHG7和miR-122-5p间的结合位点
3 讨 论
近年来胃癌在我国发病率一直很高,因早期难以诊断,患者进行治疗时大多数已发展到中晚期,常规的手术切除、放化疗等治疗手段预后很难达到预期,导致患者死亡率也一直处于高水平,如今免疫治疗在临床中越来越受重视,因此积极探寻提升免疫治疗疗效的策略具有重要临床意义〔12,13〕。SNHG7参与了胰腺癌、神经母细胞瘤、结直肠癌等人类多种癌症的发生和发展,与各种肿瘤患者的预后不良密切相关,SNHG7的高表达与不良总体生存率显著正相关,促进肿瘤恶性进展〔14〕;SNHG7在包括胃癌在内的癌症中显著上调,沉默SNHG7可显著致敏对顺铂耐药的胃癌细胞,促进其糖酵解速率及凋亡〔4〕;敲低SNHG7还可阻滞卵巢癌细胞周期,增强其对紫杉醇的敏感性,抑制其细胞活力、迁移和侵袭〔15〕。本研究结果表明,lncRNA SNHG7参与调控胃癌细胞增殖、凋亡及其进展过程,敲低SNHG7可降低胃癌细胞株MKN-45的增殖活性,减轻其免疫逃逸,增强活化CD8+T细胞杀伤力,上调凋亡点半表达,促使胃癌细胞凋亡,最终对胃癌起到明显的抗癌作用。
miR-122-5p在肝癌、胃癌中明显下调,对病情进展起着重要作用,恢复miR-122-5p的表达可显著抑制肝癌细胞增殖,在体外降低胃癌细胞增殖和转移活性,并抑制胃癌肿瘤在体内的生长〔16,17〕。CCND1在肿瘤发生及进展中具有关键作用,CCND1在胃癌组织中明显高表达,下调CCND1可导致胃癌细胞周期停滞和生长抑制,并显著抑制其细胞增殖、迁移和侵袭,进而延缓其肿瘤在体内的恶性进展〔18,19〕。在乳腺癌患者体内,miR-122-5p可能通过调控CCND1的表达影响其体质量指数和肿瘤的复发〔9〕。在肝癌细胞内,SNHG7可下调miR-122-5p,进而增强其增殖及转移〔10〕,并可通过促进神经母细胞瘤中CCND1表达起到致癌作用〔20〕。因而,可推测调控miR-122-5p/CCND1轴可能是敲低SNHG7抑制胃癌细胞的增殖及肿瘤免疫逃逸并促进其凋亡的分子机制。本研究结果证实,miR-122-5p/CCND1介导SNHG7对MKN-45细胞增殖、凋亡及肿瘤免疫逃逸的调控过程。本研究结果还表明,降低miR-122-5p表达可拮抗SNHG7的敲低对MKN-45细胞增殖的抑制作用,削弱其对MKN-45细胞的促凋亡与抗肿瘤免疫逃逸作用,最终逆转其对胃癌的抗癌作用,揭示敲低SNHG7可抑制胃癌细胞增殖及肿瘤免疫逃逸并促进其凋亡是通过上调miR-122-5p表达实现的。
