RNA结合蛋白HuR调控lncRNA DLEU2促进食管鳞癌细胞增殖、侵袭的机制
2024-02-22王伟何天乐李扬杨素清
王伟 何天乐 李扬 杨素清
(1邯郸市第一医院胸外科,河北 邯郸 056000;2中国人民解放军海军军医大学2018级;3河北医科大学第二医院感控科)
食管鳞状细胞癌(简称食管鳞癌)是我国食管癌的主要类型,其恶性程度较高,是严重威胁人类健康的肿瘤之一〔1〕。虽然近年来治疗食管鳞癌的技术有了较大提升,但是其患者的5年生存率仍然较低,在20%以下〔2〕。人抗原(Hu)R也被称为胚胎致死异常视觉蛋白(ELAVL)1,是RNA结合蛋白的一种,主要参与调控细胞的分化和应激反应。有研究〔3~5〕显示,HuR在肺癌、胃癌、乳腺癌等肿瘤细胞中均呈现高表达,其上调表达对肿瘤细胞的发生发展有促进作用。然而,HuR在食管鳞癌中的研究非常匮乏。
目前已知的是HuR在食管鳞癌中表达升高,其下调表达可抑制其癌细胞增殖和转移〔6〕,但是其具体的调节机制尚不明确。淋巴细胞白血病缺失基因(DLEU)2是长链非编码RNA(lncRNA)的一种,已被证实在食管癌细胞中上调表达,其沉默后可抑制食管癌细胞的生物学行为〔7〕。此外,starbase软件预测发现,DLEU2与HuR可能存在结合关系。因此,本研究分析HuR与DLEU2在食管鳞癌组织和细胞中的表达情况,并探讨二者的作用关系及其对食管鳞癌细胞增殖、侵袭的影响。
1 材料与方法
1.1组织与细胞来源 选取2019年10月至2021年7月在邯郸市第一医院接受食管鳞癌手术的患者24例,在手术中收集癌组织与其癌旁组织,立即放入液氮中速冻备用。参与本实验的患者均签署知情同意书,且本研究通过河北省邯郸市第一医院医院伦理委员会许可。正常人食管鳞状上皮细胞Het-1A及食管鳞癌细胞系KYSE30、KYSE70、KYSE270均由河南省工业微生物菌种工程技术研究中心提供。
1.2主要试剂与仪器 5周龄BALB/c裸小鼠购自赛业(固安)生物科技有限公司,许可证号为SYXK(冀)2021-005;HuR过表达载体及其对照空载体(pc-HuR/pcDNA)、HuR慢病毒干扰载体及其阴性对照(sh-HuR/sh-NC)、DLEU2小干扰RNA及其阴性对照(si-DLEU2/si-NC)由上海生工生物公司提供;DMEM培养基、Trizol由美国Sigma公司提供;Lipofectamime2000试剂由美国Invitrogen公司提供;2×SYBR Green PCR Mastermix试剂盒由北京索莱宝生物公司提供;CCK-8试剂盒由武汉菲恩生物科技有限公司提供;结晶紫由沈阳思诺达生物科技有限公司提供;Transwell小室由北京明阳科华生物科技有限公司提供;HuR一抗及辣根过氧化物酶(HRP)耦联的二抗由美国Abcam公司提供;RNA免疫沉淀试剂盒由苏州市赛德生物技术有限公司提供。CO2培养箱购自北京隆福佳生物科技有限公司;CFX Connect实时荧光定量聚合酶链反应(qRT-PCR)仪购自美国Bio-Rad公司;酶标仪购自山东博科科学仪器有限公司;光学显微镜购自基恩士(中国)有限公司。
1.3细胞培养、转染与分组 正常人食管鳞状上皮细胞Het-1A及食管鳞癌细胞系KYSE30、KYSE70、KYSE270放置在含胎牛血清的DMEM培养基上,胎牛血清的体积分数为10%,于CO2培养箱中进行培养,温度调整至37 ℃。利用Lipofectamime2000试剂对生长至对数期的KYSE30细胞进行转染,并随机分组为对照组(不转染)、pcDNA组(转染pcDNA)、pc-HuR组(转染pc-HuR)、sh-NC组(转染sh-NC)、sh-HuR组(转染sh-HuR)、sh-HuR+si-NC组(转染sh-HuR和si-NC)和sh-HuR+si-DLEU2组(转染sh-HuR和si-DLEU2),将转染后的各组细胞在培养箱中持续培养48 h,结束后收集细胞备用。
1.4qRT-PCR实验 采用Trizol法提取食管鳞癌组织和细胞系中的总RNA,测定浓度后对其定量,按照逆转录试剂盒说明书的方法将其反转录为cDNA,并利用2×SYBR Green PCR Mastermix试剂盒配制反应体系,然后进行PCR扩增。反应结束后,使用2-ΔΔCt法分析HuR mRNA与DLEU2表达水平,β-actin为二者的内参基因。HuR的引物序列为:正向5′-GGGTGACATCGGGAGAACG-3′,反向5′-CTGAACAGGCTTCGTAACTCAT-3′;DLEU2正向5′-GGCGGCGGGTACTTATCTC-3′,反向5′-CCAGGGAAGGATGTAGCTG-TG-3′;β-actin正向5′-CCCGAGCCGTGTTTCCT-3′,反向5′-GTCCCAGTTGGTGACGATGC-3′。
1.5CCK-8法检测KYSE30细胞活性 收集经过转染的各组细胞,将其接种在96孔细胞板上,分别在培养至24、48、72 h时加入20 μl CCK-8试剂,2 h后采用酶标仪在450 nm处检测其吸光度(OD)值。
1.6平板克隆形成实验检测KYSE30细胞增殖能力 将生长至对数期的KYSE30细胞接种在直径为6 cm的圆形培养皿上,每个培养皿细胞数控制在103个,分别加入3 ml DMEM培养基,轻轻晃动培养基使细胞平均分布在培养皿上,每2 d更换1次培养基,2 w后弃去培养基,先固定10 min,然后用结晶紫染色,30 min后在显微镜下观察并记录克隆形成数目,以克隆形成数与接种细胞数的百分比代表克隆形成率。
1.7荷瘤裸鼠实验观察KYSE30细胞在体内肿瘤生长能力 将对照组、pcDNA组、pc-HuR组、sh-NC组、sh-HuR组、sh-HuR+si-NC组和sh-HuR+si-DLEU2组细胞胰蛋白酶化成单细胞悬液,重悬于浓度为2×106/150 μl KYSE30细胞中。将5周龄BALB/c裸小鼠置于无菌条件下,随机分成7组,每组6只,分别于右侧皮下注射细胞悬液150 μl。每隔7 d用卡尺测量肿瘤,肿瘤体积(mm3)=0.5×长×宽2。28 d后处死小鼠,解剖肿瘤并称重。
1.8Transwell实验检测KYSE30细胞侵袭能力 实验前首先将稀释好的基质胶均匀铺在Transwell小室的上层,然后将收集好的各组细胞进行重悬,细胞浓度调整为3×104个/ml,在上室加入细胞悬液100 μl,下室加入培养基650 μl,24 h后进行固定和染色,最后在光学显微镜下随机挑选5个互不重叠的视野观察细胞侵袭情况并记录细胞侵袭数目。
1.9Western印迹检测HuR蛋白表达 将各组KYSE30细胞裂解后提取其总蛋白,使用BCA试剂盒检测其蛋白含量,然后取等量的蛋白样品进行聚丙烯酰胺凝胶电泳,结束后进行转膜和封闭,再加入HuR、β-actin抗体,稀释比例为1∶1 000,次日加入HRP耦联的二抗,继续孵育1 h,最后加入电化学发光(ECL)试剂进行显影,并用Quantity One Image软件分析HuR蛋白印迹,以HuR条带与β-actin的比值表示HuR蛋白表达水平。
1.10免疫沉淀(RIP)实验分析HuR与DLEU2的结合关系 使用将KYSE30细胞使用RIP裂解液进行裂解,并与磁珠共同孵育,磁珠与阴性对照正常小鼠IgG或HuR抗体结合,将收集的磁珠复合物进行洗脱,然后提取免疫沉淀RNA,并用qRT-PCR检测DLEU2水平,具体操作根据免疫沉淀试剂盒制造商说明书进行。
1.11统计学分析 采用SPSS22.0软件进行方差分析、Student-t检验。
2 结 果
2.1食管鳞癌组织和细胞系HuR与DLEU2表达水平 与癌旁组织或正常人食管鳞状上皮细胞Het-1A相比,食管鳞癌组织和细胞系KYSE30、KYSE70、KYSE270中HuR mRNA和蛋白表达及DLEU2水平均明显升高(P<0.05),见图1、表1。由于KYSE30细胞中HuR mRNA和蛋白表达及DLEU2水平最高,故选择KYSE30细胞进行后续实验。
2.2HuR对KYSE30细胞增殖的影响 与对照组和pcDNA组比较,pc-HuR组KYSE30细胞中HuR蛋白表达明显增加,48、72 h细胞活性明显增强,克隆形成率显著提高(P<0.05);与对照组和sh-NC组比较,sh-HuR组KYSE30细胞中HuR蛋白表达明显减少,48、72 h细胞活性明显减弱,克隆形成率显著下降(P<0.05),见图1、表2。
2.3HuR对KYSE30细胞侵袭的影响 pc-HuR组KYSE30细胞侵袭数明显较pcDNA组多(P<0.05);而sh-HuR组KYSE30细胞侵袭数明显比sh-NC组少(P<0.05),pcDNA组、sh-NC组与对照组细胞侵袭数差异不显著(P>0.05),见表2、图2。
2.4HuR对裸鼠皮下移植瘤生长的影响 与对照组和pcDNA组比较,pc-HuR组14、21、28 d肿瘤体积明显增加,肿瘤重量显著升高(P<0.05);与对照组和sh-NC组比较,sh-HuR组14、21、28 d的肿瘤体积明显减小,肿瘤重量显著降低(P<0.05),见表3。
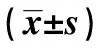
表1 食管鳞癌组织和细胞中HuR mRNA和蛋白质DLEU2表达水平比较
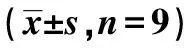
表2 HuR对KYSE30细胞增殖、侵袭的影响

图2 HuR对KYSE30细胞侵袭的影响(结晶紫染色,×200)

表3 HuR对裸鼠皮下移植瘤生长的影响
2.5HuR与DLEU2的相互作用关系 在KYSE30细胞中,HuR组DLEU2水平(6.54±1.16)明显高于IgG组(0.23±0.02;t=13.322,P<0.05)。
2.6HuR通过调控DLEU2对KYSE30细胞增殖、侵袭的影响 与sh-HuR+si-NC组相比,sh-HuR+si-DLEU2组KYSE30细胞中DLEU2水平明显降低,48、72 h细胞活性显著下降,克隆形成率明显降低,细胞侵袭数也明显变少(P<0.05);与sh-HuR组相比,sh-HuR+si-NC组KYSE30细胞中DLEU2水平、8、72 h的细胞活性与克隆形成率、细胞侵袭数均无明显改变(P>0.05),见图3、表4。

图3 各组KYSE30细胞侵袭(结晶紫染色,×200)
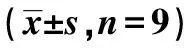
表4 HuR通过调控DLEU2对KYSE30细胞增殖、侵袭的影响
2.7HuR通过调控DLEU2对裸鼠皮下移植瘤生长的影响 与sh-HuR+si-NC组相比,sh-HuR+si-DLEU2组14、21、28 d的肿瘤体积明显减小,肿瘤重量明显下降(P<0.05);而sh-HuR组与sh-HuR+si-NC组以上指标无明显差异(P>0.05),见表5。

表5 HuR通过调控DLEU2对裸鼠皮下移植瘤生长的影响
3 讨 论
食管鳞癌属于消化道肿瘤,由于早期症状不明显和分子诊断标志物的缺乏,大部分患者发现时已到中晚期,可能错过最佳治疗时间,进而导致患者生存率下降。同时,癌细胞的易侵袭性和易转移性是引起食管鳞癌患者术后复发的主要原因,也是导致患者低生存率的重要原因〔8〕。因此,明确食管鳞癌发病机制并寻找有效的治疗靶点对食管鳞癌患者5年生存率的提高来说意义重大。
HuR是ELAV家族的成员之一,在多种细胞中均有表达,通过与靶基因mRNA的3'UTR端的ARE元件结合来稳定靶mRNA,进而调节细胞的生物学行为〔9〕。在结直肠癌〔10〕中,HuR通过与细胞分裂周期(CDC)6 3'-UTR结合上调CDC6,进而促进结直肠癌细胞增殖和体内异种移植瘤的生长及对奥沙利铂的耐药性。在卵巢癌〔11〕中,HuR和线粒体内膜转位酶(TIMM)44均上调表达,且HuR通过调控TIMM44 mRNA的稳定性促进其细胞增殖。在肝癌〔12〕中,沉默HuR表达能够抑制SMMC-7721细胞的增殖、侵袭和迁移,其机制与调控Bcl-2表达有关。此外,经HuR稳定后的致癌基因SEMA4D对食管鳞癌的增殖和迁移有促进作用,对细胞凋亡有抑制作用〔13〕。以上研究均显示,HuR作为促癌基因在肿瘤细胞中发挥作用,但是其在食管鳞癌中的研究极少,其发展机制也不甚清楚。本研究结果与Xu等〔6〕结果一致,提示HuR与食管鳞癌的进展有关。因为HuR在KYSE30细胞中表达水平最高,所以选择KYSE30细胞进行转染实验。文献〔14〕显示,细胞的异常增殖和侵袭是肿瘤发生发展的基础。本研究发现,过表达HuR可明显降低KYSE30细胞活性,降低克隆形成率和细胞侵袭数;而抑制HuR表达可显著提高KYSE30细胞活性,增加克隆形成率和细胞侵袭数,揭示HuR促进食管鳞癌的增殖和侵袭,其可能是食管鳞癌的分子标志物。而且,体内实验进一步说明,HuR在体内也能促进食管鳞癌细胞的生长。然而,HuR如何促进食管鳞癌细胞的增殖、侵袭还需进一步研究。
starbase在线软件预测结果显示,HuR可与DLEU2的3'-UTR端结合。DLEU2位于染色体13q14.3~14.4,参与多种肿瘤的发展过程〔15〕。据报道〔16〕,DLEU2在非小细胞肺癌组织和细胞中均高表达,其沉默后可通过调控miR-30c-5p/性别决定区Y框转录因子(SOX)9轴显著抑制A549细胞进展。He等〔17〕发现,DLEU2在宫颈癌组织中上调表达,能够通过抑制p53表达对宫颈癌细胞增殖和细胞周期起促进作用。Liu等〔18〕研究显示,骨肉瘤组织和细胞中DLEU2水平明显升高,其敲除后可通过海绵吸收miR-337-3p有效减弱细胞的增殖和迁移能力。本研究与Lu等〔7〕研究一致,提示DLEU2可能是食管鳞癌的分子标志物。另外,RIP实验结果说明,HuR在食管鳞癌细胞中能与DLEU2相互作用,而且HuR与DLEU2共同作用不仅在体外促进食管鳞癌细胞的增殖和侵袭,还在体内促进肿瘤生长。
综上,HuR可稳定DLEU2表达,进而促进食管鳞癌细胞的增殖、侵袭和移植瘤的体内生长。
