柚皮素激活SHH-GLI1信号通路对OGD/R诱导的神经元损伤的影响
2024-02-22单萍张继龙
单萍 张继龙
(武汉市第一医院 1神经内科,湖北 武汉 430022;2急诊科)
脑血管病是导致中国居民残疾和死亡的重要原因,其中81.9%为缺血性脑卒中〔1〕。由于高血压的持续高流行和人口老龄化,我国脑卒中发病率和死亡率均处于较高水平〔2〕。因此,了解脑缺血后神经损伤的机制,有利于寻找药物促进神经功能恢复。缺血发生时,神经元首先丧失氧气和营养物质的供应,随后发生氧化应激、兴奋性毒性和细胞凋亡等多重损伤,最终引起大脑结构损伤和功能障碍〔3,4〕。研究〔5〕显示,氧化应激为脑缺血和再灌注的关键有害因素,减轻氧化应激可抑制神经元凋亡。陈皮、枳实为常用理气中药,为中医治疗“中风”“胸痹”的共用药物〔6〕。柚皮素(NAR)为陈皮、枳实的主要活性成分,具有较强的抗神经元凋亡和抗氧化能力〔7〕。Salman等〔8〕指出,NAR可增加纹状体单胺氧化酶活性,抑制星形胶质细胞活化,减弱神经元凋亡,减轻3-硝基丙酸诱导的大鼠神经损伤。声波刺猬(SHH)-胶质瘤相关癌基因同源物(GLI)1通路为中枢神经系统发育的调节者,SHH与其受体Patched(Ptch)结合后会激活GLI,启动包括脑源性神经营养因子(BDNF)、c-AMP反应元件结合蛋白(CREB)等多种靶基因的表达,调节细胞(神经元等)的存活和分化〔9,10〕。然而NAR对SHH-GLI1通路的作用仍待探讨。因此,本研究以氧糖剥夺/复氧复糖(OGD/R)诱导神经元模拟脑缺血所致神经元损伤,基于SHH-GLI1通路探讨NAR对神经元凋亡的调控作用,以期为缺血性脑卒中的新药开发提供理论参考。
1 材料与方法
1.1细胞 大鼠皮层神经元及专用培养基(武汉普诺赛公司)。
1.2材料及仪器 NAR(≥98%纯度,美国Sigma公司);环巴胺(美国MCE公司);活性氧(ROS)试剂盒(DCFH-DA,上海碧云天公司);丙二醛(MDA)试剂盒、8-羟脱氧鸟苷(OHdG)试剂盒、CCK-8试剂盒(上海生工公司);TUNEL试剂盒、SHH、CREB、Ptch1、磷酸甘油醛脱氢酶(GAPDH)抗体、羊抗兔二抗及4′,6-二脒基-2-苯基吲哚(DAPI)试剂(美国CST公司);BDNF、GLI1(JF09-08标记)抗体(美国Thermo公司);细胞培养箱(日本PHCbi公司);荧光显微镜(日本Olympus公司);移液器(德国Eppendorf公司);酶标仪、流式细胞仪、低温离心机(美国Thermo公司)。
1.3细胞培养和分组 大鼠皮层神经元接种在专用培养基中,置于恒温培养箱(37 ℃、5%CO2)中复苏培养,取对数期神经元随机分组。(1)正常组:将神经元在37 ℃、5%CO2和95%空气下在专用培养基中培养30 h;(2)OGD/R组:将神经元在37 ℃、5%CO2和95%氮气下在无葡萄糖DMEM培养基培养6 h以实现OGD,随后立即换为专用培养基在37 ℃、5%CO2和95%空气下培养24 h以实现复氧复糖〔11〕;(3)NAR组:将神经元在37 ℃、5%CO2和95%氮气下在无葡萄糖DMEM培养基培养6 h,随后立即换为含40 mg/L NAR的专用培养基在37 ℃、5%CO2和95%空气下培养24 h;(4)NAR+环巴胺组:将神经元在37 ℃、5%CO2和95%氮气下在无葡萄糖DMEM培养基培养6 h,随后立即换为含40 mg/L NAR和46 nmol/L环巴胺的专用培养基在37 ℃、5%CO2和95%空气下培养24 h。收集神经元检测。
1.4神经元活性检测 取对数期神经元接种于96孔板(每孔接种5×103个),进行如下处理。(1)分别使用含0.0、2.5、5.0、10.0、20.0、40.0、80.0、160.0、320.0 mg/L的NAR专用培养基处理神经元24 h,每孔加入10 ml CCK-8检测液培养2 h,读取450 nm下光密度(OD)值,计算神经元活力,筛选NAR对神经元无毒的剂量进行实验。(2)在进行OGD/R诱导后,分别使用含0.0、2.5、5.0、10.0、20.0、40.0 mg/L NAR的专用培养基处理24 h,CCK-8法检测并计算神经元活力,筛选NAR抑制OGD/R诱导神经元损伤的最佳作用浓度。
1.5神经元ROS、8-OHdG、MDA水平检测 按照1.3中分组培养神经元后,更换为含10 mmol/L DCFH-DA的无血清培养基,继续常规培养25 min,离心收集管底神经元,加入上样缓冲液悬浮并计数,调整神经元悬液密度为1×106个/ml,上流式细胞仪分析ROS含量。收集1.3中分组培养的神经元,加入裂解液,在冰盒中裂解10 min,离心收集上清,转移200 ml上清至新EP管中,加入MDA检测液(体积比1∶3),盖紧煮沸60 min,冰浴冷却后离心取上清,测定530 nm处OD值,计算MDA水平。另外,将预包被酶标板置于48孔板中,加入50 ml神经元裂解液上清和50 ml 8-OHdG抗体工作液,封板后孵育45 min;加入100 ml辣根过氧化物酶(HRP)标记链霉素工作液,封板后孵育30 min;加入90 ml显色液避光孵育15 min,终止反应,测定450 nm处OD值,计算8-OHdG水平。
1.6神经元凋亡率检测 按照1.3中分组培养神经元后,按每孔1×104个细胞接种至96孔板,每孔加入50 ml预先配制好的TUNEL检测液,孵育40 min后移去TUNEL检测液;每孔加入100 ml反应缓冲液;加入DAPI染核后每孔加入100 ml 4%多聚甲醛固定20 min。荧光显微镜下检测绿色荧光强度并拍照。
1.7SHH-GLI1通路及BDNF、CREB蛋白检测 收集1.3中各组神经元,在冰上用RIPA裂解液裂解50 min,提取总蛋白。立即测定其浓度并调整至浓度一致。蛋白样品在100 ℃水浴锅中变性10 min,取30 mg上样、电泳分离、转移至聚偏氟乙烯膜,膜依次在5 g/L脱脂奶粉中封闭1 h,在一抗(SHH、GLI1、Ptch1、BDNF、CREB、GAPDH,稀释1∶500或1∶1 000)中作用过夜,在HRP二抗(稀释1∶2 000)中作用1 h,化学发光液显影并拍照。分析蛋白灰度值。
1.8免疫荧光染色 按照1.3中分组培养神经元,待神经元爬片后取出玻片,置于磷酸盐缓冲液(PBS)中浸洗,转移至4%多聚甲醛中固定,滴加山羊血清封闭,滴加荧光标记的GLI1抗体(稀释1∶100)孵育过夜,滴加DAPI复染45 min,封片,荧光显微镜下分析红色荧光强度并拍照。
1.9统计学分析 采用SPSS25软件和GraphPad8.0进行方差分析和SNK-q检验。
2 结 果
2.1筛选NAR的作用浓度 经计算,NAR半抑制浓度(IC50)为167.0 mg/L,与0.0 mg/L NAR〔(100.00±8.96)%〕比较,2.5、5.0、10.0、20.0、40.0 mg/L NAR神经元活力〔(99.68±7.36)%、(98.79±7.12)%、(100.16±6.97)%、(98.98±6.35)%、(96.43±5.16)%〕无统计学差异(P>0.05),80、160、320 mg/L NAR显著抑制神经元活力〔(74.68±9.02)%、(43.25±3.41)%、(36.12±2.33)%,P<0.05〕。表明40 mg/L NAR对神经元无毒。
2.2筛选NAR抑制OGD/R诱导神经元损伤的最佳作用浓度 单纯OGD/R诱导的神经元活力〔(49.73±5.14)%〕显著低于未经OGD/R诱导的神经元〔(100.13±7.65)%,P<0.05〕。与单纯OGD/R诱导后比较,联合5、10、20、40 mg/L NAR〔(58.71±5.08)%、(62.83±5.46)%、(72.35±5.41)%、(81.49±6.50)%〕均可显著提高神经元细胞活力(P<0.05)。后续实验均采用效果最好的40 mg/L NAR进行。
2.3NAR改善OGD/R诱导的神经元氧化损伤 相较于正常组,OGD/R组神经元中ROS相对荧光强度、8-OHdG、MDA水平显著增加(P<0.05);相较于OGD/R组,NAR组神经元中ROS相对荧光强度、8-OHdG、MDA水平显著降低(P<0.05);相较于NAR组,NAR+环巴胺组神经元中ROS相对荧光强度、8-OHdG、MDA水平显著增加(P<0.05)。见表1。
表1 各组ROS相对荧光强度、8-OHdG、MDA比较
2.4NAR减轻OGD/R诱导的神经元凋亡 TUNEL结果显示,正常组神经元细胞核呈规则圆形;OGD/R组部分神经元细胞核皱缩、破碎;NAR组神经元细胞核趋于规则;NAR+环巴胺组细胞核皱缩、破碎的神经元增多。与正常组〔(6.80±0.52)个/视野〕比较,OGD/R组TUNEL+神经元数量〔(35.33±4.27)个/视野〕显著增加(P<0.05);与OGD/R组比较,NAR组TUNEL+神经元数量〔(11.60±0.46)个/视野〕显著减少(P<0.05);与NAR组比较,NAR+环巴胺组TUNEL+神经元数量〔(24.80±3.91)个/视野〕显著增加(P<0.05),见图1。

图1 各组神经元凋亡(TUNEL染色,×200)
2.5NAR促进GLI1核转位并上调BDNF、CREB表达 相较于正常组,OGD/R组神经元中BDNF、CREB蛋白及核/质GLI1水平明显升高(P<0.05);相较于OGD/R组,NAR组神经元中BDNF、CREB蛋白及核/质GLI1水平明显升高(P<0.05);相较于NAR组,NAR+环巴胺组神经元中BDNF、CREB蛋白及核/质GLI1水平明显降低(P<0.05),见表2、图2。
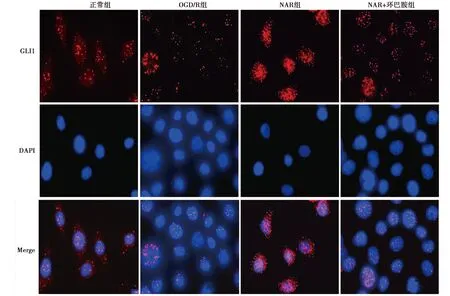
图2 各组GLI1核转位观察(免疫荧光染色,×1 000)
2.6NAR上调SHH-GLI1通路蛋白表达 相较于正常组,OGD/R组神经元中SHH、GLI1、Ptch1蛋白水平明显升高(P<0.05);相较于OGD/R组,NAR组神经元中SHH、GLI1、Ptch1蛋白明显升高(P<0.05);相较于NAR组,NAR+环巴胺组神经元中SHH、GLI1、Ptch1蛋白无明显变化(P>0.05),见表2、图3。
表2 各组SHH-GLH1通路蛋白及BDNF、CREB蛋白及核/质GLI1水平比较

1~4:正常组、OGD/R组、NAR组、NAR+环巴胺组图3 Western印迹检测各组SHH-GLI1通路蛋白及BDNF、CREB蛋白水平
3 讨 论
近年,缺血性脑卒中仍然是导致残疾和死亡的重点脑血管病,其所造成的中国乃至全球负担均呈增加趋势〔2,12〕。缺血脑区域产生的ROS可引起神经元损伤或凋亡,积极干预以减轻ROS造成的氧化损伤,逐渐有望成为挽救缺血性神经损伤的保护策略〔13〕。本研究证实了NAR的神经元保护作用。筛选中药材的有效活性成分,并对其生物活性进行证明,有利于提高中药认可度,扩大中药的使用范围。作为陈皮、枳实等重要的活性成分,NAR抗氧化活性受到广泛关注。Li等〔14〕研究表明,NAR可激活腺苷酸活化蛋白激酶(AMPK)α/沉默信息调节因子(Sirt)1信号通路,增加ROS清除,发挥保护内皮损伤的作用。Xu等〔15〕研究显示,NAR对缺血/再灌注心肌的氧化应激和铁死亡有明显抑制效果,可以激活核因子相关因子2抗氧化轴,并抑制铁沉积。与Olugbemide等〔16〕研究一致,本研究也证实,NAR可降低ROS、8-OHdG、MDA水平,减轻氧化损伤,表明NAR可减轻OGD/R诱导神经元氧化损伤。
氧化应激是脑缺血神经损伤的关键病理变化,由ROS产生、升高引起,ROS会对细胞的所有成分(包括蛋白质、脂质和DNA)造成损害〔17〕。氧化性DNA或脂质等损伤可触发多种促死亡信号,进而诱导神经细胞凋亡并危及脑卒中后功能损伤〔18〕。已有研究〔19〕发现,NAR可减轻脑缺血再灌注引起的皮层组织DNA损伤。本研究表明,NAR可以减轻OGD/R诱导的因氧化剂水平增多而发生的损伤。
SHH-GLI1通路参与调节神经存活、再生和分化,在缺血/缺氧的早期,神经元中的SHH、GLI1、Ptch1蛋白表达上调,是机体启动的创伤后自保护机制〔20〕。另外,抑制SHH-GLI1通路可加剧大鼠的缺血性损伤,可能与GLI1、Ptch表达下调相关;激活SHH-GLI1通路则可保护神经元,减轻神经胶质增生,恢复新生大鼠缺血性神经功能缺损〔21〕。本文提示,SHH信号通路为缺血性脑卒中的治疗靶点。本研究说明,NAR对神经元氧化损伤和凋亡的保护作用是通过激活SHH-GLI1通路,促进BDNF、CREB的表达实现的。SHH-GLI信号的激活也可通过保护神经血管单元〔22〕、减轻神经炎症〔23〕等发挥神经保护作用,提示NAR还可能具有保护神经血管单元、减轻神经炎症的功效,这些均有待研究。
