基于酪蛋白寡肽的W1/O/W2 双重乳液体系构建及体外模拟消化特性研究
2024-02-21姚萍王筠钠张书文逄晓阳于景华吕加平
姚萍,王筠钠,张书文,逄晓阳,于景华,吕加平*
(1. 天津科技大学食品科学与工程学院,天津 300457;2. 中国农业科学院农产品加工研究所,北京 100193)
0 引 言
在乳液包封过程中,单一乳液通常是不稳定的,对水溶性化合物的封装能力有限。然而,双重或多重乳液可以封装亲水和疏水化合物,其中分散相液滴可包含一种或多种更小的分散液滴[1]。双重乳液包括水包油包水(W/O/W)和油包水包油(O/W/O)2 种包封类型和2 种类型的界面(一级和二级界面)。乳液的稳定通常与亲油/亲水乳化剂有关,亲油乳化剂可以稳定水/油界面的初级相,进一步稳定二级界面的油/水相[2]。W/O/W 是多室液体分散体系,较小的水滴分散在油相(W1/O)中,油相进一步分散在外部水相(W2)中,简称为W1/O/W2[3]。双重乳液体系在食品中应用广泛,如活性成分的微胶囊化、强化、聚合物囊体的制造和具有改善感官特性的低热量食品的开发等[4]。生物活性肽功能丰富,但是五肽及以上的小肽在酸性、富含蛋白酶的胃肠道环境中极易被降解,双重乳液技术在保护小肽的同时,达到在胃肠道中受控释放,从而提高它们的生物利用率[5]。蛋白质降解过程中,肽的疏水性氨基酸及苦味氨基酸暴露,致使短链肽苦味增加,双乳化技术可以很好地掩蔽苦味。应欣等[6]采用双重乳液体系技术将大豆苦味低聚肽包封起来,结果显示,双乳化技术显著地降低大豆低聚肽的苦味。
体外模拟消化是在体外环境下,模拟人体口腔、胃肠阶段的生理环境,探究食品营养、活性物质及药物等的吸收利用机制。国际INFOGEST 合作组织提出模拟体外消化方案标准化了电解质、酶和胆汁浓度、稀释系数、pH 和消化时间等参数[7]。与动物实验相比,体外模拟消化实验具有操作简便,实验便于控制,成本低及重现性高等优点,已被广泛应用于食品或药品吸收利用特性的影响研究[8]。MAGOUZ O 等[9]通过模拟体外消化发酵乳酪表明,在消化过程中血管紧张素转换酶(ACE) 抑制活性、自由基清除、铁还原显著增加,表明胃肠道消化促进了发酵酪乳肽的生物活性。
活性肽是蛋白经酶法水解、化学法水解或微生物发酵后,大分子蛋白质被分解成分子量较小的肽段,进一步与蛋白分离纯化后得到的肽混合物[10]。由10 个以上氨基酸残基组成的肽被称为多肽,含10 个及以下氨基酸残基的肽称为寡肽或短肽[11]。乳源生物活性肽(BAPs)是指乳中蛋白质肽链上的某些片段,这些片段在前体蛋白质序列中不具备活性,当被蛋白水解酶作用释放时,它们可与特定受体相互作用发挥生理功能[12]。活性寡肽在胃肠道酶的作用下可能会被进一步分解而降低其生理活性,为解决这一问题,可以利用油水界面性质制备双乳液包封缓释体系,双乳液体系还可以掩盖小肽不好的感官风味,如苦味等。目前,国内对双重乳液体系应用于乳源性蛋白肽的研究较少。
目前,双重乳液的制备方式主要采用两步乳化法。在此过程中使用高速均质器和分散器等乳化设备来产生初级乳液。第一步使用均质有效降低乳液的粒径,易于双乳体的制备。第二步乳化条件非常重要,处理条件不宜过度剧烈,也不宜过度温和。过度剧烈的处理条件造成液滴破裂,包封物质溶出;过度温和条件会致使乳液体系分散不均匀,降低乳液稳定性。因此,本实验探究不同均质压力(25、60 MPa)下双乳体系的稳定性,并模拟体外消化,研究体系稳定性、微观结构、缓释过程等,为高活性、高浓度乳源性寡肽的开发利用提供理论指导和技术支持。
1 材料与方法
1.1 材料与试剂
酪蛋白寡肽,本实验室自制;胃蛋白酶(≥250 U/mg)、胰脂肪酶(≥125 U/mg),Sigma 公司;其他化学试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
K9840 半自动微量凯氏定氮仪,济南海能仪器股份有限公司;自动电位滴定仪,上海禾工科学仪器;磁力恒温水浴搅拌锅,常州金坛良友仪器公司;PHSJ-3F型pH 计,上海雷磁;光学显微镜,北京悦昌行科技有限公司;共聚焦激光扫描显微镜,德国徕卡Leica 微系统有限公司;均质机,德国APV 公司;高压微射流均质机,安拓思纳米技术有限公司;Mastersizer Malvern Zetasizer Nano ZSE 纳米粒度电位仪,英国马尔文公司;Turbiscan 稳定性分析仪,法国Formulaction 公司。
1.3 实验方法
1.3.1 双乳液体系的构建
40% (m/m)酪蛋白寡肽溶液作为内水相(W1),8%(W/W)磷脂溶解在MCT 油中作为油相,在55 ℃水浴磁力搅拌条件下,将W1∶O 按3∶7 (W/W)混合,混合液用高压均质机(均质压力25 MPa)均质3 次,获得W1/O 乳液。将抗性糊精和磷酸酯双淀粉按4∶1 (W/W)比例混合后在85 ℃下磁力搅拌溶解15 min,使其完全糊化。此溶液作为外水相(W2),W2溶液的固形物含量小于15%。将W1/O 乳液缓慢加入到W2中,采用高压均质机(均质压力25 MPa)均质3 次获得双重乳液体系。
1.3.2 不同均质条件对W1/O/W2乳液的影响
将W1/O 乳液与外水相相混合,采用以下2 种不同的均质方式制备W1/O/W2乳液:①采用均质压力25 MPa 均质3 次;②均质机均质3 次后再使用高压微射流(60 MPa)均质3 次。
1.3.3 W1/O/W2乳液体系性质测定
1.3.3.1 W1/O/W2乳液包埋率的测定
乳液中的包埋率采用内水相中含氮量与整个乳体系中的含氮量的比值表征。用超纯水稀释W1/O/W2乳液后,在4 ℃,5 000 r/min 下离心30 min,收集水层后在4 ℃,12 000 r/min 下离心15 min,收集水层并用0.45 μm 滤膜过滤去除油滴。含氮量采用凯氏定氮法测定。W1/O/W2乳液中酪蛋白寡肽的包埋率按下式计算:
式中:M为W1相中含氮量,Mf为离心后释放在外水相中的含氮量。
1.3.3.2 W1/O/W2乳液粒径的测定
采用纳米粒度电位仪测定W1/O/W2乳液的粒径大小和粒度分布。液滴的平均粒径由体积加权平均直径(D43)和表面加权平均直径(Sauter 直径)(D32)来表征,其定义公式如下:
式中:ni为直径,di为液滴的数量。
1.3.3.3 W1/O/W2乳液显微镜观察
将乳液稀释至透明状,滴在载玻片上后盖上盖玻片,先在低倍镜(10 倍)下找到视野,换成高倍油镜(100 倍)观察乳液微观结构。
1.3.3.4 W1/O/W2乳液流变特性的测定
采用TA 流变仪测定乳液的表观黏度,样品在测定前均质2 min。剪切速率范围每秒0.1~500.0。
1.3.3.5 W1/O/W2乳液稳定性的测定
采用Turbiscan 稳定性分析仪测定乳液的物理稳定性。取20 mL 样品于样品瓶中,温度设定为25 ℃,每1 h 扫描一次,扫描24 h,记录稳定性指数(TSI)及背散射光强变化(ΔBS)图谱。
1.3.4 体外消化模拟
1.3.4.1 消化液的制备
胃液消化液(SGF)和肠道消化液(SIF)配置成分参照BRODKORB A[7]等研究。
1.3.4.2 模拟胃肠道消化阶段
将SGF 提前置于37 ℃下预热,取新鲜乳液与SGF 按1∶1 混合,将混合体系的pH 调至3.0,添加胃蛋白酶(2 000 U/mL),再将混合体系置于37 ℃下恒温振摇2 h,按1∶1 加入已预热的SIF 液和胆盐溶液,调整体系pH 为7.0,添加胰酶(100 U/mL),将混合体系置于37 ℃下恒温振摇2 h,在肠消化过程中用0.1 mol/L NaOH 调整体系使其pH 始终保持7.0。
1.3.5 体外消化产物表征
1.3.5.1 消化过程中粒径和Zeta 电位的测定
粒径测定方法同1.3.3.2;Zeta 电位测定选用DTS1060 弯曲式毛细管样品池测量。
1.3.5.2 微观结构观察
胃、肠阶段的消化产物微观结构采用激光扫描共聚焦显微镜观察,先在10 倍镜下找到视野,后采用63倍油镜观看。采用0.1 g/L 尼罗河红染色乳液中的脂质,激发波长λ=543 nm,扫描范围560~620 nm,乳液中蛋白质用1 g/L 固绿染色,激发波长λ=633 nm,扫描范围655~755 nm。
1.3.5.3 酪蛋白寡肽的保留率测定
乳液中的包埋率采用内水相中含氮量与整个乳体系中的含氮量的比值表征。用超纯水稀释W1/O/W2乳液后,在4 ℃,5 000 r/min 下离心30 min,收集水层后在4 ℃,12 000 r/min 下离心15 min,收集水层并用0.45 μm 滤膜过滤去除油滴。含氮量采用凯氏定氮法测定。W1/O/W2乳液中酪蛋白寡肽的包埋率按下式计算:
式中M为W1相中含氮量,Mf为离心后释放在外水相中的含氮量。
1.3.5.4 游离脂肪酸释放率测定
采用pH-stat 法[13]。在模拟小肠消化阶段,向体系中加入0.1 mol/L NaOH 调整体系使其pH 始终保持7.0,记录耗碱量,释放的游离脂肪酸(FAA)可由以下公式计算:
式中:VNaOH为消耗NaOH 的体积(mL);
CNaOH为消耗NaOH 的浓度;
Moil为油的平均分子质量(g/mol),
MCT 油521g/mol;
Woil为消化样品中油的分子质量(g/mol)。
2 结果与分析
2.1 乳化条件对W1/O/W2 乳液的影响
2.1.1 乳化条件对W1/O/W2乳液粒径的影响
乳液的粒径在一定程度上可以表征其稳定性,通常乳液粒径越小越稳定。如图1 所示均质压力对乳液的粒径影响显著。在25 MPa 压力下均质5 次得到的乳液平均粒径为(715±7.2)nm,经高压微射流均质处理后乳液平均粒径显著降低(571.5±7.3)nm。25 MPa压力均质的乳液包封率为95.5%,60 MPa 高压微射流均质处理后包封率为92.3%,而过高的均质压力会导致第二步乳化过程中液滴破裂,降低包封率。高压微射流均质的乳液粒径呈单峰状,25 MPa 均质的乳液峰略有波动,这可能是因为未包封的物质分散在乳液体系中,与经历较高压力后连续破裂的液滴均匀性不一致[14]。

图1 不同均质压力对W1/O/W2 乳液粒径的影响
2.1.2 乳化条件对W1/O/W2乳液微观结构的影响
使用光学显微镜观察了不同均质压力下2 种乳液的形态。图2(a)是25 MPa 压力均质处理乳液,其液滴大小均匀性不如高压微射流均质处理样。如图2(b)所示,随着均质压力的增大,大液滴几乎都消失了,将25 MPa 均质样的显微镜图片放大可以清楚地看到其呈“圈套圈”状态。由此可知,由光学显微镜图像清晰呈现了双重乳液的微观形貌。

图2 不同均质压力下W1/O/W2 乳液的微观结构
2.1.3 乳化条件对W1/O/W2乳液流变学特性的影响
双重乳液的流变行为可以表征系统稳定性[15]。流体可分为剪切稀化(假塑性)流体(0<n<1)和剪切黏稠(扩张性)流体(n>1)。随着剪切速率的增加,乳化液滴开始拉长,导致体系的黏度下降,这是非牛顿流体的特征[16]。图3 中2 种加工方式下乳液的表观黏度在低剪切速率下都较高,随着剪切速率的增加呈下降趋势。25 MPa 均质乳液表现出更低的黏度,一般来说,较小的乳液颗粒尺寸会导致较低的黏度和较高的n值,乳液的剪切稀化特性较强[17]。黏度会影响双重乳液的相分离速率和稳定性,这些发现与FELIX M 等[18]的研究结果一致。
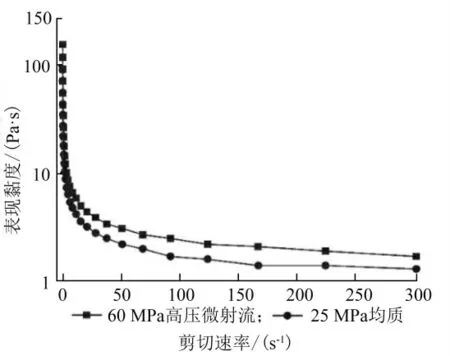
图3 不同均质压力对W1/O/W2 乳液流变特性的影响
2.1.4 乳化条件对W1/O/W2乳液稳定性的影响
背散射光强的变化率可以反映乳液系统的稳定性,并有助于解释其不稳定性的机制。乳液越稳定,反向散射的变化越小,表明液滴的数量、尺寸分布和空间分布随着时间的推移保持不变[19]。图4(a)、(b)显示出了24 h 内2 种均质压力下双重乳液的反向散射曲线。从左侧到右侧的曲线的水平轴分别代表样品池的底部和顶部。对于2 种双重乳液,样品池底部的后向散射强度均低于顶部,这可能导致双重乳液的乳状液分层。但均未观察到明显的分层现象。
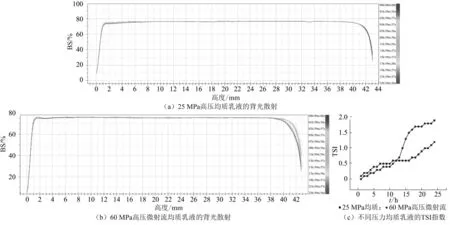
图4 不同均质压力对W1/O/W2 乳液稳定性的影响
乳液稳定性也可以通过Turbiscan 稳定性指数(TSI)来表征[20],它描述了多种不稳定现象对光强度的综合影响。一般来说,TSI 值越高,体系越不稳定[21]。双重乳液在24 h 内的TSI 数据如图4(c)所示。可以看出,在中后期,二者TSI 指数差异较大,相较高压微射流均质乳液,25 MPa 双乳体系更为稳定。这一结果与粒径测量和微观结构观察的结果相悖,乳液的过度加工可能由于表面积的增加而引起再聚结,从而有利于多分散性,可能导致最终的乳液稳定性较差[22]。
2.2 体外模拟消化产物的表征
2.2.1 体外模拟消化过程对乳液粒径和Zeta 电位的影响
由于60 MPa 压力高压微射流均质处理后的双重乳液体系稳定性较差,在后续实验中使用25 MPa 高压均质处理的W1/O/W2乳液,模拟乳液在胃肠道中的形态变化及释放特征。因乳液在口腔中停留时间较短,故本实验主要针对胃阶段和小肠阶段展开模拟。
当双乳液通过胃相时,初始平均粒径较大,如图5(a)所示。粒径增大的原因可能是由于酶和pH 值的作用导致界面上静电相互作用的变化而引起的聚集[23]。胃消化阶段40 min 后粒径变化不显著,外层水相的亲水性乳化剂是抗性糊精和磷酸酯双淀粉,二者因其耐酸,耐剪切力等特性,在pH 较低的胃液环境下仍可保持W1/O/W2乳液的特殊结构。然而,在肠道阶段,W1/O/W2乳液的大小呈先降后增的趋势,在肠阶段60 min 粒径最小(423 nm),表明酪蛋白寡肽从内部水相中释放出来。释放的机制可能是2 种现象的共同作用,一是外部环境中盐的存在引起了跨膜渗透压的变化;二是酶的存在和pH 值的变化导致了内部水相和油相的凝聚。淀粉酶作用后暴露油膜,脂肪酶进一步作用释放寡肽。

图5 体外模拟消化过程中平均粒径和Zeta 电位变化
Zeta 电位是表征胶体体系稳定性的重要参数,Zeta 电位代表运动颗粒滑动表面的电动势[24]。胃消化前期双重乳液的Zeta 电位变化没有明显差异(P>0.05),在胃阶段80 min 时Zeta 为-29.55 mV,如图5(b)所示。肠消化20 min 后,乳液的Zeta 电位值呈下降趋势,肠消化80 min 时Zeta 电绝位对值最大。通常,绝对值Zeta 电势值越高,代表体系越稳定。Zeta 电位受pH 值和体系中乳化剂类型的影响较大。由于双重乳液中pH 值的轻微变化,随着乳化剂浓度的增加,pH值降低。Zeta 电位作为强静电斥力反映了双乳液的稳定性。负电势值导致颗粒之间的排斥相互作用,从而防止聚集,为体系提供良好的物理和生物化学稳定性。要求电势的绝对值大于30 mV,以防止液滴聚集,这被称为静电稳定[25]。
2.2.2 体外模拟消化过程对乳液微观结构的影响
CLSM 结果可以直观地观察到乳化稳定剂在双乳化体系中的分布状态。油相为尼罗红染色,在图像中显示为绿色(图中圆型区域);内水相为固绿染色,在图像中显示为红色(图中方型区域),如图6 所示。这些图像清楚地表明,较大的油滴(绿色)包裹内水相(红色),边缘泛绿色芯呈黄色的球包球形态(图中三角区域)。本实验最外层水相为多糖类未被染色。在胃消化阶段,60 min 和120 min 的图像显示双重乳液液滴大小结构未发生变化,整个包封液滴呈黄色。在小肠阶段,由于脂肪酶的作用,油相层破裂,释放出更多的酪蛋白寡肽,游离在体系中。在肠阶段120 min 时观察到游离在体系中的酪蛋白寡肽明显增多,还有部分包埋形态完整的液滴。这一结果与酪蛋白寡肽的释放率相一致,说明双重复合乳液的释放主要发生在小肠阶段。这一结果与前人的研究相一致[26]。

图6 体外模拟消化过程中微观结构变化
2.2.3 体外模拟消化过程稳定性分析
在模拟人体胃肠阶段消化过程中,消化蛋白酶的作用可能会造成W1/O/W2乳液的包封结构破裂,将W1/O 相释放在体系中。在整个消化模拟过程中,乳液的寡肽释放率如图7 所示。经过2 h 胃消化,酪蛋白寡肽的保留率变化不显著,说明大部分寡肽仍以包封状态保留在W1/O/W2乳液,这一结果与粒径及微观结构的结果相一致。W1/O/W2乳液因其特殊的结构及外壁材,可以抵抗胃消化液中的胃蛋白酶的作用,从而保留较多的寡肽到小肠中进一步消化释放。在小肠消化阶段,由于脂肪酶的存在,寡肽的释放量显著增大,这是因为脂肪酶将油相的脂肪分子分解为游离脂肪酸和单酰基甘油,以释放内水相肽。小肠道阶段消化结束,酪蛋白寡肽的保留率为39.64%。为了解释双重乳液中酪蛋白寡肽的释放,将释放数据拟合到数学模型中,拟合结果显示一级动力学模型的相关系数最高(R2=0.934)。一级动力学将亲水化合物通过基质的释放速率描述为其浓度的函数[27],表明释放速率随着核心物质浓度的降低而降低,从而表明该双重乳液体系具有缓释性。
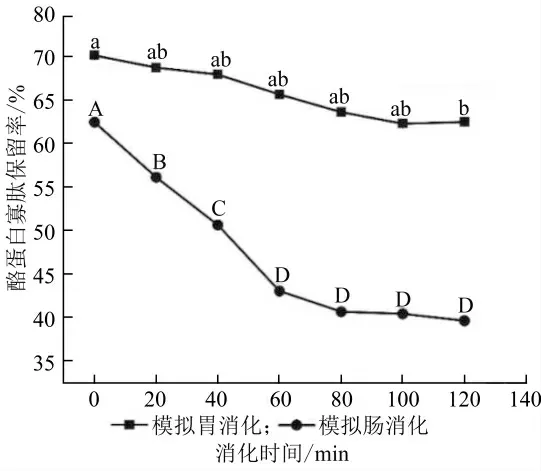
图7 体外模拟消化过程中酪蛋白寡肽的保留率
2.2.4 体外模拟消化过程中游离脂肪酸的释放
在模拟小肠消化过程中,脂肪酶将脂肪分解释放出甘油和游离脂肪酸(FFA)。图8 显示了模拟小肠阶段游离脂肪酸释放率的动力学曲线,在消化前期(<40 min),脂肪被迅速分解,生成游离脂肪酸,消化1 h 后,游离脂肪酸的释放速率减缓,消化末期,FFA 释放率为53.3%。有研究表明,中链脂肪酸的水相分散性比长链脂肪酸更高,在消化过程中能快速迁移到周边的水相中,不会影响界面处脂肪酶的作用。本实验中MCT 油为中链脂肪酸,而磷脂是长链脂肪酸,长链脂肪酸易积聚在油水界面,降低脂肪酶的酶解能力。实际上,人体能够调整肠道液体的组成,当摄入高浓度的脂质时,身体会增加小肠中脂肪酶和胆汁的浓度[28]。
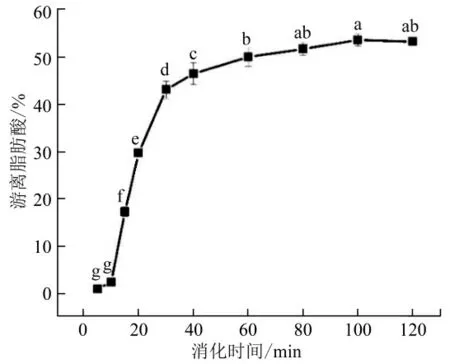
图8 体外模拟消化过程中游离脂肪酸释放率动力学曲线
采用4 种释放模型拟合分析游离脂肪酸的动力学释放曲线。零级模型显示物质释放是通过聚合物在界面上的溶解而实现的。本实验中零级方程的相关系数最差,R2=0.62。Higuchi 模型用于定义通过扩散机制的控制释放[27],本实验R2=0.78。Ritger-peppas 方程的相关系数为R2=0.87。一级方程模型与释放百分比数据吻合良好,一级方程Mt=57.09(1-e-0.03t),R2=0.89。因此表明酪蛋白寡肽的双重乳液是缓释体系。
3 讨论与结论
以酪蛋白寡肽混合物为芯材,制备W1/O/W2双重乳液体系,包封率达95.5%。构建乳液缓释体系时,选用营养较为丰富的磷脂做为亲脂性乳化剂制备外水相(W1/O),外水相W2选用磷酸酯双淀粉做亲水性乳化剂。结果表明,25 MPa 压力下乳液的稳定性较好。高压微射流使乳液体系分散更均匀,但同时导致内水相液滴的破损,降低包封率。通过体外模拟消化实验,表明双重乳液体系能够抵抗胃酶及较低的pH环境,酪蛋白寡肽的包封率保持在70%以上。在胰酶的作用下,W1/O/W2包封体系遭到破坏,随着消化进程,游离脂肪酸的释放量增加,酪蛋白寡肽的保留率降低,从而达到缓释目的。
