堇叶碎米荠低聚肽制备工艺优化及结构特征、氧化活性研究
2024-01-29问小龙向极钎李亚杰
问小龙 向极钎, 张 亮 李亚杰 龙 澜
(1. 恩施土家族苗族自治州农业科学院,湖北 恩施 445000;2. 湖北省富硒产业技术研究院,湖北 恩施 445000)
堇叶碎米荠(CardamineviolifoliaO. E. Schulz)别名野油菜,为十字花科一年或二年生草本植物,全草可作为野菜食用,也可作药用,具有清热祛湿的功能[1]。据《湖北恩施药用植物志》[2]记载,碎米荠性平,味淡,具有清热利湿的功效。2021年3月,国家卫健委批复堇叶碎米荠参照叶类蔬菜标准管理。
堇叶碎米荠中富含不饱和脂肪酸、硒蛋白、硒多糖、维生素、矿质元素等成分[3-5]。目前,关于堇叶碎米荠的研究大多集中在富硒栽培及硒耐受的机理、硒形态分析、营养成分、富硒蛋白和富硒多糖等大分子物质的功效评价等方面,吕昊[6]研究发现,堇叶碎米荠富硒蛋白具有缓解疲劳的作用;林樾[7]研究发现,堇叶碎米荠中的有机硒以硒代胱氨酸为主,并探究了富硒多肽对肝癌细胞的抑制作用及其机理。然而有关堇叶碎米荠中小分子活性成分低聚肽的系统研究尚未见报道。
研究拟以堇叶碎米荠蛋白为原料,优化酶解工艺制得堇叶碎米荠低聚肽粉末,分析检测该低聚肽的理化成分和氨基酸组成,利用相对分子质量分布、紫外全波长扫描、红外光谱和扫描电镜对其结构进行表征,并通过羟自由基清除能力等4种化学评价方法分析堇叶碎米荠低聚肽的抗氧化能力,以期为堇叶碎米荠功能食品的开发提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
堇叶碎米荠:经中科院昆明植物研究所鉴定为十字花科碎米荠属植物堇叶碎米荠,恩施州农科院;
氢氧化钠、无水乙醇、过硫酸钾、硫酸亚铁、双氧水等:分析纯,国药集团化学试剂有限公司;
水杨酸:分析纯,天津福晨化学试剂有限公司;
碱性蛋白酶(200 U/mg)、1,1-二苯基-2-三硝基苯肼:上海源叶生物科技有限公司;
2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸:上海阿拉丁生化科技股份有限公司;
抗氧化能力(FRAP法)试剂盒:苏州科铭生物技术有限公司。
1.1.2 主要仪器设备
分析天平:BS-124S型,德国Sartorius公司;
pH计:FE20K型,梅特勒—托利多科技(中国)有限公司;
离心机:TG16-WS型,湖南湘立科学仪器有限公司;
真空冷冻干燥机:S-18N型,宁波新芝生物科技股份公司;
凯氏定氮仪:K9840型,海能未来技术集团股份有限公司;
紫外可见光分光光度计:UV-1900型,日本岛津仪器有限公司;
全波长酶标仪:Spectra Max190型,美国Molecular Devices公司;
双道原子荧光光度计:AFS-9760型,北京海光仪器公司;
膜分离系统:HC-DG2540-3X型,成都和诚过滤技术有限公司;
扫描电镜:sigma3000型,德国蔡司公司;
傅里叶红外光谱仪:Nicolet IS20型,美国赛默飞公司;
高效液相色谱仪:1260型,美国安捷伦公司。
1.3 试验方法
1.3.1 堇叶碎米荠低聚肽的制备 堇叶碎米荠干粉经碱提、酸沉、脱盐、干燥后获取堇叶碎米荠蛋白,按质量分数4%称取一定量的堇叶碎米荠粗蛋白溶于蒸馏水中,升温至50 ℃,调节pH值为9,加入160 mg碱性蛋白酶,酶解2 h,酶解过程中使用氢氧化钠溶液保持pH值为9,直至酶解结束,95 ℃水浴10 min,离心,上清液依次通30,5,1 kDa的超滤膜,收集滤过液,减压浓缩后冷冻干燥,得到堇叶碎米荠低聚肽干粉。
(1) 单因素试验:固定堇叶碎米荠蛋白质量分数为4%、酶用量为5%,酶解温度为50 ℃、酶解时间2 h、pH 9,以水解度为指标,考察堇叶碎米荠蛋白质量分数(2%,3%,4%,5%,6%)、酶解温度(40,45,50,55,60 ℃)、酶用量(0%,3%,4%,5%,6%,7%)和pH值(7.5,8.0,8.5,9.0,9.5,10.0)对堇叶碎米荠蛋白酶解效果的影响。
(2) 正交试验:在单因素试验基础上,采用四因素三水平正交表 L9(34),以堇叶碎米荠蛋白水解度为测定指标,对酶解条件进行优化。
1.3.2 水解度测定 采用Ph-STAT法[8-10]。
1.3.3 成分分析
(1) 蛋白质:按GB 5009.5—2016执行。
(2) 水分:按GB 5009.3—2016执行。
(3) 硒含量:按GB 5009.93—2017执行。
(4) 氨基酸含量:按GB 5009.124—2016执行。
(5) 酸溶蛋白含量:按GB/T 22729—2008执行。
(6) 游离氨基酸含量:参考谭建宁等[11]的方法。
1.3.4 相对分子质量分布测定 参考Liu等[12]的方法。
1.3.5 结构特征
(1) 紫外全波长扫描:参考Liu等[12]的方法,扫描波长为190~400 nm。
(2) 傅里叶变换红外光谱扫描:根据朱孝晨[13]的方法。
(3) 扫描电镜:参考Qin等[14]的方法,分别于2 000,5 000倍下获取图像。
1.3.6 体外抗氧化活性测定
(1) DPPH自由基清除能力:参考Zhao等[15]的方法,按式(1)计算DPPH自由基清除率。
(1)
式中:
A——自由基清除率,%;
A2——样品组吸光值;
A1——对照组吸光值;
A0——空白组吸光值。
(2) ABTS自由基清除能力:参考Pandhare等[16]方法,按式(1)计算ABTS自由基清除率。
(3) 羟自由基清除能力:参考Amarowicz等[17]的方法,按式(1)计算羟自由基清除率。
(4) 总抗氧化能力(FRAP法):按抗氧化能力试剂盒说明书进行测定。
1.3.7 数据处理 各试验重复3次,结果以平均值±标准差表示,利用Excel 2017软件进行数据处理,采用SPSS 16.0软件进行显著性分析,OriginPro 9.1软件绘图,使用omnic 8和peakfit 4.12软件进行红外光谱数据分析。
2 结果与分析
2.1 单因素试验
2.1.1 酶用量 由图1(a)可知,随着酶用量的增加,堇叶碎米荠蛋白水解度增加。当酶用量为5%时,堇叶碎米荠蛋白水解度为9.26%,继续增大酶用量,堇叶碎米荠蛋白水解度增加的趋势比较平缓,可能是因为底物大部分已参与反应,堇叶碎米荠蛋白水解度趋于饱和[18]。因此,堇叶碎米荠蛋白酶解的最佳酶用量为5%。
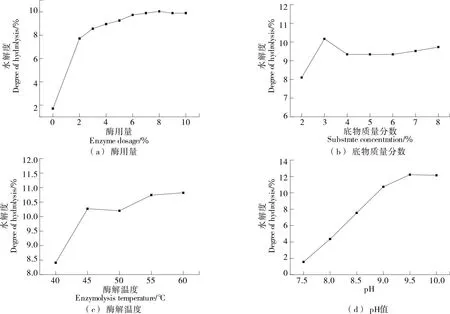
图1 各因素对堇叶碎米荠蛋白水解度的影响
2.1.2 底物质量分数 由图1(b)可知,当底物质量分数为3%时,堇叶碎米荠蛋白水解度最大,达10.17%,继续增大底物质量分数,堇叶碎米荠蛋白水解度呈下降趋势,可能是因为随着底物质量分数的增加,溶液黏度增加,减缓了酶的扩散,降低了酶分子与底物的相互作用[19],从而导致堇叶碎米荠蛋白水解度降低。因此,堇叶碎米荠蛋白酶解的最佳底物质量分数为3%。
2.1.3 酶解温度 由图1(c)可知,随着酶解温度的增加,堇叶碎米荠蛋白水解度增加。当酶解温度为55 ℃时,堇叶碎米荠蛋白水解度达10.74%,继续提升酶解温度,堇叶碎米荠蛋白水解度不再增加,可能是因为随着酶解温度的升高,酶活力受到影响甚至变性[20],导致堇叶碎米荠蛋白水解度降低。因此,堇叶碎米荠蛋白酶解的最佳酶解温度为55 ℃。
2.1.4 酶解pH 由图1(d)可知,随着酶解pH值的增加,堇叶碎米荠蛋白水解度增加。当酶解pH为9.5时,堇叶碎米荠蛋白水解度达12.22%,继续增大酶解pH,堇叶碎米荠蛋白水解度略有下降。试验选取的碱性蛋白酶的最适pH为9~10[20],当pH>10时,酶活力会下降从而导致堇叶碎米荠蛋白水解度降低。因此,堇叶碎米荠蛋白的最佳酶解pH值为9.5。
2.2 正交试验
根据单因素试验结果,选取酶解温度、pH、酶用量、底物质量分数4个因素进行正交试验,各因素水平见表1,试验设计及结果见表2。
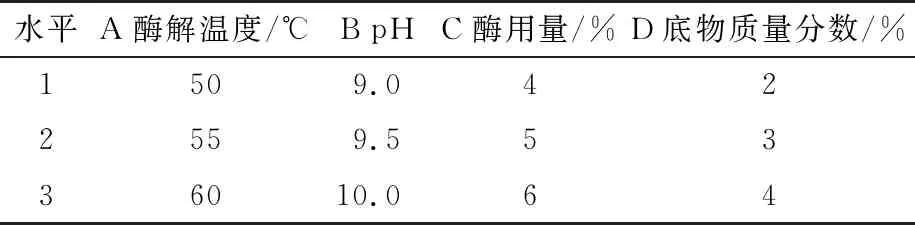
表1 正交试验因素水平表

表2 正交试验设计及结果
由表2和表3可知,各因素均会影响堇叶碎米荠蛋白水解度,影响顺序依次为pH>底物质量分数>酶解温度>酶用量,其最佳酶解组合为A1B2C2D2,即酶解温度50 ℃、pH 9.5、酶用量5%、底物质量分数3%,此时堇叶碎米荠蛋白水解度为15.1%。

表3 正交试验方差分析†
2.3 堇叶碎米荠低聚肽成分
由表4可知,堇叶碎米荠低聚肽水分含量为5.25%,蛋白质含量为49.01%,总硒含量为412.67 mg/kg,酸溶性蛋白质含量为44.2%,占总蛋白质的90%,游离氨基酸含量为1.33%,经计算,肽含量为42.87%。说明堇叶碎米荠蛋白经酶解制备得到的低聚肽,其蛋白、肽和硒元素含量较高,是开发富硒功能食品的优质原料。

表4 堇叶碎米荠低聚肽的成分
由表5可知,堇叶碎米荠低聚肽中氨基酸总量为48.10 g/100 g,其中色氨酸、胱氨酸、谷氨酰胺、天冬酰胺在酸性条件下被水解,未检测到[21]。堇叶碎米荠低聚肽中必需氨基酸种类和含量丰富(7种,24.06%),疏水性氨基酸占氨基酸总量的50.91%,给质子能力氨基酸占氨基酸总量的56.63%。有研究[22-23]报道,氨基酸的组成与低聚肽的抗氧化能力紧密相关,疏水性氨基酸和给质子能力氨基酸占比高,可稳定和清除自由基,从而提升低聚肽的抗氧化能力。
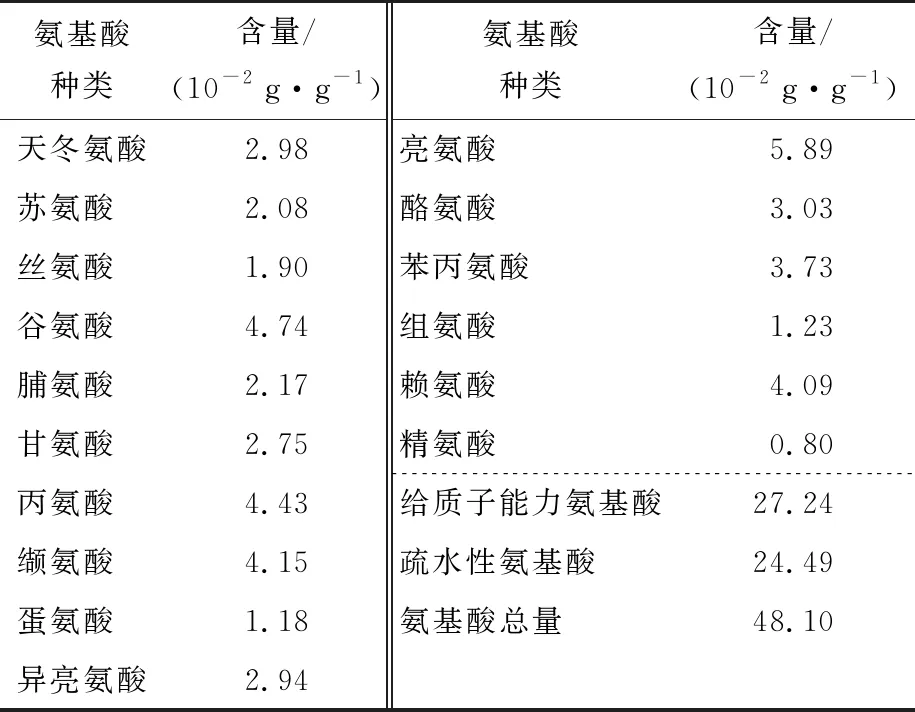
表5 堇叶碎米荠低聚肽的氨基酸组成
2.4 堇叶碎米荠低聚肽的相对分子质量分布
使用GPC软件处理色谱数据,结果显示堇叶碎米荠低聚肽的重均相对分子质量为621,数均相对分子质量为461,主要为小分子物质。由图2可知,堇叶碎米荠低聚肽的凝胶色谱图中主要有4个峰,每个峰的相对分子质量分布见表6,峰1、2、3、4的数均相对分子质量分别为1 567,782,383,238,峰面积分别为10.64%,36.13%,46.01%,7.22%,制备的堇叶碎米荠低聚肽主要以寡肽为主,且各峰的分散系数均接近1,说明相对分子质量分布越小,相对分子质量越集中。有研究[24-25]表明,抗氧化活性较好的肽,其相对分子质量均较小。
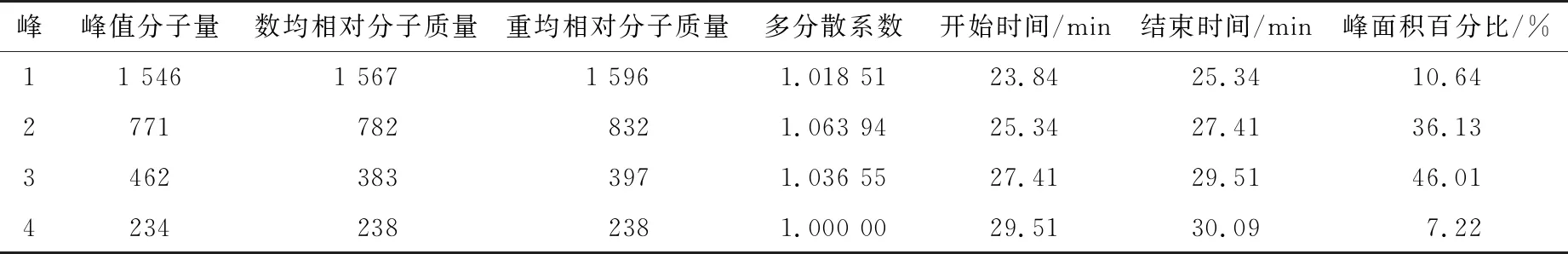
表6 堇叶碎米荠低聚肽的相对分子质量分布

图2 堇叶碎米荠低聚肽的流出曲线图
2.5 堇叶碎米荠低聚肽的紫外光谱扫描

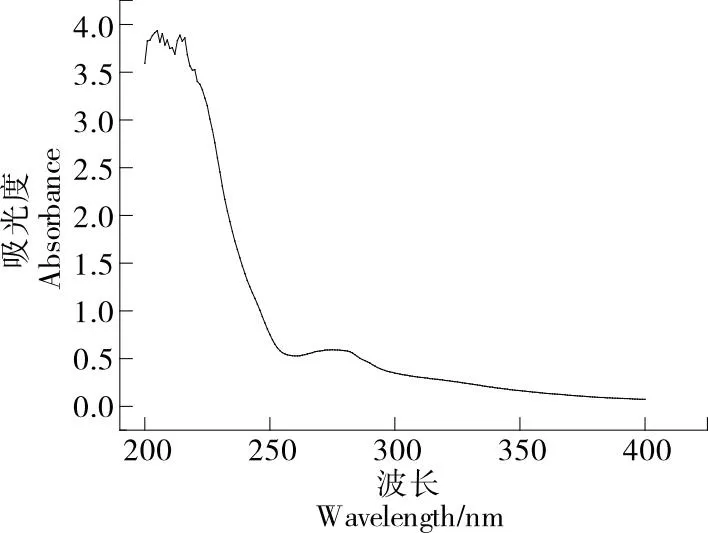
图3 堇叶碎米荠低聚肽的紫外全波长扫描
2.6 堇叶碎米荠低聚肽的红外光谱扫描
蛋白质二级结构的分析常使用酰胺Ⅰ带的谱图,它能够反映α-螺旋(1 660~1 650 cm-1)、β-折叠(1 640~1 600 cm-1)、β-转角(1 700~1 660 cm-1)及无规卷曲(1 650~1 640 cm-1)等不同结构信息[27]。通过对堇叶碎米荠低聚肽酰胺Ⅰ带(1 700~1 600 cm-1)的图谱进行基线校准、高斯去卷积、二阶导数拟合后得到分峰拟合图如图4所示。

图4 堇叶碎米荠低聚肽的红外光谱扫描图和酰胺I带分峰拟合图
由图4可知,对酰胺I带进行分峰拟合后共获得7个单一峰,各子峰的面积代表相对应结构所占比例,结果见表7。由表7可知,堇叶碎米荠低聚肽二级结构中有多种构象并存,主要以β-转角为主,含量为57.4%,其次是α-螺旋、无规卷曲和β-折叠。α-螺旋和β-折叠代表蛋白分子的有序性,β-转角和无规卷曲代表蛋白分子的分散程度[28]。这可能是因为酶解破坏了蛋白质间的氢键和肽键,从而使蛋白质结构从有序向无序转变[29]。

表7 堇叶碎米荠低聚肽的二级结构含量
2.7 堇叶碎米荠低聚肽的扫描电镜
由图5可知,堇叶碎米荠蛋白在酶解成低聚肽后,微观结构有明显差异。堇叶碎米荠蛋白的外观结构以不规则片状结构存在,表面比较平整光滑。酶解过1 000 Da超滤膜得到的低聚肽外观结构变化明显,表面不再光滑,变成具有许多小孔的海绵状。这可能是酶解导致蛋白质分子间的氢键和范德华力被破坏,蛋白质结构被破坏,内部结构中的疏水性基团暴露出来,低聚肽的抗氧化活性可能会因此而提高[24]。
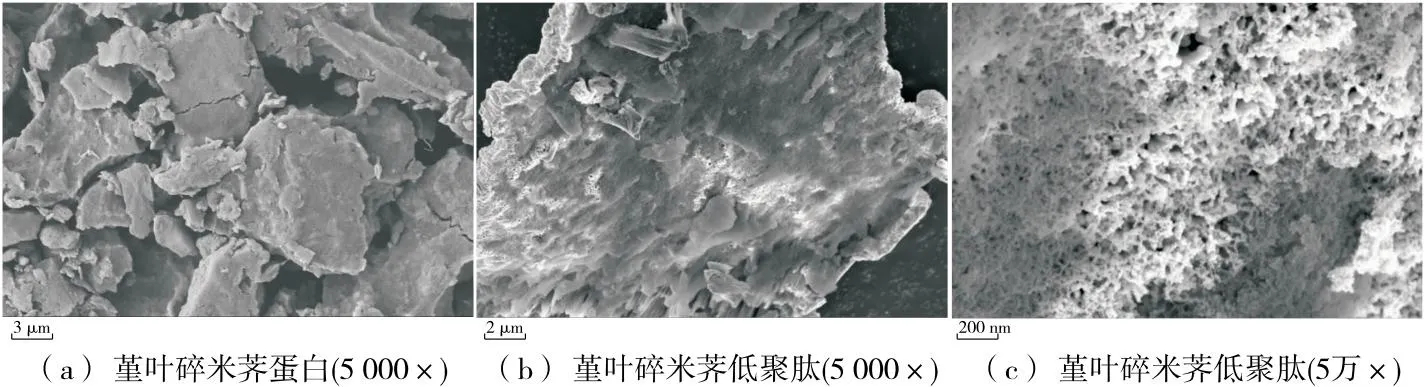
图5 堇叶碎米荠蛋白和低聚肽的扫描电镜
2.8 堇叶碎米荠低聚肽的体外抗氧化能力
由图6可知,堇叶碎米荠低聚肽清除自由基(·OH、DPPH·和ABTS·)的能力和抗氧化能力(FRAP法)均表现出明显的量效关系,随样品质量浓度的增加而增强;当堇叶碎米荠低聚肽质量浓度为20 mg/mL时,对羟自由基、ABTS自由基和DPPH自由基的清除率分别为84.54%,98.22%,60.33%,其IC50值分别为0.35,1.00,16.00 mg/mL,抗氧化能力(FRAP法)为1.82 μmol/mL Trolox。堇叶碎米荠低聚肽表现出较好的抗氧化能力,可能是蛋白被酶解后,低相对分子质量水解物或肽更能有效地与自由基发生反应[29];产生了一些离子化的氨基、羧基等供氢体与富含疏水氨基酸的肽和活性氨基酸序列[30-32],从而提高了抗氧化活性。有研究[33]报道,多肽分子量越小,表现出的抗氧化能力越强,堇叶碎米荠蛋白水解度越好,相对分子质量越小,抗氧化活性越好。总体而言,堇叶碎米荠低聚肽清除自由基的能力相对于抗坏血酸要稍弱一些,但其作为植物来源,安全性高,是开发功能食品的良好原料。
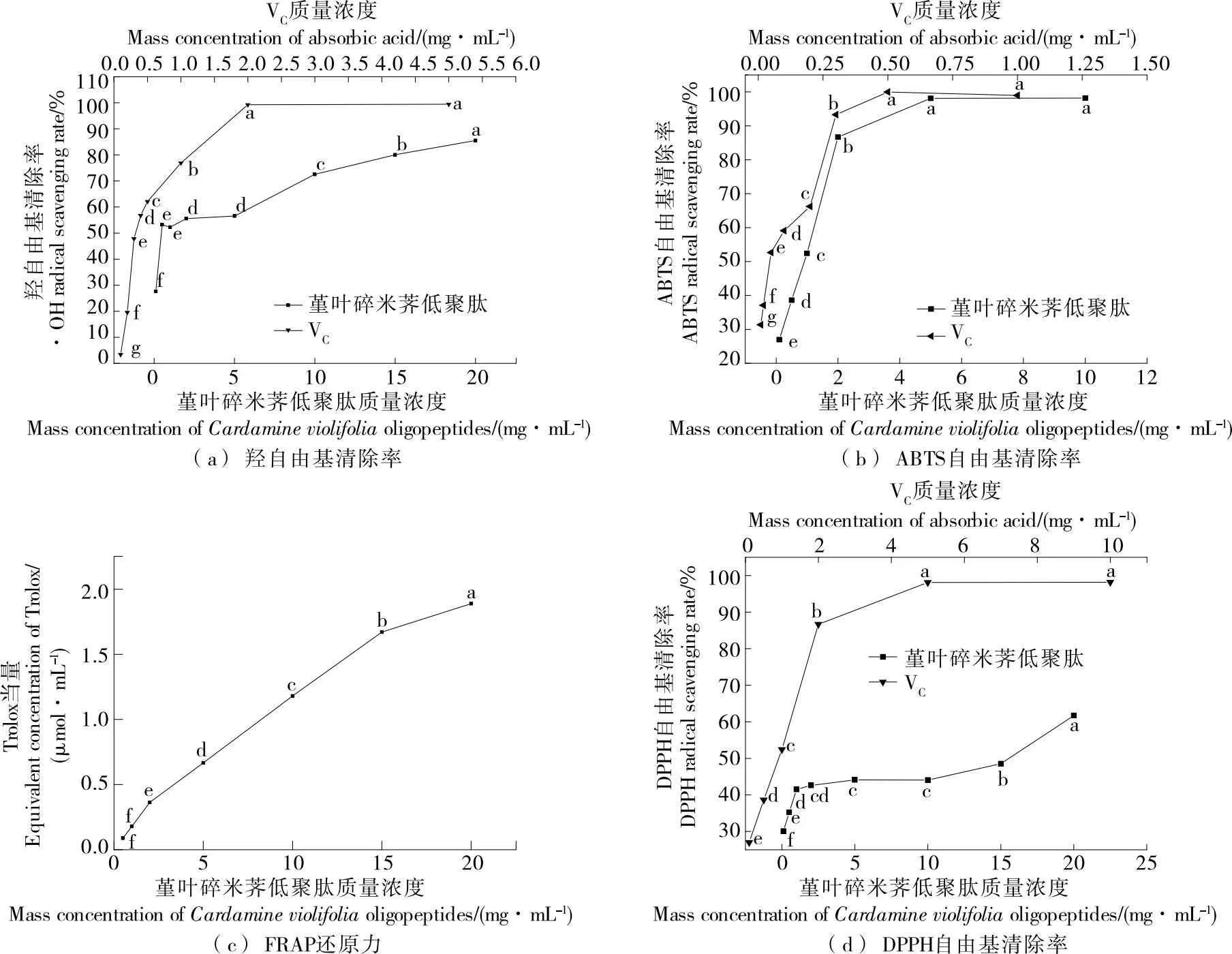
小写字母不同表示差异显著(P<0.05)
3 结论
试验表明,堇叶碎米荠低聚肽的蛋白质、肽含量较高,硒含量为(412.67±12.00) mg/kg,必需氨基酸含量为24%且种类丰富,主要成分为相对分子质量<1 000的小肽,外观结构呈明显的球体颗粒状,在200 nm处有肽键的特征吸收峰,二级结构以多种构象并存,β-转角为主要结构(57.4%)。堇叶碎米荠低聚肽的总抗氧化能力较强,对羟自由基、ABTS自由基的IC50值分别为0.5,1.0 mg/mL。综上,堇叶碎米荠低聚肽是一种有效的抗氧化小肽,是开发富硒功能食品的优质原料。后续可进一步研究堇叶碎米荠低聚肽的精制纯化、稳定性、体内抗氧化活性及其他功能活性。
