基于rGO-AuNPS修饰丝网印刷电极的电化学生物传感器快速检测甲基对硫磷
2024-01-29耿俊豪李雪芝周建平陈昌华
耿俊豪 李雪芝 周建平 陈昌华
(新疆大学智能制造现代产业学院,新疆 乌鲁木齐 830000)
有机磷农药在防治病虫害方面可以发挥重要作用。甲基对硫磷(MP)作为一种典型的硝基芳香族有机磷农药,在使用过程中容易造成水、土壤和空气污染,甚至破环人体内乙酰胆碱酶(AChE),肌肉无法放松,导致呼吸困难甚至死亡[1-2]。
当前,用于检测MP的技术有气相色谱法[3]、高效液相色谱[4]、比色法[5]、荧光生物探针等多种方法[6]。尽管这些方法能够提供高的灵敏度和选择性来检测农药残留,但价格昂贵、操作繁琐、耗时较长,无法满足一些实际要求,特别无法用于现场检测[7]。
基于AChE的MP电化学生物传感器已被证明可以提高检测效率,以简单、快速、选择性好、成本低、易于小型化等优点在农药残留检测中受到了广泛的关注[8]。在电化学分析中,常用的分立式三电极体系在检测过程中尽管检测体系各项参数良好,但灵活性较差,很难在现场对农药残留进行分析检测[9]。丝网印刷电极(SPCE)作为一款具有轻薄、便携、集成化程度高等特点的电极,简化了操作步骤,是一种可用于现场快速检测的电化学感知器件[10-11]。
为了提高AChE电化学生物传感器的性能,增加传感材料的表面积和提高导电性能是实现快速响应的关键。石墨烯基纳米复合材料因其出色的比表面积、优异的导电性以及出色的化学稳定性而备受关注,是目前研究的重要焦点[12]。与氧化石墨烯(GO)相比,还原氧化石墨烯(rGO)的导电能力显著提升,而且已被广泛验证[13]。电化学还原GO与传统热还原方法和化学还原方法相比,具有简单、省时、绿色等优点[14]。此外,rGO和金纳米颗粒(AuNPS)的结合具有独特的性质,可以作为电子传导途径,促进氧化还原体系和电极材料之间的电子转移。如金纳米颗粒具有很好的生物相容性和良好的导电性,强大的吸附能力,以及独特的物理和化学属性,由于这两个组分之间的协同作用,将金负载到石墨烯或其衍生物上时,金的电催化活性进一步提高[15]。
研究通过层层组装将rGO、AuNPS和AChE固定在电极表面,制备具有AChE/rGO/AuNPS/SPCE结构的生物传感器,对生物传感器的电子传输特性、结构稳定性、催化活性和存储稳定性进行评价,优化传感器的催化时间,并进行真实样本测试,完成对甲基对硫磷的快速检测。
1 材料与方法
1.1 试剂与仪器
氧化石墨烯分散液:南京先锋纳米材料科技有限公司;
乙酰胆碱酯酶(来自电鳗,500 U)、乙酰硫代胆碱氯化物(ATCl)、戊二醛(GA,50%)、牛血清白蛋白(BSA):美国Sigma-Aldrich公司;
磷酸二氢钠、磷酸氢二钠、氯化钠、氯化钾、铁氰化钾、亚铁氰化钾、硫酸钾、氯金酸:分析纯,国药集团化学试剂有限公司;
甲基对硫磷:北京百灵威科技有限公司;
丝网印刷电极:波探科技(威海)有限公司;
电化学工作站:DH7000C型,江苏东华分析仪器有限公司;
场发射扫描电子显微镜:JSM-7610FPlus型,深圳市蓝星宇电子科技有限公司;
X射线光电子能谱仪:ESCALAB 250Xi型,美国Thermo Fisher Scientific公司。
1.2 AChE/rGO/AuNPS/SPCE的制备
首先将丝网印刷电极在0.1 mol/L PBS(pH 7.4)中施加范围-0.6~+0.8 V的循环电位,扫速100 mV/s,进行电极激活,直到获得稳定的循环伏安图。处理完用蒸馏水对电极表面进行冲洗。如图1所示,取5 μL 0.5 mg/mL的GO分散液滴涂在电极表面,使其自然干燥,之后将其置于0.1 mol/L KCl溶液中CV还原,施加0~-1.8 V的电位以100 mV/s的速度扫描5圈,然后用蒸馏水冲洗,并在室温下自然干燥。再通过CV法进行电沉积纳米金,将样品浸入含有0.01 mol/L K2SO4和0.001 mol/L HAuCl4的溶液中沉积10 min,最后,将10 μL的AChE(0.2 U/μL)和2.0%的BSA混合液滴涂于电极表面(记为AChE/AuNPS/rGO/SPCE),35 ℃干燥30 min,完成AChE/rGO/AuNPS/SPCE的构建。

图1 GO、rGO和rGO/AuNPS修饰的SPCE的SEM图像
1.3 甲基对硫磷电化学检测
AChE/rGO/AuNPS/SPCE先在1 mmol/L的ATCL中孵育5 min,再进行DPV表征。将传感器浸泡在一定浓度的MP溶液中,抑制10 min,接着在1 mmol/L的ATCL中孵育5 min,最后进行DPV表征。按式(1)计算甲基对硫磷对传感器的抑制率。
I=[(I0-Icat)/I0]×100%,
(1)
式中:
I——传感器抑制率,%;
I0——传感器在被抑制前催化1 mmol/L ATCl时的峰值电流,μA;
Icat——传感器在被抑制后催化1 mmol/L ATCl时的峰值电流,μA。
1.4 数据处理
采用Origin 2021软件对试验数据进行处理分析并绘图。
2 结果和讨论
2.1 材料表征
通过SEM技术,对GO、rGO、rGO/AuNPS改性SPCE的表面形貌特征进行了表征。从图1(a)和图1(b)可以清晰地观察到电极表面上石墨薄膜独有的褶皱纹理,这些褶皱提高了修饰电极的比表面积,为修饰金纳米提供更多的活性位点[16]。此外,GO和rGO薄膜中C和O的存在也可以通过EDX图像得到证实,如图2(a)和图2(b)所示。GO中O的信号从22.08%显著降低到13.21%,说明GO成功还原为rGO。基于图1(c),大量AuNPS密集且均匀分散在rGO膜表面。rGO/AuNPS纳米复合材料的EDX光谱也显示了C、O和Au信号的存在,如图2(c),包括83.36%的C元素、2.58%的O元素和14.06%的Au元素。这些结果清楚地证实了rGO/AuNPS纳米复合材料在SPCE上的形成[17]。为了进一步验证复合纳米材料成功修饰在电极表面,使用X射线光电子能谱仪测试电极表面的化学元素组成和价态分布,并对能谱进行分析如图3所示。图3(a)中出现了C1s、O1s和Au 4f的峰,并分别对其进行了拟合。图3(b)和图3(c)在284.8,532.4 eV处分别为O1s和C1s的特征峰,图3(d)为Au 4f的特征峰,其在84.3,88.0 eV处出现两个特征峰,分别归属于Au 4f7/2和Au 4f5/2,表明Au元素被有效修饰在电极表面。

图2 GO、rGO和rGO/AuNPS修饰的SPCE的EDX图像

图3 rGO/AuNPS的XPS能谱图及组成元素的XPS谱图
2.2 生物传感器的催化活性
生物传感器的催化活性是传感器最重要的性能参数之一。米氏常数(Km)可以用来衡量酶的亲和力,其值越小,表明酶的亲和力越强。米氏常数可以通过Lineweaver Burk方程计算:
(2)
式中:
Icat——添加ATCl时的电流值,μA;
Imax——ATCl饱和状态下的最大电流值,μA;
C——ATCl浓度,mmol/L;
Km——米氏常数,mmol/L。
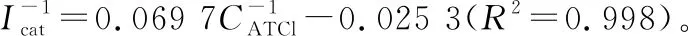
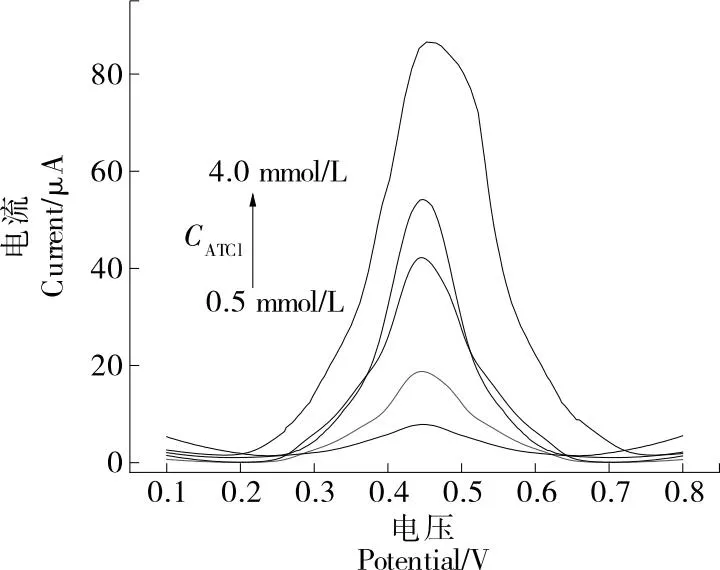
图4 AChE/AuNPS/rGO/SPCE电极对不同浓度ATCl的DPV响应

图5 峰值电流的倒数与乙酰硫代胆碱氯化物浓度的倒数的校准曲线
2.3 电化学表征
图6(a)描述了在5 mmol/L Fe3(CN)6/0.1 mol/L KCl溶液中不同修饰电极的CV图,扫描速度为0.1 V/s,电位范围为-0.6~0.8 V。在未修饰任何材料前,SPCE具有明确的可逆电化学响应。经过GO修饰,峰值电流显著下降,主要归因于GO的导电性较差。此外,与裸电极和GO修饰电极相比,还原后的rGO修饰的SPCE具有很好的导电性,表明rGO的优异导电性和大表面积有助于加快整个电化学过程[20]。
a. SPCE b. GO/SPCE c. rGO/SPCE d. AuNPS/rGO/SPCE e. AChE/AuNPS/rGO/SPCE
在沉积AuNPS后形成rGO/AuNPS复合材料,AuNPS充当电子转移通道,进一步提高rGO膜的导电性,改性层和电解质(离子)之间的电荷转移过程加快并更有效地发生。根据Randles-Sevcik方程测定了修饰rGO/AuNPS电极的电活性表面积,并与SPCE的电活性表面积进行了比较。
Ip=(2.69×105)n3/2ACD1/2v1/2,
(3)
式中:
Ip——循环伏安响应的峰值电流,μA;
n——氧化还原反应中的电子转移数;
A——电极表面积,cm2;
C——氧化还原指示剂Fe3(CN)6的浓度,mol/L;
D——扩散系数,cm2/s;
v——扫描速率,V/s。

2.4 优化设计
从图7(a)可以看出,响应电流的最大值在pH 7.5时,电解液过酸或过碱都会影响所固定的AChE的生物活性。因此,在随后的试验中选用pH 7.5的PBS。从图7(b)可以看出,随着AChE酶修饰量的增加,峰值电流会先上升后下降,可能是由于AChE的过厚导致其电阻增大。因此,选择10 μL AChE作为最佳修饰量。从图7(c)可以看出,AChE的最适温度为35 ℃,温度超过35 ℃其峰值电流出现下降,可能是温度过高对酶活性造成了影响。从图7(d)可以看出,酶的修饰时间对其影响较小,最终选择30 min作为AChE的修饰时间。从图7(e)可以看出,当底物浓度为1.0 mmol/L时,MP对AChE的抑制率达到最大,当ATCl浓度>1.0 mmol/L 时,抑制率呈下降趋势。这是因为ATCl浓度的增加导致酶活性中心逐渐被底物占据,在此过程中,酶分子上积累了过多的底物,产生了胆碱、乙酸等非活性中间体,这些不活跃的中间产物影响了电流反馈。因此,后续试验选择1.0 mmol/L作为底物浓度。另外,抑制时间对抑制率也有一定的影响,如图7(f)所示,AChE/AuNPS/rGO/SPCE在50 ng/mL的MP溶液中浸泡不同时间。结果表明,MP对AChE的抑制率随抑制时间的延长而增加,当抑制时间超过10 min时,曲线趋于平稳,表明农药与酶的结合达到了平衡。因此,选择浸泡时间为10 min。

图7 pH值、AChE修饰量、底物浓度和抑制时间优化图
2.5 农药含量检测
图8(a)显示在最优底物浓度的情况下进行DPV测试,随着不断加大农药质量浓度,传感器催化活性降低。由图8(b)可以看出,随着农药质量浓度的增加,抑制率呈线性变化。显示了两个线性范围:1~50 ng/mL的抑制率方程分别为I=0.513 8CMP+10.298(R2=0.981),50~500 ng/mL 的抑制率方程为I=0.066 5CMP+34.561(R2=0.987)。该传感器的检出限为0.692 ng/mL(使用3σ/N规则计算)。表1总结了不同修饰电极材料对于MP的电化学检测。
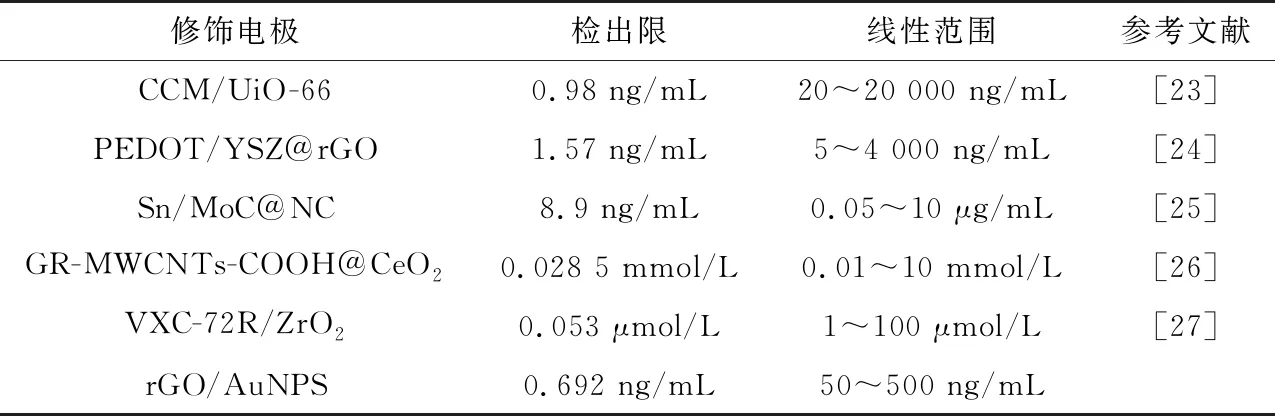
表1 与常见修饰电极的比较

图8 AChE/AuNPS/rGO/SPCE在不同浓度甲基对硫磷抑制10 min后在1 mmol/L ATCl中的差分脉冲伏安响应曲线和抑制率与甲基对硫磷质量浓度之间的关系
2.6 干扰研究
为评估AChE/AuNPS/rGO/SPCE的选择性,将0.1 mol/L NaCl、KCl和K2SO4、0.1 mmol/L PBS、1 mg/mL葡萄糖(Glucose)分别加入到质量浓度为50 ng/mL的MP中。如图9所示,添加干扰后MP溶液的电流响应无明显变化,表明制备的传感器在受到干扰时仍具有令人满意的选择性。
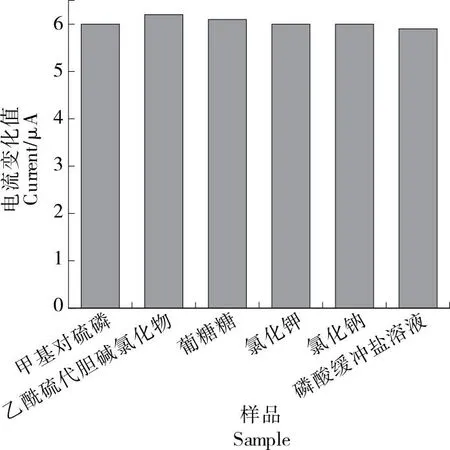
图9 不同物质对MP安培响应的干扰
2.7 实际样品检测
通过向生菜和苹果样品中添加一定量的MP来进行回收试验。样品是从附近菜市场购买,用破壁机榨汁,并用PBS稀释10倍。将MP添加到稀释的果汁样品中以制备所需浓度MP测试溶液。收集其上清液进行电化学分析。计算其回收率,结果见表2。由表2可知,MP在样品中的回收率为93.6%~101.6%,相对标准偏差(RSD)为1.84%~6.12%,与气相色谱法的检测结果基本一致。
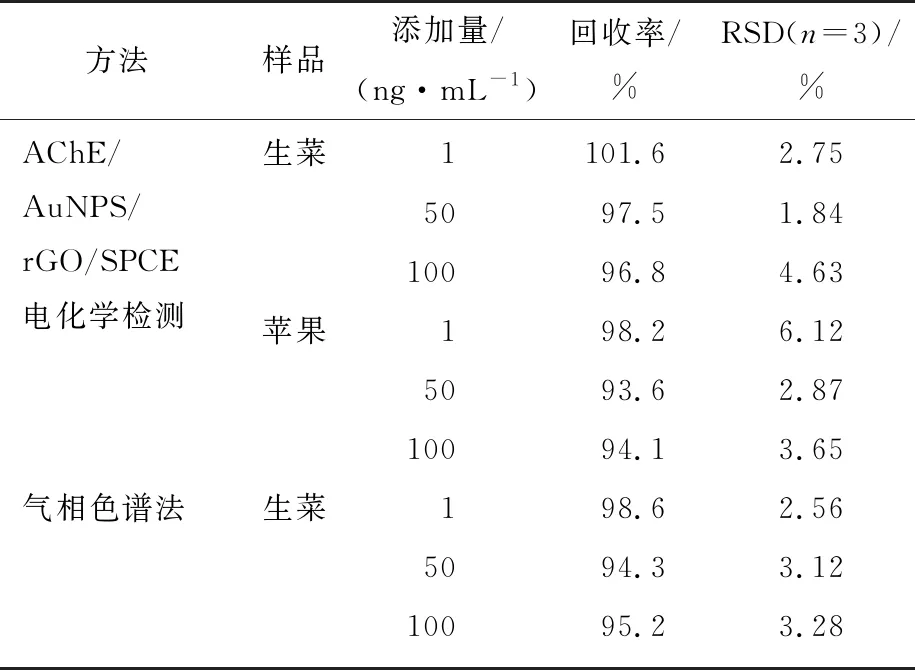
表2 样品中甲基对硫磷的检测
结果表明,该生物传感器可以非常准确地检测甲基对硫磷。
2.8 重现性、重复性、储存稳定性
选取5个酶电极,在最优试验条件下,研究了酶电极的重现性、重复性与储存稳定性,记录其对1 mmol/L底物的DPV响应电流,其相对标准偏差范围为3.10%~5.60%。单个电极连续5次在1 mmol/L底物溶液中测定的标准偏差为4.30%。随后用PBS冲洗后储存在4 ℃的冰箱中,干燥密封。测量结果为在7 d后保持初始状态95%以上,在30 d后仍保留了其初始电流响应的80%。结果表明,相比于传统的三电极,该丝网印刷电极依然具有不错的稳定性。
3 结论
该传感器将还原氧化石墨烯、金纳米颗粒和乙酰胆碱酶采用逐层组装的方法修饰在丝网印刷电极表面,制备了乙酰胆碱酶/金纳米颗粒/还原氧化石墨烯/丝网印刷电极电化学生物传感器用于检测甲基对硫磷。结果表明,甲基对硫磷的线性范围为5~500 ng/mL,检出限为0.692 ng/mL,具有低成本和良好的选择性与稳定性。
