两段阶梯加热成膜工艺对蛋白基复合材料疏水性和阻隔性能的影响
2024-01-29张文惠
王 滋 雷 桥,2,3 张文惠
(1. 上海海洋大学食品学院,上海 201306;2. 上海水产品加工及贮藏工程技术研究中心,上海 201306;3. 农业部水产品贮藏保鲜质量安全风险评估实验室〔上海〕,上海 201306)
乳清分离蛋白—酪蛋白酸钠(whey protein isolate-sodium caseinate,WPI-NaCas)复合膜具有良好的力学性能和阻隔性能。普鲁兰多糖(pullulan,PUL)制备的薄膜具有均一、透明、高韧性、可热封、高阻隔的特点。有研究[1]表明,乳清蛋白在35 ℃以上,二聚体开始解聚成单体,温度在70 ℃以上,球状分子开始展开,疏水基团外露,通过巯基与其他含硫蛋白质相互作用,形成小聚体,进而团聚形成高分子聚集体。Cheng等[2]发现,单独加热豌豆分离蛋白1 h后,能使薄膜抗拉强度(TS)增强27.7%,水蒸气渗透率降低58%,说明湿加热改善了薄膜性能。董爽等[3]发现,在高压湿热改性条件下,薄膜体外酶解抗性和抗拉强度明显增强;通过傅里叶红外光谱分析发现,湿热改性使玉米醇溶蛋白的β-转角结构向结构更加有规则的无规卷曲、β-折叠和α-螺旋结构转变。孙宏霞等[4]指出大豆蛋白质的变性与红外加热的时间和温度,以及水有很大的关联。上述研究表明,热诱导变性后的结构主要由新的分子间作用力维持,特别是暴露的巯基之间的共价键;热诱导变性会改变分子结构,从而影响薄膜各项理化指标。
前人研究采用单一温度条件加热的方式忽视温度梯度变化对蛋白质多肽链的解链过程和程度的影响,少有学者提出分梯段加热蛋白膜溶液探究薄膜成膜性能的变化,为了补充这一研究领域的空白。研究拟采用低温诱导肽链的解链和高温不可逆变性重新产生聚集体的阶梯加热的方法来制备可食性薄膜,以期改良薄膜阻隔性能和力学性能。
1 材料与方法
1.1 原材料和试剂
乳清分离蛋白粉:蛋白质质量分数≥98%,美国Isopure公司;
酪蛋白酸钠:蛋白质质量分数≥99.21%,上海麦克林生化科技有限公司;
普鲁兰多糖:质量分数为98%,上海萨斯化学技术有限公司;
丙三醇(甘油):分析纯,上海麦克林生化科技有限公司;
去离子水:实验室自制;
其他试剂均为分析纯。
1.2 仪器与设备
紫外分光光度计:U-3900型,日本日立高新技术科学公司;
色差仪:CR-400型,日本柯尼卡美能达有限公司;
接触角测量仪:JC2000C型,上海中晨数字技术设备有限公司;
氧气透过率测试仪:OX-TRAN2/2H型,美国MOCON公司;
水蒸气透过率测试仪:PERMATRAN-W1/50G型,美国MOCON公司;
智能电子拉力试验机:XLW(EC)型,济南蓝光机电技术有限公司。
1.3 方法
1.3.1 两段加热复合膜的制备 在郄梓含等[5]的方法上进行改进,CK1、CK2为对照组分别代表空白组25 ℃溶解、一段加热85 ℃,A、B、C、D、E为试验组分别代表两段阶梯加热35 ℃/85 ℃、40 ℃/85 ℃、45 ℃/85 ℃、50 ℃/85 ℃、50 ℃/85 ℃。溶解:用分析天平称量13.6 g乳清分离蛋白,20 g普鲁兰多糖,10.22 g酪蛋白酸钠,分别溶解在200 mL去离子水中,在25 ℃水浴中分别搅拌2 h充分溶解后,将酪蛋白酸钠与乳清分离蛋白、普鲁兰多糖混合后搅拌均匀1 h,等分为5份,分别在35,40,45,50,55 ℃磁力水浴锅搅拌1 h进行一段低温诱导使蛋白链展开,再二段加热,85 ℃恒温水浴15 min,使球状蛋白质中的疏水基团暴露出来便于重新聚合。增塑:将85 ℃变性的蛋白溶液冷却至室温,加入质量分数为35%的甘油,搅拌1 h。脱气和干燥:搅拌后的溶液冷却至室温后,于室温、真空度0.098 MPa条件下脱气1 h,肉眼观察无气泡,脱气结束。倒入平面皿,在65 ℃鼓风干燥箱中干燥5~6 h形成复合膜,再将膜放在30 ℃,湿度50%的恒温箱中静置24 h待测。
1.3.2 薄膜力学性能测定
(1) 厚度:根据Sukyai等[6]的方法修改如下:薄膜的厚度是利用0~25 mm量程,精度为0.001的电子数显螺旋测微仪进行测量。选取薄膜随机的5个位点,取平均值。
(2) 机械性能:根据Pankaj等[7]的方法修改如下:使用XLW(EC)智能电子拉力试验机测量薄膜的拉伸强度和断裂伸长率。待测的薄膜被切成20 mm×150 mm的矩形,有效夹持长度为65 mm,拉伸速度为300 mm/min,每种薄膜测量3次,取平均值。
1.3.3 透光率测定 根据Han等[8]的方法修改如下:将薄膜裁剪为0.8 cm宽,2.0 cm长的矩形,贴在紫外分光光度计的比色皿内壁,使用紫外分光光度计在200~800 nm波长范围内测定薄膜对光的吸收特性,不放置样品的比色皿为空白对照。每组薄膜测量3次取平均值。
1.3.4 氧气透过率测定 根据Gounga等[9]的方法进行测定,用样品切割器将薄膜切成直径约为50 mm的样品,气体输出压力调节至0.50 MPa,用于测试薄膜两侧之间的压力为101.3 kPa,在25 ℃下测定薄膜的氧气渗透率,每组薄膜测量3次取平均值。
1.3.5 水溶性测定 根据Carvalho等[10]的方法测试薄膜的水溶性。将样品切成2.0 cm×2.0 cm的小块,在105 ℃的烘箱中干燥24 h称量初始重量记为W1,将薄膜置于50 mL蒸馏水中24 h。取出未溶解的薄膜样品于105 ℃下再次干燥,直至恒重,最终质量记为W2。每个样品测定均重复3次。根据式(1)计算薄膜的水溶性(water solubility,WS)。
(1)
式中:
S——水溶性,%;
W1——薄膜初始重量,g;
W2——薄膜干燥至恒重质量,g。
1.3.6 薄膜表面接触角测定 裁剪1.0 cm×3.0 cm的薄膜放置于垂直液滴下0.5 cm处,将3~4 μm的蒸馏水滴在薄膜表面用测角仪相机快速拍摄液滴和薄膜接触图像,每张薄膜测量3个不同的位点用ImageJ软件对获取的图像进行分析。
1.3.7 水蒸气透过率测定 根据文献[11]采用PERMATRAN-W1/50G型水蒸气透过率测试仪测定。仪器参数设置:两侧相对湿度10%/100%,测试温度37.8 ℃。每种薄膜测量3次,求平均值。
1.3.8 红外光谱分析 将成膜基质放于65 ℃烘箱中干燥5~6 h去除水分,测试环境湿度保持在35%以下,分辨率4 cm-1,扫描范围4 000~500 cm-1,扫描次数16次,采用Omnic8.0软件进行光谱分析[12]。
1.3.9 薄膜色差分析 选择色差仪测定薄膜的颜色,每种薄膜测量3次;标准白板(L′=92.16,a′=1.13,b′=3.96)对仪器背景值进行校准,测定膜的L、a和b值。按式(2)计算总色差。
(2)
式中:
ΔE——膜与标准白板的色差值;
L、L′——薄膜、标准白板亮度;
a、a′——薄膜、标准白板红绿色度;
b、b′——薄膜、标准白板黄蓝色度。
1.3.10 聚丙烯酰胺凝胶电泳 根据Laemmli[13]和尹燕霞等[14]的方法修改如下:蛋白膜溶液用去离子水稀释10倍,在25 ℃水浴中磁力搅拌15 min后进行蛋白质电泳,分离胶和浓缩胶的质量分数分别为12%,5%。电泳后,用考马斯亮蓝对凝胶进行蛋白质染色。
1.3.11 差示扫描量热(DSC) 根据Tavares等[15]的方法修改如下:称量薄膜样品(约5 mg)密封在铝盘内,空样品铝盒作为对照,在氮气保护下(吹扫气流为20 mL/min),以10 ℃/min的加热速率从0 ℃到200 ℃进行加热。
1.4 统计分析
每组样品测量3次平行样。使用SPSS 20软件通过ANOVA对数据进行统计处理和分析。数据表示为平均值±标准差,并使用Origin 9.0进行数据处理。
2 结果与分析
2.1 薄膜力学性能
CK1处理条件下乳清分离蛋白仅具有弱的相互作用,如静电力、疏水和亲水相互作用薄膜力学性能较低,与Guckian等[16]所报道的结论相似。阶梯加热的加工工艺方式使蛋白质疏水核心的基团裸露出来,在疏水作用力的影响下形成新的链间二硫键,二硫键与其他次级键的共同作用下增强了成膜基材的内聚力,天然蛋白在热变性后具有强的相互作用力。如图1所示,阶梯加热的处理方式对比对照组CK1、CK2薄膜的抗拉强度(TS)、断裂伸长率(EAB)变化显著(P<0.05)。处理C与A、B、D、E以及对照组相比TS、EAB较大,变化显著(P<0.05),分析其主要原因可能是:45 ℃/85 ℃两段阶梯加热的第一段加热温度为45 ℃对比25,35,40 ℃第一段加热温度较高蛋白质肽链舒展程度更高,成膜基质多糖、甘油、酪蛋白酸钠分子之间作用更加充分,蛋白肽链之间或蛋白链和多糖、甘油的聚合程度高,分子之间作用力强,薄膜的韧性和强度也有所增强。50,55 ℃较高温度可能会破坏一些弱的次级键如氢键的形成,影响分子之间的团聚,继而影响薄膜的力学性能。阶梯加热对蛋白质解链的可调性是影响薄膜性能的关键原因。

字母不同表示差异显著(P<0.05)
2.2 氧气透过率变化
如图2所示,处理C薄膜的最低氧气渗透率(OP)与CK1、CK2、A、B、E的具有显著性差异(P<0.05)。这与蛋白质交联程度的加强,二硫键数目的增加有关。二硫键数目的增加会使蛋白质肽链之间自由体积减少,可提高薄膜对氧气的阻隔性能。这与Schmid等[17]的研究结果相似。45 ℃/85 ℃处理的蛋白质与多糖的交联共轭更充分,这些综合作用使成膜溶液的空间三维结构改变,形成黏度更大、更致密的聚集体。说明薄膜致密结构越紧凑薄膜的OP值越小。

字母不同表示差异显著(P<0.05)
2.3 水蒸气透过系数变化
如图3所示,阶梯加热45 ℃/85 ℃处理的薄膜具有最低的水蒸气透过系数(WVP),表现出更好的水蒸气阻隔性能,有较强的阻隔水蒸气交换或者迁移的能力。原因是45 ℃/85 ℃阶梯加热使球状蛋白的疏水核心基团如巯基、含苯环的芳基、酯基等由于肽链的舒展而裸露,减少了薄膜的亲水位点,薄膜的WVP减小显著。Fang等[18]指出一些疏水性官能团的加入也可以减少薄膜的亲水位点,增强薄膜的水蒸气阻隔性能。

字母不同表示差异显著(P<0.05)
成膜溶液在一段加热(25 ℃)条件下,羟基、羧基、氨基和增塑剂甘油能够与极性水分子亲和,水分子更容易穿越薄膜而不被阻拦和排斥,薄膜亲水性较强,水蒸气透过率较高。处理C与其他处理条件A、B、D、E有显著性差异(P<0.05),主要原因是解链程度对分子之间的作用强度有关,与疏水核心非极性基团的暴露数目和氢键数目有关。图3表明,较高的处理温度(处理D)不利于氢键的形成和分子团聚而影响薄膜对水蒸气的阻隔性能。阶梯加热由于改变了蛋白的疏水基团的暴露程度和结构致密程度从而改变薄膜的水蒸气阻隔性能。
2.4 水溶性变化
如图4所示,两段阶梯加热45 ℃/85 ℃处理的薄膜水溶性(WS)最小,表明其抵抗水破坏的能力最强。两段阶梯加热过程中,热变性使肽链舒展延伸在肽链之间形成强相互作用的二硫键[19],所以两段阶梯加热薄膜对比CK1表现出水溶性较低。Jafari等[20]提出了相似的观点即热变性使分子之间相互作用力增强,可以降低成膜基材在水中的溶解度,分子间的作用力和非极性共价键是薄膜力学性能、阻隔性能重要的影响因素。

字母不同表示差异显著(P<0.05)
一段加热的薄膜CK1在去离子水中,薄膜的完整性被破坏,出现断裂。原因是薄膜的凝胶化和交联程度不足,空间网络结构强度较低,肽链或肽链之间的半胱氨酸由于无法充分裸露而未形成强的二硫键,二硫键是稳定蛋白质分子结构的重要因素。对比处理C与CK1、A、B、D和E可知,蛋白解链后基团的裸露程度增大、关键基团之间的相互作用力变化、巯基数目的增加增强了基团之间的作用效果,继而显著影响薄膜各项指标。通过水溶性分析发现,增强蛋白质的变性程度可能直接影响较强共价键的形成,从而降低了薄膜在水中的溶解度。
2.5 接触角表征薄膜疏水性变化
如表1所示,所有薄膜接触角都小于90°,表现为较弱的亲水性。引入疏水性较强的非极性共价键和基团可以改良薄膜表面疏水性[21]。两段阶梯加热(45 ℃/85 ℃处理)的薄膜,相对而言接触角较大,可能的原因:① 两段阶梯加热过程中,蛋白凝胶化增强,多糖、甘油、小分子低聚物蛋白充斥在这种致密网络结构中并形成较强的分子间作用力和次级键,这种致密结构形成的薄膜具有阻隔其他液相(水或油)渗透的能力;② 乳清蛋白、酪蛋白酸钠与多糖的共轭。试验结果表明,在45 ℃/85 ℃处理的阶梯加热中,蛋白质疏水核心暴露得越充分,形成新的共价基团的可能性增大,薄膜性能更趋于稳定。

表1 薄膜接触角变化†
2.6 阻光性变化

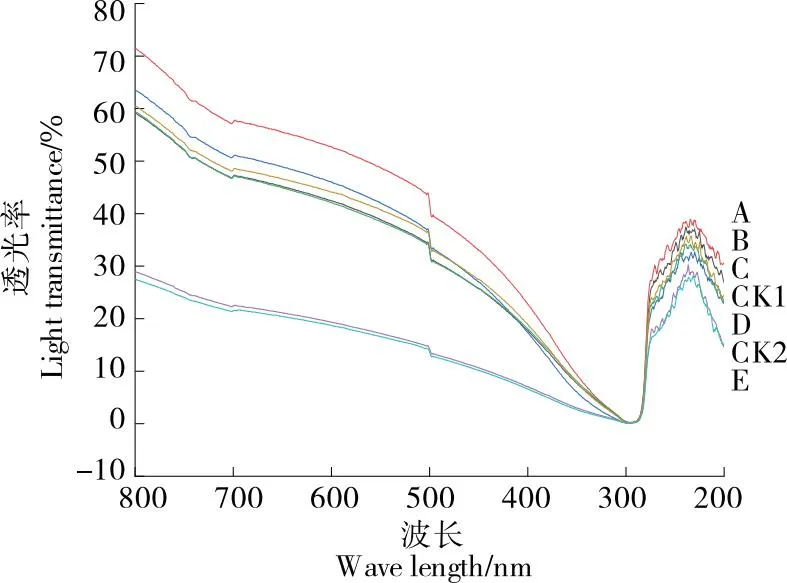
图5 紫外光谱吸收图
2.7 薄膜色差分析
试验组与对照组在ΔL值(L-L′)上没有明显的差异(表2),且值均大于85,表现出较强的亮度,Δa值(a-a′)为负值,其负值越小薄膜的颜色越偏向绿色,Δb值(b-b′)为正值,其值越大,薄膜的颜色越偏向黄色。试验组与对照组薄膜整体呈明亮的弱黄色,可能是由于:① 乳清分离蛋白和酪蛋白酸钠自身具有微黄的原始颜色;② 薄膜在制备干燥(65 ℃烘干)过程中蛋白和多糖发生了美拉德反应。蛋白质的赖氨酸ε-氨基、组氨酸、色氨酸的咪唑基和吲哚基团,以及蛋白质和肽链末端氨基酸残基的α-氨基与还原性多糖羰基缩合,形成席夫碱,发生美拉德非酶褐变反应[25]。

表2 薄膜色差的变化†
2.8 傅里叶红外光谱分析


图6 傅里叶红外光谱图
2.9 聚丙烯酰胺凝胶电泳分析不同处理条件下的成膜溶液
乳清分离蛋白主要的成分是α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg),两者含有丰富的链间二硫键和游离巯基。如图7所示,CK1、CK2、A、B的处理条件下,显示出更强的条带,C、D、E条带变弱,这是由于第一阶段加热温度较高导致第二阶段更高程度的蛋白质变性、聚集和交联,降低了蛋白质的溶解度[29],这与薄膜水溶性较低保持一致。电泳条带分析表明,两段阶梯加热能增强薄膜变性解链的程度,蛋白链的基团之间反应效果越明显,蛋白质越容易聚集交联形成团聚物。数据分析表明,薄膜的各项指标与蛋白质解链后分子之间作用力有关,成膜基质之间作用力越强,形成的高度聚合物越稳定。

图7 一段加热和两段加热电泳图
2.10 DSC分析
如图8所示,所有薄膜都显示出吸热峰,各组的DSC曲线在150~175 ℃范围内有两处尖锐的熔融吸收峰,对应其两段熔融吸收峰温度(Tm)。从左往右第一个峰可能是弱的相互作用力和一些弱的次级键转换热吸收峰,第二个峰是薄膜主要的热吸收峰,它可以反映出薄膜的有序结构或化学键在热力作用下的破坏情况[30]。温度处理的不同方式CK2、A、B、C、D、E的熔融峰发生了低位移且试验组Tm呈先增大后回落的现象。45 ℃/85 ℃处理的薄膜Tm值分别为165,171 ℃,高于其他各组薄膜,表现出更高的热稳定性,意味着打破该条件下蛋白质的结构需要更多的能量。结合电泳条带分析,45 ℃/85 ℃处理的蛋白溶液变性程度更高,分子之间作用力更强致使薄膜的稳定性更强。二硫键断裂形成新的链间二硫键使蛋白质的结构更加稳定限制了蛋白质链的移动,此外还与这种稳定的网络结构强度有关,进一步解释了两段加热的处理方式改变了成膜溶液分子之间的作用力,这与红外图谱的结论相似。

图8 不同处理温度条件下的薄膜DSC曲线分析图
3 结论
研究通过改变成膜加热方式优化成膜工艺,对薄膜几个关键指标进行系统的表征。两段阶梯加热的方式对改善聚合物之间的内聚力,增强薄膜基材之间的相互作用效果有调控的作用。电泳、红外光谱、紫外光谱分析表明,聚合物基质的结构变化、分子之间的作用力强度、网络结构的致密性与蛋白质解链程度有很大关系。两段阶梯加热的处理方式优化了成膜工艺,增强了成膜基材之间的作用效果,使薄膜具有更高的力学性能、阻隔性能,更低的水溶性、水蒸气透过性。两段阶梯加热工艺制备的薄膜具有优良的氧气阻隔性,试验组45 ℃/85 ℃的两段加热法对提高阻氧阻湿性能、力学性能最为显著,疏水性能有所改善,试验制备的薄膜机械强度与低密度聚乙烯相当,但是不如高密度聚乙烯的机械强度,薄膜的机械性虽能达到包装食品的要求,但对比其他高强度薄膜还有很大的改良空间,解决薄膜力学性能较弱的方法可以引入含有共价键较多的基材。第一段阶梯加热为50,55 ℃的两段加热方式对薄膜性能没有进一步改善,推测更高温度的两段加热方式对薄膜性能的优化效果较小,这一观察结果节省了研究成本。
