纳米粉碎对3种食用菌风味特征及减盐增鲜效果的影响
2024-01-29班鑫荣陈万超李景军
班鑫荣 杨 焱 李 文 吴 迪 张 忠 陈万超 李景军
(1. 安徽科技学院,安徽 滁州 239000;2. 上海市农业科学院食用菌研究所,上海 201403;3. 农业农村部南方食用菌资源利用重点实验室,上海 201403;4. 国家食用菌工程技术研究中心,上海 201403)
大球盖菇、双孢蘑菇和草菇作为食用菌的代表性品种,因其独特的风味品质而备受人们喜爱。食用菌所具有的特殊风味,是其成为烹饪和美食领域重要组成部分的关键原因之一[1]。然而,传统的食用菌干燥、烹调以及粉碎方法会对食用菌的风味产生影响[2]。侯会等[3]发现食用菌在热风干燥的高温、富氧环境中,其有机酸易氧化为脂肪酸和氧代有机酸,或在热干燥中发生脱羧反应,导致含量降低;刘玉荞[4]发现经高压蒸煮处理后的双孢菇香气物质最少,可能是高压蒸煮破坏了风味物质结构;刘丽娜等[5]发现常规粉碎会使产品颗粒粗糙、分布不均匀,限制风味物质释放,影响最终产品口感和风味。纳米菌粉的制备可采用高能球磨法,通过罐体的冷循环系统,在常温和低温条件下,罐体快速进行多维摆动式运动,此时球磨介质会产生强烈的冲击力,使材料颗粒不断碰撞和摩擦,进而细化和混合颗粒,实现纳米级颗粒的制备[6]。
在食品生产中,采用纳米技术可以优化食品的物理化学性质,改善其营养和风味[7-8],为推动传统食品科学和食品工业的发展提供有效途径[9]。而目前有关纳米粉碎对食用菌风味品质的影响研究尚未见报道。研究拟评估纳米粉碎对大球盖菇、双孢蘑菇和草菇风味品质的影响,探索纳米粉碎在提高非挥发性和挥发性滋味成分含量方面的潜在优势,并分析纳米粉碎对食用菌增鲜减盐效果的影响,以期为进一步优化食用菌的加工工艺和改善风味品质提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大球盖菇、双孢蘑菇:上海联中食用菌专业合作社;
草菇:江苏江南生物科技有限公司;
AccQ-Tag氨基酸测定衍生试剂盒、氨基酸混标溶液:美国Waters公司;
5′-胞苷酸、葡萄糖、赤藓糖醇等标品:美国Sigma公司;
酒石酸等有机酸标准品:上海安谱实验科技股份有限公司;
甲醇、乙腈:色谱级,美国DIKMA公司;
邻二氯苯:色谱级,国药集团化学试剂有限公司;
氢氧化钠:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
高能纳米冲击磨:CJM-SY-B01型,秦皇岛市太极环纳米制品有限公司;
摇摆式高速万能粉碎机:QE-400型,浙江屹立工贸有限公司;
离心机:Allegra25RCentrifuge型,美国Beckman公司;
阴离子色谱仪:Dionex ICS2500型,美国DIONEX公司;
高效液相色谱仪:Waters600型,含2996型二极管阵列检测器,美国Waters公司;
固相微萃取装置:美国Supelco公司;
GC-MS联用仪:7890A-5975C型,美国Agilent公司;
电子舌味觉分析系统: SA402B型,日本Insent公司;
电子鼻系统:PEN3型,北京盈盛恒泰科技有限责任公司;
扫描电子显微镜:TM4000PLUS型,日本株式会社日立高新技术那珂事业所。
1.2 试验方法
1.2.1 纳米食用菌粉的制备 采用高速万能粉碎机将干制的大球盖菇、双孢蘑菇、草菇进行预粉碎,过60目筛,得到粗粉原样,含水量均在5%以下。将粗粉与磨球按照特定的体积比装入高能纳米冲击磨罐内,密封罐盖并紧固螺钉。罐体被安装于机器的套壳内,用螺母固定后,启动设备[10]。粉碎过程持续6 h,取出样品,用标准筛分离物料,真空包装[11]。
1.2.2 扫描电镜分析 参照牛潇潇等[12]的方法略修改。取适量样品平铺于导电胶上,用洗耳球将多余的样品轻轻吹扫,采用离子溅射法对样品进行镀金,喷金时间60 s,将样品置于扫描电子显微镜下观察其微观结构。像素1 080,工作距离12.2 mm,加速电压5 kV,束流强度为标准束流,探头模式为背散射。选取500~3 000倍进行观察。
1.2.3 溶解度测定 参照许佳林等[13]的方法。称取0.2 g食用菌粉末于15 mL离心管中,加入10 mL蒸馏水,涡旋混匀,沸水浴30 min,冷却,4 000 r/min 离心20 min,将上清液倒入事先干燥至恒重的干燥皿中,105 ℃干燥至恒重,并按式(1)计算溶解度。
(1)
式中:
S——溶解度,%;
A——上清液重量,g;
M——称样量,g。
1.2.4 非挥发性风味成分
(1) 游离氨基酸含量测定:参照陈荣荣等[14]的方法。色谱条件:AccQ·Tag氨基酸分析色谱柱(3.9 mm×150 mm×4 μm),流速1.0 mL/min,柱温37 ℃,紫外检测波长248 nm,进样量10 μL,流动相A为乙腈,流动相B为超纯水,流动相C为醋酸盐—磷酸盐缓冲液。
(2) 5′-核苷酸含量测定:取500 mg样品,加入25 mL超纯水,煮沸并保持10 min,冷却,10 000×g离心15 min,取上清液过0.22 μm MCE微孔滤膜,检测。色谱条件:UltimateAQ-C18色谱柱(250 mm×4.6 mm×5 μm);流动相为10 mmol/L KH2PO4缓冲盐(pH 4.68);流速1.0 mL/min;柱温30 ℃;进样量10 μL;紫外检测波长249 nm。
(3) 等效鲜味浓度值(EUC)测定:根据陈万超等[15]的方法。
(4) 有机酸含量测定:参照李巧珍等[16]的方法。色谱条件:GreenODS-AQC18色谱柱(250 mm×4.6 mm,5 μm);流动相为10 mmol/L KH2PO4缓冲盐(pH 2.8),等度洗脱模式,流速1.0 mL/min,紫外检测波长210 nm,柱温30 ℃,进样量10 μL。
(5) 可溶性单糖、糖醇含量测定:参照陈万超等[17]的方法。色谱条件:CarboPac PA-20 色谱柱(4 mm×250 mm),进样量25 μL,流速0.4 mL/min,柱温30 ℃,流动相为0.48 mol/L NaOH。
1.2.5 挥发性风味成分分析 参照陈万超等[18]的方法。
1.2.6 电子鼻分析 参照谷镇[19]的方法。
1.2.7 电子舌分析
(1) 3种食用菌纳米粉碎前后的电子舌分析:准确称取1 000 mg样品粉末,加入30 mL蒸馏水,沸水浴30 min,冷却,10 000×g离心15 min,提取上清液,并用蒸馏水稀释5倍,以制备待测液,取40 mL倒入电子舌专用杯中测定。五味如酸味、苦味、涩味、鲜味、咸味以及甜味的数据通过仪器自带的数据处理软件获得。每个样品重复4次。
(2) 增鲜减盐试验:参照严方等[20]的方法略修改。测定质量分数为0.01%,0.05%,0.10%,0.30%,0.50%,0.70%,0.80%,0.90%,1.00%盐溶液的电子舌,以质量分数为横坐标,咸味值为纵坐标建立标准曲线(y=5.256 4lnx+33.218,R2=0.999 9)。以0.5%盐溶液为对照,且样品溶液中盐质量分数保持在0.5%水平,分别加入0.5%的食用菌粉样品进行复配混匀,并直接倒入电子舌专用杯中进行测定。
纳米菌粉与NaCl溶液的复配参照Yu等[21]的方法略修改,保持盐溶液和纳米粉碎菌粉复配液终浓度相同,以0.5%的NaCl溶液作为对照,梯度降低盐的质量分数为0.4%,0.3%,0.2%,0.1%,并分别添加0.1%,0.2%,0.3%,0.4%的纳米粉碎菌粉,混匀后进行电子舌测定。
1.3 统计学分析
利用IBM SPSS Statistics 26和Origin 2019b 32Bit软件对数据进行显著性差异分析并绘图。数据以平均数±标准偏差表示,小写字母不同表示差异显著(P<0.05)。
2 结果与分析
2.1 3种食用菌纳米粉碎前后的微观结构表征
由图1可知,3种食用菌的微观形态各有差异,大球盖菇的形态类似木炭,经纳米粉碎后颗粒变得细小且密集,更加碎片化;双孢蘑菇为多层片状结构,表面不平整,而纳米粉碎双孢蘑菇像细小的土壤颗粒,成团居多;草菇的形态与双孢蘑菇的类似,但纳米粉碎后草菇的颗粒比双孢蘑菇的更小,且成球居多。初始食用菌粉颗粒具有不规则的形状,经纳米粉碎后,颗粒形状更加均匀,更接近球形。这是因为粉碎过程中颗粒受到力的作用逐渐被破碎和研磨,形状变得更加均匀,孔隙结构更为紧密。总的来说,相比于常规粉碎,纳米粉碎能较好均质化3种食用菌粉末。

图1 纳米粉碎对3种食用菌微观结构的影响
2.2 3种食用菌纳米粉碎前后的溶解度
由图2可知,相比于常规粉碎,纳米粉碎后大球盖菇、双孢蘑菇和草菇的溶解度均显著提高,这可能是纳米粉碎技术将颗粒变得更细小均匀,增加了颗粒表面积,使颗粒表面和内部的亲水基团与水接触,因此溶解度增大;也有可能是因为纳米粉碎过程中,由于强烈的压力、剪切和摩擦力作用,食用菌中的部分不溶性物质可能发生连接键的破裂或部分熔化现象,从而转化为可溶性物质,增加了溶解性[22]。说明纳米粉碎技术对提高食用菌的溶解度具有积极作用。
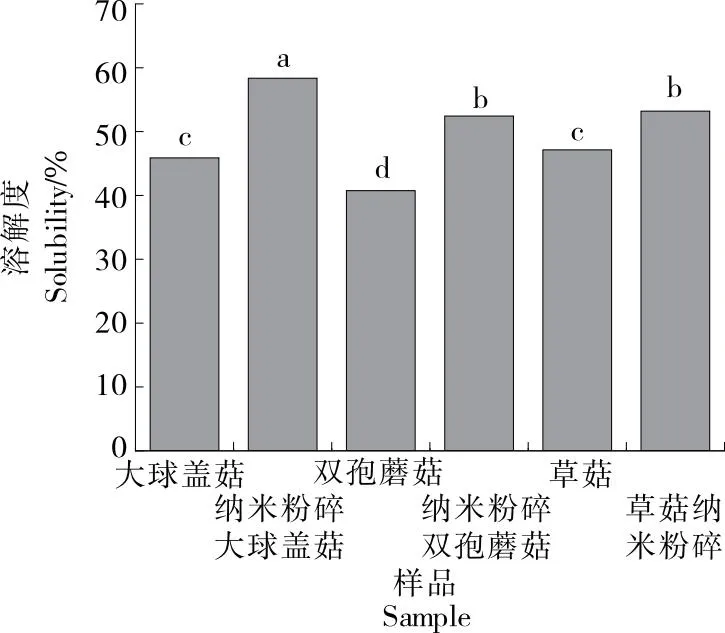
图2 3种食用菌纳米粉碎前后的溶解度
2.3 3种食用菌纳米粉碎前后的非挥发性风味成分
2.3.1 游离氨基酸和核苷酸含量 食用菌样品中的游离氨基酸和核苷酸在营养和风味方面具有重要作用。甜味与丙氨酸、甘氨酸、脯氨酸、丝氨酸和苏氨酸含量有关;谷氨酸和天冬氨酸含量与鲜味有关,风味5′-核苷酸(5′-IMP、5′-GMP和5′-XMP)也有助于食用菌的鲜味,而苯丙氨酸、异亮氨酸、亮氨酸和蛋氨酸含量与苦味有关[23]。
由表1可知,纳米粉碎后,除草菇外,其他两类样品中的游离氨基酸和核苷酸总量均显著增加(P<0.05)。常规粉碎的大球盖菇中甜味氨基酸含量最高;经纳米粉碎后,甜味氨基酸含量显著增加,其中含量最高的鲜味氨基酸谷氨酸(Glu)增加得最多,占鲜味成分的78%[24]。这可能是由于谷氨酰胺酶的水解作用。表明纳米粉碎可以有效改善大球盖菇鲜味。

表1 纳米粉碎对3种食用菌中游离氨基酸和核苷酸的影响
对于草菇来说,纳米粉碎显著提高了苦味氨基酸含量(P<0.05),不利于草菇的风味。纳米粉碎双孢蘑菇中游离氨基酸总量最高,为76.53 mg/g,且相比于常规粉碎方法,其呈味核苷酸含量显著提高,可能是由于纳米粉碎改变了双孢蘑菇的细胞壁结构,增加了其可溶性,导致游离氨基酸和核苷酸的释放。
纳米粉碎草菇的呈味核苷酸含量无明显变化,而纳米粉碎双孢蘑菇和纳米粉碎大球盖菇中的呈味核苷酸含量显著增加(P<0.05),可能是由于纳米粉体可以使呈味核苷酸更易于释放出来,增加了样品的呈味强度。
2.3.2 等效鲜味浓度(EUC) 等效鲜味浓度常用于评价氨基酸和5′-核苷酸协同作用下蘑菇鲜味,EUC值>1 000 g MSG/g为较高水平,100~1 000 g MSG/g为高水平,10~100 g MSG/g为中水平,<10 g MSG/g为低水平[25-26]。由图3可知,纳米粉碎双孢蘑菇的EUC值达到了785.77 g MSG/100 g,鲜味质量较高,其鲜味氨基酸和风味核苷酸含量也非常丰富。经纳米粉碎后大球盖菇和双孢蘑菇的EUC值显著提升(P<0.05),但草菇的增加效果不显著,其中大球盖菇的EUC值提高了159.86%,双孢蘑菇的提高了142.28%,说明纳米粉碎对其鲜味的提升作出了极大贡献,有助于提高食用菌样品的风味和营养价值。

图3 3种食用菌纳米粉碎前后的EUC值
2.3.3 有机酸含量 由表2可知,纳米粉碎后,大球盖菇和草菇的呈味有机酸含量和总量均显著提高,可能是因为纳米粉碎破坏了食用菌的细胞结构,增加了有机酸的可溶性和释放程度[27]。纳米粉碎双孢蘑菇中的有机酸含量略微增加,但无明显差异,可能是因为不同的食用菌在细胞结构和化学组成方面存在差异,从而对纳米粉碎的响应程度也不同。
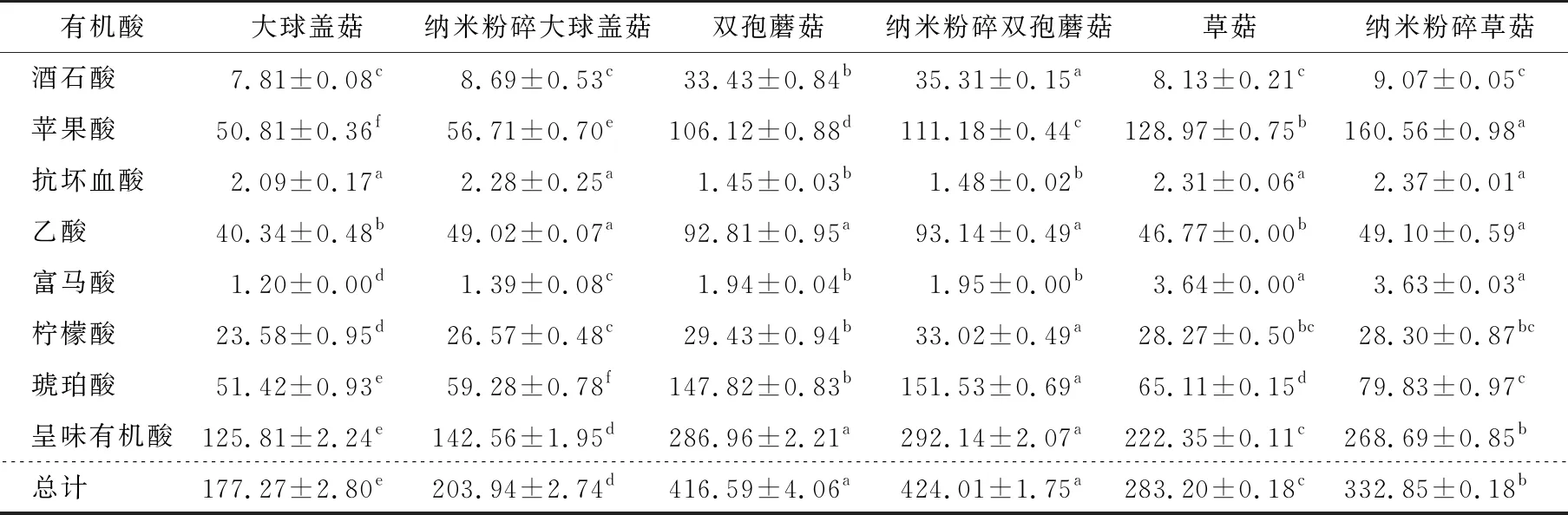
表2 纳米粉碎对3种食用菌有机酸的影响†
综合来看,纳米粉碎对食用菌中有机酸含量影响显著,但具体效果取决于菇种和化合物类型,纳米粉碎有助于释放和提取食用菌中的有机酸化合物。
2.3.4 可溶性糖含量 可溶性糖是产生甜味和影响蘑菇味道的主要物质[28]。由表3可知,纳米粉碎后,大球盖菇、双孢蘑菇、草菇的糖醇含量显著下降,可能是因为纳米粉碎过程中的高压力或剧烈搅拌等作用力导致糖醇分解或损失;大球盖菇中含量最高的单糖为葡萄糖,纳米粉碎大球盖菇的葡萄糖含量显著增加(P<0.05),双孢蘑菇和草菇中也有类似现象,可能是由于食用菌的结构在纳米粉碎的高压过程中被破坏,导致细胞破裂和破碎,细胞壁和膜的完整性被破坏,胞壁多糖降解,从而增加了葡萄糖含量[29];粉碎过程中积累的较高内部温度和增强的酶促反应也可能导致可溶性糖醇含量下降;此外,纳米粉碎可以促进蛋白质中游离氨基酸的产生以及食用菌中氨基酸和糖之间的美拉德反应,从而使食用菌中糖醇含量减少[30]。
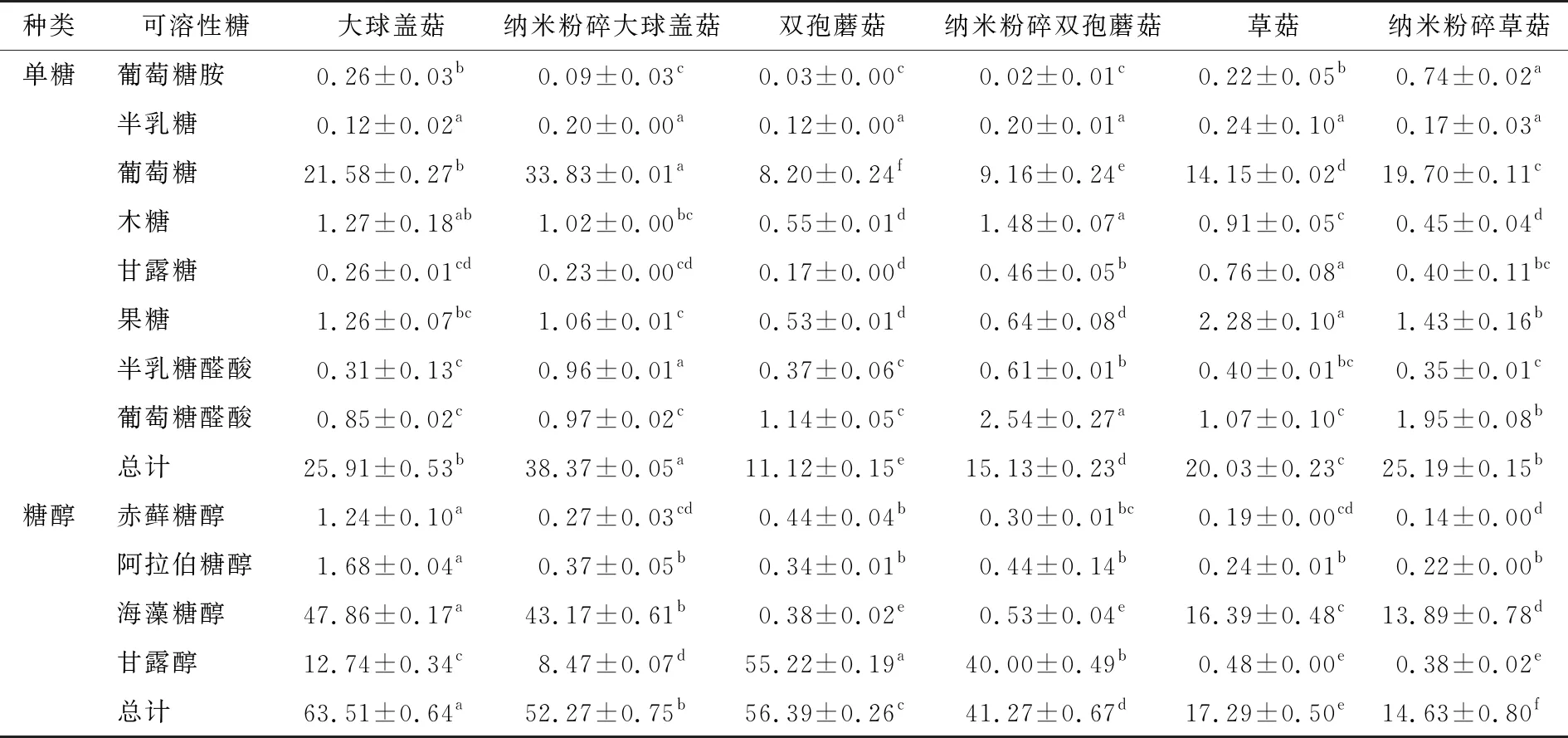
表3 纳米粉碎对3种食用菌可溶性糖含量的影响
2.4 电子鼻分析
W1C、W5S、W3C、W6S、W5C、W1S、W1W、W2S、W2W、W3S传感器分别对芳香物质、氮氧化合物、氨类及芳香物质、氢化合物、烯烃及芳香物质、烃类、含硫化合物、醇类醛酮类、芳香化合物及有机硫化物、烷烃等化学物质响应信号较强[31]。由图4(a)可知,纳米粉碎后,WIC传感器响应值增大,说明芳香物质响应信号增强,即芳香物质含量增加。W5S传感器表现出对氮氧化合物极高的敏感性,其中大球盖菇和草菇在纳米粉碎后的响应值较大,说明纳米粉碎技术可能导致菇中氮氧化合物浓度增加。由图4(b)可知,PC1的贡献率为52.4%,PC2的为28.3%,累计贡献率为80.7%,说明这两个主成分可以代表样品的大部分信息。除大球盖菇外,其余样品均分布在不同的区域,说明纳米粉碎前后的双孢蘑菇和草菇可以被区分开[32],纳米粉碎后双孢蘑菇主要在W1S传感器上差异显著,相较于常规粉碎,其响应值大幅增加,表明纳米粉碎可能导致双孢蘑菇中烃类含量增加;而纳米粉碎后草菇主要在W1S传感器上响应比较强烈,表明纳米粉碎可能促进了草菇含硫化合物的释放。综上,纳米粉碎过程可能会释放更多的挥发性化合物,或使原有的化合物更容易被传感器探测到,从而改变传感器的响应值。

图4 纳米粉碎对3种食用菌电子鼻的影响
2.5 挥发性风味成分分析
由图5可知,3种食用菌中共检出87种挥发性化合物,包括烷烃类6种、醛类18种、酯类19种、酮类12种、酸类9种以及其他类6种,各食用菌的挥发性组分存在显著差异。

图5 纳米粉碎前后3种食用菌挥发性化合物含量的聚类热图
由图6可知,大球盖菇、双孢蘑菇和草菇中分别检出43,30,34种挥发性化合物。经纳米粉碎后,各食用菌中挥发性化合物的种类和含量均有不同程度的增加,其中纳米粉碎大球盖菇增加了12种,且显著高于大球盖菇,可能是因为纳米粉碎破坏了食用菌粉的结构,更细小的颗粒和增加的表面积可以促进化合物从样品中挥发出来,增加其在气相色谱中的信号强度,从而使其含量增加[33]。
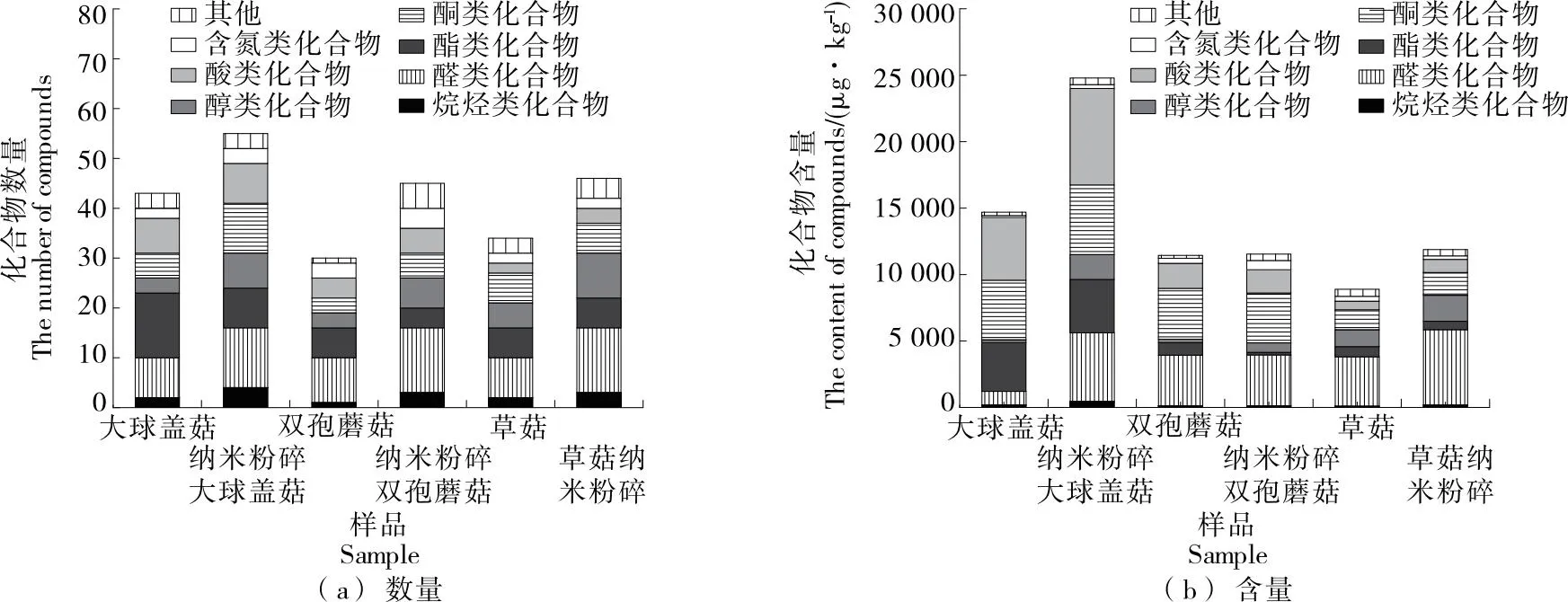
图6 样品中8组挥发性化合物的丰度
纳米粉碎后,双孢蘑菇中的烷烃类、醛类、酮类、醇类和酸类化合物含量略有上升,酯类和含氮类化合物含量变化较为稳定;而草菇中的烷烃类、醛类、酮类、醇类和酸类化合物含量相对稳定,酯类和含氮类化合物含量有所下降,可能是因为草菇在粉碎过程中引起了一些化合物的分解或挥发[34]。
综上,纳米粉碎对大球盖菇、双孢蘑菇和草菇的挥发性风味成分产生了不同程度的影响,可能与菌种的细胞结构、化合物的性质以及纳米粉碎过程中的温度、压力和力度等因素有关。此外,蘑菇的风味成分也会因种植、收获和加工条件的不同而存在较大差异。
2.6 电子舌分析
由图7(a)可知,纳米粉碎后,大球盖菇、双孢蘑菇和草菇的甜味、鲜味和苦味得分差异较大,6个样品中纳米粉碎双孢蘑菇的鲜味值最高,与EUC值变化一致;纳米粉碎后,大球盖菇的鲜味得到了显著提升,鲜味值增加了10倍。此外,纳米粉碎后,大球盖菇和双孢蘑菇表现出更为强烈的增鲜作用,因此在一定程度上可以减少食物中味精的添加量。草菇和纳米粉碎草菇的鲜味值差异不明显,但纳米粉碎草菇的甜味值最高,是草菇的2倍多,可能是由于纳米粉碎增加了食用菌粉颗粒中甜味物质的释放。综上,纳米粉碎使3种食用菌在整体口味和鲜味方面得到了提升,与非挥发性风味成分的结果一致。

图7 纳米粉碎对3种食用菌电子舌的影响
由图7(b)可知,PC1的贡献率为67.1%,PC2的贡献率为23.8%,累计贡献率为90.9%,表明这两个主成分能够代表样品的绝大部分信息[35]。纳米粉碎前后的大球盖菇和双孢蘑菇分布在不同的区域,无重叠,说明这两种菌菇在纳米粉碎后风味发生了改变,可以被区分开,而纳米粉碎前后的草菇与纳米粉碎大球盖菇间有所重叠,不能有效区分。
2.7 增鲜减盐试验
由表4可知,相对于0.5%盐溶液对照组,加入0.5%经纳米粉碎的样品后,溶液的鲜味和咸味响应值均显著升高,表明纳米粉碎样品具有增咸和增鲜的效果。其中纳米粉碎双孢蘑菇的增味效果略高于其他两种样品。0.5%的纳米粉碎双孢蘑菇、大球盖菇和草菇分别能增加0.28%,0.25%,0.25%的盐浓度。此外,在盐溶液中添加纳米样品的鲜味值高于样品溶液自身,与0.5%的盐溶液对照组相比,加入0.5%纳米粉碎双孢蘑菇后鲜味值提高了145%,加入0.5%纳米粉碎大球盖菇和纳米粉碎草菇的鲜味值为常规粉碎组的2.4倍,说明样品与盐溶液之间可能存在协同增效作用。
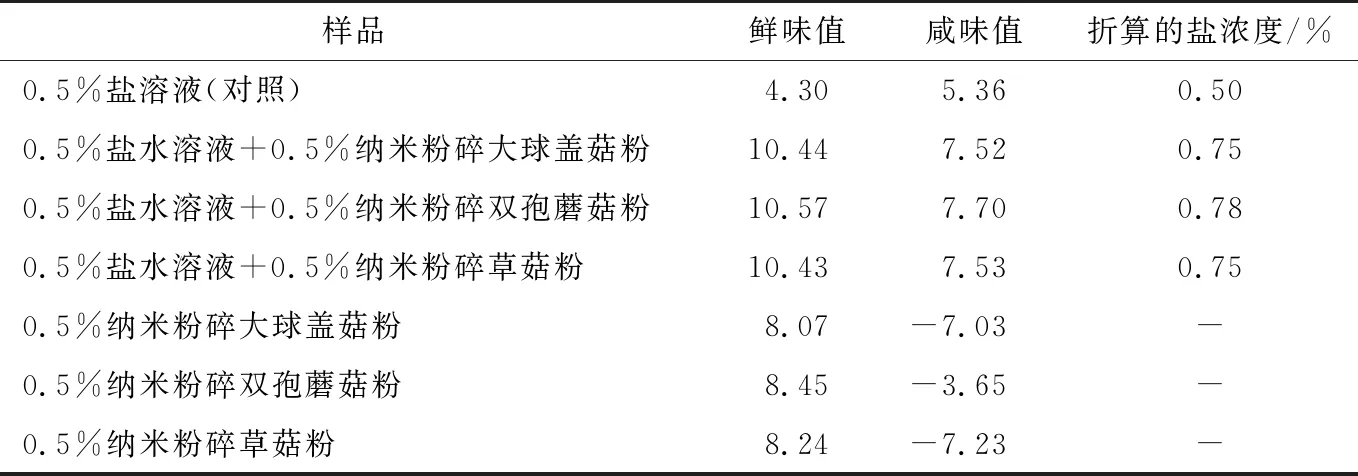
表4 纳米粉碎后样品的增味效果
由图8可知,随着纳米粉碎样品添加量的增加,NaCl溶液浓度随之降低,其增咸效果减弱,可能归因于食用菌浓度太高,其酸、苦味掩盖或抑制了复合溶液的咸味。在不影响溶液整体口味的情况下,0.2%纳米粉碎样品和0.3%盐溶液复配可以达到对照组的效果,相较于对照组,纳米粉碎后的3种食用菌均可替代40%以上的NaCl,其中双孢蘑菇的效果更显著。在相同条件下加入适量的纳米粉碎样品,能够在不减少咸味的情况下降低食盐的摄入量,从而实现科学的减盐目标,并保持咸味不减,同时还能提供额外的鲜味效果[36]。此外,纳米粉碎后的菌粉作为风味剂应用至食品工业中,具有较强的溶解性,能有效减少食物中风味增强剂的使用量。

图8 纳米粉碎后样品的减盐效果
3 结论
利用高能纳米冲击磨将大球盖菇、双孢蘑菇、草菇进行纳米粉碎,与常规粉碎相比,纳米粉碎技术通过破坏细胞壁结构和增加比表面积,可能改变了食用菌样品中的化学物质释放和可溶性,使得食用菌粉中非挥发性成分(游离氨基酸、核苷酸、有机酸)和挥发性成分含量显著增加,对食用菌的味道、风味和口感产生较大的影响。此外,纳米粉碎后的食用菌粉还具有增鲜减盐的效果,可以作为风味剂应用至复合调味品中。综上,纳米粉碎有利于食用菌粉的风味成分释放,提高食用菌粉的利用率。然而,纳米粉碎技术对食用菌样品的综合影响需进行进一步的评估,包括营养成分、稳定性和应用等方面。此外,应在食品加工和消费者层面进行进一步研究,以确定纳米粉碎技术在食用菌产品开发中的潜在应用和食品安全性。
