红景天苷改善顺铂引起的小鼠耳蜗毛细胞和螺旋神经节神经元损伤的机制*
2024-01-29李兆龙徐义策李泽文周洁
李兆龙 徐义策 李泽文 周洁
顺铂(cisplatin,CIS)是多种恶性肿瘤的一线化疗药物,可引起进行性的、不可逆的和累积性的听力损伤,这种耳毒性是限制其临床应用的重要原因[1]。目前尚无针对CIS耳毒性的有效预防措施,因此有必要寻找减轻或阻止CIS耳毒性的保护剂,以突破CIS化疗的剂量限制。研究[2,3]表明,CIS可在耳蜗中蓄积并长期存在,诱导耳蜗毛细胞(cochlear hair cell,CHC)和螺旋神经节神经元(spiral ganglion neuron,SGN)过度产生并积累活性氧(reactive oxygen species,ROS),导致细胞丢失或死亡,进而损害听力。中药提取物红景天苷(salidroside,SAL)具有抗氧化、抗凋亡、抗炎、神经保护等功效[4]。已证实,SAL可改善氨基糖苷类药物[5]及金属锰[6]的耳毒性,推测其对CIS的耳毒性也有改善作用。CHC的支持功能和SGN的传导功能依赖于细胞存活,是听力维持的生理基础[7]。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)为重要的第二信使,可诱导蛋白激酶A(protein kinase A,PKA)/cAMP效应元件结合蛋白(cAMP response element-binding protein,CREB)信号通路激活,促进下游抗凋亡蛋白(Bcl-2)和神经保护因子(BDNF、NF)的表达,预防细胞(包括神经元)凋亡,有利于细胞存活[8,9]。然而,SAL对CIS耳毒性的改善作用是否与cAMP/PKA/CREB通路有关并不清楚。故本研究拟采用CIS处理离体耳蜗组织,观察SAL干预对CIS所致CHC、SGN损伤和cAMP/PKA/CREB通路的影响,以探讨SAL改善CIS耳毒性的可能机制。
1 材料和方法
1.1实验动物 SPF级新生2 d的C57BL/6小鼠50只,由华中科技大学同济医学院实验动物中心馈赠。
1.2试剂和仪器 SAL(纯度≥98%)购自Sigma公司;特异性cAMP抑制剂SQ22536、PKA抑制剂H-89购自MCE公司;神经元β3-tubulin抗体、羊抗兔(Alexa Fluor 647或Alexa Fluo 488或HRP偶联)IgG抗体、DAPI、NF-M抗体购自CST公司;肌球蛋白(myosin7a,MYO7A)、BDNF抗体、ROS检测CellROXTMDeep Green试剂盒购自Invitrogen公司;cAMP ELISA试剂盒、GAPDH抗体、PKA抗体、p-CREB抗体、CREB抗体、Bcl-2抗体购自Abcam公司;化学发光试剂购自Millipore公司;蛋白提取试剂购自上海生工公司;激光共聚焦显微镜购自奥林巴斯公司;电泳和转膜设备购自BioRad公司。
1.3实验方法
1.3.1耳蜗基底膜的分离和培养[10]将新生2 d的C57BL/6小鼠断头处死,75%酒精消毒全身后,固定头部并暴露双侧颞骨,解剖镜下分离双侧听泡置于Hank’s平衡液中,小心去除螺旋韧带等,分离出条状的耳蜗基底膜[含有内毛细胞(IHC)、外毛细胞(OHC)及SGN]。将耳蜗基底膜(Corti器面朝上)平铺在含有胶原蛋白的无血清BME培养液凝胶表面,轻压固定,在培养箱中过夜(37℃,5%CO2)。次日,更换新鲜培养液并加入CIS或SAL进行干预。
1.3.2分组及给药 随机数字法将耳蜗基底膜分为对照组(C组)、CIS组、SAL组、SAL+SQ22536(cAMP抑制剂)组和SAL+H-89(PKA抑制剂)组,每组20条。C组仅加入无血清BME培养液;CIS组在培养液中加入15 μmol/L CIS[11];SAL组在CIS组基础上加入5 μmol/L SAL[7];SAL+SQ22536组在CIS组基础上加入5 μmol/L SAL和5 μmol/L SQ22536;SAL+H-89组在CIS组基础上加入5 μmol/L SAL和30 μmol/L H-89。在培养箱中孵育48 h后进行后续实验。
1.3.3免疫荧光染色 用4%多聚甲醛固定各组耳蜗基底膜(n=10,β3-tubulin、MYO7A各5条),用PBS、Triton X-100处理后,加入羊血清封闭45 min;滴加一抗兔抗小鼠神经元β3-tubulin(1∶800)或兔抗小鼠MYO7A(1∶50)作用过夜、滴加二抗(Alexa Fluor 647偶联抗兔IgG或Alexa Fluo 488偶联抗兔IgG,稀释比1∶500)避光作用2 h,并用DAPI(1∶1 000)核染色剂作用10 min,封片后在共聚焦显微镜下拍照。计数CHC(MYO7A标记的完整细胞)和SGN(β3-tubulin标记的完整细胞)数量。
1.3.4ROS含量检测 多聚甲醛固定各组耳蜗基底膜(n=5),用PBS处理后,加入CellROXTMDeep Green工作液(绿色荧光)避光作用30 min,加入DAPI(1∶1 000)核染色剂作用10 min,封片后在共聚焦显微镜下拍照。用Image J分析绿色荧光强度,以评估耳蜗基底膜中ROS含量。
1.3.5cAMP含量检测 将处理好的基底膜从凝胶表面小心剥离,用RIPA裂解液裂解各组耳蜗基底膜(n=5),离心上述裂解液,收集上清,按照指导书依次加入cAMP ELISA工作液,在酶标仪读取OD450nm,计算cAMP含量。
1.3.6Western blot检测 收集1.3.5所得裂解液上清并用BCA试剂盒测定蛋白浓度。用SDS-PAGE凝胶电泳分离等量的蛋白样品(30 μg),并转移到PVDF膜;用封闭液(5%脱脂奶粉)封闭后,相继加入一抗[GAPDH抗体(1∶2 000)、PKA抗体(1∶1 000)、p-CREB抗体(1∶500)、CREB抗体(1∶500)、Bcl-2抗体(1∶500)、BDNF抗体(1∶1 000)、NF-M抗体(1∶1 000)]、HRP标记二抗(1∶3 000);用化学发光液显影蛋白条带并拍照。以GAPDH为内参分析PKA等蛋白条带相对灰度。
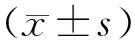
2 结果
2.1各组基底膜毛细胞免疫荧光染色观察结果 C组耳蜗基底膜中可见三排OHC和单排IHC有序紧致排列,CHC形态规则;CIS组CHC排列混乱,分层不清楚,体积肿大;SAL组CHC排列及形态趋于规则;SAL+SQ22536组和SAL+H-89组CHC排列及形态较SAL组差(图1)。与C组相比,CIS组CHC数量较少(P<0.05);与CIS组相比,SAL组CHC数量较多(P<0.05);与SAL组相比,SAL+SQ22536组和SAL+H-89组CHC数量较少(P<0.05)(表1),说明SAL可以减轻CIS引起的耳蜗毛细胞损伤。
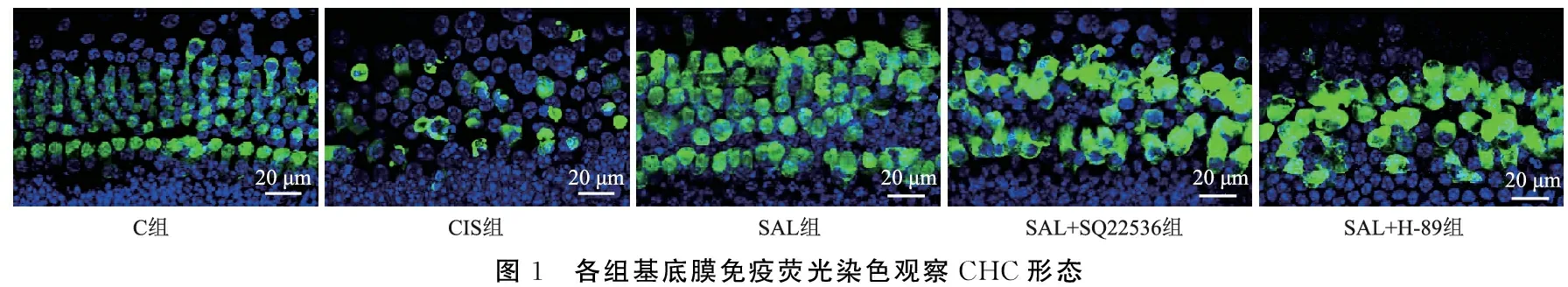
图1 各组基底膜免疫荧光染色观察CHC形态

表1 各组CHC、SGN数量及ROS相对荧光强度比较
2.2各组基底膜SGN免疫荧光染色观察结果 C组耳蜗基底膜中可见密集分布的圆形或椭圆形的SGN,细胞质、核染色均匀,可见大量由胞体延伸出的神经突;CIS组个别SGN细胞核破碎,大量SGN的神经突缺失;SAL组SGN形态趋于正常;SAL+SQ22536组和SAL+H-89组SGN形态较SAL组差(图2)。与C组相比,CIS组SGN数量较少(P<0.05);与CIS组相比,SAL组SGN数量较多(P<0.05);与SAL组相比,SAL+SQ22536组和SAL+H-89组SGN数量较少(P<0.05)(表1),说明SAL可以减轻CIS引起的耳蜗SGN损伤。
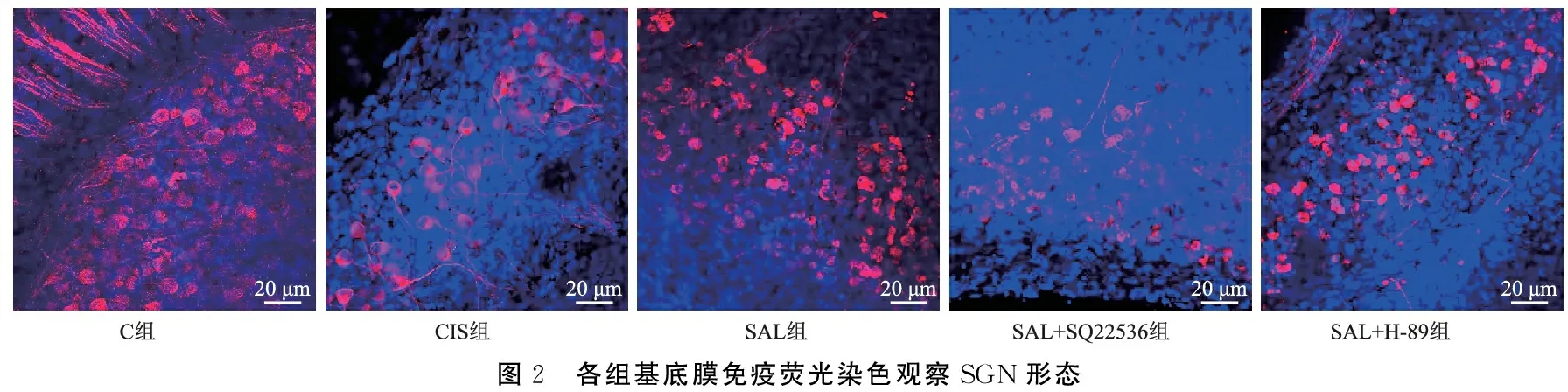
图2 各组基底膜免疫荧光染色观察SGN形态
2.3各组ROS含量检测结果 由表1可见,与C组相比,CIS组ROS含量较高(P<0.05);与CIS组相比,SAL组ROS含量较低(P<0.05);与SAL组相比,SAL+SQ22536组和SAL+H-89组ROS含量较高(P<0.05)(图3、表1),说明SAL可改善GIS引起的氧化损伤。
图3 CellROXTM Deep Green试剂盒检测耳蜗基底膜ROS含量
2.4各组cAMP/PKA/CREB信号通路检测结果 由表2可见,与C组相比,CIS组cAMP含量、PKA蛋白及p-CREB/CREB水平较高(P<0.05);与CIS组相比,SAL组cAMP含量、PKA蛋白及p-CREB/CREB水平较高(P<0.05);与SAL组相比,SAL+SQ22536组cAMP含量、PKA蛋白及p-CREB/CREB水平较低(P<0.05),SAL+H-89组PKA蛋白及p-CREB/CREB水平较低(P<0.05)(图4、表2),说明SAL激活了cAMP/PKA/CREB信号通路。

表2 各组cAMP含量、PKA、p-CREB、CREB蛋白水平比较
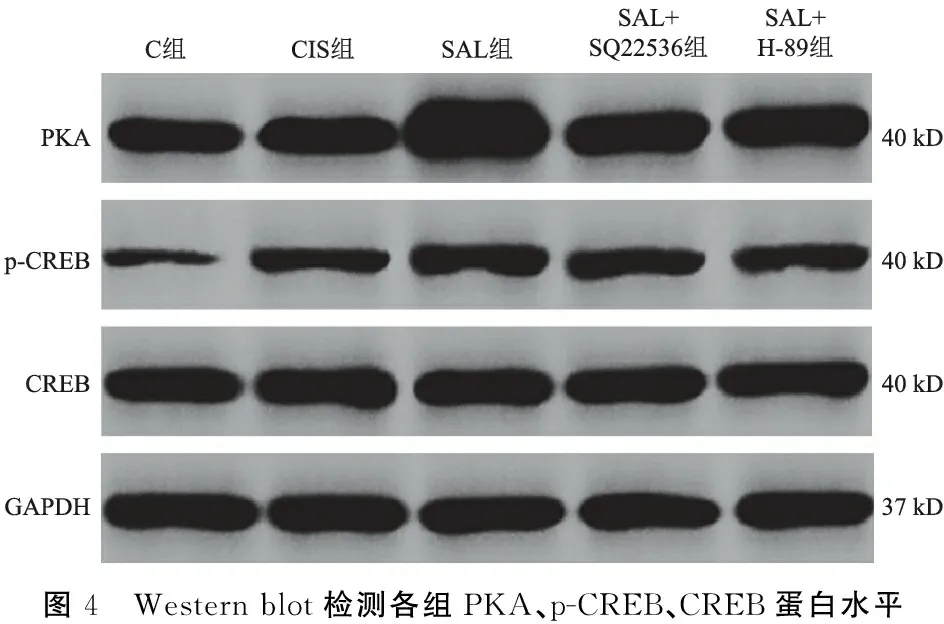
图4 Western blot检测各组PKA、p-CREB、CREB蛋白水平
2.5各组BDNF、NF-M、Bcl-2蛋白表达检测结果 由表3可见,与C组相比,CIS组BDNF、NF-M、Bcl-2蛋白水平较高(P<0.05);与CIS组相比,SAL组BDNF、NF-M、Bcl-2蛋白水平较高(P<0.05);与SAL组相比,SAL+SQ22536组、SAL+H-89组BDNF、NF-M、Bcl-2蛋白较低(P<0.05)(图5、表3),说明SAL促进了BDNF、NF-M、Bcl-2蛋白的表达。

表3 各组BDNF、NF-M、Bcl-2蛋白水平比较
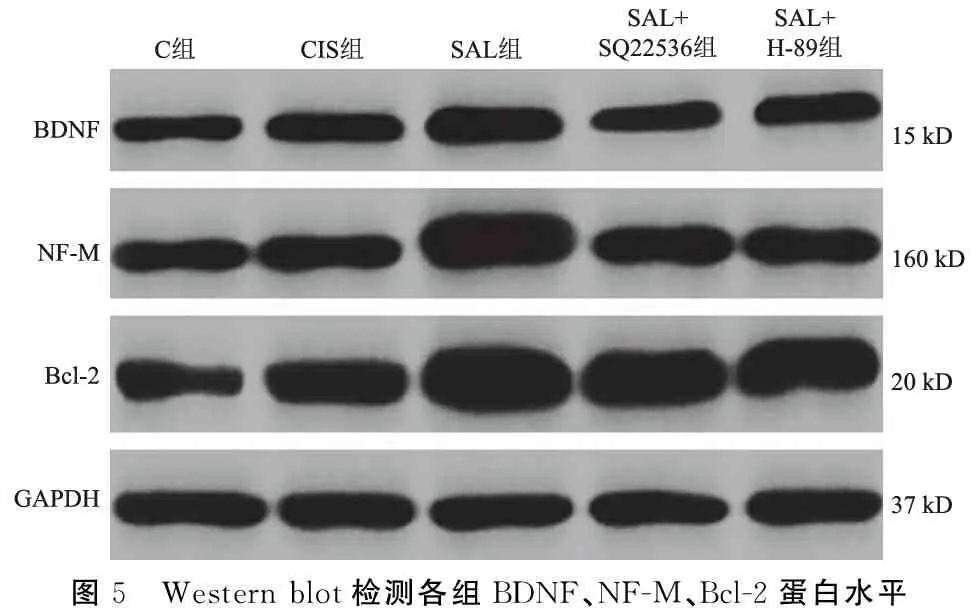
图5 Western blot检测各组BDNF、NF-M、Bcl-2蛋白水平
3 讨论
据报道,约40%~80%的CIS化疗患者会出现永久性听力损伤[12]。本研究中,CIS组CHC和SGN数量显著减少且排列混乱,大量SGN的神经突缺失,同时ROS含量增加了3.8倍,这是因为耳毒性药物可引起耳蜗组织中ROS/氮物质的积累、线粒体功能障碍等,造成CHC和/或SGN损伤[3,13]。
中药红景天具有“扶正益本、补气生血”等功效,SAL为其糖苷提取物,可通过抗焦亡、抗氧化、抗代谢应激等对大脑[14]、耳[6]、肝脏[15]等产生保护作用。本研究中SAL的作用浓度为5 μmol/L,这是由于Ding等[5]通过一系列实验确定了5 μmol/L SAL预处理能显著减轻锰诱导的耳毒性,故本实验中采用这一浓度。既往研究[3,13]已证实,ROS在CIS所致听神经损害中发挥关键作用,其水平增加最终导致CHC和SGN凋亡和死亡,抑制其可减轻CIS所致的听神经损害。本研究显示,与CIS组相比,SAL组ROS含量降低了2.5倍,CHC和SGN数量和形态均明显改善,表明SAL可以降低CIS诱导的CHC和SGN内ROS含量,从而起到保护CHC和SGN的作用,缓解CIS引起的耳毒性。
cAMP/PKA/CREB通路的活化通过PKA介导的CREB磷酸化实现,它作为转录因子调节各种基因[16]。正常生理环境下,PKA以无活性的形式存在于细胞中;遇刺激时,cAMP在细胞中积累增加,与调节亚基结合释放出具有活性的PKA,催化CREB蛋白的Ser133发生磷酸化(p-CREB),p-CREB与BDNF、NF、Bcl-2等靶基因启动子区特定序列结合并启动转录,提高细胞的抗凋亡能力和存活能力[8,9,16],是细胞损伤后启动的自我修复。BDNF和NF是重要的神经营养因子,有利于神经元的生长、分化和存活,维持神经元的功能和可塑性,是细胞应对多种伤害性刺激的保护因子[17]。Bcl-2为重要的抗凋亡蛋白,通过阻止细胞凋亡促进细胞存活[8]。本研究结果中,CIS组耳蜗基底膜中cAMP含量及PKA、p-CREB/CERB、BDNF、NF-M、Bcl-2蛋白水平增多,可能因为CIS产生的ROS等有害物质激活了自我保护性cAMP/PKA/CREB信号通路,但不足以抵抗CIS造成的CHC和SGN损伤。而SAL可以进一步增加耳蜗基底膜中cAMP含量、PKA、p-CREB/CERB蛋白水平及下游靶蛋白BDNF、NF-M、Bcl-2的表达,说明SAL的保护作用导致cAMP/PKA/CREB信号通路进一步活化,有助于减轻多种条件诱导的细胞凋亡[18,19]。本研究还发现,SAL的上述保护作用可被cAMP抑制剂SQ22536或PKA抑制剂H-89减弱,提示激活cAMP/PKA/CREB信号通路可能是SAL改善CIS耳毒性的机制之一。
综上所述,SAL可能通过cAMP/PKA/CREB通路促进抗凋亡蛋白和神经保护因子表达,缓解CIS引起的CHC和SGN损伤,且SAL也具有抗癌活性[20],并可增强顺铂的抗癌作用[21],提示SAL可能可以作为预防CIS耳毒性的药物。
