胃蛋白酶在声带息肉、声带癌中的作用分析△
2024-01-29高竞逾罗仁婧阮标江超武刘卓慧龙瑞清梁秋林张策苏路李鹏
高竞逾 罗仁婧 阮标 江超武 刘卓慧 龙瑞清 梁秋林 张策 苏路 李鹏
咽喉反流(laryngopharyngeal reflux,LPR)由于较高的发病率以及与一系列耳鼻咽喉科、呼吸内科疾病的相关性而得到越来越多的重视[1,2]。研究证实LPR是咽喉部良性和恶性病变的危险因素之一[3,4]。大量研究发现胃蛋白酶(pepsin)可能在声带息肉、任克水肿、声带白斑、喉癌等疾病的发病中起重要作用[5-7]。但声带良恶性病变中胃蛋白酶表达的差异仍然没有明确的报道。本研究比较声带癌、声带息肉与健康人群间反流症状指数(reflux symptomindex,RSI)、反流体征评分(reflux finding score,RFS)、胃蛋白酶检测试剂盒结果的差异,探讨胃蛋白酶在声带良恶性疾病发病中的作用,为声带良恶性疾病的防治提供参考。
1 资料与方法
1.1研究对象 选取2020年5月至2021年12月就诊于昆明医科大学第一附属医院耳鼻咽喉科的住院患者及健康志愿者共77例。分为声带息肉组、声带癌组以及对照组。患者在检查前2周内均未服用质子泵抑制剂、胃动力药物等。排除标准:①处于急性上呼吸道感染或此前有咽喉部、胃肠道手术史者;②有Zolling-Ellison综合征、贲门失弛缓、贲门痉挛、食管狭窄及其他食管病变者;③此前一个月内进行CPAP治疗;④重大慢性疾病病史、精神疾病、神经系统疾病者;⑤中途发生严重症状,临床判定需要进行干预者。所有研究对象均同意参与该项研究并签署知情同意书,该项研究通过昆明医科大学第一附属医院伦理委员会审批[(2022)伦审L第130号]。
声带息肉组27例,入选标准:喉镜检查示声带息肉,经保守治疗(声休、发声训练)无效,行支撑喉镜下声带息肉取材活检术,且术后病理检查结果提示声带息肉。声带癌组27例,入选标准:喉镜检查示声带肿物,且经保守治疗无效,行支撑喉镜下声带肿物取材活检术,术后病理检查结果提示声带鳞状细胞癌;其中,原位癌8例,浸润癌4例,鳞状细胞癌15例(高分化6例,中-高分化1例,中分化7例,低分化1例)。对照组23例,入选标准:无明显声带病变,无耳鼻喉科相关疾病,无胃肠道相关疾病。三组年龄及性别分布见表1。
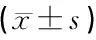
表1 三组受试者临床资料、RSI、RFS评分及Peptest检查结果
1.2研究方法
1.2.1RSI和RFS评分 对声带息肉组、声带癌组、对照组由同一医师行电子喉镜检查以及 RSI、RFS评分,RSI>13分和/或RFS>7分者为阳性;反之则为阴性。
1.2.2胃蛋白酶检测试剂盒试验 收取研究对象早餐后1 h的唾液对三组受试者行胃蛋白酶检测试剂盒(Peptest)检测,并用定量仪精确测定胃蛋白酶浓度。
1.2.3胃蛋白酶的免疫组化检测 采用两步法对声带息肉组、声带癌组标本行胃蛋白酶免疫组化染色,根据染色的深浅和范围对研究对象进行咽喉反流的客观评估。一抗:胃蛋白酶A多克隆抗体[(PA5-103156)赛默飞世尔科技公司(中国上海)];二抗:增强酶标山羊抗小鼠/兔IgG聚合物(北京中杉金桥生物技术有限公司)(中国北京)。PBS代替一抗作为阴性对照,以胃底黏膜细胞的胃蛋白酶免疫染色结果为阳性对照。依据Formwitz评分方法,根据显色程度与显色细胞占比评分的乘积将显色强度分为4级:0分为阴性,记0级;1~4分为弱阳性,记1级,5~8分为阳性记2级,9~12分为强阳性,记3级。
1.3统计学方法 运用SPSS25.0统计软件包进行统计学分析,正态分布计量资料采用均数±标准差表示,多组间均数差异比较采用方差分析,两组间均数差异比较采用Dunnett多重比较,两组间等级资料差异比较采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1三组RSI、RFS评分及Peptest检查结果 由表1可见,经方差分析及多重比较:三组RSI评分均数存在着统计学差异(F=4.457,P=0.015),对照组与声带息肉组(P=0.026)、声带癌组存在着统计学差异(P=0.04),声带息肉组与声带癌组无统计学差异(P>0.05)(表1)。
三组RFS评分总体均数存在着统计学差异(F=37.534,P<0.001),对照组与声带息肉组(P<0.001)、声带癌组存在着统计学差异(P<0.001),声带息肉组与声带癌组存在着统计学差异(P=0.002)。
三组胃蛋白酶检测试剂盒总体均数存在着统计学差异(F=3.435,P=0.037),对照组与声带息肉组(P=0.044)、声带癌组存在着统计学差异(P=0.045),声带息肉组与声带癌组无统计学差异(P>0.05)。
2.2声带息肉组和声带癌组胃蛋白酶免疫组化结果 由表2可见,经两样本秩和检验,声带息肉组和声带癌组胃蛋白酶免疫组化结果差异无统计学意义(P>0.05)(表2)(图1)。

表2 声带息肉、声带癌组织中胃蛋白酶的表达(例)
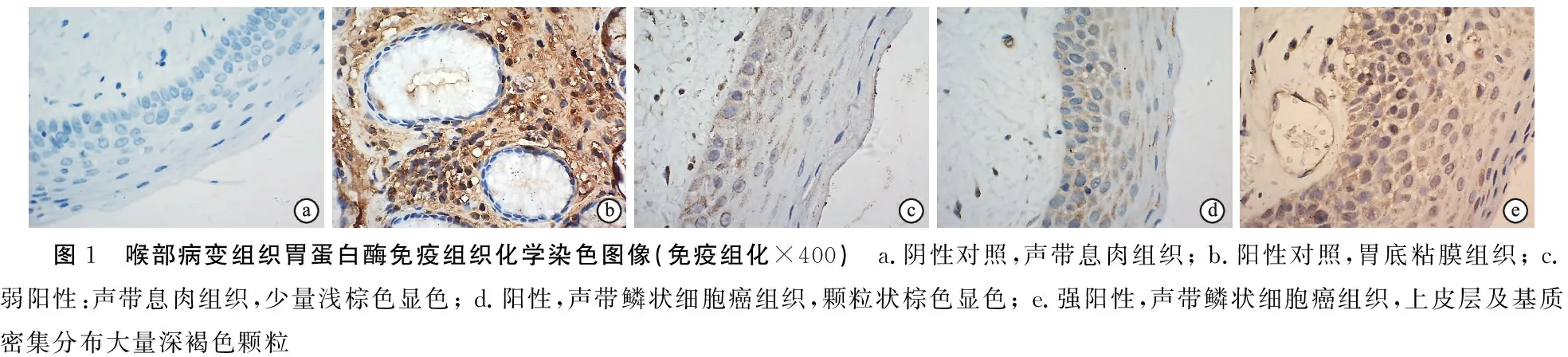
图1 喉部病变组织胃蛋白酶免疫组织化学染色图像(免疫组化×400) a.阴性对照,声带息肉组织; b.阳性对照,胃底粘膜组织; c.弱阳性:声带息肉组织,少量浅棕色显色; d.阳性,声带鳞状细胞癌组织,颗粒状棕色显色; e.强阳性,声带鳞状细胞癌组织,上皮层及基质密集分布大量深褐色颗粒
3 讨论
近年来研究发现LPR所致的胃内容物反流至食管上括约肌以上被认为是引起声带病变的重要因素[8]。胃内容物除胃酸、胆汁、胰酶和食糜外,还含有胃蛋白酶,它是一种必需的、最具侵袭性的蛋白酶[9,10]。当LPR发生时,只要咽喉部pH>5.0时,就会激活静态胃蛋白酶[11]。与食管黏膜不同,喉和下咽黏膜缺乏会产生碳酸氢盐来保护黏膜细胞的碳酸酐酶[12],自我保护能力相对较弱,即使是少量的胃内容物反流,也会导致严重损伤,从而导致炎症[10]。而反复的炎症刺激导致咽喉上皮黏膜损伤,进一步增加其恶性转化的风险。

本研究发现声带息肉组与声带癌组之间胃蛋白酶检测试剂盒、RSI以及胃蛋白酶免疫组化结果差异无统计学意义(P>0.05),但两组间RFS结果有差异(P<0.05),提示声带息肉和声带癌的发生都与咽喉反流有关,但其发病机制可能有所不同。咽喉反流所致的咽喉部损伤的诸多原因可分为两方面[2,16]:一是直接损伤:胃十二指肠反流物胃酸、胃蛋白酶、胰酶、胆汁酸等对咽喉黏膜的直接刺激所导致的炎症损伤,其中尤以胃蛋白酶对黏膜上皮的损伤最为严重;二是间接损伤:胃十二指肠反流物对食管远端黏膜化学感受器的刺激引起迷走神经反射,所致的咳嗽、清嗓等间接刺激所致的黏膜损伤。Wang等[17]研究表明LPR内容物胃酸、胃蛋白酶所致的喉黏膜直接损伤是导致声带息肉的主要原因;而胡鸿敏等[3]通过病例对照研究发现LPR引起的清嗓可能是导致声带息肉的主要原因;Zou等[18]研究发现胃蛋白酶可能通过促进免疫细胞聚集,增加局部细胞因子,促进炎症反应,可能是导致声带息肉发病的新机制。本研究认为这两方面的因素均参与了声带息肉的发生,但哪方面因素为主有待进一步研究;而声带癌则主要与咽喉反流所致的咽喉部直接损伤有关。这也可以解释本研究中声带息肉组RSI量表评分略高于声带癌组,可能是由于间接损伤所致的咽喉部的这种反应所致,例如咳嗽、清嗓等。
本研究中声带癌组RFS结果高于声带息肉组(P<0.05),提示声带癌组中咽喉黏膜的炎性反应较重,可能与胃蛋白酶所致损伤较重有关。结合本研究胃蛋白酶免疫组化分析结果,提示胃蛋白酶在声带息肉和声带癌组中的含量较高,胃蛋白酶更可能通过直接作用于细胞浆而损伤喉黏膜上皮细胞。Ao等[19]研究发现,高表达的 Glut-1 可能通过上调喉部 H+/K+-ATPase 的表达以重新激活吸收的胃蛋白酶,损伤喉黏膜,从而促进声带白斑向声带癌进展。Tina等[20]通过RNA测序鉴定胃蛋白酶失调通路和喉癌基因位点的差异,发现胃蛋白酶激活喉癌相关的信号通路,可能是导致喉癌发生的新机制。Johnston等[21]研究发现在胃蛋白酶的刺激下喉上皮细胞miRNA水平出现显著变化;在暴露于非酸性胃蛋白酶的喉上皮细胞中,miRNA表达显著失调,并表现出相应的靶癌蛋白Ras表达增加。Ras表达增加与细胞增殖增加相关,在喉癌中观察到Ras表达异常[22]。上述机制可能在胃蛋白酶所致的声带黏膜损伤中起重要作用,最终导致声带癌的发生。
综上所述,胃蛋白酶可能是声带息肉、声带癌的致病因素之一,但发病机制可能有所不同。本研究也存在局限性,由于考虑到伦理因素,未取正常人群的声带组织作为对照组进行研究。在声带良恶性疾病的防治过程中,如何抑制胃蛋白酶的作用将是未来研究重方向之一。
