羊源牛恶性卡他热的病理学观察及病原核酸检测
2024-01-29申丹妮娜仁其木格希尼尼根吉林台
申丹妮,金 山,娜仁其木格,希尼尼根,海 鹰*,吉林台*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.农业部动物临床诊疗技术重点实验室,内蒙古呼和浩特 010018;3.乌审旗动物疫病预防控制中心,内蒙古乌审旗 017300)
恶性卡他热(Malignant catarrhal fever,MCF)是由γ疱疹病毒亚科马卡病毒属病毒( Malignant catarrhal fever virus,MCFV)引起的一种影响牛和其他反刍动物的致命性淋巴增生性疾病,该病在世界范围内传播,牛和羊是该病的主要感染者,少数情况下鹿、野牛和猪都会感染该病毒[1-2]。该属的10种病毒中,其中6种明显与临床疾病相关,狷羚疱疹病毒1型(AlHV-1)和绵羊疱疹病毒2型(OvHV-2)分别为引起角马相关MCF(WA-MCF)和绵羊相关MCF(SA-MCF)的主要病原体,另外4种还包括山羊疱疹病毒2型(CpHV-2)、白尾鹿(MCFV- wtd)携带的来源不明的MCFV、野山羊携带的山羊MCFV(MCFV-ibex)以及杰克逊大羚羊携带的AIHV-2样病毒[3]。其中,AlHV-1和OvHV-2是传播最广泛的2种病原[4]。由这2种病原引起的疾病中,具有临床症状的终末宿主并不是感染源,病毒只由原始宿主(角马或绵羊)排出[5]。病毒通过其原始宿主的鼻腔分泌物或粪便排到环境中,易感动物通过直接吸入或接触受污染的食物和水从而被感染[6]。γ疱疹病毒会在宿主的淋巴细胞中潜伏,当宿主的免疫反应不足以控制受感染细胞的数量时,就会发生致命的MCF疾病。γ疱疹病毒感染的结果不仅取决于病毒本身,还取决于宿主本身。MCFV在原始宿主体内同宿主一起进化,从而免受宿主免疫反应的破坏,同时这些宿主也进化为没有任何临床症状的隐性感染者,并在没有任何疾病症状的情况下传播病毒。未参与病毒共同进化的动物则会发生致命的恶性卡他热,因此,患有恶性卡他热的牛会表现出明显的临床症状,而羊一般呈隐性感染[7]。
牛的恶性卡他热以散发为主,多发于2~4岁的牛,老龄牛和犊牛很少发生[8]。牛的发病率通常为15%到100%不等,牛群死亡率为60%到100%不等[9]。病牛通常有与羊的接触史,同群饲养或放牧都会增加牛感染该病的风险。稽留热是牛恶性卡他热的典型症状之一[10],除此之外,病牛还表现为呼吸急促,食欲废绝,初期便秘后期腹泻,口腔溃疡唇部长白色丘疹,眼角膜水肿混浊导致失明,鼻镜干燥且鼻腔流出恶臭的黏液[11]。根据临床症状,该病可分为头眼型、最急性型、肠型和皮肤型,其中头眼型最为常见。病理剖检结果为淋巴结普遍肿大,消化道、呼吸道以及多种脏器出血[12]。组织学病变包括坏死性血管炎,表现为中膜和外膜伴随淋巴细胞和巨噬细胞浸润,组织病理学一直被认为是MCF的重要诊断方法,然而,病毒核酸检测依然是公认的MCF诊断方法[13]。牛恶性卡他热严重威胁到牛的健康,使畜牧业经济受到损失,本研究将通过病理剖检、组织病理学和病原体核酸检测对病死牛进行诊断,以确认是否为恶性卡他热,为恶性卡他热的诊断和防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病料 采集疑似羊源性牛恶性卡他热2头病牛(分别命名为1号牛和2号牛)的组织,其中包括1号牛的脾脏、肺脏、心脏、肾脏和淋巴结,2号牛的脑组织、肺脏和脾脏,以及10只绵羊的鼻拭子。病死牛与120只羊同场放牧,均来自鄂尔多斯市某牧场。
1.1.2 主要试剂 拭子基因组DNA提取试剂盒,北京聚合美生物科技有限公司产品;组织基因组DNA 提取试剂盒,天根生化科技(北京)有限公司产品;TaqPCR Mix酶、琼脂糖凝胶,US Everbright公司产品;核酸染料,北京泰克生物技术有限公司产品;标准分子量核酸DNA Marker DL 1 000,TaKaRa生物有限公司产品;OvHV-2病毒引物,生工生物工程(上海)有限公司产品;HE染色试剂盒,北京索莱宝科技有限公司产品;阳性对照 OvHV-2病毒DNA,由内蒙古农业大学兽医学院动物临床诊疗实验室提供。
1.1.3 仪器设备 组织脱水机、组织包埋机,日本Sakura樱花公司产品;离心机,Sigma公司产品;PCR仪,Gene Company Limited公司产品;核酸电泳仪,美国Bio-Rad公司产品;凝胶成像仪,上海日复科技有限公司产品;显微镜,星特朗电子科技有限公司产品。
1.2 方法
1.2.1 临床观察及病理剖检 对2头牛进行病情调查及临床症状观察后,剖检,并采集脑、肝脏、脾脏、肾脏、肺脏和淋巴结等组织器官,为组织病理学检查和病原体分子核酸检测做准备。
1.2.2 组织病理学检查 将病死牛脑、肝脏、脾脏、肾脏、肺脏和淋巴结组织固定在10%中性缓冲福尔马林液中,包埋于石蜡后制作病理切片,通过苏木精-伊红(HE)染色后显微镜下进行组织病理学观察。
1.2.3 病原体分子检测及分子生物学分析 用组织基因组DNA提取试剂盒提取2头病牛的脑、脾脏、肺脏和肝脏组织中的DNA基因组,用拭子基因组提取试剂盒提取鼻拭子基因组DNA,采用聚合酶链反应(PCR)检测方法,对OvHV-2病毒片段进行扩增,引物序列[14]:OvHV-2-F:5′-AGTCTGGGGTATATGAATCCAGATGGCTCTC-3′,OvHV-2-R:5′-AAGATAAGCACCAGTTATGCATCTGATAAA-3′。反应体系如下:基因组DNA模板3 μL;引物OvHV2-F 1.0 μL;引物OvHV2-R 1.0 μL;TaqPCR Mix酶12.5 μL;ddH2O 7.5 μL,总体系25 μL。PCR反应条件为:95 ℃预变性10 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,共30个循环;72 ℃ 7 min。扩增完成后,对PCR产物进行2%琼脂糖凝胶电泳检测,PCR目的片段大小为 423 bp。将PCR检测为阳性的产物送至生工生物工程(上海)股份有限公司进行测序。用DNA Star软件,对PCR产物的测序结果进行同源性分析和遗传进化分析。
2 结果
2.1 临床观察及病理剖检结果分析
2头病牛均为成年牛,症状相同,病程约一个半月,临床表现为体温升高,食欲废绝,流泪,眼鼻黏性分泌物增多,出现明显的视力障碍,同时腹泻严重,并导致进行性消瘦,在病程期间用过头孢类药物,食欲稍有恢复,但最终均死亡。
对病牛进行剖检后观察到的病变如下。如图1所示,双侧眼结膜潮红,剥离眼结膜晶状体可见角膜与虹膜浑浊。外阴黏膜潮红,全身及皮下出现严重的淤血情况。肩前淋巴结肿大、充血潮红;颌下淋巴结充血出血。如图2所示,上颚严重充血,黏膜坏死、溃疡。如图3所示,咽喉与气管黏膜潮红,脱落形成假膜。如图4所示,肺脏严重淤血出血,肺间质气肿。心脏外膜淤血,冠状脂肪出血。如图5所示,大脑脑膜淤血,嗅球与其相连的脑组织坏死萎缩。如图6所示,脾脏变软,被膜形成皱褶,表面可见白色斑点,切面白髓模糊不清。如图7所示,肾脏肾盂与肾实质严重淤血。如图8所示,肠黏膜坏死脱落形成假膜,空肠、回肠和结肠的浆膜均有淤血出血的情况。以上结果表明,2头死牛临床症状及病理变化与牛恶性卡他热临床症状及剖检病理变化完全一致。

图1 眼结膜充血,眼角膜浑浊Fig.1 Conjunctival congestion and corneal opacity

图2 上颚充血,黏膜坏死、溃疡Fig.2 Upper jaw congestion,mucosal necrosis and ulcer

图3 咽喉与气管黏膜潮红、脱落形成假膜Fig.3 The mucous membranes of the throat and trachea are flushed and peeled off to form a pseudomembrane

图4 肺脏严重淤血,肺间质气肿Fig.4 Severe congestion of the lungs,pulmonary interstitial emphysema
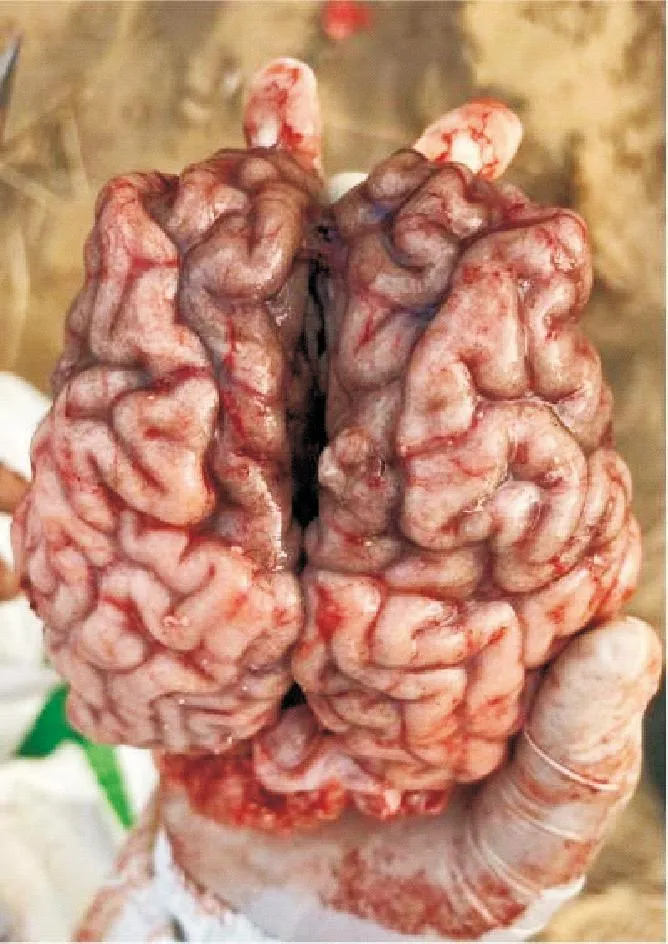
图5 脑膜淤血,嗅球与其相连的脑组织萎缩Fig.5 Meningeal congestion,atrophy of the brain tissue adjacent to the olfactory bulb

图6 脾脏被膜皱褶可见白色斑点,切面白髓模糊不清Fig.6 White spots can be seen on the folds of the spleen capsule,and the white pulp on the section is unclear
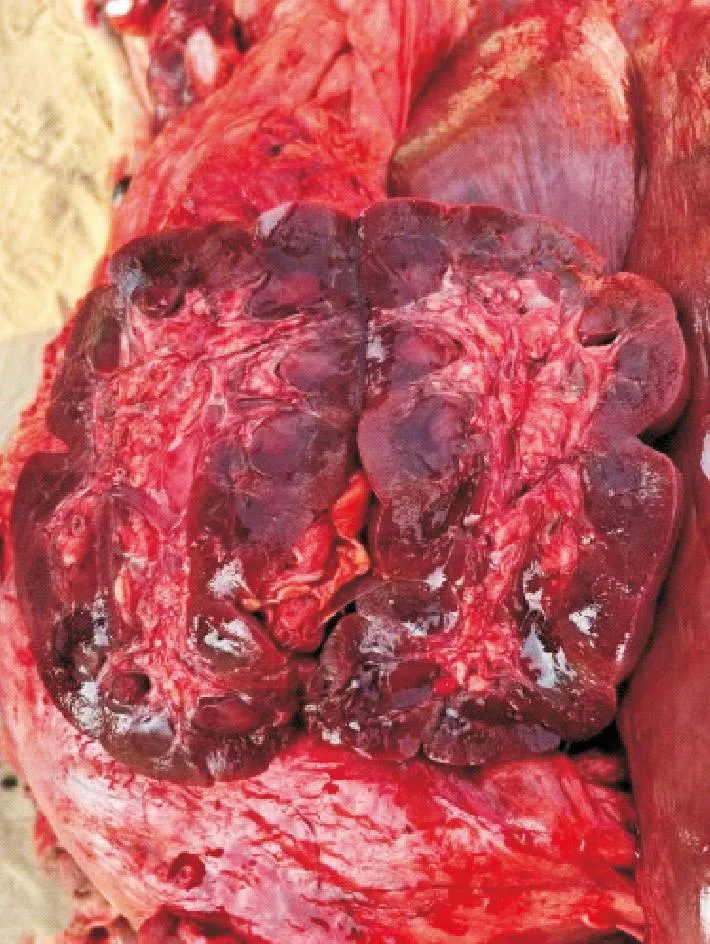
图7 肾盂与肾实质严重淤血Fig.7 Severe congestion of renal pelvis and parenchyma

图8 肠黏膜坏死脱落形成假膜Fig.8 Necrosis and desquamation of intestinal mucosa forming pseudomembrane
2.2 组织病理学检查结果
对2头病死牛组织切片的观察结果如下。如图9所示,1号牛伴有出血性坏死性淋巴结炎,表现为淋巴结充血,弥漫分布有大小不等、形态不一的坏死灶且坏死灶内轻度出血;皮质淋巴窦内水肿,浆液积聚,被膜淋巴管普遍明显扩张,淋巴细胞显著减少;此外,淋巴结小动脉壁因炎性细胞浸润而增厚,其周围可见以淋巴细胞为主的炎性细胞浸润。如图10所示,2号牛脑组织病变提示为非化脓性脑炎,表现为神经细胞变性坏死,胶质细胞增生;脑膜下的动脉周围出现淋巴细胞浸润。如图11所示,2号牛肺组织病变表现为严重水肿,肺泡腔内有大量浆液性渗出物,轻度出血,且小动脉周围可见以淋巴细胞为主的炎性细胞浸润。如图12所示,1号牛脾脏有充血和出血情况,红髓出现大量吞铁细胞,白髓淋巴细胞稀疏,淋巴细胞数量显著减少;动脉壁增厚,中膜疑似肉芽组织增生,可见新生小血管,外膜可见以淋巴细胞为主的炎性细胞浸润。如图13所示,1号牛肾脏髓质部动脉壁增厚疏松,渗出的炎性细胞使中膜和外膜增宽,疑似肉芽组织增生;动脉壁及外围伴有淋巴细胞为主的炎性细胞浸润。2头病死牛淋巴结、脑组织、肺组织、脾脏以及肾脏等组织病理变化与牛恶性卡他热的组织病变基本一致。

图9 淋巴结充血,可见大小不等坏死灶(HE)Fig.9 Hyperemia of lymph nodes with necrotic foci of varying sizes(HE)

图10 神经细胞变性坏死,胶质细胞增生;动脉壁周围淋巴细胞浸润(HE)Fig.10 Neurocyte degeneration and necrosis,glial cell proliferation;periarterial lymphocytic infiltration(HE)

图11 肺泡腔内有大量浆液性渗出物,动脉壁周围淋巴细胞浸润(HE)Fig.11 There is a large amount of serous exudate in the alveolar cavity,and lymphocytes infiltrate around the arterial wall(HE)
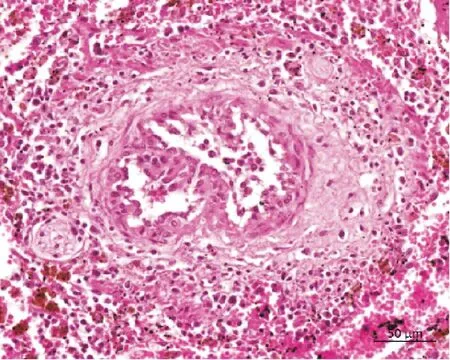
图12 脾脏出血,动脉壁及周围淋巴细胞浸润、纤维素渗出(HE)Fig.12 Spleen hemorrhage,arterial wall and peripheral lymphocyte infiltration,and fiber exudation (HE)

图13 肾动脉壁疏松增宽、网状细胞增生,且其周围有淋巴细胞浸润(HE)Fig.13 Renal artery wall is loose and widened,reticular cells proliferate,and lymphocytes infiltrate around it(HE)
2.3 病原体分子检测及分子生物学分析结果
对1号病牛的脾脏和肺脏及2号牛的脑组织、肺脏和脾脏DNA中的OvHV-2病毒进行PCR检测,结果如图14所示,凝胶电泳在423 bp处均出现ORF75 DNA片段目的基因,均为阳性。1~10号羊的鼻拭子DNA进行检测,结果如图15所示,3号、6号和10号样品凝胶电泳在423 bp处均出现ORF75 DNA片段目的基因,为阳性。将1号牛的脾脏、2号牛的肺脏及6号羊的鼻拭子PCR产物测序后所得序列在NCBI网站上进行Blast比对后,结果为绵羊疱疹病毒2型(OvHV-2)。核苷酸序列使用Clustal W算法对齐,邻接算法(NJ)估计系统发育,同源性分析和构建进化树结果如图16和图17所示,本研究3条毒株序列(命名为NM01.seq、NM02.seq和NM03.seq)与GenBank中其他14株OvHV-2病毒的核苷酸序列同源性为97.2%~99.7%。其中,3个毒株序列均与伊拉克毒株(GenBank登录号MN419919)同源性最高,分别为99.1%、99.7%和98.9%。以上结果表明1号牛的脾脏和肺脏,2号牛的脑、肺脏和脾脏组织中检测到OvHV-2病毒ORF75 DNA片段,2头牛均由OvHV-2引起的恶性卡他热病而死亡。

M.DNA 标准DL 1 000;1、2.1号牛的脾脏和肺脏的OvHV-2病毒ORF75 DNA片段PCR产物;3~5.分别为2号牛的脑、肺脏和脾脏组织OvHV-2病毒ORF75 DNA片段PCR产物;6.阳性对照;7.阴性对照M.DNA Marker DL 1 000;1,2.PCR products of OvHV-2 virus ORF75 DNA fragments from the spleen and lungs of No.1 cattle;3-5.PCR products of OvHV-2 virus ORF75 DNA fragments from the brain,lung,and spleen tissues of No.2 cattle;6.Positive control;7.Negative control图14 牛组织中OvHV-2病毒膜蛋白基因片段PCR扩增结果Fig.14 PCR amplification results of membrane protein gene fragment of OvHV-2 virus in bovine tissues

M.DNA标准DL 1 000; 1~10.羊鼻拭子OvHV-2病毒膜蛋白基因片段PCR产物; 11.阳性对照; 12.阴性对照M.DNA Marker DL 1 000; 1-10.PCR products of OvHV-2 virus ORF75 DNA fragments from sheep nasal swabs; 11.Positive control; 12.Negative control图15 绵羊鼻拭子中OvHV-2病毒膜蛋白基因片段PCR扩增结果Fig.15 PCR amplification results of membrane protein gene fragment of OvHV-2 virus in sheep nasal swabs

图16 OvHV-2病毒膜蛋白基因序列相似性和遗传偏离Fig.16 Sequence similarity and genetic deviation of OvHV-2 virus membrane protein gene
3 讨论
恶性卡他热是一种可以引起牛和其他反刍动物的致命淋巴增生性疾病。在已知引起该病的多种MCFV中,AlHV-1和OvHV-2是传播最广泛的2种病原。其中,AlHV-1在非洲大陆地区可以自然感染角马,并在当地牛群中引起角马相关的MCF(WA-MCF),而OvHV-2主要感染绵羊,从而在世界大部分地区的易感动物中引起绵羊相关的MCF(SA-MCF)。OvHV-2病毒可以潜入绵羊体内的淋巴细胞中,造成绵羊终身感染,但这种感染是隐性的,绵羊感染后可继而通过粪便或鼻腔分泌物自然传播给山羊、牛、鹿和猪等易感动物[15]。OvHV-2病毒主要存在于绵羊的鼻分泌物中,通常6~10月龄的绵羊通过鼻分泌物可以间歇性排出大量病毒。牛和羊同群饲养或放牧是导致牛感染的主要途径,牛的感染一年四季均可发生,且多发生于围产期[16],而本研究中的牛皆发病于春季和冬季同时伴有流产,可以推测内蒙古地区冬春季节寒冷的极端天气条件和处于围产期会使牛的免疫机能下降,从而导致发病。
OvHV-2病毒和AlHV-1病毒在易感动物中引起的宏观和微观病变是相似的。2013年,Richa表明印度牛中检测到SA-MCF病例中,临床特点体现为高热以及头部的黏膜炎症,比如角膜水肿溃疡,鼻腔内有黏脓性鼻分泌物,鼻黏膜和颊黏膜表面坏死明显等[17]。死后剖检表现为脑、心脏、肺脏和肾脏等器官充血淤血,消化道和呼吸道器官发生明显黏膜出血和溃疡,本次诊断的病例多个实质性器官明显充血,且淋巴结肿大,气管与上颚黏膜坏死脱落,与印度地区病例症状基本吻合。
由于恶性卡他热病的发病机制十分复杂,症状与其他疾病有很多相似之处,因此对于该病的诊断并不能仅仅依靠临床体征和病理剖检,在进行分子检测方法之前,组织病理学可以作为一种有用的诊断工具对多种组织进行检查。2017年,Martins M S N等[18]报道,巴西一起患有恶性卡他热病的牛颈动脉、脑和肾组织中显示出坏死性血管炎特征。本次诊断研究显示,在脑组织内观察到明显的非化脓性脑炎,同时,脾组织、肺组织、肾组织和淋巴结组织均出现明显的坏死性血管炎,其小动脉周围都出现了以淋巴细胞为主的炎性细胞浸润现象,这也进一步说明,多器官的小血管坏死性炎症可以作为诊断牛恶性卡他热的重要组织学特征。
针对病毒的核酸检测是目前公认的MCF诊断方法。2019年,Cristina P等[19]对意大利中部地区的一起牛恶性卡他热的病例进行检测后发现病原为OvHV-2病毒。本次诊断中,以编码OvHV-2病毒被膜蛋白基因的ORF75 DNA片段为目标进行PCR试验,最终在病死牛的多个器官中检测到该目的片段,证实了病死牛感染的是以OvHV-2病毒参与的牛恶性卡他热病。同时,与牛同群饲养的绵羊鼻拭子中也检测出了OvHV-2病毒,由于只有该病毒的原始宿主才能排毒,进一步推测病牛极大可能被处于隐性感染的绵羊排出的病毒所感染。目前,AlHV-1病毒已被分离出来,而OvHV-2病毒的分离还没有成功,利用AlHV-1病毒构建的cELISA对牛疱疹病毒具有交叉反应,所以无法区分不同的MCFV[20]。因此,针对OvHV-2病毒的分离是接下来有待进一步研究的方向。
恶性卡他热是一种重要且被低估的疾病,由于该病多呈散发性,在我国尚未引起兽医、牧民或研究人员的重视。该病的发病机制尚无清晰定论,也无有效的治疗方法,只能依靠科学的管理来预防该病的发生和传播。随着PCR检测技术的普及,应该在全国范围内对该病进行调查,为SA-MCF相关的流行病学和经济损失提供新的数据信息。同时,应该为牧民和牧场工作人员普及该病的危害性并建立严格的饲养管理模式,例如牛、羊不可同群饲养和同场放牧;对新引进的动物应进行严格的检疫,只引进血清阴性的动物。对该病进行系统监测,确定该病的现状并制定有效的控制措施,对减少经济损失和推动畜牧业的发展至关重要。
