鸡产蛋下降综合征病毒间接免疫荧光检测方法的建立及应用
2024-01-29孔冬妮翟天舒黄小洁候力丹吴华伟薛青红李俊平毛娅卿
孔冬妮,王 嘉,邓 永,翟天舒,刘 丹,黄小洁,薛 琪,候力丹,吴华伟,薛青红,李俊平,毛娅卿
(中国兽医药品监察所,北京 100081)
鸡产蛋下降综合征(Egg drop syndrome,EDS)又称为鸡减蛋综合征,是由鸡产蛋下降综合征病毒(EDSV)引起的一种无明显症状但产蛋量明显下降的一种疫病。该病的特征是鸡在性成熟前为隐性感染,鸡开产后才表现出临床症状,主要引起产蛋下降及卵壳形成不全等临床症状,造成养禽业的巨大损失。鸡产蛋下降综合征最初只局限于欧洲,随后澳大利亚、比利时、法国、英国、日本等国家发生该病[1-2]。我国李刚等于1991年分离到EDSV,从而证实了EDSV在我国的存在[3]。不同品种的鸡均能感染EDSV,鸭、鹅、麻雀、鹌鹑等大多数禽类均能感染EDSV并携带病毒[4]。
EDSV为无囊膜的线性双链DNA病毒,目前分离到的EDSV毒株均属于同一个血清型,但存在不同的基因型[5-7]。目前实验室检测EDSV的方法主要为病原学方法、血清学方法[8-9]、病毒核酸检测法等[12],其中常用的方法是血凝抑制试验[10],检测方法不同,其灵敏性也有差异。目前纳入我国法规的检测方法有《中华人民共和国兽药典》(三部)2020年版鸡检查法,其中针对EDSV检验的方法是血凝抑制试验检测病毒抗体。但上述法定方法均存在不足,EDSV血凝抑制试验抗体检测必须通过鸡获得鸡血清进行检测,存在费时、成本高的问题。疫苗中污染EDSV是引起EDS传播和流行的潜在风险,因此建立稳定高效的检测EDSV方法用于禽活疫苗质量检测和EDS疫病诊断是当务之急[15-18]。
1 材料与方法
1.1 材料
1.1.1 细胞和毒株 鸡胚肝细胞由本实验室制备;产蛋下降综合征病毒EDSV/K-11株,由中国兽医药品监察所菌种保藏室保存;禽副流感病毒4型毒株、新城疫病毒、鸡传染性支气管炎病毒等由本实验室保存。
1.1.2 主要试剂 EDSV多抗血清由本实验制备;鸡产蛋下降综合征血凝抑制试验阳性血清、鸡新城疫阳性血清、SPF鸡阴性血清由本实验制备保存;FITC标记的兔抗鸡IgG、FITC标记的兔抗鸡IgG,Sigma公司产品;0.01 mol/L pH 7.2 PBS、灭菌生理盐水,北京中海生物科技有限公司产品;SPF鸡红细胞,由中国兽医药品监察所基础保障处提供;禽流感病毒(H5、H7、H9亚型)阳性血清,均购自哈尔滨兽医研究所;丙酮、无水乙醇,国药集团化学试剂有限公司产品。
1.1.3 主要仪器设备 倒置显微镜、荧光显微镜,Nikon公司产品;恒温水浴锅,上海一恒生物科技有限公司产品;CO2细胞培养箱,Thermo公司产品。
1.1.4 实验动物 SPF鸭胚,购自哈尔滨兽医研究所;SPF鸡及鸡胚,购自勃林格殷格勒股份有限公司。
1.2 方法
1.2.1 免疫原制备
1.2.1.1 种毒复壮 用灭菌生理盐水将种毒复溶后进行5倍稀释,接种10日龄易感鸭胚,0.1 mL/胚,置37 ℃继续孵育120 h后,无菌收获120 h活鸭胚尿囊液(P1),混合后进行HA试验,HA效价应不低于1∶2 560,将收取的胚液用生理盐水进行10倍稀释后,接种10日龄易感鸭胚,0.1 mL/胚,置37 ℃继续孵育120 h,无菌收获120 h活鸭胚尿囊液(P2),混合后进行HA试验,HA效价应不低于1∶10 240,无菌检验,置-40 ℃保存。
1.2.1.2 种毒增殖 取上述胚液(P2),室温融化做适当稀释后,接种10日龄易感鸭胚,0.1 mL/胚,置37 ℃继续孵育120 h后收获活鸭胚液(P3),混合后进行HA试验,HA效价应不低于1∶10 240,无菌检验,置-40 ℃保存。
1.2.1.3 抗原灭活和配苗 将收获后的病毒经0.2%甲醛溶液灭活后加入2%吐温-80为水相,10号白油加入10%司本-80为油相,按水相∶油相1∶2的比例,乳化后制成油佐剂灭活苗。
1.2.2 多抗血清制备
1.2.2.1 免疫
(1)首免:每只SPF鸡皮下或肌肉注射油佐剂灭活苗0.5 mL。
(2)加强免疫:首免后21 d进行第2次免疫,每只鸡皮下或肌肉注射灭活苗1 mL。
1.2.2.2 多抗血清制备 第2次免疫28 d后,无菌操作进行心脏采血,分离血清。经56 ℃水浴灭活30 min。
1.2.3 多抗血清检验 将制备的多抗血清按现行《中国兽药典》三部进行无菌检验、效价测定(HI抗体效价应不低于1∶256)、特异性检验(仅与鸡减蛋综合征HI抗原出现血凝抑制反应,与禽流感病毒HI抗原(H5、H7、H9亚型)和鸡新城疫病毒HI抗原血凝抑制试验应为阴性)。
1.2.4 IFA方法的初步建立
1.2.4.1 鸡胚原代肝细胞制备、培养 选取13~16日龄发育良好的SPF鸡胚制备鸡胚原代肝细胞,用含5%~10%胎牛血清或新生牛血清的细胞培养液制备成每毫升含50万~100万个细胞的悬液,并接种96孔细胞板,0.2 mL/孔,放入37 ℃ CO2培养箱培养,待肝细胞长至单层后即可后续使用。
1.2.4.2 待检样品的准备 取EDS/K-11株病毒管(94年、2005年及2011年制备)各1只,用无血清细胞培养液将病毒复溶,然后以此为基础分别进行10倍梯度稀释,取10-3、10-4、10-5、10-6、10-7、10-86个稀释度备用。
1.2.4.3 一抗的准备 取制备好EDSV多抗血清,用无血清的细胞培养液进行2倍梯度稀释,取1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280,8个稀释度备用。
1.2.4.4 接种与判定 待鸡胚肝细胞长成单层后弃去所有孔中液体,接种EDSV- K-11株(1∶10系列稀释)6个稀释度,每一稀释度接种6孔,每孔接种0.1 mL,并设立阳性对照孔、病毒对照孔、正常细胞对照孔各4孔,接种后37 ℃吸附1 h,所有孔再加入0.1 mL/孔的细胞维持液,并置37 ℃、体积分数为5%的CO2细胞培养箱中继续培养。培养96 h后,弃去2%维持液,用灭菌的PBS洗涤 96 孔细胞培养板2次;用80%的冷丙酮溶液于2~8 ℃固定30 min,后弃去固定液,室温自然晾干10 min;用PBS洗涤细胞2次,每次洗涤时每孔加200 μL,室温静置3 min;弃去PBS,每孔加入作100倍稀释的EDSV多抗血清100 μL,同时以EDSV阳性血清作阳性对照,以不接毒的正常细胞为阴性对照,37 ℃恒温箱中避光作用 1 h,后弃去板孔中的溶液,用PBS洗涤3次,方法同上;每孔加入作200倍稀释的FITC标记的兔抗鸡IgG 50 μL,阳性对照孔加入FITC标记的兔抗鸡IgG 50 μL,37 ℃恒温箱中避光作用1 h;弃去板孔中的溶液,用PBS洗涤5次,方法同上;置倒置荧光显微镜下用蓝色激发光观察。判定:(1)当阳性对照孔出现典型的特异性绿色荧光,阴性对照孔未出现特异性绿色荧光时,试验成立。否则,判试验无结果。(2)如待检细胞孔出现典型的特异性绿色荧光,判为阳性。否则,判为阴性。
1.2.5 EDSV多抗血清最适工作浓度和孵育时间的确定 将EDSV多抗血清用无血清细胞培养液按1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280倍比稀释后,分别加入固定好的接种EDSV的96孔细胞板孔中进行IFA(方法同前),选择荧光清晰明亮且稀释度最大的多抗稀释倍数为最适工作浓度,同时设阴性与阳性对照。多抗按照最适工作浓度并固定其他条件的基础上,将一抗在37 ℃恒温箱中避光作用的时间分别设为30、45、60 min 后进行IFA,选择荧光清晰明亮的孵育时间作为一抗最佳孵育时间,同时设阴阳性对照。
1.2.6 FITC标记的兔抗鸡IgG荧光抗体最适工作浓度和孵育时间的确定 多抗血清按照最适工作浓度稀释以及最佳孵育时间进行孵育并固定其他条件的基础上,将FITC标记的兔抗鸡IgG用无血清细胞培养液按1∶100、1∶200倍比稀释后,依次加入96孔细胞板孔中进行IFA,选择荧光清晰明亮且稀释度最大的荧光抗体稀释倍数作为FITC 标记的兔抗鸡IgG最适工作浓度,同时设阴性与阳性对照。多抗血清按照最适工作浓度稀释以及最佳孵育时间进行孵育,FITC标记的兔抗鸡IgG荧光抗体按照最适工作浓度稀释并固定其他条件的基础上,将荧光二抗在37 ℃恒温箱中避光作用的时间分别设为 30、45、60 min后进行IFA,选择荧光清晰明亮的孵育时间作为二抗最佳孵育时间,同时设阴性与阳性对照。
1.2.7 敏感性试验
1.2.7.1 病毒敏感性试验 测定1994年、2005年、2011年EDSV-K-11株的病毒滴度分别为106.5、 107.0、107.0TCID50/0.1mL,用含2%新生犊牛血清的DMEM维持液将10-7.0~10-1.0TCID50/0.1 mL的不同代次病毒依次接入已长至单层鸡胚肝细胞的96孔细胞培养板,各6个孔,每孔100 μL ,同时设不加病毒的对照孔,37 ℃、体积分数为5%的CO2恒温箱培养合适的时间后固定,以EDSV多抗血清为一抗,以EDSV阳性血清为一抗作阳性对照,然后利用条件优化好的IFA方法进行检测。不加病毒的对照孔应全部为阴性,检测单抗能反应的最小病毒滴度的病毒。
1.2.7.2 多抗血清敏感度试验 用灭菌的PBS将多抗血清按1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280倍比稀释后,加到固定好的接种了EDSV/K-11株病毒的细胞培养板孔中,每孔50 μL,阳性对照孔中加EDSV阳性血清为一抗,每孔50 μL,同时设不加病毒的阴性对照孔,然后利用条件优化好的IFA方法进行检测。以抗原板孔上出现明显荧光的最大单抗稀释度为其检测的灵敏度。
1.2.8 特异性试验 制备长成单层的鸡胚肝细胞培养板,分别接种EDSV/K-11株(2005/2011)、FAdV-4、NDV/La Sota株、IBDV/J1C7株、IBV/H120、REV、ALV等病毒,37 ℃吸附1 h,补加维持液至200 μL/孔,继续在37 ℃恒温箱中培养24~96 h,并分别设阴性与阳性对照,然后利用条件优化好的IFA方法进行检测。EDSV多抗血清和FITC标记的兔抗鸡IgG分别按照最适工作浓度稀释以及最佳孵育时间进行孵育,检测是否存在交叉反应。
1.2.9 重复性试验 取相同批次的EDSV多抗血清、FITC标记的兔抗鸡IgG二抗和细胞培养板检测相同的样品,其中包括EDSV/K-11株病毒液、IBDV/J1C7株病毒液、FadV-4株病毒液、鸡胚肝细胞空白对照,各做6个重复,同时以EDSV阳性血清为一抗作阳性对照,进行批内重复试验。取不同批次的EDSV多抗血清,相同批次的FITC标记的兔抗鸡IgG二抗和细胞培养板检测相同的样品,其中包括EDSV/K-11株病毒液(1994年、2005年、2011年)、IBDV/J1C7株病毒液、FadV-4株病毒液、鸡胚肝细胞空白对照,各做6个重复,同时以EDSV阳性血清为一抗作为阳性对照,进行批间重复试验。
1.2.10 初步应用 将本研究方法应用于禽病毒类活疫苗的外源病毒检验,本试验选取了10家国内生产企业生产的禽用活疫苗重点品种,按照本研究方法进行EDSV检测,并根据现行《中国兽药典》三部对选取的禽病活疫苗进行EDSV污染检验。同时设置PBS组作为阴性对照,感染EDSV/K-11组作为阳性对照。
2 结果
2.1 EDSV多抗血清最适工作浓度和孵育时间的确定
2.1.1 EDSV多抗血清最适工作浓度的确定 试验结果表明,EDSV多抗血清在 1∶160、 1∶320和1∶640时检测到的荧光均清晰明亮,但多次试验表明多抗血清在1∶320时检测到的荧光结果更稳定,所以确定单抗最适工作浓度为1∶320(图1)。
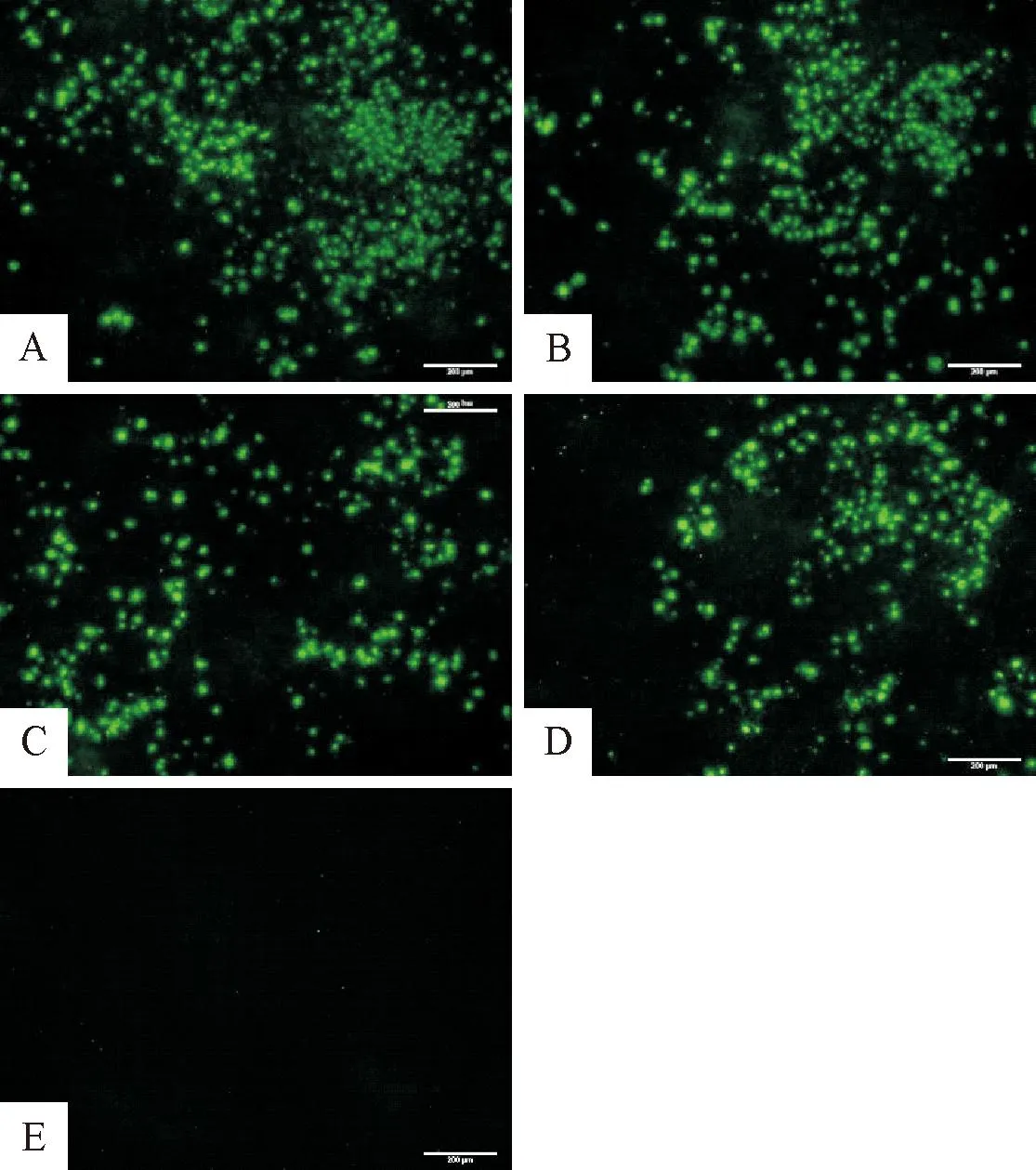
A.1∶160稀释; B.1∶320稀释; C.1∶640稀释;D.阳性对照(EDSV阳性血清为一抗); E.阴性对照(未接种EDSV 的鸡胚肝细胞)A.1∶160 dilution; B.1∶320 dilution; C.1∶640 dilution;D.Positive control(Positive serum of EDSV); E.Negative control(Embryonic hepatocytes without EDSV inoculation)图1 EDSV多抗血清最适工作浓度(100×)Fig.1 The optimal working concentration of polyclonal antibodies of EDSV(100×)
2.1.2 EDSV多抗血清最佳孵育时间的确定 试验结果表明,多抗在孵育45 min和60 min时荧光效果几乎无差异,所以为节省试验时间,确定单抗的最佳孵育时间为45 min(图2)。

A.孵育30 min;B.孵育45 min;C.孵育60 min;D.阳性对照(EDS 阳性血清为一抗);E.阴性对照(未接种EDSV 的鸡胚肝细胞)A.Incubation for 30 min; B.Incubation for 45 min; C.Incubation for 60 min;D.Positive control(Positive serum of EDSV); E.Negative control(Embryonic hepatocytes without EDSV inoculation)图2 EDSV多抗血清最佳孵育时间(100×)Fig.2 The optimal incubation time of polyclonal antibodies of EDSV(100×)
2.2 FITC标记的兔抗鸡IgG荧光抗体最适工作浓度和孵育时间的确定
2.2.1 FITC标记的兔抗鸡IgG荧光抗体最适工作浓度的确定 试验结果表明,FITC标记的兔抗鸡IgG荧光抗体在1∶200时检测到的荧光仍清晰明亮,所以为节省试剂,确定二抗的最适工作浓度为1∶200(图3)。

A.二抗1∶100稀释;B.二抗1∶200稀释;C.阳性对照(EDSV阳性血清为一抗);D.阴性对照(未接种EDSV的鸡胚肝细胞)A.Secondary antibody 1∶100 dilution; B.Secondary antibody 1∶200 dilution; C.Positive control(Positive serum of EDSV); D.Negative control(Embryonic hepatocytes without EDSV inoculation)图3 FITC标记的兔抗鸡IgG荧光抗体最适工作浓度(100×)Fig.3 The optimal working concentration of FITC-labeled goat anti-mouse IgG (100×)
2.2.2 FITC标记的兔抗鸡IgG荧光抗体最佳孵育时间的确定 试验结果表明,FITC 标记的兔抗鸡IgG荧光抗体在孵育30 min时荧光即清晰明亮,所以确定荧光二抗的最佳孵育时间为30 min(图4)。

A.二抗孵育30 min;B.二抗孵育45 min;C.二抗孵育60 min;D.阳性对照(EDSV阳性血清为一抗);E.阴性对照(未接种EDSV的鸡胚肝细胞)A.Incubation for 30 min; B.Incubation for 45 min; C.Incubation for 60 min; D.Positive control(Positive serum of EDSV); E.Negative control(Embryonic hepatocytes without EDSV inoculation)图4 FITC标记的兔抗鸡IgG荧光抗体最佳孵育时间(100×)Fig.4 The optimal incubation time of FITC-labeled goat anti-mouse IgG (100×)
2.3 敏感性试验结果
2.3.1 病毒敏感性试验结果 病毒敏感性试验结果表明,EDSV多抗血清能检测到 10-2TCID50/mL的病毒,具有较高的敏感性,适合检测鸡减蛋综合征病毒抗原(图5)。
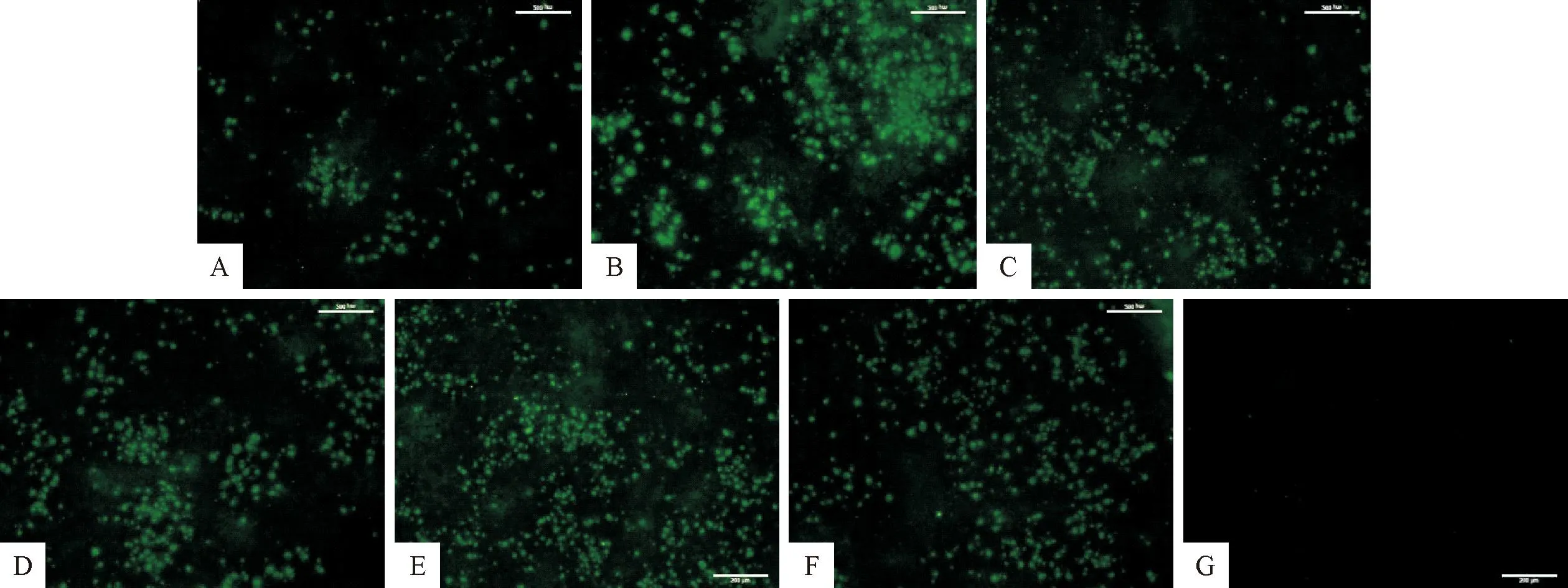
A.10-7.0 TCID50/0.1mL;B.10-6.0 TCID50/0.1mL;C.10-5.0 TCID50/0.1mL;D.10-4.0 TCID50/0.1mL;E.10-3.0 TCID50/0.1mL;F.阳性对照(EDSV多抗血清为一抗);G.阴性对照(未接种EDSV的鸡胚肝细胞)A.10-7.0 TCID50/0.1mL;B.10-6.0 TCID50/0.1mL;C.10-5.0 TCID50/0.1mL;D.10-4.0 TCID50/0.1mL;E.10-3.0 TCID50/0.1mL;F.Positive control (Positive serum of EDSV);G.Negative control(Embryonic hepatocytes without EDSV inoculation)图5 EDSV敏感性试验结果(100×)Fig.5 The result of EDSV sensitivity test (100×)
2.3.2 多抗血清敏感度试验结果 多抗血清敏感度试验结果表明,多抗血清稀释度为1∶1 280时荧光仍清晰明亮,故多抗血清具有较高的敏感度,适合检测鸡减蛋综合征病毒抗原(图6)。

A.多抗 1∶160 稀释;B.多抗1∶320 稀释;C.多抗1∶640 稀释;D.多抗1∶1 280 稀释;E.阳性对照(EDSV阳性血清为一抗);F.阴性对照(未接种EDSV的鸡胚肝细胞)A.PcAb 1∶160 dilution; B.PcAb 1∶320 dilution; C.PcAb 1∶640 dilution; D.PcAb 1∶1 280 dilution;E.Positive control(Positive serum of EDSV);F.Negative control(Embryonic hepatocytes without EDSV inoculation)图6 EDSV多抗血清敏感度试验结果(100×)Fig.6 The result of polyclonal antibody sensitivity test (100×)
2.4 特异性试验结果
特异性试验结果表明,该方法只针对EDSV,与FAdV、NDV、IBDV、IBV、REV、ALV等不反应,特异性良好(图7)。

A.FAdV 4型(KR5株);B.NDV(La Sota株);C.IBDV(J1C7株);D.IBV(120株);E.REV;F.ALV;G.EDSV/K-11/2011;H.EDSV/K-11/2005;I.阴性对照A.FAdV 4/KR5 strain; B.NDV La Sota strain;C.IBDV/J1C7 strain; D.IBV/120 strain; E.REV; F.ALV;G.EDSV/K-11/2011; H.EDSV/K-11/2005; I.Negative control图7 特异性试验结果(100×)Fig.7 The result of specificity test(100×)
2.5 重复性试验结果
2.5.1 批内重复性试验结果 批内重复试验结果表明,检测EDSV/K-11株病毒液(2005年制备及2011年制备)各孔均为阳性,检测FAdV-4(KR5株)和IBDV/J1C7株病毒液各孔,结果均为阴性,检测鸡胚肝细胞对照为各孔均为阴性,批内检测结果一致,表明该方法具有较好的批内重复性(图8)。
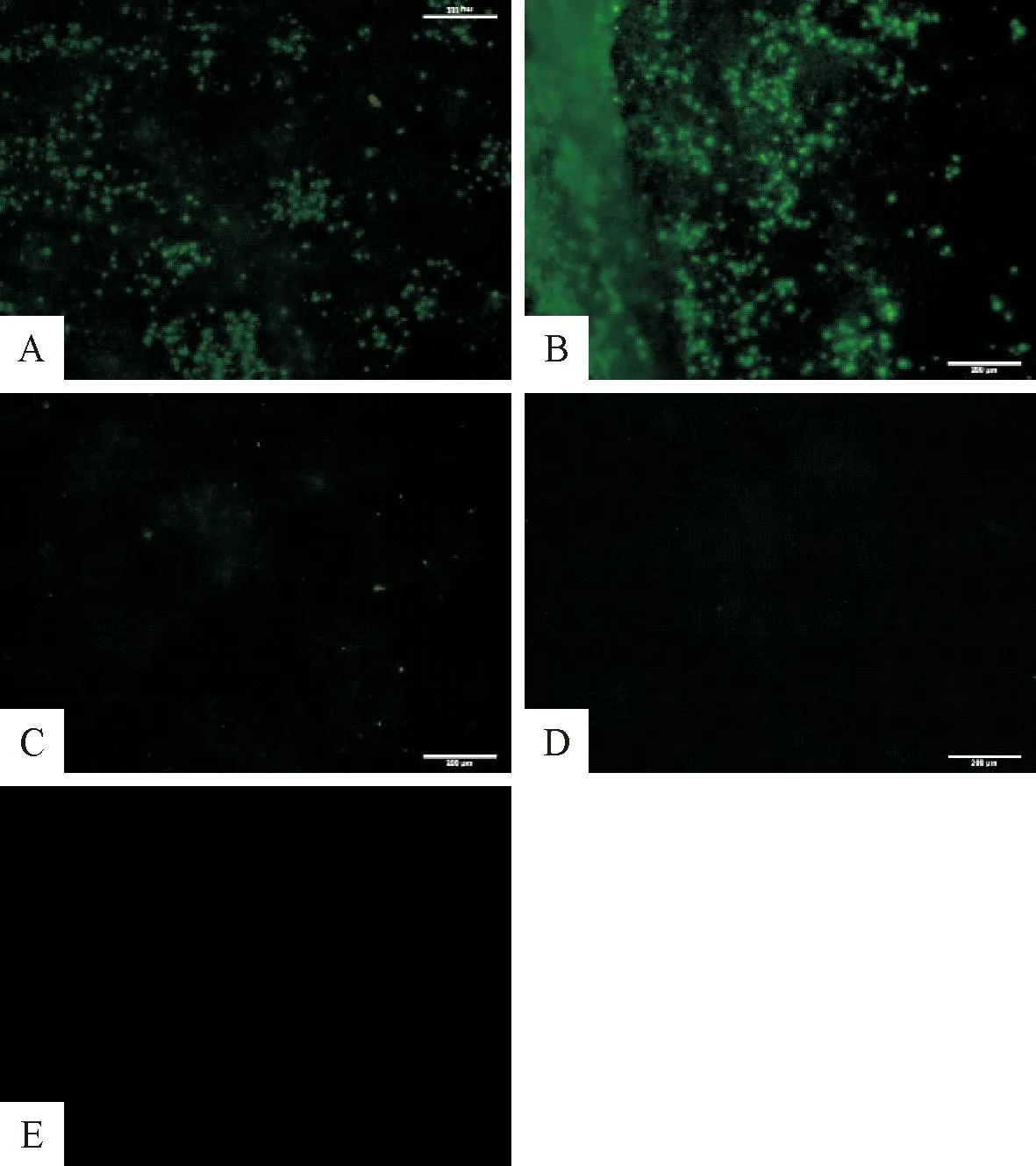
A.EDSV/K-11strain-2005;B.EDSV/K-11 strain-2011;C.IBDV(J1C7株);D.FAdV 4型(KR5株);E.阴性对照(未接种EDSV的鸡胚肝细胞)A.EDSV/K-11strain-2005; B.EDSV/K-11 strain-2011; C.IBDV/J1C7strain D.FAdV 4/KR5 strain;E.Negative control(Embryonic hepatocytes without EDSV inoculation)图8 批内重复性试验结果(100×)Fig.8 The result of intra batch repeatability test (100×)
2.5.2 批间重复性试验结果 取制备的两批多抗血清,批号分别为2019批和2021批,进行批间重复性试验。用不同批次的多抗分别检测EDSV/K-11株病毒液各孔,结果均为阳性,检测FAdV-4(KR5株)和IBDV/J1C7株病毒液各孔,结果均为阴性,检测鸡胚肝细胞对照各孔,结果均为阴性。批间检测结果一致,表明该方法具有较好的批间重复性(表1)。
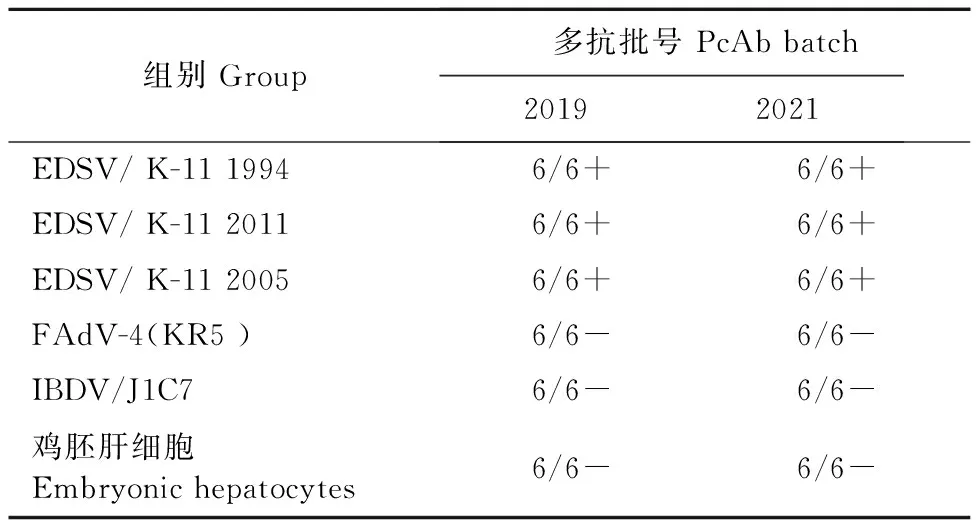
表1 批间重复性试验结果Table 1 The results of inter batch repeatability test
2.6 初步应用试验结果
初步应用试验结果表明,血清学检验和应用本研究方法检测的结果一致,所选取的禽用活疫苗有1家产品检测阳性,其余家均阴性,阴性对照为EDSV检测阴性,阳性对照为EDSV检测阳性(表2)。
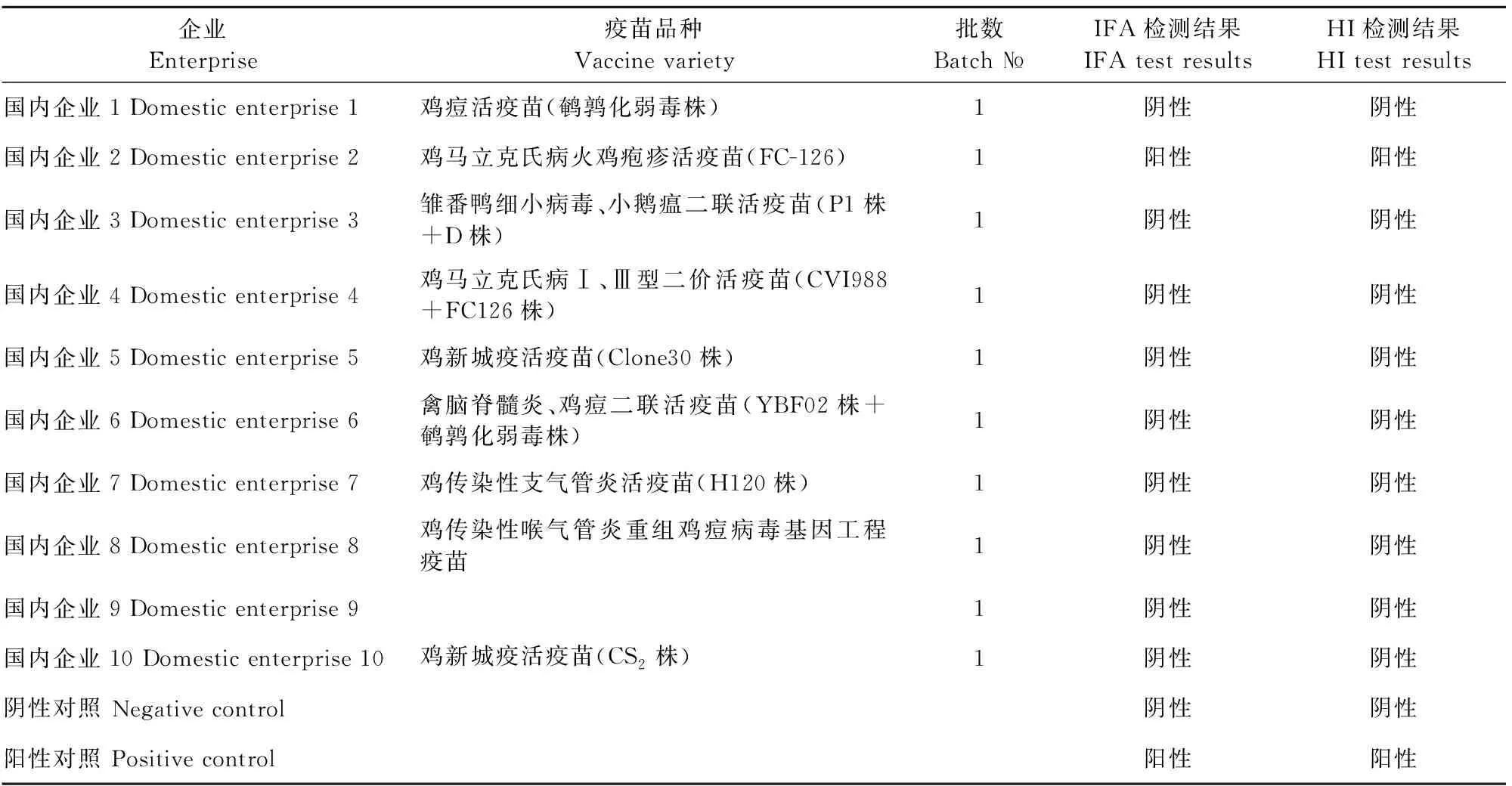
表2 初步应用试验结果Table 2 The result of primary application test
3 讨论
间接免疫荧光方法(IFA)是近年来血清学检测中常用的方法,以多克隆抗体作为一抗建立的IFA检测方法具有特异性好、灵敏度高、成分均一,易于大规模生产,适用于临床检测大量样本的诸多优点,是目前发展最迅速、应用最广泛的检测技术。《中国兽药典》(2020 年版三部)外源病毒检验法中,对于禽源和非禽源制品及其细胞的检验中就采用了荧光抗体检测方法,包括禽腺病毒Ⅰ群4型、猪瘟病毒和猪圆环病毒2型等,说明该方法具有实用性和便利性以及巨大的市场需求。本研究以鸡产蛋下降综合征病毒多克隆抗体和FITC标记的兔抗鸡IgG组合,建立了间接免疫荧光检测EDSV抗原的方法。特异性试验表明该方法只与EDSV反应,与禽腺病毒Ⅰ群4型、新城疫病毒、鸡传染性支气管炎病毒等病原无反应;敏感性试验表明该方法可以检测到10-2TCID50/mL的病毒,敏感度试验表明当多克隆抗体稀释到1∶1 280时仍可见较明显的特异性荧光;批内重复试验和批间重复试验结果表明该方法具有很好的重复性。本研究间接免疫荧光方法的初步建立为我国禽源性生物材料EDSV的外源病毒检测提供了技术支持,也为我国EDSV的病毒含量测定、临床鉴定及诊断监测奠定了基础,有巨大的市场需求。
