血清4型禽腺病毒胶体金免疫层析检测方法的建立
2024-01-29陈乐乐王凯莉杜旭升曹胜亮李玉保路建彪司振书
陈乐乐,王凯莉,刘 成,杜旭升,曹胜亮,李玉保,路建彪,司振书
(聊城大学农学与农业工程学院,山东聊城 252059)
血清4型禽腺病毒(Fowl adenovirus-4,FAdV-4)可引起鸡心包积液-肝炎综合征(Hepatitis-hydropericardium syndrome ,HHS)。FAdV-4属于禽腺病毒属 Ⅰ 群禽腺病毒C种,属于无囊膜的双股DNA病毒,呈20面体对称结构,由DNA、核心蛋白和衣壳蛋白组成[1-4]。六邻体蛋白是含量最多的衣壳蛋白,包含群、亚群和型特异性抗原决定簇,与致病性关系密切,是禽腺病毒分型的主要依据[5]。六邻体的L1区域属于高变区,对其PCR之后进行DNA测序,可以区分5个种内的12个血清型[6]。胶体金免疫层析技术(colloidal gold immunochromatogra-phyic assay,GICA)是Faulk和Taylor在1971年首次建立的[7],该技术以微孔滤膜为载体、用胶体金作为示踪标记物,通过待检样品中相应的抗体或抗原在载体的特定部位发生特异性免疫反应来判定结果[8]。目前检测FAdV-4的方法主要是PCR和ELISA,这两种检测方法均需要专业的仪器设备,且耗时较长,不适合临床应用,因此建立操作简便、结果可靠、快速的临床检测FAdV-4方法显得尤为重要。本研究将FAdV-4的hexon-L1进行了原核表达,将表达纯化后的蛋白免疫清洁级新西兰大白兔制备hexon-L1多克隆抗体,用其作为金标抗体,建立了检测FAdV-4的胶体金免疫层析检测方法。
1 材料与方法
1.1 材料
1.1.1 毒株 FAdV-4山东分离株SDLC202009、FAdV-4HuB株;FAdV-8山东分离株SDLC202031;禽流感病毒、禽传染性喉气管炎病毒、鸡传染性贫血病毒、禽白血病病毒、禽传染性法氏囊病病毒、新城疫病毒、马立克病病毒,均由聊城大学畜禽疫病防控技术研究所分离鉴定并保存。
1.1.2 实验动物 清洁级45日龄雄性新西兰大白兔2只,体重1.3~1.4 kg,购自济南西岭角养殖繁育中心。
1.1.3 主要试剂 质粒pET32a、PremixTaq酶、T4快速连接酶、大肠埃希氏菌DH5α、大肠埃希氏菌Rosetta、小量质粒提取试剂盒、BamHⅠ、Hind Ⅲ,TaKaRa公司产品;SDS-PAGE电泳相关试剂、氨苄霉素,上海碧云天生物技术有限公司产品;包涵体蛋白纯化试剂盒,康为世纪生物科技有限公司产品;40 nm的胶体金颗粒、硝酸纤维素膜、玻璃纤维膜、样品垫、吸水垫、PVC底板,武汉金开瑞生物工程有限公司产品。
1.1.4 主要仪器 XK97-2型双向恒温搅拌器,江苏新康医疗器械有限公司产品;连续点膜机、台式点金标机、切割机,杭州格伦坤科技有限公司产品;PCR仪,Bio-DL公司产品;电泳仪,北京六一生物科技有限公司产品;凝胶成像扫描仪,科创锐新生物科技有限公司产品;脱色摇床TS-1 000,海门市其林贝尔仪器制造有限公司产品;超声波细胞粉碎机,新芝生物科技股份有限公司产品;化学发光成像分析系统、Bio-Rad电泳仪,Bio-Rad公司产品;酶标仪,Thermo公司产品。
1.2 方法
1.2.1 引物设计与合成 根据SDLC202009 hexon-L1基因序列,应用Primer 5.0设计引物,上游引物(5′-ATAGGATCCATGGTCCTGGACATGGGGTC-3′,斜体为BamHⅠ酶切位点)、下游引物(5′-CATAAGCTTCTCGGTATTCCGGTCGGGC-3′,斜体为Hind Ⅲ酶切位点);由北京三博远志生物技术有限责任公司合成。
1.2.2hexon-L1基因表达载体的构建 提取FAdV-4 SDLC202009的DNA,对hexon-L1基因片段进行PCR扩增。PCR扩增体系:上、下游引物各1 μL,2×TaqMaster Mix 12.5 μL,DNA模板2 μL,ddH2O 8.5 μL,总体积为25 μL。扩增条件:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 90s,共30个循环;72 ℃ 延伸10 min。扩增产物用1%琼脂糖凝胶电泳,将目的片段和pET32a载体分别用BamHⅠ和Hind Ⅲ双酶切后进行回收,用T4快速连接酶进行连接,连接产物转化至DH5α感受态,经双酶切鉴定和测序分析获得pET32a-hexon-L1重组质粒。
1.2.3 pET32a-hexon-L1融合蛋白的诱导表达及纯化 将pET32a-hexon-L1转化至rosetta感受态中,用IPTG进行诱导表达,经超声破碎后获得hexon-L1粗蛋白,使用His标签蛋白纯化试剂盒进行纯化。
1.2.4 hexon-L1多克隆抗体的制备及效价测定 将纯化的hexon-L1蛋白和弗氏完全佐剂1∶1乳化,乳化完全后分别免疫注射两只45日龄雄性新西兰大白兔,背部皮下多点注射,每只免疫hexon-L1蛋白;2周后,用弗氏不完全佐剂与蛋白1∶1乳化进行二免,1 mg/只;间隔2周进行3免,1 mg/只。1周后采血分离血清,纯化后即为hexon-L1多克隆抗体,保存于-80 ℃。
取hexon-L1蛋白进行SDS-PAGE电泳,用获得的hexon-L1多抗做一抗进行Western blot,对hexon-L1多克隆抗体进行验证。
用间接ELISA方法对hexon-L1多克隆抗体的效价进行测定。将纯化的hexon-L1蛋白用pH 9.6的碳酸盐稀释至1 μg/mL,4 ℃过夜包被96孔板,将多抗从10 000 ng/mL依次二倍稀释至19.5 ng/mL,分别加入96孔板,37 ℃孵育1 h,分别加入1∶10 000稀释的酶标羊抗兔IgG二抗,37 ℃孵育40 min,加入显色液作用15 min后加终止液,用酶标仪在吸光度450 nm处读数。
1.2.5 胶体金检测卡的制备
1.2.5.1 最佳抗体包被量的确定 取5个EP管,各加入1 mL胶体金溶液,在pH 8.0的条件下加入多抗使溶液中多抗的终浓度分别为5、10、15、20、25 μg/mL,4 ℃反应15 min,分别加入100 μL 100 mg/mL氯化钠溶液,混匀后放入4 ℃冰箱,静置3 h后观察,使胶体金溶液呈现橙红色的最小多抗用量为最低稳定量,最佳抗体用量是最低稳定量的10倍。
1.2.5.2 质控线(C线)和检测线(T线)的喷涂 将兔多克隆抗体稀释成1.5 mg/mL,羊抗兔二抗稀释成1 mg/mL,用连续点膜机在NC膜上分别喷涂T线和C线。
1.2.5.3 胶体金检测卡的组装 将样品垫、结合垫、NC膜、吸水滤纸按从上到下依次固定于PVC底板上,裁切成18 mm宽的试纸条,装入塑料外壳中,再与干燥剂一起装入铝箔袋内,密封室温贮存。
1.2.5.4 检测结果判定标准 检测抗原样品时,C线和T线同时出现红色条带,表明FAdV-4阳性;只有C线出现红色条带,为阴性。
1.2.6 检测卡的性能检验
1.2.6.1 敏感性试验 将FAdV-4的病毒液分别按照原液、1∶10、1∶20、1∶40、1∶60、1∶70、1∶80比例稀释,取3滴稀释液分别加入胶体金检测卡的加样孔,静置5~10 min观察结果。
1.2.6.2 特异性试验 将实验室保存的FAdV-8、传染性喉气管炎病毒、传染性贫血病病毒、白血病病毒等不同禽类病毒样品,离心后取上清液,取3滴稀释液分别加入胶体金检测卡的加样孔,静置5~10 min后观察结果。
1.2.6.3 稳定性试验 取不同批次制备的胶体金试卡,分别对FAdV-4病毒液和FAdV-4阴性样本进行检测。
1.2.7 临床样本的检测 将50份疑似感染4型禽腺病毒的送检病料进行研磨,离心后取上清液,用制备的胶体金检测卡进行检测,同时提取病毒DNA,进行PCR检测。
2 结果
2.1 hexon-L1基因表达质粒的构建
经PCR扩增得到Hexon-L1基因大小与预期一致(图1)。将构建好的重组质粒pET32a-hexon-L1进行双酶切鉴定(图2),并送生工生物工程(上海)股份有限公司测序。对测序结果进行分析显示插入的hexon-L1基因大小为690 bp,且测序正确,表明其已成功连接至pET32a载体上。

M.DNA标准DL 2 000;1.Hexon-L1基因扩增产物;2.阴性对照M.DNA Marker DL 2 000; 1.Hexon-L1 gene amplification product; 2.Negative control图1 Hexon-L1基因扩增结果Fig.1 Results of Hexon-L1 gene amplification
2.2 重组蛋白表达与纯化
重组菌经IPTG诱导表达后,进行SDS-PAGE电泳,结果显示,hexon-L1在44.23 ku处有明显单一条带,主要以包涵体的形式存在于沉淀中,用亲和层析法纯化蛋白hexon-L1(图3)。
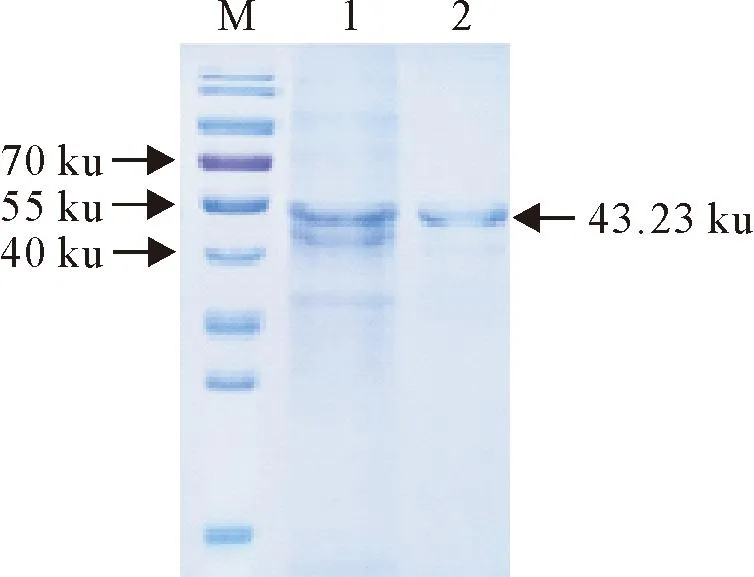
M.蛋白分子质量标准; 1.未纯化蛋白;2.纯化后蛋白M.Protein molecular weight Marker; 1.Unpurified protein; 2.Purified protein图3 hexon-L1纯化蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of hexon-L1 purified protein
2.3 Western blot检测
Western blot分析纯化后重组蛋白能与FAdV-4阳性血清发生特异性反应,在44.23 ku左右的位置有1条特异性条带(图4)。

M.蛋白分子质量标准;1.阴性对照;2.纯化后蛋白M.Protein molecular weight Marker; 1.Negative control; 2.Purified protein图4 hexon-L1蛋白Western blot分析Fig.4 Western blot analysis of hexon-L1 protein
2.4 多抗效价检测结果
根据检测结果数据分析,在hexon-L1抗体浓度为39 ng/mL时,OD值为0.458 5(表1),根据效价与OD值转换公式算出,hexon-L1抗体的效价达到了1∶256 000。

表1 多抗效价检测结果Table 1 The results of polyclonal antibody titer detection
2.5 胶体金检测卡的性能评价结果
2.5.1 敏感性试验结果 将FAdV-4病毒液按1∶10~1∶80不同稀释度稀释后,用试纸条检测,结果如图5所示,样品稀释1∶70后在检测线出现较弱的条带,稀释1∶80后只有质控线有条带,表明该检测卡可检出FAdV-4含量为102.094 5EID50的样本,具有良好的敏感性。

图5 胶体金试纸条敏感性检测结果Fig.5 Sensitivity test results of colloidal gold test strip
2.5.2 特异性试验结果 分别对禽流感病毒、禽白血病病毒、FAdV-4、FAdV-8等不同病毒进行检测,结果显示只有FAdV-4病毒液的试纸条T线和C线同时出现红色条带,其他病毒液的检测卡只有C线出现红色,表明该检测卡具有良好的特异性(图6)。

图6 胶体金试纸条特异性检测结果Fig.6 Specificity test results of colloidal gold test strip
2.5.3 重复性试验结果 用不同批次制备的胶体金检测卡检测FAdV-4病毒液时,T线和C线均出现红色条带,检测FAdV-4阴性样本时,只有C线出现红色条带,表明该试纸条的质量稳定(图7)。

图7 不同批次试纸条对FAdV-4病毒液的检测结果Fig.7 Test results of different batches of test strips to FAdV-4
2.6 临床样品检测结果
用制备的胶体金检测卡与PCR同时对50份临床样品进行检测,检测结果见表2,其中36份样品2种方法均检测为阳性,13份样品均检为阴性,符合率(36+13)/50=98%。

表2 临床样品检测结果Table 2 Test results of clinical samples
3 讨论
FAdV-4给养禽业造成了巨大的经济损失[9-10]。六邻体蛋白是其主要衣壳蛋白,由4个环区L1-L4和2个保守的基底座区P1-P2组成,其中L1区域含有型特异性抗原决定簇,有特定序列负责抗体结合,根据L1区域设计引物可对毒株进行分型[11-18]。因此,本研究选取六邻体的L1区(hexon-L1)进行原核表达,制备多抗,建立了胶体金检测方法。
目前诊断该病常用的方法是PCR和ELISA。这两种方法敏感性较高,但需要PCR仪或酶标仪等仪器,而胶体金试纸条特异性和敏感性强,操作简便,检测时间短,结果肉眼可见,不需特殊仪器设备,适用于临床大量样品的检测[19-20]。FAdV-4胶体金检测方法的报道较少,本研究用hexon-L1的多克隆抗体建立了检测FAdV-4的快速胶体金检测方法,与PCR的符合率为98%,敏感性强。Xie S等[21]用抗Fiber-2的单克隆抗体建立了用于检测FAdV-4的快速胶体金试纸条,与PCR检测临床肝脏样品的符合率为94.7%。本研究虽选用的是多抗,但建立的方法敏感性和特异性都较强,与PCR检测的符合率高。万文妍等[22]根据hexon基因设计特异性RPA引物,建立了RPA-LFD(重组酶聚合酶扩增-胶体金侧向流试纸条)检测方法,适用于FAdV-4的现场诊断和流行病学调查。
本研究成功建立了检测FAdV-4的胶体金检测方法,可用于FAdV-4感染的快速诊断,适合在临床现场检测中推广应用。
