牡荆素调控Sirt1/FoxO1 通路介导的铁死亡对变应性鼻炎大鼠鼻黏膜损伤的保护作用
2024-01-29李艳峰卢振民
李艳峰,卢振民
新乡医学院第一附属医院 耳鼻咽喉科,河南 新乡 453100
变应性鼻炎是一种以鼻塞、流鼻涕、打喷嚏及鼻痒等为主要特征且病因较为复杂的鼻黏膜变应性炎症性的疾病,也被称为过敏性鼻炎[1]。近年来,变应性鼻炎的发病率呈逐年上升态势,全球有10%~40%的人口患有变应性鼻炎,严重影响了患者的生活质量,已经成为耳鼻咽喉科临床医生和患者共同关注的重要医疗疾病[2]。目前,关于变应性鼻炎的治疗药物主要包含抗组胺药、抗白三烯和皮质类固醇等。然而,上述药物在长期治疗变应性鼻炎中可能会有一定的不良反应,且在治疗患者中疗效并不理想。此外,变应性鼻炎的发病机制也较为复杂,与氧化应激反应、炎症及免疫调控失衡等密切相关。但是有关其发病的具体机制至今尚未完全阐明。因此,积极探寻变应性鼻炎的发病机制并开发新型治疗药物对于改善变应性鼻炎患者临床症状具有重大意义。
铁死亡是由脂质过氧化引起的一种铁依赖性、非凋亡形式的调节性细胞死亡,是机体抗氧化和氧化系统失衡的结果[3]。铁死亡与呼吸道炎症性疾病密切相关。研究显示,白细胞介素-6(IL-6)能够通过诱导活性氧气簇(ROS)依赖性的脂质过氧化以及铁离子稳态,诱导上皮细胞铁死亡[4]。采用铁死亡抑制剂处理能够明显减轻氧化损伤、影响铁代谢进而抑制卵清白蛋白诱导的小鼠哮喘以及白细胞介素-13(IL-13)诱导的支气管上皮细胞铁死亡发生[5]。此外,在脂多糖(LPS)诱导的人支气管上皮细胞系BEAS-2B 体外急性呼吸窘迫综合征模型中,细胞铁死亡标志蛋白溶质载体家族7 成员11(SLC7A11)、谷胱甘肽过氧化物酶4(GPX4)表达明显降低,丙二醛(MDA)和铁离子水平显著升高,而铁死亡抑制剂ferrostatin-1 处理后能够改善LPS诱导的损伤,减轻肺部炎症[6]。新近研究证实,膳食碘能够通过调控活化B细胞铁死亡改善变应性鼻炎症状[7]。此外,PM2.5能够通过激活腺苷酸活化蛋白激酶(AMPK)介导的细胞自噬促进人鼻黏膜上皮细胞铁死亡,从而引起鼻黏膜上皮损伤,加重变应性鼻炎,而采用铁死亡抑制剂去铁胺和ferrostatin-1 能够显著逆转PM2.5诱导的人鼻黏膜上皮细胞铁死亡,改善PM2.5诱导的鼻黏膜损伤[8]。以上研究表明铁死亡可能是变应性鼻炎鼻黏膜损伤的治疗的潜在靶点。沉默信息调节因子1(Sirt1)/叉头框蛋白O1(FoxO1)信号通路参与了氧化应激[9]、细胞凋亡[10]以及铁死亡[11]等过程。研究证实,Sirt1能够促使FoxO1 去乙酰化进而影响下游基因表达,从而抑制机体氧化应激反应[12]。Yuan 等[13]研究证实,Sirt1 能够通过抑制变应性鼻炎小鼠中Th2 细胞介导的促炎症细胞因子的释放,减轻小鼠过敏性症状。此外,白藜芦醇能够通过激活鼻黏膜组织中Sirt1 蛋白表达,抑制炎症细胞因子释放,进而改善卵清白蛋白诱导的小鼠变应性鼻炎[14],表明通过调节Sirt1/FoxO1 通路可能是改善变应性鼻炎的重要机制。
牡荆素是一种天然的生物活性黄酮类化合物,具有抗炎[15]、抗氧化[16]以及抗肿瘤[17]等多种生物学活性,且对疾病的治疗效果较为显著,不良反应小、安全性较高等优势,被认为是一种极具开发潜力的活性天然化合物。本课题组前期研究显示,牡荆素能够通过抑制AMPK/Nod 样受体蛋白3(NLRP3)通路介导的细胞焦亡,降低中耳黏膜组织炎症反应,减轻分泌性中耳炎大鼠中耳黏膜组织病理性损伤[18]。但是,有关牡荆素对变应性鼻炎大鼠鼻黏膜损伤的影响及其调控机制尚不清楚。为此,本研究拟通过卵清白蛋白诱导变应性鼻炎大鼠模型,以Sirt1/FoxO1 信号通路介导的细胞铁死亡为机制靶标,探究牡荆素对变应性鼻炎模型大鼠鼻黏膜损伤的保护作用,以期阐明牡荆素对变应性鼻炎的治疗作用及为变应性鼻炎疾病的防治提供一定的理论支持。
1 材料与方法
1.1 材料
1.1.1 动物 雄性,SPF 级,SD 大鼠90 只,6~8周龄,体质量180~200 g,购买于上海斯莱克实验动物有限责任公司[SCXK(沪)2021-0026]。动物饲养条件为温度:(25±2)℃,相对湿度50%~65%,12 h/12 h 昼夜交替光照,自由饮食、饮水,适应性喂养1 周。动物实验符合3R 原则,且本实验研究通过医院医学伦理委员会审查(批准号LLSC2021-08-015)。
1.1.2 试剂 牡荆素(质量分数>98%,成都植标化纯生物技术有限公司,批号20220312);Sirt1 抑制剂EX527(美国ApexBio 公司,货号A4181);卵清蛋白、氢氧化铝粉末[西格玛奥德里奇(上海)贸易有限公司,货号M0228A、MKCM1237];超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH)、丙二醛(MDA)、Fe2+检测试剂盒(南京建成生物工程研究所,货号A001-3-2、A005-1-2、A003-1-2、A039-2-1);ROS 检测试剂盒(北京百奥莱博科技有限公司,货号SY0802);苏木素-伊红(HE)染色试剂盒、蛋白质浓度测定试剂盒、ECL 发光液、山羊抗兔二抗、山羊抗小鼠二抗、GPX4 抗体、SLC7A11 抗体及β-actin 抗体(上海碧云天生物技术公司,批号C0105S、P0011、P0018FS、A0409、A0413、AF7020、AF7992、AF0003);ACSL4 抗体(Abcam 公司,货号ab155282);Sirt1 抗体、FoxO1抗体、磷酸化FoxO1(p-FoxO1,美国Cell Signaling Technology,货号9475、2880、9461);乙酰化-FoxO1抗体(Ac-FoxO1,美国Thermo Fisher Scientific 公司,货号PA5104560)。
1.1.3 仪器 BX53 型光学显微镜(日本Olympus公司);H-2050R-1 型离心机(湖南湘仪实验室仪器开发有限公司);LD-96A 型酶标仪(山东莱恩德智能科技有限公司);Gel dox XR+型凝胶成像系统(Bio-Rad 公司)。
1.2 方法
1.2.1 分组、造模及给药 将SD 大鼠随机分为对照组、模型组、牡荆素(3、6、12 mg/kg)组[18],每组各10 只。除对照组外,其余各组大鼠均采用卵清白蛋白诱导建立变应性鼻炎大鼠模型。依据参考文献报道[1]复制变应性鼻炎大鼠模型:以0.3 mg 卵清白蛋白为抗原+30 mg 氢氧化铝为佐剂混合后溶解于1 mL 生理盐水中制备混悬液,予以大鼠ip 进行基础致敏,隔天1 次,连续8 次,共计15 d。第16 天时经鼻腔滴入2%的卵清白蛋白溶液(每侧50 μL),连续7 d,强化致敏。在末次滴鼻结束后30 min,观察大鼠在5 min 内的行为,并按照变应性鼻炎行为学指标进行评分,若总分≥5 分则视为变应性鼻炎大鼠模型构建成功[19]。待变应性鼻炎模型构建成功后,牡荆素各剂量组大鼠ip 相应药物浓度。对照组和模型组大鼠ip 等量的生理盐水,1 次/d,连续14 d。
1.2.2 大鼠行为学评分 末次给药结束30 min 后,观察并记录在5 min 内各组大鼠的行为并进行行为学评分。喷嚏次数:1~3 个计1 分,4~10 个计2分,≥11 个计3 分;鼻流涕:鼻涕流至前鼻孔计1分,超出前鼻孔计2 分,鼻涕流至满面计3 分;鼻痒程度:轻度的瘙痒、抓挠1~2 次计1 分,剧烈瘙痒、抓挠>2 次计2 分;将上述每项评分相加得到其行为学评分,若行为学评分≥5 分视为模型构建成功[1]。
1.2.3 大鼠鼻黏膜组织形态学观察 末次给药结束后,ip 戊巴比妥钠麻醉大鼠,进行鼻腔开缝,剥离鼻黏膜组织,放置于4%的多聚甲醛中固定2 d,梯度乙醇脱水、二甲苯透明、组织石蜡包埋、切片3~5 μm,行HE 染色,显微镜下观察鼻黏膜组织形态学变化。
1.2.4 大鼠鼻黏膜组织中氧化应激指标及Fe2+水平检测 取各组大鼠鼻黏膜组织,加入预冷的生理盐水充分碾磨,4 ℃、3 000 r/min 离心15 min,吸取上清液,采用生化法检测鼻黏膜组织匀浆中SOD、GSH、MDA 含量,比色法测定Fe2+含量。
1.2.5 ROS 水平检测 取鼻黏膜组织50 mg,加入适量的缓冲溶液进行充分碾磨,于4 ℃、3 000 r/min离心15 min,吸取上清液,按照ROS 检测试剂盒进行ROS 含量测定,使用荧光酶标仪测定荧光强度,BCA 法测定蛋白质浓度。
1.2.6 Western blotting 检测铁死亡相关蛋白及Sirt1/FoxO1 通路蛋白表达 末次给药结束后,立即将大鼠处死,取适量的鼻黏膜组织并提取总蛋白,按照1∶5 质量与体积比加入细胞裂解液,于4 ℃条件下裂解40 min;BCA 法测定各组大鼠鼻黏膜组织蛋白质浓度;蛋白上样(按照每孔上样量30 μg计算得出上样体积);凝胶电泳;湿转法转膜;5%BSA 室温封闭2 h;分别加Sirt1 抗体(1∶500)、Ac-FoxO1 抗体(1∶500)、p-FoxO1 抗体(1∶500)、FoxO1 抗体(1∶1 000)、ACSL4 抗体(1∶1 000)、SLC7A11(1∶500)、GPX4(1∶1 000)以及β-actin抗体(1∶2 000),4 ℃条件下孵育16 h;37 ℃条件下二抗孵育60 min;去除二抗后TBST 洗膜15 min;滴加显影液于Gel Doc XR+成像系统中显影拍照,并采用Image Pro Plus 6.0 软件进行蛋白质条带灰度值半定量分析。
1.2.7 Sirt1 抑制剂对牡荆素改善大鼠鼻黏膜损伤的影响
将SD 大鼠随机分为对照组、模型组、牡荆素(12 mg/kg)组、牡荆素+Sirt1 抑制剂(EX527,5 mg/kg)组,每组各10 只。除对照组外,其余各组大鼠均采用卵清白蛋白诱导建立变应性鼻炎大鼠模型。待模型构建成功后,牡荆素组大鼠ip 12 mg/kg牡荆素;牡荆素+Sirt1 抑制剂组大鼠ip 12 mg/kg 牡荆素后,即刻注射5 mg/kg EX527;对照组和模型组大鼠ip 等量的生理盐水。各组大鼠给药1 次/d,连续14 d。
1.3 统计学分析
采用SPSS 20.0 统计软件进行数据分析。实验结果以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 牡荆素对大鼠行为学评分的影响
如表1 所示,与模型组相比,牡荆素各剂量组大鼠行为学评分均显著降低(P<0.05),且呈剂量相关性。
表1 各组大鼠行为学评分比较(,n =10)Table 1 Comparison of behavioral scores of rats in each group (,n =10)

表1 各组大鼠行为学评分比较(,n =10)Table 1 Comparison of behavioral scores of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素3 mg·kg-1 组比较:&P<0.05;与牡荆素6 mg·kg-1 组比较:△P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin 3 mg·kg-1 group;△P < 0.05 vs vitexin 6 mg·kg-1 group.
2.2 牡荆素对大鼠鼻黏膜组织损伤的影响
对照组大鼠鼻黏膜组织形态、结构正常。模型组大鼠鼻黏膜组织结构损伤严重,纤毛出现大片脱落,且伴有大量的炎症性细胞浸润,固有层血管扩张明显。与模型组相比,牡荆素各剂量组大鼠鼻黏膜组织上皮排列相对整齐,纤毛完整、排列方向一致,炎症性细胞浸润程度明显减轻,固有层血管扩张降低,且呈剂量相关性改善鼻黏膜损伤,见图1。
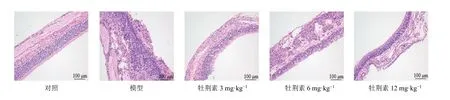
图1 各组大鼠鼻黏膜组织病理学(HE,×200)Fig.1 Histopathology of nasal mucosa of rats in each group (HE,× 200)
2.3 牡荆素对大鼠鼻黏膜组织氧化应激水平及Fe2+水平的影响
如表2 所示,与模型组相比,牡荆素各剂量组大鼠鼻黏膜组织匀浆SOD、GSH 活性显著升高,MDA、ROS、Fe2+含量均显著降低(P<0.05),且呈剂量相关性。
表2 各组大鼠鼻黏膜组织SOD、GSH、MDA、ROS、Fe2+水平比较(,n =10)Table 2 Comparison of SOD,GSH,MDA,ROS,and Fe2+ levels in nasal mucosa tissues of rats in each group (,n =10)

表2 各组大鼠鼻黏膜组织SOD、GSH、MDA、ROS、Fe2+水平比较(,n =10)Table 2 Comparison of SOD,GSH,MDA,ROS,and Fe2+ levels in nasal mucosa tissues of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素3 mg·kg-1组比较:&P<0.05;与牡荆素6 mg·kg-1 组比较:△P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin 3 mg·kg-1 group;△P < 0.05 vs vitexin 6 mg·kg-1 group.
2.4 牡荆素对大鼠鼻黏膜组织铁死亡相关蛋白表达的影响
如图2、表3 所示,与模型组相比,牡荆素各剂量组大鼠鼻黏膜组织SLC7A11、GPX4 蛋白表达显著升高,ACSL4 蛋白表达显著降低(P<0.05),且呈剂量相关性。

图2 各组大鼠鼻黏膜组织SLC7A11、GPX4、ACSL4 蛋白表达条带图Fig.2 Expression bands of SLC7A11,GPX4,and ACSL4 proteins in the nasal mucosa of rats in each group
表3 各组大鼠鼻黏膜组织SLC7A11、GPX4、ACSL4 蛋白相对表达量(,n =10)Table 3 Relative expression of SLC7A11,GPX4,and ACSL4 proteins in nasal mucosa tissues of rats in each group (,n =10)

表3 各组大鼠鼻黏膜组织SLC7A11、GPX4、ACSL4 蛋白相对表达量(,n =10)Table 3 Relative expression of SLC7A11,GPX4,and ACSL4 proteins in nasal mucosa tissues of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素3 mg·kg-1组比较:&P<0.05;与牡荆素6 mg·kg-1 组比较:△P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin 3 mg·kg-1 group;△P < 0.05 vs vitexin 6 mg·kg-1 group.
2.5 牡荆素对大鼠鼻黏膜组织Sirt1/FoxO1 通路的影响
如图3、表4 所示,与模型组相比,牡荆素各剂量组大鼠鼻黏膜组织Sirt1、FoxO1 蛋白表达均显著升高,p-FoxO1、Ac-FoxO1 蛋白表达显著降低(P<0.05),且呈剂量相关性。
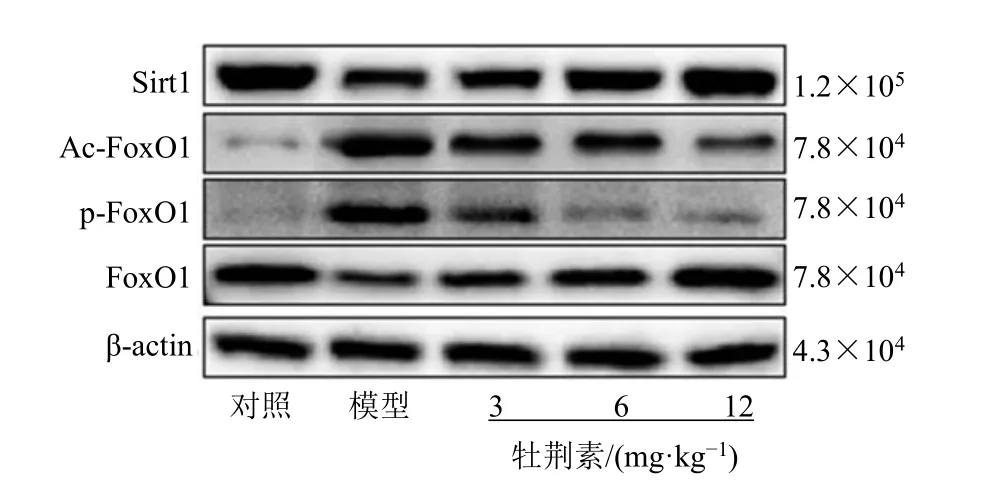
图3 各组大鼠Sirt1、FoxO1、p-FoxO1、Ac-FoxO1 蛋白表达条带图Fig.3 Protein expression bands of Sirt1,FoxO1,and Ac-FoxO1 in each group of rats
表4 各组大鼠鼻黏膜组织Sirt1、FoxO1、p-FoxO1、Ac-FoxO1 蛋白相对表达量(,n =10)Table 4 Relative expression of Sirt1,FoxO1,p-FoxO1,and Ac-FoxO1 proteins in nasal mucosa tissues of rats in each group(,n =10)

表4 各组大鼠鼻黏膜组织Sirt1、FoxO1、p-FoxO1、Ac-FoxO1 蛋白相对表达量(,n =10)Table 4 Relative expression of Sirt1,FoxO1,p-FoxO1,and Ac-FoxO1 proteins in nasal mucosa tissues of rats in each group(,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素3 mg·kg-1组比较:&P<0.05;与牡荆素6 mg·kg-1 组比较:△P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin 3 mg·kg-1 group;△P < 0.05 vs vitexin 6 mg·kg-1 group.
2.6 Sirt1 抑制剂对牡荆素改善大鼠鼻黏膜损伤的影响
如表5、图4 所示,与模型组相比,牡荆素组大鼠行为学评分显著降低(P<0.05),鼻黏膜上皮损伤明显减轻。与牡荆素组相比,牡荆素+EX527组大鼠行为学评分显著升高(P<0.05),鼻黏膜上皮损伤程度加重。

图4 Sirt1 抑制剂对大鼠鼻黏膜组织病理形态学的影响(HE,×200)Fig.4 Effect of Sirt1 inhibitor on the pathological morphology of rat nasal mucosa tissue (HE,× 200)
表5 各组大鼠行为学评分比较(,n =10)Table 5 Comparison of behavioral scores of rats in each group (,n =10)

表5 各组大鼠行为学评分比较(,n =10)Table 5 Comparison of behavioral scores of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin group.
2.7 Sirt1 抑制剂对大鼠鼻黏膜氧化应激及Fe2+水平的影响
如表6 所示,与模型组相比,牡荆素组大鼠鼻黏膜组织匀浆SOD、GSH 活性显著升高,MDA、ROS、Fe2+含量均显著降低(P<0.05)。与牡荆素组相比,牡荆素+EX527 组大鼠鼻黏膜组织匀浆SOD、GSH 活性显著降低,MDA、ROS、Fe2+含量均显著升高(P<0.05)。
表6 各组大鼠鼻黏膜组织SOD、GSH、MDA、ROS、Fe2+水平比较(,n =10)Table 6 Comparison of SOD,GSH,MDA,ROS and,Fe2+levels in nasal mucosa tissues of rats in each group (,n =10)

表6 各组大鼠鼻黏膜组织SOD、GSH、MDA、ROS、Fe2+水平比较(,n =10)Table 6 Comparison of SOD,GSH,MDA,ROS and,Fe2+levels in nasal mucosa tissues of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin group.
2.8 Sirt1 抑制剂对大鼠鼻黏膜组织Sirt1/FoxO1通路及铁死亡的影响
如图5、表7 所示,与模型组相比,牡荆素组大鼠鼻黏膜组织中Sirt1、FoxO1、GPX4、SLC7A11蛋白表达均显著升高,p-FoxO1、Ac-FoxO1、ACSL4蛋白表达均显著降低(P<0.05)。与牡荆素组相比,牡荆素+EX527 组大鼠鼻黏膜组织中Sirt1、FoxO1、GPX4、SLC7A11 蛋白表达均显著降低,p-FoxO1、Ac-FoxO1、ACSL4 蛋白表达均显著升高(P<0.05)。

图5 各组大鼠鼻黏膜组织Sirt1、FoxO1、p-FoxO1、Ac-FoxO1、SLC7A11、GPX4、ACSL4 蛋白表达条带图Fig.5 Expression bands of Sirt1,FoxO1,p-FoxO1,Ac-FoxO1,SLC7A11,GPX4,and ACSL4 proteins in the nasal mucosa of rats in each group
表7 各组大鼠鼻黏膜组织Sirt1、FoxO1、p-FoxO1、Ac-FoxO1、SLC7A11、GPX4、ACSL4 蛋白相对表达(,n =10)Table 7 Relative expression of Sirt1,FoxO1,p-FoxO1,Ac-FoxO1,SLC7A11,GPX4,and ACSL4 proteins in nasal mucosatissues of rats in each group (,n =10)
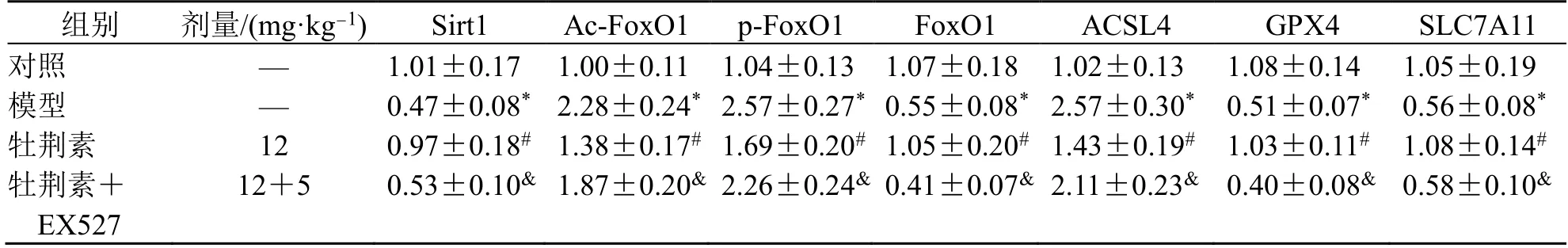
表7 各组大鼠鼻黏膜组织Sirt1、FoxO1、p-FoxO1、Ac-FoxO1、SLC7A11、GPX4、ACSL4 蛋白相对表达(,n =10)Table 7 Relative expression of Sirt1,FoxO1,p-FoxO1,Ac-FoxO1,SLC7A11,GPX4,and ACSL4 proteins in nasal mucosatissues of rats in each group (,n =10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与牡荆素组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs vitexin group.
3 讨论
变应性鼻炎具有发病率、复发率高等特点,但是目前有关其防治手段较为有限,加之变应性鼻炎临床症状与分泌性中耳炎、过敏性结膜炎及鼻窦炎等疾病的发生密切相关,已严重影响患者的生活质量,增加了社会及家庭的经济负担。现如今,变应性鼻炎患者的临床治疗药物多以糖皮质激素及抗组胺类药物为主,能够明显减轻患者症状,但是长时间的使用会诱发患者鼻出血、嗜睡等不良反应[1]。伴随中医药在防治变应性鼻炎中的不断发展,其在变应性鼻炎防治中的优势已逐渐显现,可以显著弥补糖皮质激素及抗组胺类药物的不足之处。
牡荆素是从干燥的山楂叶中提取并分离得到的一种黄酮类单体,具有抗炎、抗氧化等生物学作用。研究显示,牡荆素能够降低LPS 诱导的支气管上皮细胞凋亡及炎症因子的释放[20]。另外,牡荆素能够通过调控自噬、炎症以及氧化应激等途径改善过敏性哮喘诱发的肺部损伤[21]。以上研究提示,牡荆素能够改善呼吸道炎症性疾病,但是有关其对上呼吸道炎症性疾病变应性鼻炎的作用尚不清楚。为此,本研究首先通过构建变应性鼻炎大鼠模型,观察牡荆素对其治疗效果。结果显示,牡荆素能够以剂量相关性降低变应性鼻炎大鼠行为学评分,改善鼻黏膜组织病理性损伤,表明牡荆素具有治疗变应性鼻炎作用。铁死亡是一种新型的细胞调节性死亡,被认为是铁依赖性的脂质过氧化反应的异常代谢,导致ROS 产生增加,进而诱发机体脂质过氧化反应,从而触发细胞死亡[22-24]。SOD 和GSH 作为细胞内抗氧化损伤的关键调节酶,其活性的降低可导致细胞内ROS 的积累增加,诱导细胞损伤[25]。MDA 作为细胞膜脂质过氧化的终产物,其含量的高低是反映细胞损伤的重要指标[26]。此外,铁离子可通过Fenton 反应诱导ROS 产生增加以及脂质过氧化反应,并最终导致细胞产生氧化应损伤[27]。本研究结果显示,牡荆素能够呈剂量相关性增强SOD、GSH 活性,降低MDA、ROS 和Fe2+含量,表明牡荆素能够抑制变应性鼻炎鼻黏膜组织氧化应激性损伤。
GPX4、SLC7A11、ACSL4 被认为是铁死亡发生的关键调控基因,其中GPX4 是细胞中催化还原脂质过氧化产物关键性调控酶,能够降解脂质过氧化产物诱发的细胞毒性。SLC7A11 介导的胱氨酸/谷氨酸转运系统是合成GSH 所需胱氨酸的主要途径,抑制SLC7A11 后会降低GSH 生物合成,导致GPX4 抗氧化能力减低,诱导MDA 产生增多,从而导致细胞铁死亡发生。ACSL4 被证实是铁死亡的标志物,ACSL4 表达上调时脂质过氧化产物产生会明显增多,且GPX4 表达被显著抑制,从而导致ROS清除不及时,进而诱导铁死亡的发生[28-29]。Gu 等[8]研究发现,铁死亡参与了PM2.5诱导的急性鼻黏膜上皮细胞损伤。本研究结果显示,模型组大鼠鼻黏膜组织中SLC7A11、GPX4 表达降低,ACSL4 表达升高,提示变应性鼻炎大鼠鼻黏膜组织存在细胞铁死亡。牡荆素能够以剂量相关性地上调SLC7A11、GPX4,下调ACSL4,抑制细胞铁死亡发生。以上研究表明,牡荆素能够通过抑制细胞铁死亡的发生,进而改善变应性鼻炎大鼠鼻黏膜损伤。
Sirt1/FoxO1 信号通路是与细胞的氧化应激反应、炎症及凋亡等密切相关。研究显示,Sirt1 相关蛋白FoxO1 能够促进SOD 合成,而Sirt1 为NAD+依赖性脱乙酰酶能够直接去乙酰化FoxO1,可明显促进细胞保护基因的表达[30]。本研究结果显示,牡荆素能够以剂量相关性激活Sirt1/FoxO1 信号通路,改善变应性鼻炎大鼠症状。既往研究显示,天麻素能够通过激活SIRT1/FOXO3A/GPX4 信号通路抑制肾小管上皮细胞铁死亡,从而改善顺铂诱导的小鼠急性肾损伤[31]。Zeng 等[32]研究显示,白藜芦醇能够通过激活Sirt1/Nrf2 通路介导的心肌细胞铁死亡改善脓毒症诱导的大鼠心肌病,而采用Sirt1 抑制剂EX527 处理能够诱导心肌细胞铁死亡,从而逆转白藜芦醇对脓毒症诱导的大鼠心肌病的保护作用。为进一步明确Sirt1/FoxO1 信号通路在牡荆素抑制细胞铁死亡,改善变应性鼻炎大鼠鼻黏膜损伤中的作用。本研究通过对牡荆素处理组大鼠ip Sirt1 抑制剂EX527,观察其对变应性鼻炎大鼠鼻黏膜损伤的作用。结果显示,EX527 能够抑制Sirt1/FoxO1 信号通路活化,诱导鼻黏膜上皮细胞铁死亡,逆转牡荆素对变应性鼻炎大鼠鼻黏膜损伤的保护作用。
综上所述,本研究通过探究牡荆素对变应性鼻炎大鼠鼻黏膜损伤的保护作用及其调控机制。结果显示,牡荆素能够改善变应性鼻炎大鼠鼻黏膜损伤,其机制与激活鼻黏膜组织Sirt1/FoxO1 通路,抑制细胞铁死亡有关。
利益冲突所有作者均声明不存在利益冲突
