基于HGF/c-Met 通路探究矢车菊素-3-O-葡萄糖苷改善高糖高脂诱导胰岛β 细胞损伤的机制
2024-01-29马存花高静
马存花,高静
新疆医科大学第五附属医院 内分泌科,新疆 乌鲁木齐 830000
随着社会经济的发展、生活方式的改变和人口老龄化,糖尿病的患病率不断上升,现已成为全球大多数国家亟待解决的健康问题。近年来,我国2型糖尿病患病率迅速上升,现已成为我国重要的公共卫生问题[1]。此外,越来越多的糖尿病患者出现严重并发证,如糖尿病视网膜病变、糖尿病肾病、糖尿病心肌病等,无疑给患者和社会带来了沉重负担[2-4]。胰岛β 细胞的胰岛素分泌水平是维持机体内葡萄糖稳态的关键环节之一,当遗传因素和环境因素损害胰岛β 细胞导致胰岛素分泌遭到破坏时,便会引发代谢性疾病糖尿病的发生[5]。因此,保护胰岛β 细胞免受损伤以维持其正常功能是防治糖尿病的有效手段。
矢车菊素-3-O-葡萄糖苷是类黄酮家族中最丰富的花青素之一,广泛分布于紫色、红色蔬菜和水果中,具有抗癌、抗炎、抗氧化应激等作用[6-7]。目前,已在人类和实验动物中证实花青素可以降低胰岛素抵抗,促进对葡萄糖的吸收和利用,在预防和治疗2 型糖尿病中起着重要作用[8]。还有研究报道指出,在胰岛淀粉样蛋白、β-淀粉样蛋白 1-42(Aβ1-42)、雷帕霉素刺激下,矢车菊素-3-O-葡萄糖苷能够发挥抗氧化和抗炎症作用从而提高胰岛β 细胞活力,维持其正常功能[9]。
肝细胞生长因子(HGF)是一种含肽的多功能细胞因子,能调节细胞增殖、存活、分化、形态以及受损器官的组织再生,通过与其特异性受体间质上皮转化因子(c-Met)结合,将信号传递到细胞中并触发c-Met 的内在激酶活性,发挥相关作用。以往研究表明,HGF/c-Met 信号传导对于胰岛β 细胞的增殖至关重要,激活该途径可以增强胰岛β 细胞的再生能力[10]。基于此,本研究采用葡萄糖与棕榈酸模拟高糖高脂环境诱导胰岛β 细胞损伤,观察矢车菊素-3-O-葡萄糖苷对葡萄糖+棕榈酸钠(HGHF)诱导的胰岛β 细胞损伤的影响并探究可能的作用机制,为矢车菊素-3-O-葡萄糖苷防治糖尿病提供实验依据。
1 材料与方法
1.1 主要材料与试剂
INS-1 胰岛β 细胞(中国科学院细胞库,批号SCSP-5061),矢车菊素-3-O-葡萄糖苷(质量分数≥98%,北京康瑞纳生物科技有限公司,批号LB1573),c-Met 抑制剂SU11274(北京百奥莱博科技有限公司,批号M01028),胎牛血清(南京森贝伽生物公司,批号BC-SE-FBS01),RPMI-1640 培养液(美国ScienCell 公司,批号09511),胰蛋白酶(美国Hyclone 公司,批号SH30042),葡萄糖与棕榈酸(美国Sigma 公司,批号G8270、P5585),CCK-8 试剂盒(上海优利科生命科学有限公司,批号Y1026S),DCFH-DA 活性氧(ROS)荧光探针(西安百萤生物科技有限公司,批号BY15204),超氧化物歧化酶(SOD)、丙二醛(MDA)测试盒(武汉伊莱瑞特生物科技股份有限公司,批号E-ELH6188、E-EL-K027),酶联免疫吸附法(ELISA)胰岛素检测试剂盒(上海远慕生物科技有限公司,批号YM-PF0588),蛋白裂解液(上海雅吉生物科技有限公司,批号3222),二辛可宁酸(BCA)蛋白定量试剂盒(北京天根生化科技有限公司,批号PA115-01),聚偏二氟乙烯膜(PVDF)和ECL 化学发光液(上海碧云天生物研究所,批号FFP39、P0018M),HGF、磷酸化的间质表皮转化因子受体(p-c-Met)、c-Met、β-肌动蛋白(β-actin)抗体及辣根过氧化物酶标记的IgG 抗体(英国Abcam 公司,批号分别为 ab178395、ab278552、ab68141、ab179467、ab205718)。
1.2 方法
1.2.1 细胞培养 使用含10%胎牛血清和1%青链霉素双抗的RPMI-1640 培养液培养胰岛β 细胞,将培养体系放于37 ℃、5% CO2恒温箱内,每隔1 d换液1 次,进行常规传代培养,取对数生长期的细胞进行实验。
1.2.2 CCK-8 法检测细胞活力 将胰岛β 细胞按照每孔5×103个的密度接种于96 孔板,在37 ℃、5% CO2恒温箱过夜培养至贴壁后,换用含10、20、30、40、50 μmol/L 矢车菊素-3-O-葡萄糖苷的培养液处理24 h,对照组为不含矢车菊素-3-O-葡萄糖苷的常规培养液培养的胰岛β 细胞,CCK-8 法检测不同处理下的细胞活力,多功能酶标仪测定490 nm 处每孔的吸光度(A),分别计算各处理组的细胞活力。
1.2.3 实验分组与处理 将胰岛β 细胞以每孔2×105个的密度接种于6 孔板中,分为4 组进行实验,具体分组与处理如下:对照组使用常规培养液培养胰岛β 细胞24 h;模型组参考文献报道[11],使用含25 mmol/L 葡萄糖与0.5 mmol/L 棕榈酸的培养液培养胰岛β 细胞24 h,诱导细胞损伤;矢车菊素-3-O-葡萄糖苷10、50 μmol/L 组在模型组基础上分别使用含10、50 μmol/L 矢车菊素-3-O-葡萄糖苷的培养液培养胰岛β 细胞24 h。处理结束后收集细胞,CCK-8 法检测各处理组细胞活力。
1.2.4 ELISA 法测定胰岛素分泌量 为通过检测胰岛素分泌量变化来判断胰岛β 细胞功能是否正常,将分组处理后的胰岛β 细胞收集至离心管,1 000 r/min 离心20 min,弃上清,PBS 洗涤,分别添加含2.8、16.7 mmol/L 葡萄糖的KRBH 缓冲液(无BSA,无糖),在37 ℃、5% CO2恒温箱孵育1 h,离心后收集上清,采用ELISA 法测定上清液中胰岛素分泌量,严格按照说明书操作。
1.2.5 DCFH-DA 荧光探针法检测细胞内的ROS 水平 将胰岛β 细胞按照每孔1×105个的密度植入6孔板中,按分组进行对应处理后,去除上清,在细胞孔中添加含1 μmol/L DCFH-DA 荧光探针的培养液,在37 ℃、5% CO2恒温箱内避光孵育30 min,结束后,PBS 洗涤细胞,采集荧光图像,使用Image J 软件分析各组的荧光强度,以荧光强度表示细胞内ROS 水平。
1.2.6 SOD 活性和MDA 含量检测 胰岛β 细胞分组处理后,4 000 r/min 离心10 min,弃上清,在沉淀中加入蛋白裂解液提取总蛋白,采用比色法检测SOD 活性与MDA 含量,严格根据试剂盒说明书进行测定。
1.2.7 Western blotting 法检测相关蛋白表达 在各处理组胰岛β 细胞中加入适量蛋白裂解液,置于冰上充分裂解细胞,提取总蛋白,BCA 法对蛋白浓度进行定量。各样本均取30 μg 蛋白上样至凝胶孔,10% SDS-PAGE 电泳分离蛋白,并电转至PVDF 膜,再将膜浸入脱脂奶粉中封闭2 h,TBST 洗膜,加入HGF、p-c-Met、c-Met 抗体(1∶1 000),4 ℃摇床孵育过夜,取膜复温,TBST 洗膜,加入二抗(1∶5 000)室温孵育2 h。结束后,ECL 化学发光液显影,采集蛋白条带,使用Image J 软件分析条带灰度值,选择β-actin 作为内参蛋白,以目的蛋白灰度值与内参蛋白灰度值的比值来统计目的蛋白相对表达量。
1.2.8 c-Met 抑制剂SU11274 干预细胞 将胰岛β细胞分为对照组、模型组、矢车菊素-3-O-葡萄糖苷组、矢车菊素-3-O-葡萄糖苷+SU11274 组进行实验,按照每孔2×105个的密度接种于6 孔板中,进行对应处理,具体如下:对照组使用常规培养液培养胰岛β 细胞24 h;模型组使用含25 mmol/L 葡萄糖与0.5 mmol/L 棕榈酸的培养液培养胰岛β 细胞24 h;矢车菊素-3-O-葡萄糖苷组使用含50 μmol/L矢车菊素-3-O-葡萄糖苷的培养液培养胰岛β 细胞24 h;矢车菊素-3-O-葡萄糖苷+SU11274 组使用含50 μmol/L 矢车菊素-3-O-葡萄糖苷的培养液培养胰岛β 细胞,并加入5 μmol/L SU11274 共作用24 h。结束后,收集各组细胞,CCK-8 法检测细胞活力,按1.2.4项下ELISA 法测定上清液中胰岛素分泌量。
1.3 统计学分析
实验数据用GraphPad Prism 8.0.1 软件进行统计分析,制作统计图。实验结果用表示。多组数据差异比较和组间两两比较分别采用单因素方差分析与LSD-t检验。
2 结果
2.1 矢车菊素-3-O-葡萄糖苷对胰岛β 细胞活力的影响
结果显示,相较于对照组,10、20、30、40、50 μmol/L 矢车菊素-3-O-葡萄糖苷均显著提高了胰岛β 细胞活力(P<0.05),见图1。
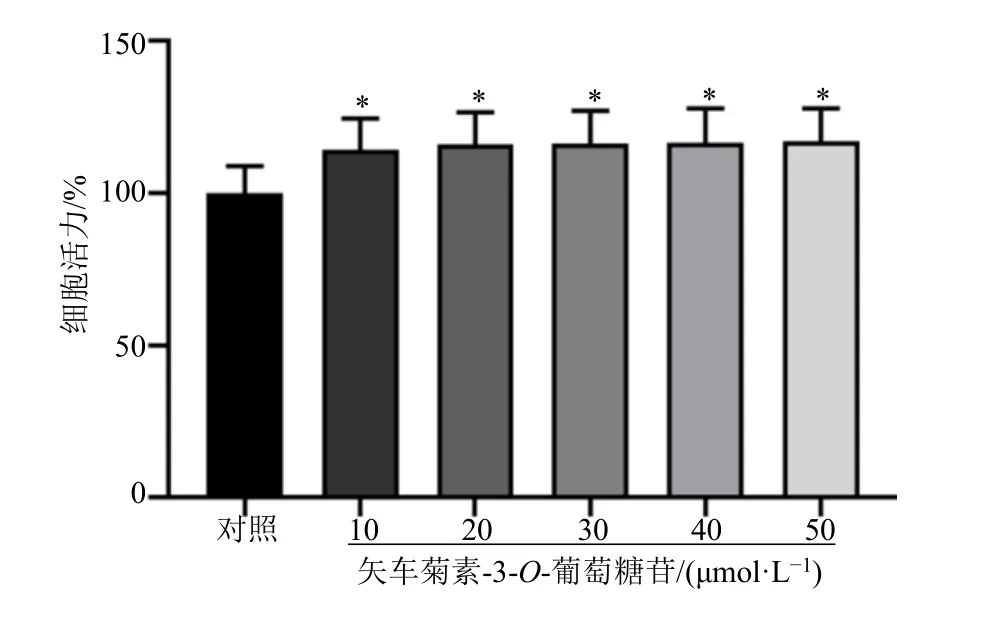
图1 不同浓度矢车菊素-3-O-葡萄糖苷处理下胰岛β 细胞活力比较(,n =6)Fig.1 Comparison of islet β cell activity under different concentrations of cyanidin-3-O-glucoside (,n =6)
2.2 矢车菊素-3-O-葡萄糖苷对HGHF 诱导下的胰岛β 细胞活力的影响
结果显示,与模型组比较,矢车菊素-3-O-葡萄糖苷10、50 μmol/L 组细胞活力显著升高(P<0.05),且矢车菊素-3-O-葡萄糖苷50 μmol/L 组细胞活力升高更为显著(P<0.05),见图2。
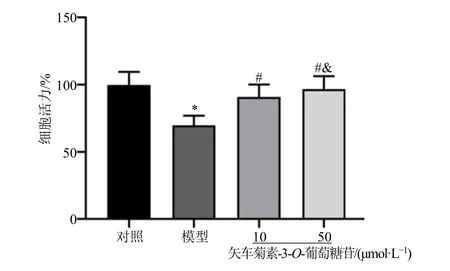
图2 各处理组胰岛β 细胞活力比较(,n =6)Fig.2 Comparison of islet beta cell activity among treatment groups (,n =6)
2.3 矢车菊素-3-O-葡萄糖苷对HGHF 诱导下的胰岛β 细胞胰岛素分泌水平的影响
在2.8、16.7 mmol/L 葡萄糖刺激下,与对照组相比,模型组胰岛素分泌水平显著降低(P<0.05);与模型组比较,矢车菊素-3-O-葡萄糖苷10、50 μmol/L 组胰岛素分泌水平均显著增加(P<0.05),且矢车菊素-3-O-葡萄糖苷50 μmol/L 组胰岛素分泌水平升高更为显著(P<0.05),见表1。
表1 各组胰岛β 细胞分泌胰岛素水平比较(,n =6)Table 1 Comparison of insulin secreted by islet β cells among groups (,n =6)
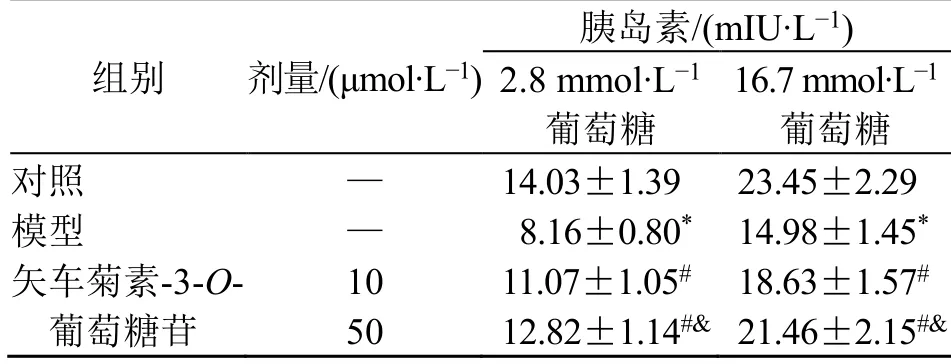
表1 各组胰岛β 细胞分泌胰岛素水平比较(,n =6)Table 1 Comparison of insulin secreted by islet β cells among groups (,n =6)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与矢车菊素-3-O-葡萄糖苷10 μmol·L-1 组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs cyanidin-3-O-glucoside 10 μmol·L-1 group.
2.4 矢车菊素-3-O-葡萄糖苷对HGHF 诱导下的胰岛β 细胞氧化损伤的影响
与模型组比较,矢车菊素-3-O-葡萄糖苷10、50 μmol/L 组细胞内ROS 水平、MDA 含量显著降低,SOD 活性显著升高(P<0.05)。与矢车菊素-3-O-葡萄糖苷10 μmol/L 组比较,矢车菊素-3-O-葡萄糖苷50 μmol/L 组细胞内ROS 水平、MDA 含量显著降低,SOD 活性也显著升高(P<0.05),见表2。
表2 各组胰岛β 细胞氧化应激相关指标比较(,n =6)Table 2 Comparison of oxidative stress-related indexes in islet β cells of each group (,n =6)

表2 各组胰岛β 细胞氧化应激相关指标比较(,n =6)Table 2 Comparison of oxidative stress-related indexes in islet β cells of each group (,n =6)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与矢车菊素-3-O-葡萄糖苷10 μmol·L-1 组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs cyanidin-3-O-glucoside 10 μmol·L-1 group.
2.5 矢车菊素-3-O-葡萄糖苷对HGHF 诱导下的胰岛β 细胞中HGF/c-Met 信号通路的影响
Western blotting 结果显示,与模型组比较,矢车菊素-3-O-葡萄糖苷10、50 μmol/L 组细胞中HGF、p-c-Met/c-Met 蛋白水平显著上调(P<0.05);与矢车菊素-3-O-葡萄糖苷10 μmol/L 组比较,矢车菊素-3-O-葡萄糖苷50 μmol/L 组细胞中的HGF、p-c-Met/c-Met 蛋白表达水平也要显著升高(P<0.05),见图3。
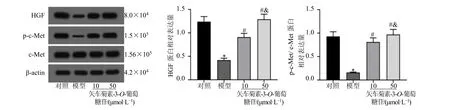
图3 各组胰岛β 细胞中HGF 和p-c-Met/c-Met 蛋白表达水平比较(,n =6)Fig.3 Comparison of HGF and p-c-Met/c-Met protein expression levels in islet β cells of different groups (,n =6)
2.6 c-Met 抑制剂SU11274 作用下对矢车菊素-3-O-葡萄糖苷改善HGHF 诱导下胰岛β 细胞损伤效果的影响
结果显示,与模型组比较,矢车菊素-3-O-葡萄糖苷组细胞活力显著升高(P<0.05);与矢车菊素-3-O-葡萄糖苷组比较,矢车菊素-3-O-葡萄糖苷+SU11274 组细胞活力显著降低(P<0.05),见图4。
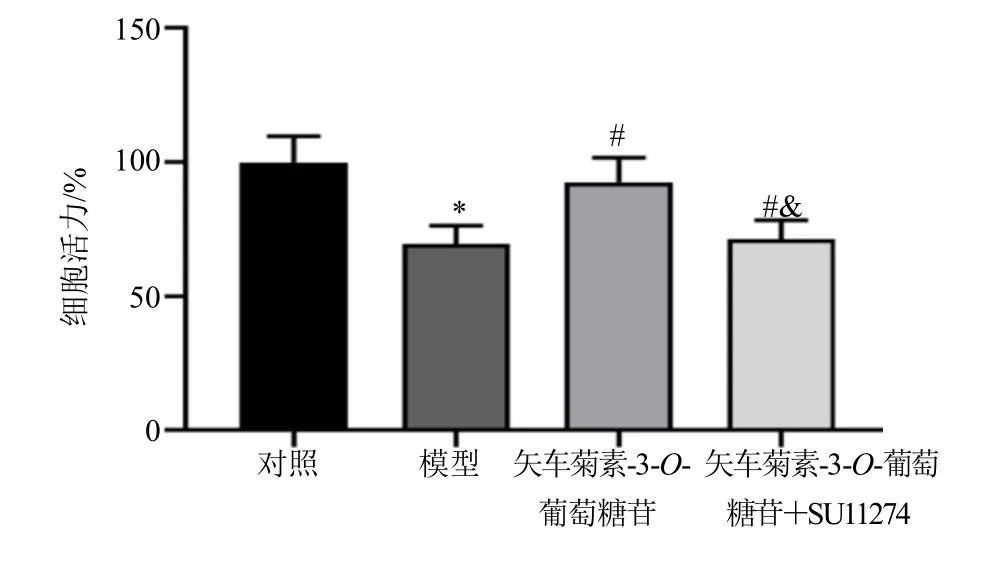
图4 各组胰岛β 细胞活力比较(,n =6)Fig.4 Comparison of islet β cell activity among treatment groups (,n =6)
胰岛β 细胞分泌胰岛素水平结果显示,经过2.8、16.7 mmol/L 葡萄糖刺激下,与模型组比较,矢车菊素-3-O-葡萄糖苷组胰岛素分泌水平均显著增加(P<0.05);而与矢车菊素-3-O-葡萄糖苷组比较,矢车菊素-3-O-葡萄糖苷+SU11274 组胰岛素分泌水平显著减少(P<0.05),见表3。
表3 各组胰岛β 细胞分泌胰岛素水平比较(,n =6)Table 3 Comparison of insulin secreted by islet β cells among groups (,n =6)

表3 各组胰岛β 细胞分泌胰岛素水平比较(,n =6)Table 3 Comparison of insulin secreted by islet β cells among groups (,n =6)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与矢车菊素-3-O-葡萄糖苷组比较:&P<0.05。*P < 0.05 vs control group;#P < 0.05 vs model group;&P < 0.05 vs cyanidin-3-O-glucoside group.
3 讨论
糖尿病作为一种慢性疾病,是全球十大死因之一,发病率呈逐年上升趋势,对人类健康造成了严重威胁[12]。胰岛β 细胞功能障碍和/或胰岛β 细胞丢失引起的胰岛素分泌不足是引发糖尿病的关键原因。胰岛β 细胞功能障碍或死亡可能由多种代谢紊乱引发,如糖毒性、脂毒性、氧化反应等[13-14]。研究表明,高糖高脂环境极易诱发胰岛β 细胞死亡,引起血糖水平增高,形成恶性循环,促进了疾病进展[15]。因此,保护胰岛β 细胞免受高糖高脂环境诱导的损伤是延缓糖尿病进程的关键。本研究结果显示,经过在葡萄糖与棕榈酸建立的高糖高脂环境中培养胰岛β 细胞后,细胞活力显著降低,通过2.8、16.7 mmol/L 葡萄糖刺激后,胰岛β 细胞分泌胰岛素的水平也显著减少。由此说明,在葡萄糖与棕榈酸诱导下胰岛β 细胞发生了糖脂毒性损伤。
近年来,越来越多的研究揭示了矢车菊素-3-O-葡萄糖苷对人体健康的益处,如矢车菊素-3-O-葡萄糖苷通过抑制c-Jun 氨基末端激酶(JNK)通路阻断肿瘤细胞及其微环境中的自噬水平,在体内表现出抗肿瘤作用[16];矢车菊素-3-O-葡萄糖苷能够修复破损肠黏膜和调节肠道菌群,改善肠道疾病与保持肠道稳态,起到肠道保护作用[17];矢车菊素-3-O-葡萄糖苷能够减少心肌缺血再灌注损伤中心肌梗死面积,减轻组织病理改变,减弱氧化应激反应,其可能是保护心肌免受缺血再灌注损伤的潜在药物[18]。此外,矢车菊素-3-O-葡萄糖苷对糖尿病及其并发证产生积极作用。Ye 等[19]研究发现,矢车菊素-3-O-葡萄糖苷能够抑制高浓度高葡萄糖和棕榈酸诱导胰岛β 细胞的氧化损伤,并缓解糖尿病db/db 小鼠胰岛氧化应激;Bartel 等[20]研究表明,矢车菊素-3-O-葡萄糖苷参与缓解炎症、降低血糖以及与2 型糖尿病发展相关的基因表达,有助于预防与减轻2 型糖尿病的发生发展;Anfuso 等[21]研究指出矢车菊素-3-O-葡萄糖苷能提高高浓度葡萄糖刺激下人视网膜内皮细胞的活力,降低细胞内ROS 水平,防治血液-视网膜屏障破坏,有效地保护视网膜内皮细胞免受高葡萄糖损伤。本研究结果显示,相较于单独在高糖高脂环境下培养的胰岛β 细胞,在高糖高脂环境中同时加入10、50 μmol/L 矢车菊素-3-O-葡萄糖苷培养胰岛β 细胞后,细胞活力显著升高,2.8、16.7 mmol/L 葡萄糖刺激下的胰岛素分泌水平也显著增加,细胞内ROS 水平、MDA 含量显著降低且SOD 活性显著升高。由此说明,在高糖高脂环境下,矢车菊素-3-O-葡萄糖苷能够提高胰岛β 细胞活力,改善其胰岛素分泌功能,抑制氧化应激反应。
与其他生长因子及其受体不同,HGF 作为独特的配体与c-Met 结合,诱导c-Met 的聚集和磷酸化,随后导致适配器分子与其结合并介导下游信号的传输。HGF/c-Met 信号通路的生物学功能广泛而多样,对于肝脏损伤修复、肝纤维化、肝移植后再生具有重要的临床意义[22],激活该通路也能够促进子宫内膜损伤的修复作用[23]。先前已有研究表明,在高糖刺激下,缺失了c-Met 的胰岛INS-1 细胞表现为胰岛素分泌不足[24],提示HGF/c-Met 信号通路对于维持正常的胰岛分泌功能至关重要。本研究检测发现,在高糖高脂环境中培养的胰岛β细胞中HGF、p-c-Met/c-Met 蛋白水平显著下调;而加入10、50 μmol/L 矢车菊素-3-O-葡萄糖苷培养的胰岛β 细胞中检测到HGF、p-c-Met/c-Met 蛋白水平显著上调。因此推测,HGF/c-Met 信号通路可能参与胰岛β 细胞的糖脂毒性损伤。为了进一步验证该结论,在高糖高脂环境联合矢车菊素-3-O-葡萄糖苷培养的体系中加入c-Met 抑制剂SU11274 处理胰岛β 细胞后,检测到细胞活力显著下降,且胰岛素分泌水平显著减少。以上结果表明,矢车菊素-3-O-葡萄糖苷对HGHF 诱导的胰岛β 细胞损伤的保护效应与激活HGF/c-Met 通路有关。
综上所述,本研究表明矢车菊素-3-O-葡萄糖苷能够提高高糖高脂诱导下的胰岛β 细胞活力,改善胰岛素分泌功能,抑制氧化应激损伤反应,该作用与其激活HGF/c-Met 通路有关。本研究为糖尿病的治疗提供新的切入点,并为探究矢车菊素-3-O-葡萄糖苷的抗糖脂毒性作用提供实验依据。
利益冲突所有作者均声明不存在利益冲突
