光动力疗法治疗神经胶质瘤的研究进展*
2024-01-27杨田田胡美纯
杨田田,常 婧,胡美纯
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部基础医学院)
神经胶质瘤因其恶性程度高,并且无法治愈的特点使其已成为全世界癌症死亡的主要原因之一[1]。神经胶质瘤患者平均生存期不超过1.5年[2]。目前主要的神经胶质瘤治疗方案有手术切除、化疗和放疗等。由于手术切除不完全,长期使用替莫唑胺(temozolomide,TMZ)存在发生耐药及放疗毒性的局限性[3]。因此,针对神经胶质瘤急需寻找新的治疗方案。已有临床研究表明[3],光动力疗法(photodynamic therapy,PDT)可以延长癌症患者的生存期,提高病人的生活质量,已成为前景广阔的肿瘤治疗最新候选方案之一。本文将从PDT单独治疗、PDT联合化疗药物、PDT联合手术、PDT联合其他治疗方法这几方面来综述PDT治疗神经胶质瘤的研究进展。
1 光动力疗法概述
PDT由光敏剂(photosensitizers,PS)、光和氧三种基本成分组成。这些物质单独存在时没有毒性,但它们同时存在会引发光化学反应,以特定波长的光源激发光敏剂,随后迅速与周围的氧发生作用,产生可以攻击靶细胞或组织等生物大分子的活性氧(reactive oxygen species,ROS),后者可迅速引起细胞毒性来促进细胞凋亡,从而达到治疗目的[4]。所以PDT的关键在于光敏剂、光源和氧的协同作用。对于光动力治疗,第一个不可缺少的因素是PS。PS是一种积聚在肿瘤组织中并选择性地使其对光敏感的物质,单一的纯化合物,成本低、稳定性好,600~800nm的高吸收峰(红色到深红色)是理想的光敏剂。第一代PS是一种血卟啉衍生物(hematoporphyrin derivatives,HPD),其纯化形式为Photofrin,它应用最为广泛。第二代PS是5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)、硼酸原卟啉(boric acid protoporphyrin,BOPP)。其中5-ALA可以口服或静脉注射,5-ALA需要转化为原卟啉才能有活性,它暗毒性低,并且从正常组织中清除速度快,从而减少光毒性副作用。第三代PS是光敏剂可以共价结合到几种对肿瘤具有亲和力的生物分子上,这些生物分子包括抗体、蛋白质、碳水化合物或其他物质,光敏剂也可以封装在载体中,如金纳米颗粒、二氧化硅纳米颗粒、量子点、碳纳米管或其他载体,以引导光敏剂进入肿瘤。光动力治疗的另一个因素是应有相应波长的光源,通过光源可加强积累在肿瘤区域的PS。红光和红外辐射穿透率最高,蓝光穿透组织率较低,也可以应用激光和白炽光源。PS的吸收程度和疾病的特征都与选择的光源相关。光的剂量、暴露时间和光传递模式等决定了PDT的临床疗效。光动力治疗最后一个必要的刺激是分布在整个组织中的氧气,在PDT过程中氧对ROS的产生至关重要。PDT主要通过直接杀伤肿瘤细胞、诱导血管微循环损伤、刺激炎症反应激活抗肿瘤免疫系统等机制抑制肿瘤,见图1。
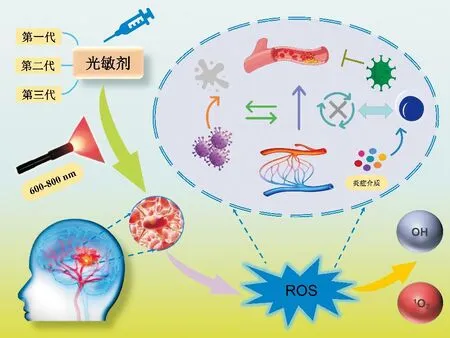
图1 PDT治疗神经胶质瘤的简要机制图
2 光动力单独疗法治疗神经胶质瘤
Jiang等[5]通过MTT法和克隆实验测定Photofrin对神经胶质瘤细胞的毒性,在定性球体对抗试验中,肿瘤球体和脑聚集物之间共培养的亚细胞毒性,PDT没有进行性肿瘤侵袭和脑聚集物的破坏。通过基质人工基底膜迁移实验,细胞毒性研究结果表明Photofrin介导PDT对神经胶质瘤细胞具有剂量依赖的抗肿瘤和抗侵袭特性。当神经胶质瘤细胞被高剂量PDT处理时,部分细胞被杀死,抑制了细胞侵袭。然而,当细胞被低剂量PDT处理时即使不能达到显著的细胞毒性,仍然可以显著抑制肿瘤细胞的侵袭。因此,高剂量PDT具有细胞毒性可以抑制肿瘤,而低剂量PDT可以特异性地减少肿瘤侵袭。但此项研究尚缺乏体内实验进一步验证。
5-ALA与第一代光敏剂不同,它需要转换成血红素合成过程中的产物原卟啉,才能发挥光敏剂的作用,它在体内代谢快,副作用很小。5-ALA低浓度时,原卟啉的含量随着5-ALA的浓度增高而增高;但在高浓度范围内,原卟啉出现了饱和现象,所以PDT用低浓度的5-ALA更有效。研究表明神经胶质瘤U251细胞随着激光剂量的增加而不断凋亡。换言之,随着激光剂量不断增加,吸收的光敏剂越多,杀死的肿瘤细胞越多[6]。美国食品药品监督管理局已经批准5-ALA用于PDT治疗癌症和恶性疾病[7]。
3 光动力联合化疗药物治疗神经胶质瘤
3.1 光动力联合替莫唑胺
治疗神经胶质瘤最常见的化疗药物是TMZ。目前临床上神经胶质瘤对TMZ敏感性降低的问题仍然很棘手,有待解决[8]。细胞增殖周期分别为G1、S、G2、M期,其中肿瘤耐药基因多发生在G1期向S期转换过程中。有研究[9]结果表明光照射肿瘤细胞后会出现细胞核畸形、多核巨细胞、畸变的染色体等现象。TMZ和PDT联合使用可以抑制肿瘤细胞增殖,防止耐药基因由G1期向S期转化,从而降低其耐药性。PDT提高了胞内的血药浓度,增强杀伤能力,进而降低耐药性是因为破坏了肿瘤细胞膜上的蛋白,改变血脑屏障的通透性,拮抗药物排出胞外的能力,使药物更容易进入胞内。长期随访PDT联合TMZ治疗神经胶质瘤的患者,通过评估分析患者的临床症状、预后及影像学指标等,表明患者术后临床症状改善,没有发生不良反应,治疗效果明显好转[11]。
联合治疗的基本原理是通过靶向和TMZ不同药理机制的其他关键分子或通路,从而增加TMZ的疗效,降低神经胶质瘤细胞多重耐药性(multi-drug resistance,MDR)的发生[12]。侯魁元等[13]发现PDT增强了TMZ对U251细胞的增殖抑制及细胞的局部侵袭,还发现PDT不仅增加了U251细胞对TMZ的敏感性,还增加了其细胞毒作用。众所周知,PDT主要产生ROS,它可以破坏线粒体膜,诱导线粒体氧化应激,从而启动线粒体途径的Bax/细胞色素C/caspase-3经典细胞凋亡途径。线粒体膜电位(mitochondrial membrane potential,MMP)是线粒体膜两侧离子浓度差异所产生的跨膜电位差,它反映了线粒体功能状态。ROS与MMP呈负相关。总之,PDT作用下,TMZ增加了神经胶质瘤细胞内ROS,降低MMP水平;PDT也增强了神经胶质瘤细胞对TMZ的敏感性,延缓了MDR的发生。这为临床应用奠定了基础。
3.2 光动力联合布美他尼
由于外科手术治疗神经胶质瘤术后出现了瘤周水肿。NKCC-1是中枢神经系统最主要的Na-K-CL共转运蛋白,参与多种细胞功能的调节,然而NKCC-1过度激活可能导致生理功能的紊乱及细胞肿胀。研究人员[14]猜想NKCC-1可能参与PDT诱导的瘤周水肿过程,所以采用了NKCC-1抑制剂布美他尼,检测其能否减轻PDT诱导的瘤周水肿。在建立的大鼠神经胶质瘤模型中,将荷瘤成功的大鼠随机分为空白对照组、PDT组、布美他尼组、联合治疗组,观察大鼠生存期和肿瘤的重量、体积以及通过干湿重法测定脑组织瘤周水含量。Western blot实验和免疫组化染色表明PDT组NKCC-1表达明显增强,联合组NKCC-1表达明显减弱。联合治疗组的血脑屏障大量开放,裂隙增宽,联合治疗抑制了NKCC-1过表达,减轻了肿瘤周围水肿;同时也发现布美他尼能通过抑制神经胶质瘤细胞DNA的合成来抑制肿瘤生长。因此,布美他尼与PDT联合治疗不仅增强了PDT抗肿瘤作用,而且减轻了瘤周水肿。
4 光动力治疗及荧光引导手术
有研究[15]表明应用0.5mmol/L 5-ALA的浓度对培养的U251细胞进行PDT,明显降低了肿瘤细胞的侵袭性,通过电镜观察到细胞结构发生明显破坏,如膜状伪足、丝状伪足和微绒毛等。Li等[16]应用HPD介导PDT联合手术治疗恶性脑肿瘤,手术前24h避光注入5.0mg/kg的光敏剂,设置PDT治疗仪输出功率为500mW、总能量240J/cm2、波长628nm,治疗效果明显,减轻了脑水肿,控制了颅内压,延长了肿瘤复发时间。在5-ALA应用于荧光引导的神经胶质瘤切除手术中,5-ALA增加了对高级别神经胶质瘤的辨识度,有利于完整切除肿瘤,从而有助于改善患者的预后。
王宏伟等[17]研究发现,在减缓出现新的神经功能缺失、改善患者生活质量等方面,神经导航显微手术与PDT联合治疗功能区脑胶质瘤具有一定的优势,可使残余肿瘤体积缩小,减少神经功能缺失,从而有效抑制肿瘤生长。根据诊断收集65例患者临床资料,其中治疗组40例,对照组25例。结果显示,治疗组8周出现新的神经功能缺失率为2.5%,有31例水肿带减轻,8例残留肿瘤明显缩小;对照组出现新的神经功能缺失率为8.0%,15例水肿带减轻,4例术后残留肿瘤没有明显变化。PDT主要是通过在术中对肿瘤残腔或少量残留肿瘤细胞进行治疗,提前静脉注射光敏剂可以选择性地汇集在肿瘤细胞中,在有氧条件下,给予特定波长的光束照射肿瘤细胞内的光敏剂,使其产生单线氧和自由基杀伤肿瘤细胞,从而达到治疗目的[17]。切除胶质瘤后行PDT其优越性在于侵入性小,对瘤细胞的选择性高,毒性小和术后不良反应少,在保留神经功能的基础上,有效杀伤肿瘤细胞。在现有的临床研究中,PDT联合外科手术已经成为治疗神经胶质瘤的主流方案。
5 光动力联合其他治疗方法
5.1 光动力联合声动力学疗法
卟啉钠(sinoporphyrin sodium,DVDMS)是一种通过激光和超声波激活的新型敏化剂。研究已经证实[18],DVDMS介导的PDT和声动力学疗法(sonodynamic therapy,SDT)通过生成ROS,损伤DNA,基质金属蛋白酶下调,F-肌动蛋白丝崩溃和细胞凋亡等机制抑制肿瘤。结果表明DVDMS-PDT和DVDMS-SDT均在体外显著抑制神经胶质瘤U-118 MG细胞的增殖并诱导细胞凋亡。此外,在裸鼠异种移植模型中静脉注射DVDMS,24h后行PDT和SDT,治疗前肿瘤大小无明显差异,但治疗后PDT组和SDT组肿瘤明显减小,这两组的肿瘤增殖也低于对照组,PDT联合SDT后凋亡细胞比例随时间延长而增加。另外,DVDMS具有良好的水溶性和稳定性,DVDMS可能是一种有希望的PDT和SDT增敏剂。DVDMS可作为荧光指示剂显示肿瘤边界并指导手术切除,然而血脑屏障可能会阻止DVDMS进入大脑。有研究[19-20]表明与锰离子螯合的DVDMS封装到纳米脂质体中,使用超声靶向微泡破坏结合iRGD修饰的DVDMS脂质体治疗神经胶质瘤可行,表明DVDMS介导的PDT和SDT增加了cleaved-caspase 3,抑制了增殖细胞核抗原和Bcl-xL的表达水平,并减少了PI3K/AKT/mTOR通路的蛋白质磷酸化来抑制神经胶质瘤细胞增殖并诱导细胞凋亡。综上所述,DVDMS-PDT和DVDMS-SDT可能会成为治疗神经胶质瘤的潜在方案。
5.2 光动力联合高热疗法
Hermisson等[21]在人类和大鼠神经胶质瘤球体中进行了高热疗法(hyperthermia therapy,HT)和PDT联合治疗的研究,观察到显著的抑制反应,在49℃以下,反应程度明显与温度和光照有关,治疗效果随着温度和光照影响的增加而提高。总而言之,细胞凋亡是低通量PDT和HT+PDT联合治疗后细胞死亡的主要模式,通过荧光图像显示HT+PDT对细胞凋亡的诱导作用显著,而HT单独对细胞凋亡的诱导作用较差。在神经胶质瘤的治疗中,同时添加HT也可能是增加ALA介导的PDT抗肿瘤作用的有效策略[22]。有研究发现[23]在HT中,将光敏剂注入体内可以很好的靶向富集在肿瘤附近,增强癌组织周围的近红外吸收,光能与热能间转换效率明显提升,以实现杀死癌细胞的目的。通过上调Caspase-3、Caspase-8、Caspase-9、Bax和下调Bcl-2,HT可显著促进PDT抑制神经胶质瘤细胞增殖,促进细胞凋亡。
5.3 光动力联合纳米技术
Chen等[24]报道[Ru(bpy)2(tip)]2+(RBT)是PDT治疗肿瘤的高效光敏剂。通过负载RBT药物的纳米载体对神经胶质瘤进行靶向化疗和PDT是一种合理可行的治疗方案。为了克服血脑屏障和靶向性低,提高纳米药物的抗神经胶质瘤活性,科学界已开发具有双重靶向功能的介孔钌纳米体系RBT@MRN-SS-Tf/Apt。该疗法有助于特异性靶向肿瘤类型,同时确保对神经胶质瘤的高度特异性。而且纳米药物递送系统可以稳定地包裹RBT,克服血脑屏障并深入肿瘤组织,通过荧光成像可以观察纳米药物靶向脑肿瘤的递送及其组织分布。同时研究结果也表明与Tf和AS1411协同偶联的纳米颗粒对神经胶质瘤的疗效显著提高,这可以为抗神经胶质瘤治疗提供潜在的药物递送系统。在异种裸鼠模型中注射RBT、RBT@MRN-SS-Tf+激光治疗20d后观察小鼠体重分别为14.6、18.99g,存活的时间分别为26、56d。显然,RBT@MRN-SS-Tf/Apt+激光治疗可以显著提高裸鼠的生存时间,改善体重。随后,在PDT过程中通过观察模型小鼠的日常行为,如饮食、饮水、梳理、探索行为、排便或神经状态,小鼠没有死亡或明显的毒性反应。因此,这种化学PDT纳米系统可以作为一种高效、强大的协同系统,用于治疗脑肿瘤和其他中枢神经系统的脑疾病[25]。
Wang等[26]为了解决神经胶质瘤组织中光敏剂浓度低和缺氧微环境阻碍PDT的问题,构建了PB@PMO-5-ALA来增强PDT治疗。体内实验结果表明PB@PMO5-ALA在注射后12h在肿瘤组织中高度积聚,与5-ALA相比,原卟啉I X(protoporphyrin I X,PpI X)浓度显著增加了75%。PBS治疗的小鼠出现了肿瘤增大,5-ALA组肿瘤生长适度抑制,而PB@PMO-5-ALA介导的PDT对肿瘤生长延迟的影响最为明显。体外实验表明PB@PMO-5-ALA在激光照射下诱导了大量ROS的产生,与5-ALA组相比,PB@PMO-5-ALA细胞的活力12h时降至45%以下。激光照射PB@PMO-5-ALA引起显著的氧化应激、肿瘤细胞凋亡和抑制细胞增殖,成功延缓肿瘤生长。体外和体内的结果表明PB@PMO-5-ALA可以通过增加光敏剂的积累和氧气供应来增强对PDT治疗效应。总之,5-ALA结合PB@PMO纳米颗粒无明显毒性,并在肿瘤细胞中将5-ALA转化为足够的PpIX,从而协同增强PDT抗肿瘤活性。PB@PMO-5-ALA协同PDT在治疗神经胶质瘤方面具有治疗潜力[26]。
6 总结与展望
PDT与传统的癌症治疗方法相比,具有治疗效果较好、副作用较低、耗时短、愈合后几乎没有疤痕等优点。PDT治疗无需大手术,显微手术切除后仅配合内镜或其他介入技术将光源引导到颅内进行治疗,尽可能避免手术造成的创伤和痛苦。但是,治疗侵袭性神经胶质瘤的挑战仍然艰巨,比如中枢神经系统肿瘤位置较深,需要手术后再进行光源照射,在治疗的可重复性、手术风险、治疗的安全性与便利性及患者经济负担方面均存在较多挑战。此外,PDT治疗后可能会出现光敏性。PDT治疗效果取决于照射的准确性,所以很难用于播散性转移瘤。组织氧合对于光动力效应的发生至关重要,因此,被坏死组织或致密肿瘤肿块包围的肿瘤会导致PDT无效。而且,由于可见光对组织的渗透率低,深部肿瘤如果不进行手术干预,不易进入,难以治疗。这些临床应用上的不便也促进了广大研究人员对PDT的不断探索。当然,肿瘤切除是保障PDT治疗效果最大化的重要前提。综上所述,PDT为诊断和治疗神经胶质瘤提供了重要的临床选择方案。尤其是对于不能接受传统治疗或治疗效果不佳的患者,PDT可以高度选择性地治疗肿瘤,准确度高,恢复期快,显著改善病人生活质量。PDT随着分子生物学、光学和其它交叉学科的不断融合与深入发展,相信在未来的临床治疗中将扮演重要角色,为神经胶质瘤临床治疗策略提供新选择。
