意大利蜜蜂乙醇胺激酶1蛋白的序列特征和同源性分析
2024-01-26李桂林夏文丽张呈豪张新怡
李桂林, 夏文丽, 张呈豪, 张新怡, 赵 航
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
0 引 言
乙醇胺激酶(Ethanolamine kinase,ETNK)最早是由Weinhold和Rethy从鼠的肝脏中分离纯化得到的,分为ETNK1和ETNK2[1]. ETNK1是一种胞内乙醇胺特异性蛋白激酶,与胆碱激酶(Choline kinase,CEK)共同参与Kennedy通路[2,3]. ETNK1能够促进乙醇胺被ATP磷酸化,形成磷酸乙醇胺和ADP,这是生物体合成磷脂酰乙醇胺的第一步[4,5]. 目前关于ETNK功能的研究主要集中在真核生物中[6]. 研究表明,ETNK1的过表达是癌细胞中磷酸乙醇胺水平升高的主要原因. 磷酸乙醇胺水平增加后有利于癌细胞的生存[7]. ETNK2主要分布于肝脏和生殖组织中,它能够调节胎盘迷路层止血,防止血栓形成,以保障哺乳动物晚期胚胎发育[8]. 小鼠海马区ETNK1等基因的表达会导致其认知能力下降[9]. 在果蝇中,ETNK控制果蝇蘑菇体内神经母细胞分裂[10]. 在真菌中,里氏木霉的ETNK1影响其本身的径向生长和细胞壁的完整性[6]. 这些结果表明ETNK在生物体中具有重要功能.
意大利蜜蜂是我国饲养的主要西方蜜蜂品种,其个体大,吻长,利用零星蜜粉源的能力较差,对大宗蜜源的采集能力较强,易于管理[11]. 但是,近年来,热胁迫、农药毒害、虫害等严重威胁意大利蜜蜂的生存,不利于农业发展[12-14]. 挖掘能够响应胁迫的意大利蜜蜂基因和蛋白具有重要的意义.
前期使用阿维菌素处理意大利蜜蜂并进行转录组测序,通过分析转录组数据发现,ETNK1受阿维菌素胁迫的诱导表达[15].推测ETNK1可能在意大利蜜蜂响应阿维菌素胁迫时发挥重要作用. 然而,关于意大利蜜蜂ETNK1的序列特征尚不清楚. 本研究主要利用NCBI、DNAMAN、ProtParam等多个生物信息学平台及软件对意大利蜜蜂ETNK1进行序列分析,探究ETNK1的蛋白质基本信息及进化情况,为之后研究其功能以及保护蜂种资源等提供理论依据.
1 材料与方法
1.1 氨基酸序列
本实验室先前通过克隆得到意大利蜜蜂的ETNK1编码区核苷酸序列,进而获得其氨基酸序列. 本文使用的其它物种的蛋白质序列是从NCBI数据库中下载. 其物种名和登录号分别为黑大蜜蜂(Apislaboriosa,XP_043793613.1)、大蜜蜂(Apisdorsata,XP_006624851.1)、小家鼠(Musmusculus,NP_083526.2)、单峰驼(Camelusdromedarius,XP_010991298.1)、科莫多巨蜥(Varanuskomodoensis,KAF7234763.1)、跳镰猛蚁(Harpegnathossaltator,XP_011150452.1)、陷阱颚蚁(Odontomachusbrunneus,XP_032687288.1)、西部锦龟(Chrysemyspictabellii,XP_005296668.1)、火红熊蜂(Bombuspyrosoma,XP_043584450.1)、大分舌蜂(Colletesgigas,XP_043262954.1)、大腹园蛛(Araneusventricosus,GBM90567.1)、美洲东部熊蜂(Bombusimpatiens,XP_012243619.1)、欧洲熊蜂(Bombusterrestris,XP_003402908.1)、纸巢胡蜂(Polistesfuscatus,XP_043498263.1)、麦茎蜂(Cephuscinctus,XP_015594955.1)、黑褐毛山蚁(Lasiusniger,KMQ98398.1)、丽蝇蛹集金小蜂(Nasoniavitripennis,XP_016836805.2)、哥伦比亚芭切叶蚁(Attacolombica,KYM78136.1)、菜粉蝶盘绒茧蜂(Cotesiaglomerata,XP_044592485.1)、埃及血吸虫(Schistosomahaematobium,KAH9579151.1).
1.2 生物信息学分析工具
利用ProtParam、ProtScale等多种生物信息学软件(表1)分析意大利蜜蜂的ETNK1的基本理化性质、信号肽、跨膜区、核定位信号、亚细胞定位、蛋白质修饰位点和进化保守性.

表1 本文使用的生物信息学分析工具
2 结果与分析
2.1 理化性质分析结果
为获得ETNK1的基本理化性质参数,利用ProtParam工具对该蛋白进行了分析,结果如表2所示.

表2 意大利蜜蜂ETNK1的多种理化性质
ETNK1的分子式为C1928H2931N479O525S10,分子量为41.54 kD,包含348个氨基酸. 在所有的氨基酸残基中,种类最多的氨基酸为异亮氨酸和亮氨酸,带负电荷的氨基酸残基有43个,带正电荷的氨基酸残基有40个,理论等电点为6.38,蛋白质偏酸性. 不稳定系数小于40表示蛋白质拥有稳定的结构. ETNK1的不稳定系数为37.34,说明ETNK1是个稳定的蛋白质. 同时,ETNK1的总平均亲水性预测值为-0.257. 上述结果表明,ETNK1是一个带负电的稳定的亲水性蛋白. 为深入探究意大利蜜蜂ETNK1的亲疏水性,利用ProtsScale对其进行更详尽的分析,获得结果如下页图1所示. 在所有的氨基酸残基中,疏水性最强的是第310位的半胱氨酸残基,其得分为1.778;亲水性最强的是第84位的苏氨酸残基,其得分为-2.678. 此外,该蛋白质约62%的氨基酸残基的平均疏水指标得分为负数. 由于负数表示亲水性,该结果进一步证明意大利蜜蜂ETNK1具有亲水性.
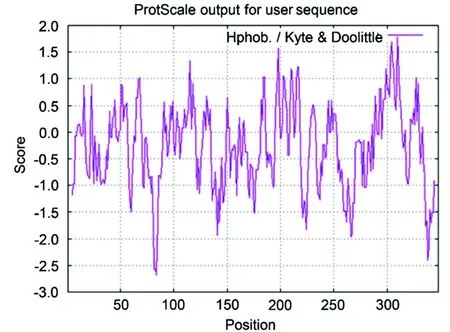
图1 意大利蜜蜂ETNK1亲疏水性分布图
注以Hphob. Kyte &Doolittle为默认标度,横坐标为氨基酸位置,纵坐标为氨基酸标度值. 每个氨基酸得分是滑动窗口内所有氨基酸的平均标度值. 氨基酸平均标度值大于0,表示疏水性,小于0则表示亲水性.
2.2 信号序列分析结果
为确定意大利蜜蜂的ETNK1是否具有信号肽,利用SignalP 5.0 Server分析其氨基酸序列,发现ETNK1具有信号肽的可能性为0.04%,无信号肽的可能性为99.96%. 由此可确定,意大利蜜蜂ETNK1不具有信号肽.
2.3 跨膜区分析结果
为确定意大利蜜蜂ETNK1是否具有跨膜螺旋,利用TMHMM Server 2.0对其蛋白质序列进行分析,预测出的跨膜螺旋数为0,由此可以推测意大利蜜蜂ETNK1不存在跨膜螺旋结构,不属于跨膜蛋白.
2.4 核定位和亚细胞定位分析结果
为了确定ETNK1是否具有核定位信号,利用NLStradamus 1.8对其蛋白质序列进行分析,发现ETNK1很可能不具有核定位信号序列,不定位于细胞核. 此外运用PSORT II Prediction软件对意大利蜜蜂ETNK1的亚细胞定位特性进行分析,发现ETNK1不存在于细胞核和线粒体等细胞器中,有44.4%的可能性定位于细胞质,55.6%的可能性定位于细胞骨架. 因此,ETNK1更有可能是一种定位在细胞骨架中的蛋白质.
2.5 蛋白质修饰位点分析结果
利用NetPhos 3.1 Server分析意大利蜜蜂ETNK1多肽链合成后的磷酸化修饰情况,发现具有19个可能的磷酸化修饰位点,在这些修饰位点中,苏氨酸、丝氨酸、酪氨酸位点分别为5、6、8个. 此外,为了解意大利蜜蜂ETNK1的糖基化修饰情况,使用NetOGlyc 4.0 Server分析ETNK1的糖基化修饰位点,得知ETNK1潜在的糖基化位点预测分数均小于0.5,因此ETNK1可能不存在糖基化位点.
2.6 蛋白质同源性分析结果(图2)

图2 8种生物ETNK1的多序列比对结果
为了了解意大利蜜蜂ETNK1的进化保守性,从NCBI中下载了意大利蜜蜂ETNK1的氨基酸序列并与其他7个物种的氨基酸序列进行比对,总体相似度为66.14%. 其中,不同蜜蜂中的ETNK1的相似度较高,可以达到96.74%. 截取了以上8个物种ETNK1磷酸转移酶序列所在的区域(图2中用红色方框标注),并进行了氨基酸多重序列比对,发现它们的相似度高达87.50%. 因此认为该磷酸转移酶序列在不同物种的ETNK1中可能高度保守,发挥重要的生物学功能.
图2中单字母氨基酸背景颜色为深蓝色表示相似度为100%,粉色表示相似度为75%以上,蓝色表示相似度为50%以上,无颜色表示相似度在50%以下. 红色方框里是不同物种ETNK1中磷酸转移酶序列可能存在的位置.
为了明确不同生物的ETNK1亲缘关系,运用Mega4软件构建出了20种生物的系统进化树(图3). 通过图3可知,意大利蜜蜂ETNK1与黑大蜜蜂、大蜜蜂ETNK1的亲缘关系最近,与氨基酸多序列比对的结果一致.

图3 最大简约法构建的ETNK1系统进化树
红色三角形表示意大利蜜蜂ETNK1在系统进化树中的位置.
3 讨 论
通过分析转录组数据发现意大利蜜蜂ETNK1受阿维菌素胁迫的诱导表达,表明ETNK1可能在蜜蜂抵御阿维菌素胁迫时起重要作用[15]. 然而,关于意大利蜜蜂ETNK1蛋白的序列特征仍然需要进一步分析. 本研究结果表明意大利蜜蜂ETNK1是稳定的亲水性蛋白质(表2和图1). 信号肽是位于新生肽链N-末端的一小段氨基酸序列,它指导蛋白质进入内质网腔中,经内膜系统包装和运输,最终被分泌到细胞外[16]. ETNK1不具有信号肽,可能属于胞内蛋白. 同时,经跨膜区分析可知,ETNK1不含有跨膜螺旋,可能不是跨膜蛋白.
核定位信号是蛋白质上一条短的氨基酸序列,它能够识别并定位于细胞核,介导蛋白质入核,并且核定位信号肽可以用作构建纳米载药体系的通用工具[17,18]. 生物信息学软件得出的结果显示,ETNK1很可能不具有核定位信号序列,因此,ETNK1不定位于细胞核. 细胞骨架是丝状聚合物和调控蛋白组成的相互连接的网络,属于细胞质的一部分,有助于为细胞提供形状和结构[19]. 意大利蜜蜂ETNK1的亚细胞定位有44.4%的可能定位于细胞质,有55.6%的可能定位于细胞骨架. 由此得出,意大利蜜蜂ETNK1可能定位于细胞骨架.
磷酸化与糖基化可能是维持蛋白质构象的重要原因. 蛋白质的磷酸化是指在蛋白激酶催化反应过程中,ATP上的γ位磷酸基团脱下,转移到底物蛋白质上并形成共价键,被磷酸化的主要氨基酸残基是苏氨酸,丝氨酸和酪氨酸[20]. 该过程是调节许多细胞活动和功能的重要机制. ETNK1具有19个可能的磷酸化修饰位点,在这些修饰位点中,苏氨酸、丝氨酸、酪氨酸位点分别为5、6、8个.
