阴离子交换树脂固定化核酸酶P1的研究
2024-01-25王天赐侯亚利杨忠华
王天赐,徐 康,侯亚利,杨忠华
(武汉科技大学 化学与化工学院,湖北 武汉 430081)
5′-核苷酸及其衍生物具有很高的营养保健价值、药用价值和鲜味,被广泛用于食品添加剂[1]、婴幼儿奶粉[2]、药品[3]和饲料[4]中。目前,工业上主要利用核酸酶P1生产5′-核苷酸。然而,游离酶在实际应用时存在易失活、酶与产物难以分离、对极端环境的耐受能力差、成本昂贵、难以重复利用等问题。通过研究,科研工作者们发现将核酸酶P1进行固定化不但可以使核酸酶P1重复利用,在一定程度上还可以增强目标酶的稳定性[5]。
载体的选择是固定化酶技术的核心,它直接关系到固定化酶的酶学性质、固定化效果和酶学性质。树脂作为一种价格低廉、载酶量大、稳定性好且对人体无毒无害的载体,受到研究者们的青睐,因而被广泛使用。目前,以树脂作为固定化载体时,最常用的固定化方法为吸附法和交联法。吸附法虽然具有操作简单、条件温和及酶活回收率高等优点,但是固定化酶的稳定性较差,导致固定化酶很难满足工业生产的需要。对于交联法,虽然酶活回收率会有一定程度的降低,但固定化酶的稳定性会大幅度提高,从而可以满足工业生产的需求。因此,工业上更多采用交联法固定酶。Zhong等[6]发现,利用戊二醛对氨基树脂LX-1000HA进行交联固定化的脂肪酶,其稳定性大幅度提高,在重复利用15次后,酶活仍保留87.3%。
基于此,本研究利用不同类型树脂对核酸酶P1进行固定化,以固定化核酸酶P1的酶活为评价标准,对固定化载体进行筛选并对固定化工艺条件进行优化,然后检测在最佳条件下制备的固定化酶的储存稳定性,以期为核酸酶P1固定化酶的工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
核酸酶P1,安琪酵母股份有限公司赠予;环氧树脂(ER)、氨基树脂1(AR1)、氨基树脂2(AR2)、带氨基和环氧基的树脂(EAR)、阳离子交换树脂1(CR1)、阴离子交换树脂1(AER1)、大孔吸附树脂1(MPAR1)、大孔吸附树脂2(MPAR2),西安蓝晓科技新材料股份有限公司;阴离子交换树脂2(AER2),郑州勤实科技有限公司;阳离子交换树脂2(CR2),上海安澜德生物科技有限公司;含氰基的树脂(CGR)、阳离子交换树脂3(CR3),天津允开树脂科技有限公司;醋酸、醋酸钠、钼酸铵、高氯酸为分析纯,戊二醛(体积分数为25%)为生化试剂,国药集团化学试剂有限公司。表1为各种树脂的理化参数。
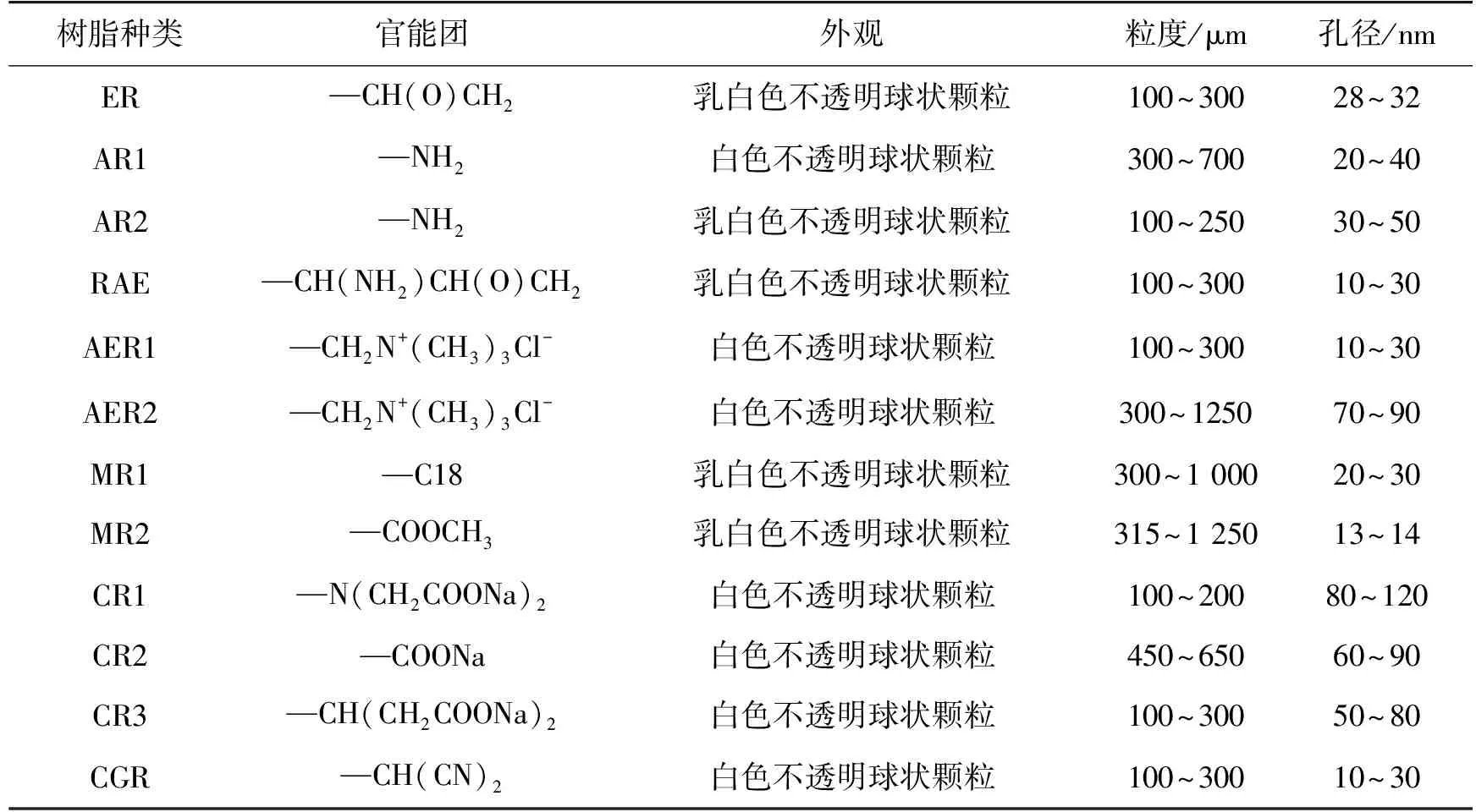
表1 各种树脂的理化参数
1.2 实验方法
1.2.1 酶活和蛋白检测方法
蛋白质含量的测定采用Bradford染色法[7]。
核酸酶P1酶活的检测采用紫外-可见分光光度法[8]。测定原理是,通过检测核酸酶P1酶解RNA的产物在260 nm处的吸光值,来间接测得酶活。具体测定方法如下:以pH 5.4的30 g/L RNA为底物,在70 ℃下与酶反应,利用核酸沉淀剂(2.5 g/L钼酸铵-25 g/L高氯酸溶液)终止反应后,于260 nm处测定析光值。酶活力定义:在所述测定条件下,1 min催化生成的核苷酸使260 nm处的吸光度A260差值为 1.0 时的酶量为一个单位(U)。
相对酶活和酶活回收率的计算分别见式(1)和(2)。
相对酶活=固定化酶酶活/固定化酶最高酶活×100%
(1)
酶活回收率=固定化酶总酶活/样品总酶活×100%
(2)
1.2.2 核酸酶P1的初步纯化
采用热激、硫酸铵分级沉淀及透析的方法,对源于桔青霉发酵液中的核酸酶P1进行初步纯化[8],从而去除杂蛋白,提高核酸酶P1的浓度。纯化后酶液的蛋白质量浓度为529.0 μg/mL,酶活为13 253.3 U/mL。将该酶液储存在4 ℃的冰箱中,作为后续实验使用的酶液。
1.2.3 核酸酶P1的固定化
1)吸附法。取1.0 g树脂于100 mL烧杯中,加入pH 5.4的核酸酶P1的酶液40 mL(含10 mL的核酸酶P1粗酶液),在25 ℃、60 r/min下吸附一定时间。倒去上清并用去离子水洗去未结合的酶,用滤纸吸干树脂表面附着的去离子水,储存于4 ℃的冰箱中备用。
2)交联法。取1.0 g树脂于50 mL离心管中,加入10 mL一定浓度的戊二醛,交联一定时间后,用去离子水洗去未交联的戊二醛。后续操作同吸附法。
1.2.4 固定化条件
载体材料的性质和固定化过程是影响固定化核酸酶P1催化性能的关键因素。首先,利用不同类型树脂材料为载体固定化核酸酶P1,以吸附量和核酸酶P1的酶活为评价指标筛选最佳固定化载体。其次,采用交联法优化固定化条件,即分别加入0.25 mL~5.0 mL的酶量、质量分数0.25%~3.0%的戊二醛、交联时间0.5~3 h、固定化时间2 ~12 h、酶液的pH 4.2~5.8,制备固定化酶,分析探讨固定化条件对核酸酶P1酶活的影响。最后,检测在优化条件下制备的固定化酶的酶活。
1.2.5 响应面分析
1)Plackett-Burman实验。根据单因素实验的结果,利用Minitab软件设计Plackett-Burman实验,筛选出对固定化效果影响最大的3个因素,利实验因素和水平设计见表2。
2)Box-Behnken实验。对于Plackett-Burman实验筛选出对固定化效果影响最大的3个因素,设计Box-Behnken实验,确定最佳的固定化条件,实验因素和水平设计见表3。通过Minitab软件进行响应面模型的建立和数据处理,并进行实验验证。
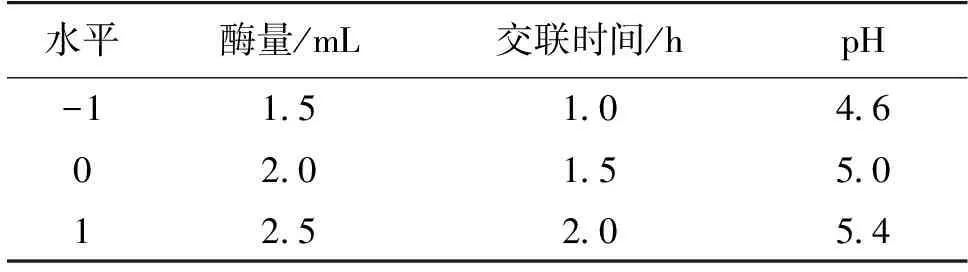
表3 Box-Behnken实验的因素和水平设计
1.2.6 固定化酶的稳定性
1)热稳定性。向10 mL的离心管中分别加入等量的游离酶和固定化酶,再加入等体积10 mmol/L pH 6.0的醋酸-醋酸钠缓冲液,分别置于40、50、60、70、80和90 ℃的水浴锅中,水浴30 min,然后测固定化酶和游离酶的相对酶活。
2)酸碱稳定性。向10 mL的离心管中分别加入等量的游离酶和固定化酶,再加入等体积10 mmol/L pH分别为4.0、5.0、6.0、7.0、8.0和9.0的醋酸-醋酸钠缓冲液,置于4 ℃的冰箱中,保温1 h,然后测固定化酶和游离酶的相对酶活。
3)储存稳定性。向50 mL的离心管中分别加入等量的游离酶和固定化酶,置于4 ℃的冰箱中。第3天和第7天时测一次游离酶和固定化酶的酶活,随后每隔7 d测一次酶活。
4)操作稳定性。将固定化酶按照1.2.1节的方法,连续操作8次,测相对酶活。将第一次的酶活定义为100%。
2 结果与分析
2.1 树脂的筛选
ER、AR1、AR2、EAR、MR1和MR2等大孔树脂主要是通过氢键和范德华力对酶分子进行吸附,而AER1、AER2、CR1、CR2、CGR等离子交换树脂通过离子键和范德华力对酶分子进行吸附[9]。所有树脂对核酸酶P1的吸附结果如表4所示。

表4 各种树脂吸附数据统计各种树脂吸附数据统计
注:ER为环氧树脂,AR1、AR2为氨基树脂,EAR为同时有氨基和环氧基的树脂,AER1、AER2为阴离子交换树脂,MPAR1、MPAR2为大孔吸附树脂,CR1、CR2、CR3为阳离子交换树脂,CGR为带氰基的树脂。
由表4可知: ER、MR1、MR2、CR1、CR2、CR3和CGR树脂固定化后的酶活较低,这可能是由于树脂表面的官能团羧基、氰基、酯基和碳18等与核酸酶P1结合后,严重影响了核酸酶P1活性中心,导致酶活降低。在ER、EAR、AR1、AR2、AER1和AER2这6种树脂中,以AER1树脂为载体时,酶活最高,主要原因可能是,与AR2树脂相比,AR1树脂的亲水性较弱,不利于核酸酶P1和底物的结合;与AR2树脂和RAE树脂不同,AER1树脂主要通过离子键吸附核酸酶P1,而核酸酶P1含有3个Zn2+,导致更易于形成离子键;与AER2树脂相比,由于树脂的孔径等因素的影响,AER1树脂对核酸酶P1的吸附量更大。以AER1树脂为载体,仅在对树脂进行筛选时,固定化酶的比酶活就能达到35 131.7 U/g,远高于其他研究成果。如,刘红等[5]以纤维素为载体,其比酶活达到6 000.0 U/g。何林姣等[10]以氨基树脂固定化核酸酶P1,其比酶活也仅能达到10 013.0 U/g。因此,选择离子交换树脂AER1作为固定化酶的载体进行下一步的研究。
2.2 固定化条件的优化
2.2.1 酶量
酶量直接关系到载体所能结合的酶分子的数量,是影响固定化酶酶活的主要因素。考察酶量对固定化酶的酶活的影响,结果如图1所示。由图1可知:随着酶量的增加,固定化酶的酶活先增加后基本不变,最佳的酶量为2.0 mL。当酶量从0.25 mL增至2.0 mL时,固定化酶的酶活不断增加;当酶量从2.0 mL增至5.0 mL时,固定化酶的酶活基本不变。这可能是因为过多的酶负载在载体上会导致载体表面上酶分子聚集和酶分子的催化位点被覆盖,使酶活不再增加[11]。综上所述,最佳的酶量为2.0 mL。
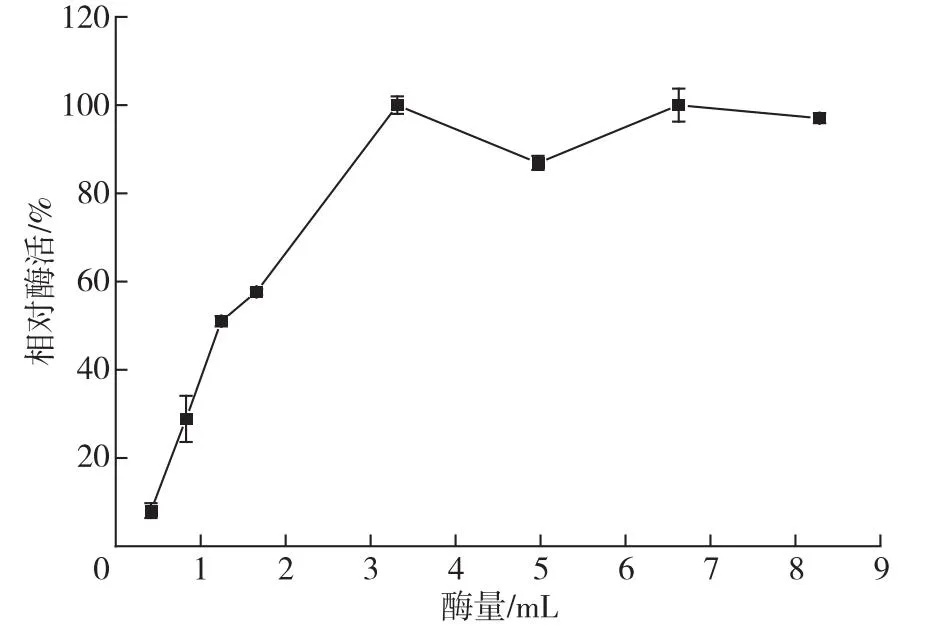
图1 酶量对核酸酶P1固定化效果的影响Fig.1 Effect of enzyme amount on immobilization of nuclease P1
2.2.2 戊二醛用量
戊二醛作为最常用的交联剂,可以通过多点或多亚基固定来提高酶的稳定性[12]。考察戊二醛用量对核酸酶P1固定化效果的影响,结果如图2所示。由图2可知:随着戊二醛质量分数的升高,固定化酶酶活先增大后减小,在戊二醛质量分数为0.25%时达到最大值。这可能是由于戊二醛可以提高酶和载体结合的稳定性,防止酶分子从载体上脱落;但是戊二醛也会和酶的活性中心交联,导致酶活降低;而且在戊二醛的浓度较高时,戊二醛分子可能会出现羟醛缩合,附着在载体表面,从而阻碍酶分子和载体结合,导致酶活降低[13]。综上所述,最佳的戊二醛质量分数为0.25%。

图2 戊二醛用量对核酸酶P1固定化效果的影响Fig.2 Effect of glutaraldehyde mass ratio on immobilization of nuclease P1
2.2.3 交联时间
交联时间影响结合到载体上的戊二醛数量和戊二醛的稳定性,从而对核酸酶P1的固定化效果产生影响,因此考察交联时间对固定化酶酶活的影响,结果见图3。由图3可知:随着交联时间的延长,固定化酶的酶活先增大后减小。这可能是因为当交联时间较短时,随着交联时间的延长,载体和酶结合的稳定性增强,导致酶分子不易从载体上脱落,使酶活不断增大;当交联时间较长时,戊二醛分子会被氧化,导致无法和酶分子结合,使酶活降低。邵卫祥等[14]制备的磁性交联酶聚集体,最佳的交联时间为2.0 h,载体的不同导致最佳交联时间也不同,但是在不同时长的条件下交联时,固定化效果的变化和本研究一致。因此,最佳的交联时间为1.5 h。

图3 交联时间对核酸酶P1固定化效果的影响Fig.3 Effect of cross-linking time on immobilization of nuclease P1
2.2.4 固定化时间
固定化时间是核酸酶P1和载体的接触时间,它影响着固定在载体上的酶分子数量,对核酸酶P1的固定化效果有着巨大的影响,因此考察固定化时间对固定化酶酶活的影响,结果见图4。由图4可知:随着固定化时间延长,固定化酶的酶活先增加后降低,在固定化时间为10 h时达到最大值。这可能是因为当固定化时间较短时,随着固定化时间的延长,载体吸附的酶分子数量不断增加;当固定化时间较长时,载体表面吸附的酶分子过多,产生了一定的空间位阻,阻碍底物和产物的进出,并且部分酶失活。这与文献[15]的结果较为一致。

图4 固定化时间对核酸酶P1固定化效果的影响Fig.4 Effect of immobilization time on immobilization of nuclease P1
2.2.5 pH
pH会影响酶和载体的电离状态,进而影响酶和载体的结合与空间结构,使固定化效果受到影响[16]。因此考察pH对固定化酶酶活的影响,结果见图5。由图5可知:随pH的增大,固定化酶的酶活呈现先增加后下降的趋势,最佳的pH为5.0。这可能是由于AER1树脂作为离子交换树脂,与核酸酶P1的结合主要依赖离子键的作用。当pH发生变化时,酶分子和AER1树脂的电离情况随之发生变化,离子键也受到影响。当pH较低时,随着pH的增大,载体表面的电荷分布逐渐有利于酶分子和载体的结合;当pH较高时,随着pH的增加,载体表面的电荷分布逐渐不利于酶分子和载体的结合,使酶活降低[17]。固定化时最佳的pH为5.0,比核酸酶P1游离酶的最适pH为5.5[18]的低。这与Zou等[19]在制备固定化卤醇脱卤酶时的现象一致。
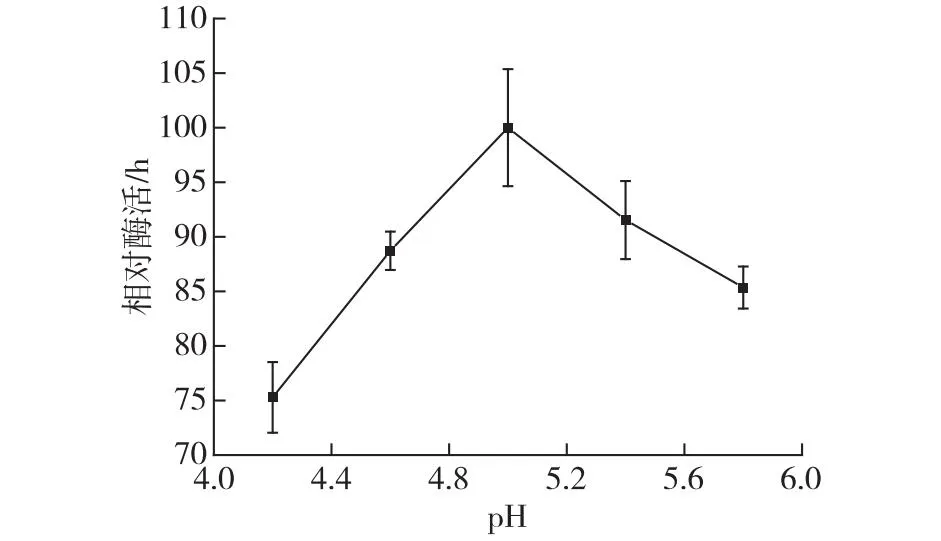
图5 pH对核酸酶P1固定化效果的影响Fig.5 Effect of pH on immobilization of nuclease P1
2.2.6 响应面分析
1)Plackett-Burman实验结果与分析。利用Minitab 17软件进行实验设计与分析,Plackett-Burman设计与结果见表5,方差分析结果见表6。以固定化酶的酶活(表观酶活)为响应值,对数据进行分析。

表5 Plackett-Burman实验设计及结果
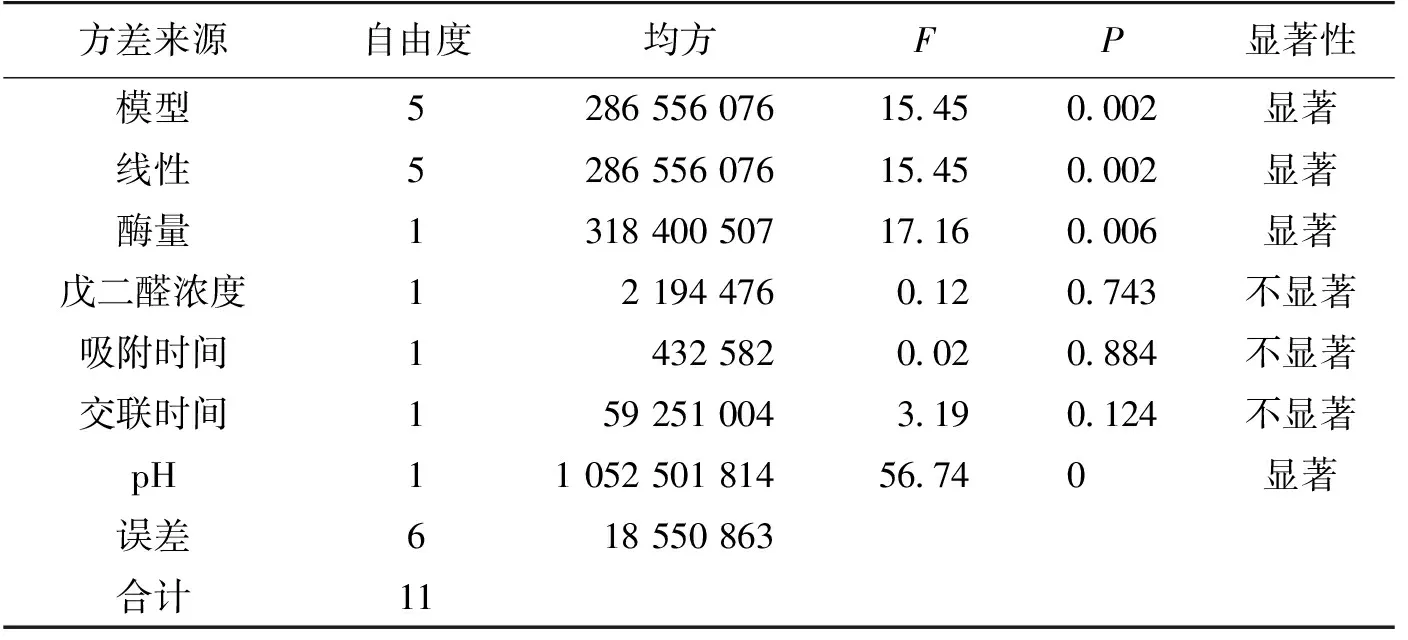
表6 Plackett-Burman实验方差分析结果
由表6可知:酶量和pH对固定化酶酶活的影响显著,戊二醛质量分数、交联时间和固定化时间对固定化酶酶活的影响不显著。其中,交联时间的P=0.124,接近0.05,所以可以将其视作对固定化酶酶活有较大影响的因素。因此,进一步研究酶量、pH和交联时间对固定化酶表观酶活的影响(Box-Behnken实验)。
2)Box-Behnken实验结果与分析。利用Minitab 17软件进行实验设计与分析,研究酶量(A)、pH(B)和交联时间(C)对固定化酶酶活的影响,Box-Behnken实验设计与结果见表7,方差分析结果见表8。以固定化酶酶活为响应值,对数据进行回归拟合,得到固定化酶酶活与各因素的回归方程为固定化酶酶活=-645 879+67 024A+230 998B+47 395C-14 668A2-22 218B2-13 062C2-1 233AB+ 1 875AC-2 298BC。

表7 Box-Behnken实验设计与结果
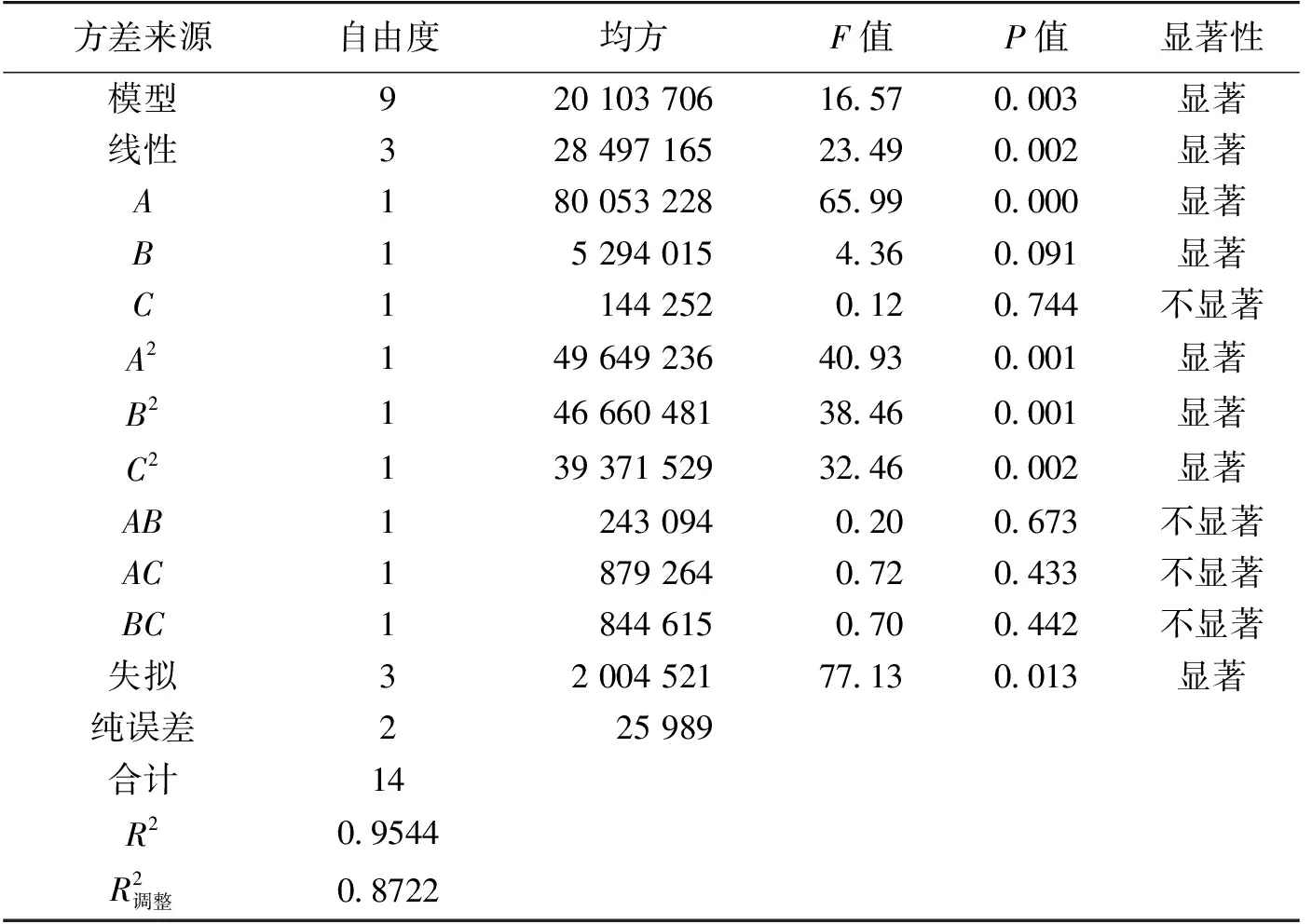
表8 Box-Behnken实验方差分析结果
由表8可知:模型的P=0.002<0.05,说明该模型有显著意义。R2=0.954 4,表明该模型的拟合度很好,可以比较好地反映各因素对固定化酶酶活的影响。所有项中,AB、AC和BC是不显著,表明酶量、pH和交联时间的交互作用对固定化酶酶活的影响较小。
3)实验验证。根据响应面分析(图6)的结果,确定最佳的固定化条件为酶量2.17 mL、pH 5.06、交联时间1.53 h。在该条件下,模型预测的固定化酶的比酶活为47 177.09 U/g。考虑实际的可操作性,调整固定化条件为酶量2.2 mL、pH 5.1、交联时间1.5 h。在此条件下制备固定化酶,其比酶活为47 980.95 U/g,与预测值比较接近。这表明该模型可以很好地反映固定化酶的酶活与各种固定化条件之间的关系,固定化条件的优化比较合理。

图6 各因素交互作用影响固定化酶酶活的响应面图Fig.6 Response surface map of the interaction of various factors affecting the enzymatic activity of immobilized enzymes
2.3 固定化酶的稳定性
2.3.1 热稳定性
酶对温度的变化非常敏感。因此考察固定化酶的热稳定性,结果见图7。由图7可知:随着温度的升高,固定化酶和游离酶的酶活回收率不断降低,并且两者降低的幅度基本一致,但在大部分温度条件下,固定化酶的热稳定性都略高于游离酶。这表明固定化后核酸酶P1的热稳定性有一定程度的提高。

图7 固定化酶和游离酶的热稳定性Fig.7 Thermostability of immobilized and free enzymes
2.3.2 酸碱稳定性
考察pH对固定化酶酶活的影响,结果见图8。由图8可知:游离酶的稳定性受pH变化的影响较大,在pH 6.0时,稳定性最好,在4 ℃下储存1 h后保留75.4%的酶活;而固定化酶的稳定性受pH变化的影响较小,并且在所有pH条件下的稳定性均高于游离酶。这可能是由于固定化后改变了酶分子所处的微环境,使外界环境的pH变化对酶分子的影响减小。综上所述,固定化后核酸酶P1的酸碱稳定性大幅度提高。

图8 固定化酶和游离酶的酸碱稳定性Fig.8 Acid-base stability of immobilized and free enzymes
2.3.3 储存稳定性
固定化酶在实际使用时,储存和运输是无法避免的。如果酶的储存稳定性不好,即使酶的其他性质再好,也失去了意义。因此储存稳定性是衡量固定化效果的一个重要指标[20]。考察固定化酶的储存稳定性,结果见图9。由图9可知,与游离酶相比,固定化酶在4 ℃下的储存稳定性有一定程度的提高。固定化酶在4 ℃下储存6周后,仍能保留51.8%的酶活,是游离酶的1.6倍。这可能是由于固定化后,酶分子所处的微环境发生了改变,核酸酶P1的活性中心受到了一定的保护,从而提高了酶的储存稳定性。这有利于核酸酶P1的工业化应用,为工业化连续生产核苷酸奠定了基础。

图9 固定化酶和游离酶在4 ℃储存的稳定性Fig.9 Stability of immobilized and free enzymes stored at 4 ℃
2.3.4 操作稳定性
固定化酶在实际应用中,往往会多次重复利用。因此,操作稳定性也成为了衡量固定化酶稳定性的一个重要指标。图10为固定化酶的操作稳定性。由图10可知:随着使用次数的增加,固定化酶的酶活回收率不断降低;在连续使用8次后,固定化酶的酶活只保留7.5%。这可能是由于载体为离子交换树脂,戊二醛对稳定性的提升不足,在多次重复利用后,载体上的酶大量脱落,导致酶活不断降低。
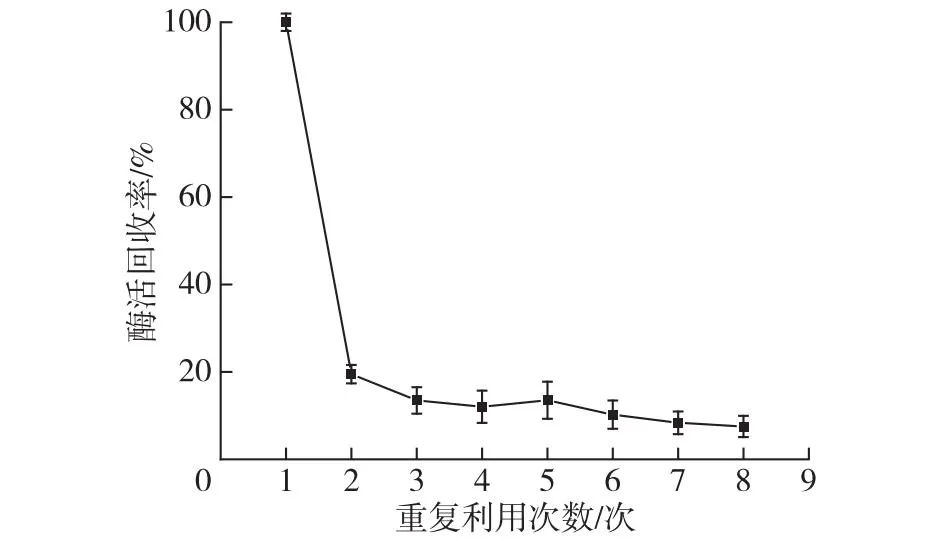
图10 固定化酶的操作稳定性Fig.10 Operational stability of immobilized
3 结论
以戊二醛交联的树脂为载体,固定化核酸酶P1。对载体进行筛选后,确定的最佳载体为AER1树脂。优化的固定化条件为酶量2.2 mL、戊二醛质量分数0.25%、交联时间1.5 h、固定化时间10.0 h、pH 5.1。在该条件下制备的核酸酶P1的酶活为48 168.9 U/g。固定化酶在60 ℃下水浴30 min,酶活保留了49.6%,是游离酶的1.15倍;与游离酶相比,固定化酶在所有pH条件下的稳定性都有一定程度的提高,在4 ℃、pH 8.0下储存1 h后保留95.8%的酶活;固定化酶在4 ℃下储存6周后,仍能保留51.8%的酶活,是游离酶的1.6倍;固定化酶在连续使用8次后,固定化酶的酶活保留7.5%。本文的研究结果可为固定化核酸酶P1的工业化应用奠定基础。
