贻贝足蛋白fp-5在大肠杆菌中的表达、修饰与功能分析
2024-01-25谢紫莎张鲁嘉
姚 林,谢紫莎,王 瑞,2,张鲁嘉,李 莎,2
(1. 南京工业大学 食品与轻工学院,江苏 南京 211800;2. 南京工业大学 材料化学工程国家重点实验室,江苏 南京211800;3. 华东师范大学 化学与分子工程学院,上海 201100)
贻贝(mussel)多生长在寒温带,属广盐性贝类,遍布世界各沿海国家,其分泌的足丝能够形成足丝盘固定在海洋礁石上[1-2]。贻贝足丝的主要成分为贻贝足蛋白(Mfp),该蛋白具有卓越的黏附能力、良好的生物相容性和生物降解性,因此在生物医药领域作为一种生物胶黏剂被广泛研究[3-4]。其中,3,4-二羟基苯丙氨酸(Dopa)在黏附中起到至关重要的作用,使Mfp能够通过氢键、π-π/π-阳离子相互作用、静电相互作用、氧化交联和金属-邻苯二酚配位键与底物相互作用[5]。目前已经报道的Mfp有6种(Mfp-1~Mfp-6),其中Mfp-5位于贻贝足底部与外界基层接触部分,Dopa含量高达25%~30%,是发挥黏附作用的关键蛋白[6]。
在天然条件下,通过酸萃取法直接从贻贝足部获得的蛋白量极少[7-8]。利用基因工程手段在大肠杆菌(E.coli)中合成贻贝足蛋白是一种可行的技术,有望带来巨大的经济和社会效益。然而,大肠杆菌细胞无法实现将酪氨酸残基羟基化为Dopa的翻译后修饰过程,而体外通过酪氨酸酶修饰存在效率低的缺陷。Choi等[9]将贻贝融合蛋白fp-151与来自抗生链霉菌(Streptomycesantibiocus)的酪氨酸酶(TyrSa)共表达,得到cofp-151,与体外修饰蛋白相比,黏合强度提高了4倍。该研究为改善重组贻贝足蛋白的功能提供了新的思路,而高效的酪氨酸酶是实现这一过程的关键因素之一。同时,Streptomycescastaneoglobisporu具有更强的黑色素合成能力[10-11],来源于S.castaneoglobisporus的酪氨酸酶(TyrSc)活性更强。此外,来自多刺疣微菌(Verrucomicrobiumspinosum)的酪氨酸酶(TyrVs)可高效生产L-Dopa,有助于提升Mfp黏合性能[12]。
为了进一步改善Mfp在真核表达系统中产量低、在原核系统中缺乏至关重要的翻译后修饰过程的问题,本研究在E.coli中表达地中海贻贝足蛋白(fp-5),同时将不同来源的酪氨酸酶(TyrSa、TyrSc、和TyrVs)与fp-5共表达进行体内修饰,并对修饰前后的fp-5蛋白测定修饰率和性能,以期为贻贝足蛋白的功能性表达与潜在应用奠定基础。
1 材料与方法
1.1 材料
使用的菌株、质粒和引物列于表1。大肠杆菌E.coliDH5α和大肠杆菌E.coliBL21(DE3)分别作为克隆宿主和表达宿主。密码子优化后的基因合成委托生工生物工程(上海)股份有限公司,引物合成及测序验证委托通用生物系统(安徽)有限公司。胰蛋白胨和酵母提取物,Oxoid公司;限制性核酸内切酶和Primerstar Max聚合酶,ThermoFisher公司;4×SDS-PAGE上样缓冲液和标准蛋白分子量Marker,宝日医生物技术(北京)有限公司;来源于蘑菇的酪氨酸酶,上海阿拉丁生化科技股份有限公司。其他化学试剂均为市售分析纯。

表1 本研究使用的菌株、质粒和引物
1.2 方法
1.2.1 重组表达载体的构建
从NCBI数据库中搜索得到贻贝足蛋白fp-5的cDNA基因mgfp-5序列(GenBank AY521220.1),并基于大肠杆菌的密码子使用偏好进行了密码子优化。根据模板基因序列和pET28a(+)载体设计引物P1和P2,扩增成熟肽编码区域。用1%琼脂糖凝胶电泳验证PCR扩增产物,并回收mgfp-5基因,BamHⅠ和XhoⅠ限制性内切酶对pET28a(+)质粒和PCR产物双酶切并胶回收,再将线性质粒和PCR产物在37 ℃下连接30 min,所得质粒命名为pET28a(+)-fp5,在N端带有6×His标签。
类似地,将编码不同来源酪氨酸酶的DNA序列合成并分别插入pACYCDuet-1的BamHⅠ/HindⅢ 酶切位点和NdeⅠ/XhoⅠ 酶切位点(TyrSa/ORF438:GenBank M11582.1;TyrSc/ORF378:GenBank AY254101.1/GenBank AY254102.1);pETDuet-1的NdeⅠ/XhoⅠ 酶切位点(TyrVs:GenBank MK550618.1)。得到的质粒分别命名为pACYC-TyrSa-438、pACYC-TyrSc-378和pETDuet-TyrVs。用引物对P3/P4从pET28a-fp5扩增mgfp-5基因,连接到EcoR Ⅰ/HindⅢ 酶切的pETDuet-TyrVs线性载体上,得到质粒pETDuet-TyrVs-fp5。
1.2.2 重组质粒的转化
用化学转化法将重组质粒pET28a-fp5转入E.coliBL21(DE3)感受态细胞中,产物在抗性平板(含25 μg/mL卡那霉素)上均匀涂布,37 ℃过夜培养后挑取单克隆进行双酶切验证,验证正确的阳性克隆送至测序。
用CaCl2法制备工程菌E.coli(pET28a-fp5)感受态,然后将pACYC-TyrSa-438、pACYC-TyrSc-378转化至该感受态细胞,得到双载体表达系统。将pETDuet-TyrVs-fp5转化至E.coliBL21(DE3)感受态细胞,实现酪氨酸酶和fp-5共表达。同上述方法涂布在相应抗性的平板并进行验证。
1.2.3 重组贻贝足蛋白的表达纯化
挑取测序正确的单克隆接种于5 mL含有25 μg/mL卡那霉素的LB培养基(NaCl 10 g/L、蛋白胨10 g/L、酵母粉5 g/L)中,37 ℃、200 r/min过夜培养。将菌液按1%的接种量转接至100 mL相应抗性的LB液体培养基中,振荡培养OD600达到0.6~0.8,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度1 mmol/L,相同条件下继续培养6 h。发酵结束后在5 000 r/min、4 ℃下离心20 min收集菌体,并储存在-80 ℃以供后续使用。
将收集的菌体用磷酸缓冲盐液(PBS)洗涤,参照文献[13]纯化目的蛋白。用Bradford法检测蛋白质含量后冷冻干燥,-80 ℃保存。
1.2.4 重组贻贝足蛋白的修饰
1)NBT/Gly染色试验。由于硝基蓝四氮唑(NBT)在碱性条件下发生氧化还原反应具有染色能力,因此常用NBT/Gly染色法检测多巴和多巴醌的存在。将冻干蛋白粉重溶在0.1 mol/L PBS(pH 7.0)中,使用10 U来源于双孢蘑菇的商品化酪氨酸酶室温下振荡修饰6 h,得到体外酪氨酸酶修饰的fp-5(mfp-5)。牛血清白蛋白(BSA)为阴性对照,分别将2 μL质量浓度为1 mg/mL的蛋白溶液滴在PVDF膜表面,37 ℃下过度干燥后,参照文献 [13]进行染色试验。
2)差异光谱法。为了定量酪氨酸酶修饰的fp-5中的Dopa含量,酸-硼酸盐差异光谱法测定。在碱性pH下Dopa与硼酸盐配位化合,因此紫外吸收光值更高。用紫外-可见分光光度计测量1 mmol/L Dopa标准品和修饰后fp-5分别在0.1 mol/L HCl和0.1 mol/L硼酸钠中250~350 nm波长处的吸光值。用样品在0.1 mol/L硼酸钠中292 nm处的吸光值减去0.1 mol/L HCl中的吸光值,得到差异光谱值。根据比尔定律(式(1))计算样品中Dopa的浓度。
A=εbc
(1)
式中:A—Dopa在292 nm下的吸光差值;ε—摩尔吸光系数,3 200 L/(mol·cm);b—吸收层厚度,cm;c—Dopa的浓度,mol/L。
再以蛋白浓度计算得到Dopa的数量,每个fp-5分子含有20个酪氨酸残基,由此得到修饰率[14]。
1.2.5 重组贻贝足蛋白的功能分析
1)附着力。研究了未修饰和修饰fp-5在不同类型材料表面的涂层能力。具体涂层显色过程参照文献[15],增设了聚苯乙烯和聚乙烯两种较玻璃具有不同亲疏水性的材料。通过Gel-Pro Analyzer软件(Media Cybernatics,version 4.0.0.4)对蛋白斑点图像进行扫描分析,比较斑点强度。每个样品重复测量3次。
2)黏附力。通过Mfp黏结两块铝片(宽10 mm×长 100 mm)的搭接剪切实验,可以测量Mfp的大规模黏附强度。将铝片依次浸泡在正己烷、丙酮、乙醇和MQ水中15 min,清洁铝片表面[16]。在室温下干燥过夜后,在每个铝片黏附端滴加10 μL的50 g/L乙酸溶液,将5 mg冻干蛋白粉溶解并用抹刀均匀涂抹,2个铝片覆盖重叠(10 mm × 10 mm)。为保证重叠区贴合均匀,用夹子固定,放入37 ℃培养箱3 h进一步交联。用万能材料试验机测量剪切力,用100 N称重传感器,剪切方向的速度为 2 mm/min。
2 结果与讨论
2.1 序列分析及重组质粒的构建
用Signalp-5.0在线软件[17]进行信号肽预测,通过Neighbor-Joining方法,对细菌和真菌来源的酪氨酸酶进行系统发育树分析,并对重组载体进行验证,结果见图1。由图1可知:fp-5的成熟肽区域由76个氨基酸构成。经NCBI同源性比对,贻贝5型足蛋白具有高度保守序列,来源于紫贻贝(Mytilusedulis)和地中海贻贝(Mytilusgalloprovincialis)的5型足蛋白的氨基酸序列几乎一致。来源于Verrucomicrobium属、Strepthomyces属和Agaricus属的酪氨酸酶处于不同进化枝,其中TyrSa和TyrSc处于相对近距离进化枝。为了实现重组TyrSa/TyrSc的功能表达,插入ORF438/ORF378片段,它们可以促进Cu2+进入活性位点以具有酶活[18]。如果表达TyrVs去除C端延伸区的截断部分,酶活会更高[19]。
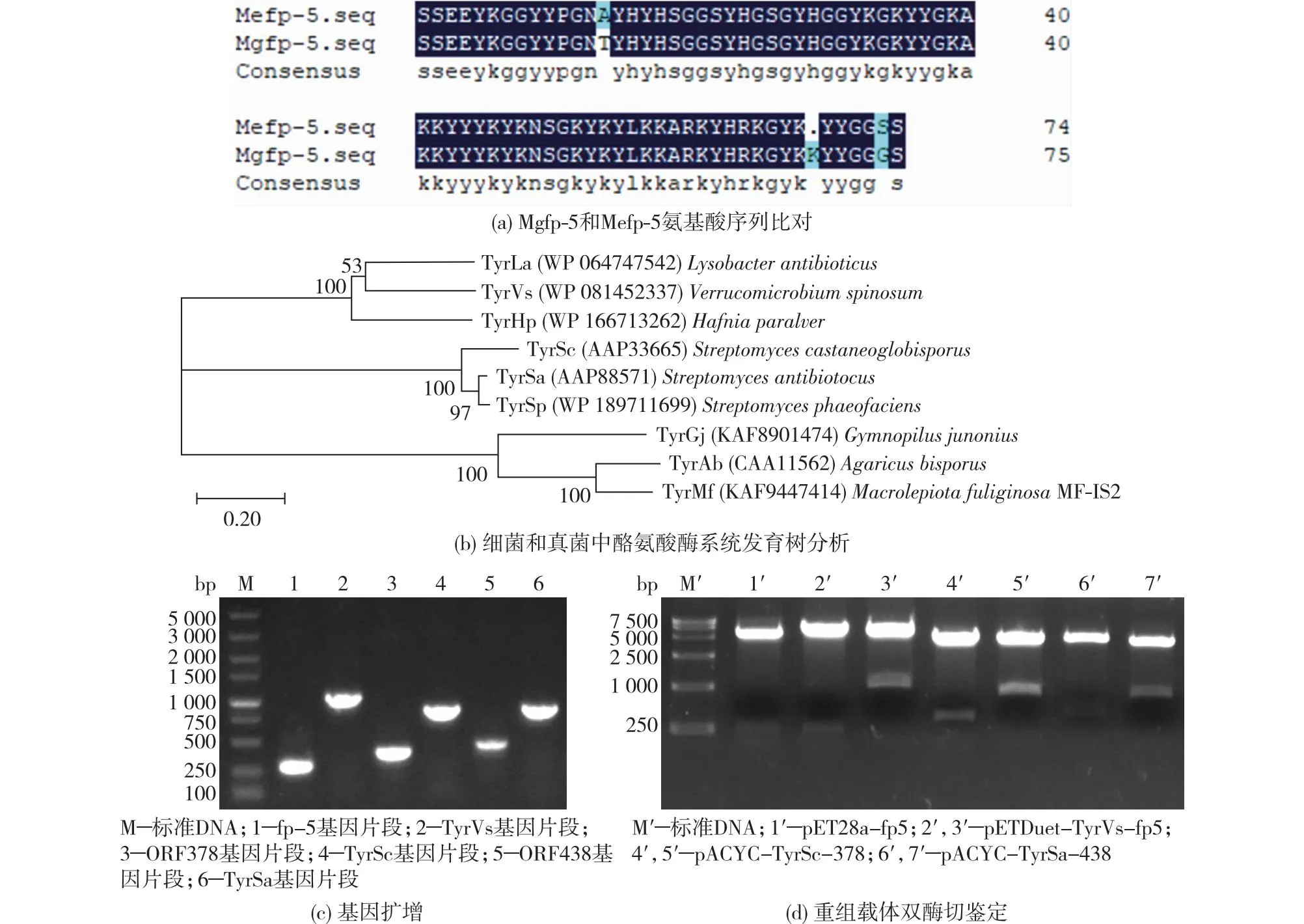
图1 序列分析及重组载体的验证Fig.1 Sequence analysis and verification of recombinant vector
通过PCR从克隆质粒扩增目的基因片段,fp-5、TyrSa、ORF438、TyrSc、ORF378和TyrVs的基因片段的理论大小分别为250、822、441、822、381和1 011 bp。对构建的重组载体进行双酶切验证,条带大小与预期一致(图1(d))。再将构建的质粒送至公司测序验证,插入序列正确,表明重组表达载体构建成功。
2.2 重组贻贝足蛋白的表达与纯化
图2为重组贻贝足蛋白的表达与纯化结果。由图2可知:E.coli(pET28a-fp5)经IPTG诱导后能够表达分子量~1.24×104的可溶蛋白fp-5,与理论分子量一致,表达量约为总蛋白量的51%,产量约为19.3 mg/L。N端融合6×His标签的fp-5经Ni柱亲和层析纯化,洗脱得到纯度约98%的目的蛋白(图2(b)),在双载体和单载体系统中,重组fp-5蛋白与来源于细菌的酪氨酸酶成功共表达,体内修饰fp-5(cofp-5)和TyrVs(~3.80×104)以可溶形式表达,而TyrSa(~3.24×104)和TyrSc(~3.27×104)大部分表达为包涵体,cofp-5在单载体表达系统中的分子量(~1.07×104)小于双载体系统中的分子量(~1.24×104)。ORF438(~1.49×104)或 ORF378(~1.30×104)的分子量与cofp-5相似,因此,它们不能通过SDS-PAGE清楚地区分。当单独携带pACYC-TyrSa-438或pACYC-TyrSc-378质粒的大肠杆菌表达时,ORF438或ORF378仅以不溶性形式存在(数据未显示)。

图2 重组蛋白的表达与纯化SDS-PAGE电泳图Fig.2 SDS-PAGE analysis of recombinant protein expression and purification
2.3 重组贻贝足蛋白的修饰分析
通过NBT/Gly氧化还原循环染色方法,定性检测Dopa残基,不同颜色强度的斑点反映了不同水平的Dopa含量,结果见图3(a)。由图3(a)可知:作为阴性对照的BSA和缺乏Dopa的未修饰fp-5完全没有被染色,体外修饰的mfp-5可以看到一个淡蓝紫色的斑点,与TyrSa体内修饰的cofp-5(5-Sa)颜色强度相近。此外,TyrSc体内修饰的cofp-5(5-Sc)颜色较浅,而TyrVs体内修饰的cofp-5(5-Vs)显示出最强的蓝紫色斑点。由此可见,不同修饰方式和酪氨酸酶能够对fp-5蛋白的酪氨酸残基进行不同程度的修饰。

图3 cofp-5中酪氨酸残基修饰的分析Fig.3 Analysis of tyrosine modifications in cofp-5
进一步比较3种表达系统中cofp-5的产量和酪氨酸的修饰率,结果见图3(b)。由图3(b)可知:体内修饰蛋白5-Vs、5-Sa和5-Sc的产量分别为18.6、27.2和19.1 mg/L。该产量低于先前文献[20]的fp-5产量(4.5 L培养物产量约为50 mg/L),可能是由于摇瓶试验和发酵罐发酵工艺的不同,其中5-Vs表达量的降低可能是由于TyrVs的大量可溶表达。
通过酸-硼酸盐差异光谱分析定量体内修饰cofp-5中Dopa,结果见图3(b)。由图3(b)可知:5-Vs中的20个酪氨酸残基中约有11个羟基化为Dopa,修饰率约为55.20%,高于5-Sa(约15.70%)和5-Sc(约26.00%)。目前仅有报道对共表达修饰前后的黏附性进行测试,而未进一步分析修饰率[9]。总体而言,采用共表达体内修饰与体外修饰的贻贝足蛋白(9.6%)相比[21],修饰率显著提高。
2.4 重组贻贝足蛋白在不同表面的附着力
为了研究不同酪氨酸修饰率的fp-5蛋白的附着和涂层性能,本研究对BSA、mBSA(体外修饰的BSA)、fp-5、mfp-5(体外修饰的fp-5)、5-Vs、5-Sa和5-Sc进行了对比分析。分别将这几种蛋白质溶液滴在不同种材料的表面,即载玻片(glass)、聚苯乙烯板(PS)和聚乙烯薄膜(PE)。通过振荡冲洗后考马斯亮蓝染色,研究蛋白附着力强度,结果如图4(a)、4(b)和4(c)所示。由图4(a)~(c)可知:BSA和mBSA被完全冲掉,未修饰和修饰的fp-5不同程度地黏附在所有测试基材上。修饰后的fp-5表现出显著的表面包覆能力,而未修饰的fp-5轻微黏附在表面,这表明Dopa不是促成Mfp黏附特性的唯一因素[22]。已有的研究仅对Mfp(fp-5[23]和fp-3[15])体外修饰前后在玻璃表面的附着力进行测试,其中fp-5的附着强度仅通过肉眼观察比较。选取不同亲疏水性表面,通过软件分析斑点强度,发现在更疏水的表面,Dopa对附着力影响更大,这可能是由于Dopa含有大量的芳香结构,通过疏水相互作用附着在疏水材料表面,在Dopa氧化自聚合过程中,逐渐形成更大的共轭结构,疏水作用显著增强。
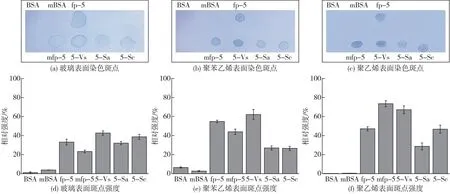
图4 修饰/未修饰fp-5在各种表面涂层分析Fig.4 Recombinant fp-5 with or without tyrosinase modified coating to various surfaces
通过Gel-Pro软件对蛋白斑点强度进行分析,结果如图4(d)~4(f)所示。由图4(d)~4(f)可知:5-Vs的蛋白斑点颜色在所有材料表面相对较深。这说明通过酪氨酸酶共表达修饰,将酪氨酸残基羟基化为Dopa,Dopa通过π-π/π-阳离子相互作用,从而一定程度提升了重组贻贝足蛋白的附着力。
2.5 重组贻贝足蛋白的黏附强度
为了量化重组贻贝足蛋白的大规模黏附水平,通过搭接剪切试验,分别对fp-5、5-Vs、5-Sa和5-Sc黏附铝片的情况进行研究,结果如图5(a)所示。对5-Vs进行黏附试验,结果见图5(b)。由图5(a)可知:未修饰fp-5的剪切强度为(0.07±0.002) MPa,而5-Sa((0.08±0.030) MPa)和5-Sc((0.14±0.006) MPa)的剪切强度值略高于未修饰fp-5的。值得注意的是,cofp-5中黏附强度最大的为5-Vs((0.32±0.02) MPa),约为未修饰的fp-5的4.6倍。这是由于酪氨酸酶体内修饰后,Dopa通过形成金属-邻苯二酚配位键增强黏附作用。尽管cofp-5的整体黏附强度小于之前的文献报道,其中fp-5的强度为1.11 MPa[20],但这些研究是在不同的实验条件下进行的,并且先前的研究未测试修饰后的黏附强度,难以直接进行比较。由图5(b)可知:力-距离曲线的最高点为黏合头的物理断裂处,后逐渐下降。综上,采用来源于多刺疣微菌的酪氨酸酶体内修饰fp-5的策略获得了具有强黏附特性的贻贝蛋白(5-Vs)。

图5 fp-5和cofp-5的大规模黏附强度Fig.5 Bulk-scale adhesive strength of fp-5 and cofp-5
3 结论
在E.coli中实现fp-5的共表达修饰,并对修饰率和黏附性进行定量分析,主要结论如下:
1)成功在大肠杆菌中共表达fp-5和酪氨酸酶,实现酪氨酸残基体内羟基化为Mfp黏附过程中的关键物质Dopa。
2)比较不同体内修饰cofp-5的产量和修饰率,筛选出最佳共表达系统,蛋白5-Vs产量18.6 mg/L,修饰率约为55.20%,远高于体外修饰效率。
3)对5-Vs附着力和黏附强度进行评价,黏附力约为未修饰fp-5的4.6倍,有望作为生物黏合剂应用于生物医用材料等领域。
