亮菌口服溶液对结肠癌、黑色素瘤转移和肉瘤的保护研究
2024-01-23韩丹阳王晨莉时美伶苏兆铎杜宝珍
韩丹阳,王晨莉,时美伶,苏兆铎,杜宝珍
(北京市鼓楼中医医院肿瘤科,北京 100075)
天然来源的多糖类药物在发挥抗肿瘤效果的同时,表现出低细胞毒性或无细胞毒性的显著优势[1]。研究[2]已经表明,多糖类药物能够通过激活巨噬细胞和产生炎症介质来调节免疫系统。提示多糖可能具有免疫保护的能力。亮菌口服液(Armillariella oral solution,AOS)作为拥有完全知识产权的中成药,亮菌多糖是其核心成份,临床上被用于改善慢性胃炎、肠炎的临床症状和体征[3]、放化疗引起的白细胞减少[4]和结直肠癌的抗肿瘤治疗[5]。尤其Cheng HR 等报道,亮菌多糖中的β-1,6-葡聚糖,即AAMP-A70,能激活巨噬细胞介导的免疫应答,并将促瘤的M2 型巨噬细胞转化为抑瘤的M1 型巨噬细胞,发挥抗肿瘤作用[6]。此外亮菌多糖还具有更高的利用率、更低的生产成本和更高的回收率,有利于在工业规模上的扩大生产。然而,亮菌多糖能否对结肠癌、黑色素瘤和肉瘤等恶性肿瘤是否有保护作尚未有报道。本研究分别从离体(采用人结肠癌细胞系HCT 116 细胞和鼠转移性黑色素瘤细胞系B16-F10 细胞)和在体(构建肉瘤荷瘤小鼠)两个层面,检测亮菌多糖的对结肠癌/黑色素瘤肿瘤细胞的毒性、抗增殖活性和对肉瘤荷瘤小鼠外周血的血小板计数、总白细胞计数、白细胞分型计数、天冬氨酸氨基转移酶(AST)和尿素水平(UREA)的含量以及肝、肾、脾的组织病理学的影响。以期为亮菌口服液疗效的开发和临床合理用药提供参考。
1 材料和方法
1.1 实验动物
选取6 ~8 周龄Balb/c 雌性小鼠24 只,随机分为对照组(Control 组)、低剂量组(亮菌多糖25 mg·kg-1)和高剂量组(亮菌多糖50 mg·kg-1)。小鼠平均体质量(28±2)g,购自北京维通利华公司[合格证号:SCXK(京)2014-0001]。饲养温度26 ~28℃,光照12 h,均自由采食和饮水,适应性喂养1 周后进行实验。本研究符合伦理学相关标准,且经我院医学伦理会审核批准(批号:20210503096),并遵循了有关实验动物管理和使用的规定[7]。
1.2 试剂及仪器
亮菌口服溶液,购自四川先通药业有限责任公司(口服,1 次10 ~20 mL,每日3 次,国家准字号:H51023188,规格:10 mL,无糖型)。氢氧化钠、乙二胺四乙酸、半胱氨酸、木瓜蛋白酶、TRISHCl、EDTA (pH 7.4)、MTT [3-(4,5-二甲基噻唑-2-甲基)-2,5-二苯基四氮唑溴盐]均购自美国Sigma公司,人结肠癌细胞系HCT 116 细胞和鼠转移性黑色素瘤细胞系B16-F10 细胞购自中国典型培养物保存中心,酶标仪(Biotek H1,美国),光学显微镜(Leica DM4 B&DM6 B,德国),恒温震荡培养箱(SL- 222,SOLAB,巴西),高效液相色谱(岛津,京都株式会社,日本)。
1.3 实验方法
1.3.1 亮菌多糖的提取及结构鉴定[8]取15 mL 亮菌口服液加入丙酮中,4℃下充分混合24 h。将析出物在60℃下干燥成干亮菌粉,悬浮析出物加入提取缓冲液(0.1 M 氢氧化钠,5.0 mM 乙二胺四乙酸和5.0 mM 半胱氨酸,1.0 g 木瓜蛋白酶,pH 6.0)中,并在60℃下以200 rpm 搅拌孵育12 h。然后将培养混合物离心(2 500 g,室温下20 min),并保存上清液。将残余物重新悬浮在相同的提取缓冲液中,利用DMB 在 A525 条件下的异染特性进行查验,直到上清液中没有亮菌多糖为止。将对异染特性敏感的上清液合并,称之为粗制物,并在乙醇存在下沉淀亮菌多糖(最终浓度分别为9%、23%、45%和75%)。将每种沉淀的多糖透析、冷冻干燥并在-20℃下储存。在这些步骤后获得约0.26 g(干重)的总粗多糖和0.19 g F9(产率分别为1.7%和1.3%),使用以下等式计算:产率(m/m,%)=总粗多糖重量(g) / 干亮菌粉重量(g)×100%。此外,F9 中存在的硫酸化多糖的含量为2.9%,使用以下等式计算:亮菌多糖的产率(%)=硫酸化多糖的生化剂量(g)/干亮菌粉的重量(g)×100%。
1.3.2 亮菌多糖的纯化 将乙醇条件下沉淀的亮菌多糖溶解在5 mL 20 mM TRIS-HCl 和50 mM EDTA(pH 7.4)混合的缓冲液中,然后通过上述溶液平衡的DEAE-纤维素柱(10.0 cm×2.0 cm)纯化,并用50 mL 上述缓冲液洗涤。柱的流速为0.5 m·min-1。收集1.0 mL 样品后用DMB 和电导率异染分析法测定亮菌多糖。在平衡、洗脱、收集和馏分检查相同的条件下,将DEAE-纤维素(亮菌多糖)获得的峰应用于高效液相色谱。
1.3.3 肿瘤细胞培养 采用人结肠癌细胞系HCT 116 细胞和鼠转移性黑色素瘤细胞系B16-F10 细胞检测亮菌多糖的细胞毒性。HCT 116 细胞在装有RPMI-1640 培养基的塑料烧瓶中生长,含有10%胎牛血清、2 mM 谷氨酰胺、100 g·mL-1链霉素和100 U·mL-1青霉素,并在37℃和5% CO2条件下孵育。注射肉瘤细胞到小鼠的腹膜腔中以进行体内抗肿瘤检测。从供体动物的腹腔收集腹水,并制备含有5 mL乳酸林格氏液、0.2 mL 庆大霉素(5 mg·mL-1)和0.5 mL 腹水的悬浮液。受体动物腹腔接种2×106cells/0.5 mL。该过程每10 d 进行1 次。
1.3.4 MTT 法检测细胞毒性 通过MTT [3-(4,5-二甲基噻唑-2-甲基)-2,5-二苯基四氮唑溴盐]测定法进行评估。HCT116 和B16-F10 细胞以每孔4×104的密度接种在96 孔板上,培养基为200 μL。加入亮菌多糖的浓度分别为10 μg·mL-1、100 μg·mL-1和250 μg·mL-1。 以二甲基亚砜(DMSO,0.05%)为阴性对照,以抗肿瘤化合物阿霉素(0.016 ~50 μM)为阳性对照。处理后,将培养基重新放入含有MTT 溶液(0.5 mg·mL-1)的新鲜培养基中,再培养3 h。然后,取出MTT 溶液,将平板在35℃条件下干燥30 min。将甲瓒产物溶解在150 μL 二甲基亚砜中,在570 nm 读取吸光度。使用GraphPad Prism 6.1 软件,通过非线性回归的算法将标准化吸光度数值转化为生长抑制百分比,计算抑制浓度均值(IC50)及其95%置信区间(CI 95%)。
1.3.5 肉瘤动物模型构建 将8 日龄肉瘤腹水肿瘤细胞稀释在乳酸林格氏液中,经皮下植入小鼠左腋窝(2×106cells/500 μL)。肿瘤移植后24 h,腹腔注射溶于盐水或无菌盐水的亮菌多糖(25 mg·kg-1或50 mg·kg-1)。腹腔注射7 d 后,从小鼠眼眶后丛收集外周血样本。并对动物实施安乐死,切除肿瘤、肝脏、脾脏和肾脏,称重并固定在10%甲醛中。肿瘤生长抑制率由下式计算:抑制率(%)=[(A-B)/A]×100%,其中A 为阴性对照的肿瘤重量平均值,B 为治疗组的肿瘤重量平均值。在肿瘤移植当天和治疗的最后1 d 测量体质量。血样用于血液和生化分析。
1.3.6 生化分析 血液2 500 rpm·min-1离心15 min后,对所获得的血清样品进行生化分析。测定天冬氨酸氨基转移酶(AST)和尿素水平(UREA)的含量。
1.3.7 血液分析 每只小鼠取外周血500 μL 置于乙二胺四乙酸中,在光学显微镜下通过标准手动程序进行各种血液学参数(血小板、总白细胞、淋巴细胞和单核细胞计数)的记录。
1.3.8 组织病理学和形态学分析 用甲醛固定后,大体检查肿瘤、肝脏、脾脏和肾脏的大小、颜色变化以及出血情况。然后,将肿瘤、肝、脾和肾切成5 μm 厚度的切片,对组织切片进行苏木精和伊红染色。在光学显微镜进行组织学分析。
1.4 统计学方法
以SPSS 22.0 软件对实验数据进行统计分析,计量资料以均数± 标准差(±s)表示,组间比较进行单因素方差分析,进一步2 组间比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 亮菌多糖对离体条件下肿瘤细胞增殖的影响
在体外检测亮菌多糖对结肠癌B16-F10 细胞和黑色素转移瘤HCT116 细胞的抗增殖作用,不同浓度(10 μg·mL-1、100 μg·mL-1和250 μg·mL-1)的硫酸化亮菌多糖均未发挥细胞毒性作用,均未能显著抑制上述肿瘤细胞系生长(P>0. 05)。见图1。
2.2 亮菌多糖对在体条件下肿瘤细胞增殖和器官重量的影响
在给予亮菌多糖治疗后,小鼠肉瘤的生长显著延迟。对照组的肉瘤重量为(2.09±0.42)g,而剂量为25 mg·kg-1和50 mg·kg-1亮菌多糖治疗组的小鼠的肉瘤重量分别为(1.15±0.27)g 和(1.01±0.19)g。与对照相比,25 mg·kg-1和50 mg·kg-1的亮菌多糖对肿瘤生长抑制百分比分别为42.32%(P<0.05)和51.26%(P<0.05),见图2A。与对照组相比,亮菌多糖剂量依赖性地增加小鼠的相对脾脏重量,25 mg·kg-1和50 mg·kg-1剂量的亮菌多糖分别诱导脾脏重量增加39.70%(P<0.05)和70.51%(P<0.05),见图2B。亮菌多糖处理后的小鼠肾脏重量与对照组相比显著增加(P<0.05),见图2C。但亮菌多糖处理后小鼠肝脏重量与对照组相比无显著变化(P>0.05),见图2D。

图2 亮菌多糖对在体条件下肿瘤细胞增殖和器官重量的影响
2.3 亮菌多糖对荷瘤小鼠外周血和生化参数的影响
与对照组相比,剂量为25 mg·kg-1和50 mg·kg-1的亮菌多糖处理组外周血的血小板计数均显著增加(P<0.05),见图3A;而总白细胞计数、中性粒细胞、淋巴细胞和单核细胞的百分比没有显著差异(P>0.05),见图3B-E。与对照组相比,剂量为25 mg·kg-1和50 mg·kg-1的亮菌多糖处理组的血浆尿素水平无显著差异(P>0.05),但丙氨酸转氨酶(AST)水平显著增加(P<0.05),见图4。

图3 亮菌多糖对小鼠外周血中血小板计数、总白细胞计数、嗜中性粒细胞、淋巴细胞和单核细胞的影响

图4 亮菌多糖对小鼠的血浆尿素(UREA)水平和丙氨酸转氨酶(AST)水平的影响
2.4 亮菌多糖对荷瘤小鼠肿瘤、脾、肝和肾组织病理形态的影响
肿瘤的组织病理学分析显示对照组和亮菌多糖治疗组之间的荷瘤模式未见差异。各组均出现恶性肿瘤,并伴有强烈的细胞解体(图5A-C)。各组肿瘤中伴有大量有丝分裂像、骨骼肌浸润和凝固性坏死。各组动物脾脏的组织病理学分析显示白髓增生、卵泡解体和巨核细胞的存在。剂量为25 mg·kg-1和50 mg·kg-1亮菌多糖处理组小鼠的脾脏均显示出强烈的卵泡解体(图5D-F)。各组的小鼠肾脏组织病理学分析显示肾小球保存良好,并有轻度出血。剂量为25 mg·kg-1亮菌多糖处理组小鼠肾脏呈现管状上皮的小空泡化和坏死点,而剂量为50 mg·kg-1亮菌多糖处理组小鼠仅呈现管状上皮的空泡化。各实验组均出现肾小管上皮细胞中度肿胀以及肾小球和肾小管出血(图6D-F)。对小鼠肝脏的组织病理学评估显示,各组均存在库普弗细胞增生和细胞肿胀。对照组显示肝细胞中度细胞肿胀。剂量为25 mg·kg-1和50 mg·kg-1亮菌多糖处理组小鼠肝脏均呈现局灶性炎性病灶和棕色色素沉积,提示上述剂量亮菌多糖处理都造成小鼠肝脏胆红素的产生(图6A-C)。
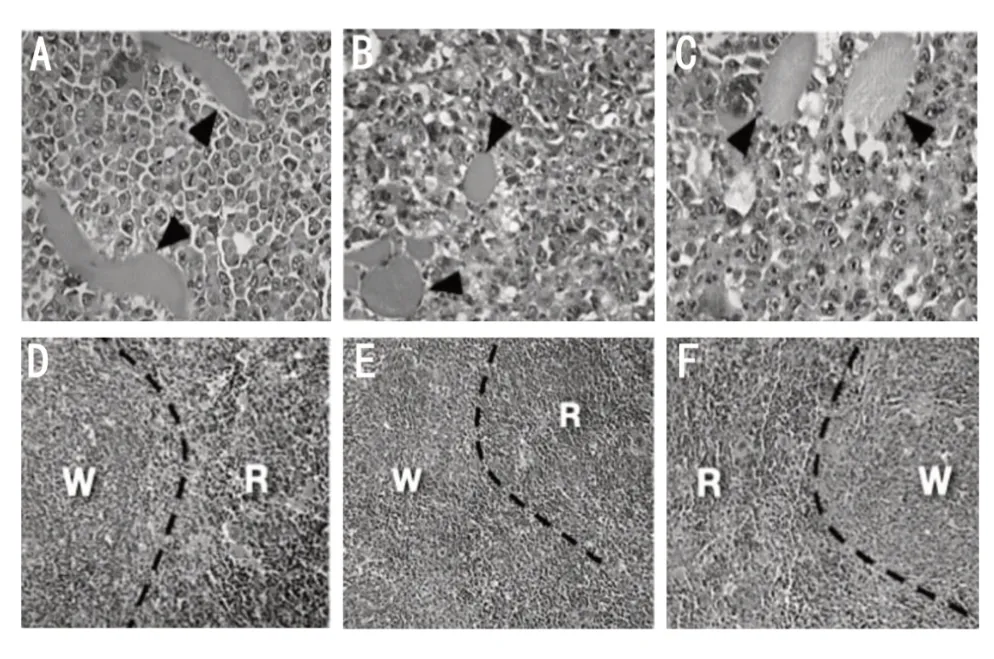
图5 亮菌多糖对荷瘤小鼠肿瘤和脾的影响

图6 亮菌多糖对荷瘤小鼠肾脏和肝脏的影响
3 讨论
CIUREA 等[9]报道,抗癌治疗通常会伴发血小板减少症,最终导致出血和死亡。本研究发现亮菌多糖治疗会引起荷瘤小鼠外周血血小板计数增加。这提示亮菌多糖在发挥抗肿瘤作用的同时,还能有效避免血小板减少症的出现,进而对肿瘤患者发挥保护作用。LIU 等[10]研究表明当归根多糖通过PI3K/AKT 途径促进小鼠造血和血小板生成。此外,荷瘤小鼠经亮菌多糖处理后,没有显著的白细胞计数改变。而白细胞减少也是临床使用的一些抗肿瘤药物的常见副作用。
此外,通过对小鼠脏器的组织病理学和生物化学分析发现,经亮菌多糖处理的小鼠没有表现出生物学相关的肝或肾毒性。而RAMOS 等[11]报道,用松叶提取物处理后,荷瘤小鼠外周血的AST 水平增加2 ~3 倍,尤其是小鼠发生肝细胞空泡化和肝脂肪变性,虽然亮菌多糖处理的荷瘤小鼠血清AST 水平升高,但肝脏结构未见显著变化。而抗癌治疗对健康组织毒性很大,过大的副作用会直接影响到疗效。因此,亮菌多糖与化疗的联合应用可能会改善化疗的副作用。
本项研究中的所有小鼠都移植了肿瘤,也包括对照组,因此高剂量亮菌多糖对外周血单核细胞计数的影响与肿瘤的存在无关。先天或适应性免疫反应依赖于粒细胞穿过血管,髓样细胞正是由于对肿瘤微环的境刺激十分敏感,才成为癌症发生发展的关键。所有降低肿瘤微环境的促瘤特征或激发免疫反应是当今主流的抑制肿瘤增殖的策略。在亮菌多糖处理的小鼠中观察到的单核细胞数量减少以及肿瘤生长延迟可能与单核细胞活化有关,值得进一步研究。本研究结果提示高剂量亮菌多糖诱导有可能发挥宿主依赖性抗肿瘤作用。
