跑台运动对慢性应激大鼠抑郁行为及内质网应激介导的细胞凋亡和BDNF/TrkB表达的影响
2024-01-23崔建梅宋艳丽苏英敏周琛斐杨子欣李中华苏晓云王晓鹏
崔建梅,宋艳丽,苏英敏,周琛斐,杨子欣,李中华,苏晓云,王晓鹏

近年来,运动疗法在抑郁症治疗领域发展迅速,作为一种非药物的方式,具有运动强度可控、无毒副作用且成本相对较低等优点[7]。经前期研究证实,连续28天CUMS可诱导大鼠焦虑及抑郁行为和前额叶皮质神经元损伤增强,而中等强度跑台运动可以缓解这一趋势[8]。并且Li等[9]的研究发现,脑卒中后24 h中等强度跑台运动可显著降低脑组织GRP78、PERK(蛋白激酶RNA样内质网激酶)及CHOP蛋白(环磷酸腺苷反应元件结合转录因子同源蛋白)表达,神经缺损及脑水肿均显著改善,提示跑台运动可能通过降低内质网应激发挥神经保护作用。此外据邓钰等[10]研究可知,BDNF/TrkB通路在运动抗抑郁作用中起着重要的调节作用。Wang等[11]研究发现,抗抑郁药硫化氢可在CUMS暴露大鼠中通过激活BDNF/TrkB通路抑制海马内质网应激发挥抗抑郁样作用。然而,长期运动能否通过激活前额叶皮质BDNF/TrkB通路及降低前额叶皮质内质网应激诱导的细胞凋亡改善CUMS大鼠抑郁样行为还有待探讨。PERK/eIF2α(真核翻译起始因子2α)/CHOP是调控内质网应激的重要信号通路[12]。因此,本研究通过观察4周中等强度跑台运动对CUMS大鼠抑郁样行为的影响,并通过测量前额叶皮质内质网应激蛋白(PERK、eIF2α、CHOP)及凋亡蛋白(Bax、Bcl-2)表达和BDNF、TrkB表达的影响,探讨PERK /eIF2α/CHOP信号通路、Bcl2/Bax及BDNF/TrkB通路参与跑台运动改善CUMS大鼠抑郁样行为的作用机制。
1 材料与方法
1.1 实验动物及分组

1.2 试剂及仪器
兔抗大鼠PERK、eIF2α、CHOP、Bax、Bcl-2、BDNF及TrkB多克隆抗体,羊抗兔IgG二抗,兔抗鼠β-actin蛋白抗体,BCA试剂盒均购于武汉博士德生物有限公司;石蜡捞片机、石蜡切片机、恒温展片机、Leica DM2500显微镜购于德国Leica公司;Himac CF15R高速低温离心机购于日本Hitachi公司;图像分析软件ImageProPlus6.0购于美国Media Cybernetics公司;数字切片阅片软件K-Viewer 1.5.3.1、Western印迹电泳、转膜系统、Chemi DocTM XRS凝胶图像分析系统购于美国Bio-Rad公司;Hitachi HT7800电子显微镜购于日本Hitachi公司;KFBIO(KF-PRO-005)数字切片扫描仪、动物跑步机(FT-200)。
1.3 方 法
根据Zheng等[19]描述的慢性温和应激程序稍作修改制备大鼠CUMS应激程序,CUMS及CUMS+E组大鼠接受7种不同的应激刺激,大鼠每天接受一种应激(同种应激源不连续出现)(见表1),每周应激源随机安排,连续4周。

表1 CUMS应激安排表
1.3.2 中等强度跑台运动干预训练方案
CUMS+E组大鼠从第2周开始,每天上午接受为期4周的CUMS,下午按Zielinski等[14]描述的运动方案进行4周中等强度的跑台运动。跑台训练时大鼠跑速18~20 m/min(第1周18 m/min,第2周19 m/min,第3、第4周20 m/min),跑台运动4周(60 min/天/6天/周,周一到周六,周日休息1天),跑台训练时不能对大鼠使用电击装置驱赶。
1.3.3 行为学测试
(1)强迫游泳实验。实验第37天对大鼠进行强迫游泳实验(forced swimming test,FST),FST根据Porsolt等[15]详细描述的方案进行了一些修改,是一种专门评估啮齿类动物抑郁样行为的测试方法。大鼠被禁食16 h后单独放在塑料桶中(水深30 cm,直径18 cm,高50 cm),水温控制在21 ℃~23 ℃,并保证大鼠的尾巴不能到达塑料桶底部,强迫游泳6 min,用摄像机记录大鼠后4 min内的静止不动时间(大鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持头部在水面,s)、静止潜伏期及攀爬持续时间(s)。

另外,得了带状疱疹不要焦虑,饮食宜清淡,避免过度劳累及锻炼。尽量避免接触免疫功能低下者,如老人、儿童,以免传染。

(4)新奇抑制摄食实验。实验第41天参考以往学者的研究采用新奇抑制摄食实验[17](Novelty suppressed feeding test,NSFT)评估大鼠禁食后在饥饿状态下新奇的环境中产生摄食和对新环境恐惧的矛盾冲突。测试前,大鼠被放置在不同于饲养环境的实验环境中,实验时要求光线充足(光线强度大于饲养环境)。禁食24 h后将大鼠放置在方形敞箱(76 cm×76 cm×76 cm)的角落,敞箱中心放入9段大小相等的饵料,记录5 min内大鼠第一次开始咬食(不是嗅或玩弄饵料)饵料的时间,记作摄食潜伏期(s)。为消除食欲差异对大鼠摄取饵料的影响,将大鼠放回原来的饲养环境及饲养笼后再次记录大鼠5 min咬食饵料的潜伏期(s)。
1.3.4 Western blot法检测前额叶皮质内质网应激蛋白及BDNF、TrkB表达

1.4 统计学分析
所有数据采用SPSS 17.0统计软件进行分析。数据表示为mean±SD,大鼠体重的变化采用重复测量方差分析,其他指标3组之间数据的统计比较采用单因素方差分析,以P<0.05表示有统计学意义,P<0.01表示有极显著差异。
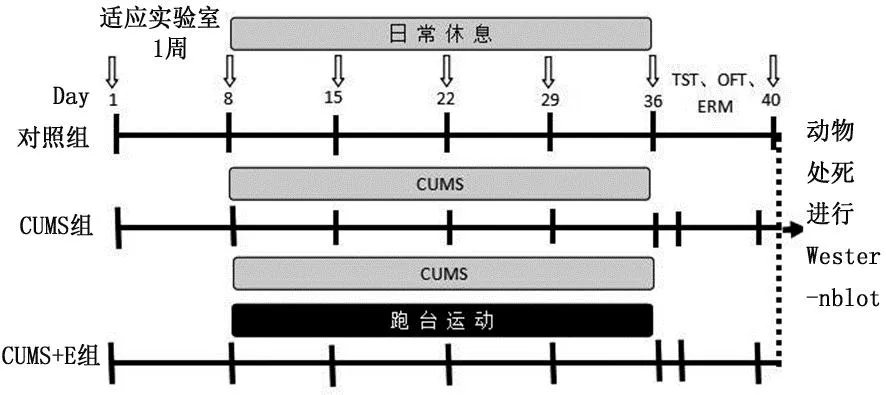
图1 实验流程图Figure 1 Protocols of the experiment 注:FST,强迫游泳实验;OFT,开场实验;SPT,糖水偏爱实验;NSFT,新奇抑制摄食实验。
2 结果与分析
2.1 跑台运动对CUMS大鼠体重的影响
重复测量方差分析显示,组别及时间对大鼠体重有显著影响(F=11.129,P=0.000)。CUMS及跑台运动开始前[F(2,27)=1.135,P=0.336]及第1周[F(2,27)=0.367,P=0.696]、第2周[F(2,27)=2.902,P=0.072]三组大鼠体重无显著差异,第3周[F(2,27)=16.626,P=0.000]及第4周[F(2,27)=12.143,P=0.000]三组大鼠体重差异显著。CUMS 组大鼠在慢性应激2周后体重开始显著低于对照组(P=0.023),并且一直延续到慢性应激的第3周(P=0.000)和第4周(P=0.000);跑台运动从慢性应激第3周开始显著改善CUMS大鼠体重的增长缓慢,CUMS运动组大鼠第3周(P=0.006)及第4周(P=0.015)体重显著高于CUMS组大鼠,第1周(P=0.649)、第2周(P=0.193)两组体重无显著差异。而与对照组比较,CUMS+E组大鼠表现为慢性应激第3周(P=0.009)及第4周(P=0.021)体重均显著降低,第1周(P=0.696)及第2周(P=0.294)两组大鼠体重无显著差异(见图2)。
2.2 跑台运动对CUMS大鼠抑郁样行为的影响
2.2.1 跑台运动对CUMS大鼠开场实验的影响

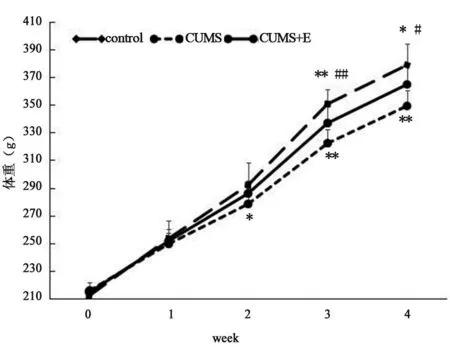
图2 各组大鼠第0~4周体重比较图Figure 2 Comparation of the body weight of rats at 0~4 week in each group 注:**P<0.01,*P<0.05,与对照组比较;##P<0.01,#P<0.05,CUMS运动组与CUMS组比较。下同。
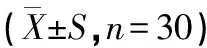
表2 各组大鼠开场实验中跨格次数、直立 次数及中央格时间结果表Table 2 Results of crossing numbers, vertical numbers and time of staying in center in OFT in various n=30)
2.2.2 跑台运动对CUMS大鼠强迫游泳实验的影响
单因素方差分析,组别对强迫游泳实验静止潜伏期[F(2,27)=20.772,P=0.000]、静止时间[F(2,27)=16.910,P=0.000]及攀爬时间[F(2,27)=11.454,P=0.000]均有显著影响。与对照组(静止潜伏期:78.80±11.00 s;静止时间:53.90±8.99 s)比较,CUMS(静止潜伏期:51.20±8.79 s;静止时间:82.30±11.08 s)及CUMS+E(静止潜伏期:68.60±9.11 s;静止时间:67.50±12.42 s)组大鼠静止潜伏期显著缩短、静止时间显著增加(P=0.000,P=0.026;P=0.000,P=0.010)。与CUMS组比较,CUMS+E组大鼠静止潜伏期显著延长、静止时间显著缩短(P=0.000,P=0.005)。与对照组(59.80±8.90 s)比较,CUMS(42.60±5.60 s)及CUMS+E组(48.10±9.56 s)大鼠攀爬时间显著缩短(P=0.000,P=0.004)。而与CUMS组比较,CUMS+E组大鼠攀爬时间无显著统计学差异(P=0.146)(见图3)。

图3 各组大鼠强迫游泳实验中静止潜伏期、 静止时间及攀爬时间比较图Figure 3 Comparation of the latency of immobility, immobility time and climbing time in the forced swimming test of rats in each group
2.2.3 跑台运动对CUMS大鼠糖水偏爱实验的影响

2.2.4 跑台运动对CUMS大鼠新奇抑制摄食实验的影响
单因素方差分析显示,组别对新奇抑制摄食实验大鼠新环境摄食潜伏期有显著影响[F(2,27)=13.765,P=0.000],但对原饲养笼摄食潜伏期无显著影响[F(2,27)=1.950,P=0.162]。与对照组(102.50±17.32 s)比较, CUMS组(151.40±21.85 s)大鼠新环境摄食潜伏期显著延长(P=0.000)。CUMS+E组大鼠新环境摄食潜伏期与对照组比较均无显著差异(P=0.095),但与CUMS组大鼠比较显著缩短(P=0.002)。原饲养笼三组摄食潜伏期之间无显著差异(P>0.05)(见图5)。
图4 各组大鼠糖水偏爱实验中糖水摄入量、总摄入量及糖水偏爱率比较图Figure 4 Comparation of the sugar water intaking, total intaking and sugar water preference rate in sucrose preference test of rats in each group

图5 各组大鼠新奇抑制摄食实验新环境摄食潜伏期 及原饲养笼摄食潜伏期比较图Figure 5 Comparation of the latency of feed in new environment and the latency of feed in original cage of rats in novelty suppressed feeding test in each group
2.3 跑台运动对CUMS大鼠前额叶皮质内质网应激及凋亡蛋白表达的影响
图6为3组大鼠前额叶皮质PERK、eIF2α、CHOP、BAX、Bcl-2、BDNF及TrkB蛋白表达情况。单因素方差分析显示,组别对大鼠前额叶皮质PERK[F(2,15)= 8.488,P=0.003]、eIF2α[F(2,15)=29.929,P=0.000]、CHOP[F(2,15)=16.316,P=0.000]、BAX[F(2,15)=7.369,P=0.006]、Bcl-2[F(2,15)=30.631,P=0.000]、BDNF[F(2,15)=19.294,P=0.000]及TrkB[F(2,15)=25.834,P=0.000]蛋白表达均有显著影响。与正常组比较,CUMS组大鼠前额叶皮质内质网应激蛋白PERK、eIF2α、CHOP及促凋亡蛋白BAX(P=0.000,P=0.001,P=0.003,P=0.032)表达均显著增加,抗凋亡蛋白Bcl-2及BDNF、TrkB蛋白表达均显著下降(P均=0.000)与CUMS组比较,CUMS+E组大鼠前额叶皮质PERK、eIF2α、CHOP蛋白表达显著下降(P=0.039,P=0.002,P=0.047),Bcl-2、BDNF及TrkB蛋白表达显著增加(P=0.001,P=0.013,P=0.029),而BAX蛋白表达无显著差异(P=0.371)。
3 讨 论
3.1 跑台运动对CUMS大鼠抑郁样行为的影响
多数研究认为,暴露于CUMS可导致动物出现类似抑郁的行为,如,行为绝望、快感缺乏、运动能力下降及对新环境产生恐惧等[18]。本研究表明,CUMS诱导了大鼠抑郁样行为,表现为蔗糖偏好实验中蔗糖消耗及糖水偏爱率下降,强迫游泳实验中静止时间增加、静止潜伏期及游泳时间均缩短。然而有学者认为,强迫游泳实验中CUMS大鼠静止时间延长可能是一种习得反应[19]。本研究选择的刺激不是固定不变的,而是每天一种、随机选取、不可预测的,避免了大鼠对应激条件的习惯;并且本实验中抑郁大鼠糖水消耗量的下降,也不能单纯地解释为大鼠的渴觉下降,因为与对照组比较,CUMS大鼠的总液体消耗量并未减少,这些数据可被解释为CUMS模型大鼠出现行为绝望和对奖励刺激的反应减少。此外本研究还发现,开场实验中大鼠中央格时间显著缩短、水平穿格次数和直立次数均显著下降;新奇抑制摄食实验中新环境中大鼠摄食潜伏期延长,提示CUMS模型大鼠表现出类似于人类抑郁症的临床表现特征,如,对外界事物缺乏兴趣、绝望,探索行为、运动能力下降及在饥饿状态下的新奇环境中产生摄食和对新环境恐惧的矛盾冲突等,与前期学者研究结果一致[20]。总之,本研究中的4周CUMS诱导了大鼠的行为绝望和恐惧,以及诱发了体重、探索能力、蔗糖偏好率的显著降低,这些都与重度抑郁症患者的临床症状相似。结果表明,本研究成功建立了大鼠抑郁模型。
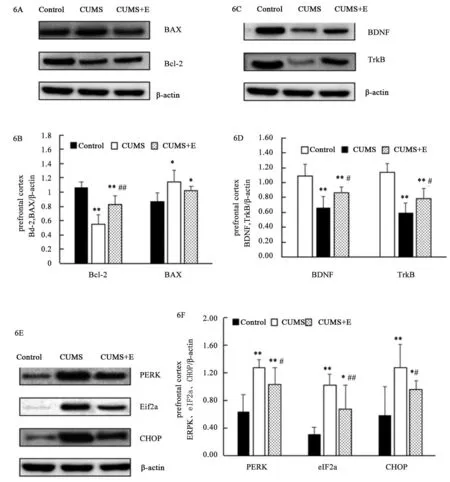
图6 各组大鼠前额叶皮质PERK、eIF2α、CHOP、BAX、Bcl-2及BDNF、TrkB蛋白表达图Figure 6 The protein expression of PERK, EIF2α, CHOP, BAX, Bcl-2, BDNF and TrkB in the prefrontal cortex of rats in each group
研究已经证实,作为一种非药物干预方式,有氧运动可以帮助缓解抑郁症状,其效果与药物治疗和其他心理干预相当[21]。并且Meta分析显示,运动,尤其是中等强度的有氧运动可显著改善抑郁症患者的抑郁症状[22]。此外本课题组前期研究发现,4周中等强度跑台运动可通过增强海马CA1、CA3区NGF 的表达,改善CUMS大鼠的绝望及探索行为[23]。因此,本研究给予大鼠4周中等强度跑台运动,结果发现,4周中等强度跑台运动可显著改善CUMS大鼠的抑郁样行为,具体表现为与CUMS组比较,CUMS运动组大鼠糖水偏爱实验中蔗糖偏好率增加,强迫游泳实验中静止时间、静止潜伏期及新奇抑制摄食实验中新环境中大鼠摄食潜伏期均缩短,开场实验中中央格时间延长;但是与对照组比较,CUMS运动组大鼠蔗糖偏好实验中蔗糖消耗降低,强迫游泳实验中静止时间及静止潜伏期及新奇抑制摄食实验中新环境中大鼠摄食潜伏期均延长,开场实验中中央格时间显著减少,说明4周跑台运动可在一定程度上改善CUMS大鼠的抑郁样行为,但却不能完全逆转。然而屈红林等[24]研究发现,8周跑台运动可逆转CUMS诱导的大鼠抑郁样行为。因此,后续研究可以考虑延长跑台运动的干预时间。此外,食欲下降是抑郁动物的常见症状之一,因此体重减轻常被用作抑郁的辅助指标之一[25]。本研究发现,4周CUMS(7种应激,每天随机接受一种应激)可导致大鼠体重增长速度下降,而4周中等强度跑台运动可提高大鼠体重的增幅,与之前的学者的研究结果不一致。Luo等[26]认为28天CUMS可以降低慢性应激大鼠体重,而慢性应激后6周跑台运动干预可以提高大鼠的体重,但是与CUMS大鼠比较运动后两组之间无显著差异。另外Zhuang等[27]发现,21天CUMS(11种应激源:第1周,每天施加1次应激;第2周,每隔1天使用两种应激;第3周,每天随机接受两种应激)可导致大鼠体重显著下降,同时21天中等强度跑台运动会导致慢性应激大鼠体重的缓慢增加。针对不同研究CUMS运动组大鼠出现不同结果可能与应激程度及运动时机及干预方案不同有关。
3.2 跑台运动对CUMS大鼠前额叶皮质内质网应激蛋白及凋亡蛋白的影响
越来越多的证据表明,内质网应激反应与神经精神障碍,如重度抑郁症和双相情感障碍之间显著相关[28]。动物实验研究结果表明,21天CUMS可导致小鼠海马内质网应激蛋白GRP78及CHOP表达增加和细胞凋亡蛋白caspase-12被激活,而减少内质网应激可改善CUMS小鼠的抑郁样行为,提示CUMS小鼠的抑郁行为与内质网应激有关[29]。PERK/eIF2α/CHOP是调节内质网应激的重要信号通路[30]。因此,本研究使用Western blot检测了CUMS大鼠前额叶皮质PERK、eIF2α及CHOP蛋白表达水平,结果发现连续28天的CUMS后,前额叶皮质PERK、eIF2α及CHOP蛋白水平均显著升高。结果提示CUMS可诱导前额叶皮质内质网应激,激活的PERK可导致eIF2α的磷酸化,使蛋白质合成受到抑制,诱导CHOP转录,而长期活化的CHOP可通过下调抗凋亡基因 Bcl-2,上调促凋亡基因 Bax 等凋亡反应蛋白,促进细胞凋亡、激活促凋亡蛋白的表达[31]。本研究发现,连续4周的CUMS后,除了前额叶皮质内质网应激通路PERK/eIF2α/CHOP相关蛋白水平提高外,CUMS大鼠前额叶皮质抗凋亡基因 Bcl-2表达显著下降,促凋亡基因 Bax蛋白表达显著增加,提示长期CUMS导致大鼠抑郁样行为可能与CUMS增强海马内质网应激调控的PERK/eIF2α/ CHOP信号通路介导的细胞凋亡有关,可能是治疗抑郁症的潜在靶点。
研究认为,运动是一把双刃剑,既能诱发内质网应激,又能改善疾病状态下的内质网应激,并且运动对内质网应激的有益影响与运动强度有关[32-33]。Ruan等[34]研究发现,与高(25~28 m/min,坡度10o)、低强度(15 m/min,0坡度)跑台运动相比,中等强度运动(20~25 m/min,0坡度)在抑制非酒精性肝炎肝细胞凋亡方面效果更为显著,其机制可能与中等强度运动降低内质网应激信号通路PERK-eIF2α-CHOP介导的细胞凋亡有关。基于上述文献可知,中等强度有氧运动对内质网应激的调控可能更有益处。因此本研究给予CUMS大鼠4周中等强度跑台运动,发现长期跑台运动可使CUMS运动组大鼠前额叶皮质内质网应激蛋白PERK、eIF2α及CHOP蛋白表达水平显著下调,抗凋亡基因 Bcl-2表达增加。此外本研究还发现,CUMS+E组大鼠抑郁样行为显著改善,可能与此运动在一定程度上减轻慢性应激诱导的内质网应激PERK/eIF2α/CHOP通路介导的细胞凋亡有关,具体机制需进一步研究。
3.3 跑台运动对CUMS大鼠前额叶皮质BDNF/TrkB表达的影响
BDNF是主要的神经营养因子之一,在内质网中,BDNF主要以前体蛋白存在,通过运输分化,在高尔基体中形成成熟的BDNF,在神经元成熟、突触形成和突触可塑性等过程中发挥作用,是抑郁症病理生理学和抗抑郁药治疗机制的重要组成部分[35]。且有研究表明,单次向脑室或直接向双侧海马灌注BDNF足以诱导相对快速和持续的抗抑郁类作用,而BDNF受体TrkB抑制剂灌注到脑室及海马可阻断其抗抑郁作用,结果表明BDNF-TrkB信号通路在抗抑郁药的治疗作用中起关键作用[36]。本研究聚焦前额叶皮质,通过4周慢性不可预知应激发现,与正常大鼠比较,CUMS组大鼠前额叶皮质BDNF及TrkB 蛋白表达均显著减少,提示前额叶皮质中BDNF-TrkB信号通路蛋白表达降低在CUMS诱导的大鼠抑郁样行为中发挥重要作用。为了进一步研究长期跑台运动对内质网应激介导的神经凋亡的神经保护作用机制,本研究测定了前额叶皮质BDNF/TrkB通路蛋白表达,通过western blot检测发现,4周跑台运动使CUMS+E组大鼠前额叶皮质BDNF及TrkB蛋白表达均显著增加。同时本研究还发现CUMS增加了大鼠前额叶皮质内质网应激相关标志物的表达,而跑台运动可减弱这些标志物的表达,提示削弱内质网应激诱导的凋亡及上调BDNF/TrkB 信号通路在运动改善CUMS大鼠抑郁样行为中起重要作用。有研究表明,BDNF/TrkB通路在对抗内质网应激中发挥重要作用[37]。Wei 等[38]研究发现,硫化氢可通过上调BDNF-TrkB通路,减轻同型半胱氨酸处理的大鼠海马内质网应激(GRP78、CHOP蛋白表达下降)和神经元凋亡(caspase-12蛋白表达下降),且进一步研究发现,K252a(BDNF/TrkB通路的抑制剂)可明显增加上述蛋白的表达,削弱H2S对CUMS大鼠的神经保护作用,提示BDNF/TrkB通路介导的H2S对CUMS大鼠的神经保护作用可能与其抑制内质网应激诱导的凋亡有关[39]。并且有研究报道,脑神经保护药物可降低内质网应激标志物mRNA和蛋白表达,增加BDNF和TrkB mRNA和蛋白表达,并且减少了脑卒中大鼠梗死面积、增加了神经元存活率,认为脑神经保护药可通过BDNF/TrkB信号通路调节的内质网应激介导的细胞凋亡发挥神经保护作用[40]。因此,本研究中的前额叶皮质BDNF/TrkB通路可能在CUMS暴露大鼠跑台运动的抗抑郁作用中发挥了重要的中介作用,其机制可能是通过抑制前额叶皮质内质网应激PERK/eIF2α/CHOP通路诱导细胞凋亡。但是由于本研究中未加入 BDNF-TrkB 通路的激动剂及阻断剂,是本研究的一个缺陷。本研究只能说明前额叶皮质BDNF-TrkB 通路涉及到跑台运动的抗抑郁作用,后续工作还有待进一步研究BDNF-TrkB 通路通过何种途径介导抑制CUMS引起的内质网应激PERK/eIF2α/CHOP通路激活及凋亡蛋白的表达。
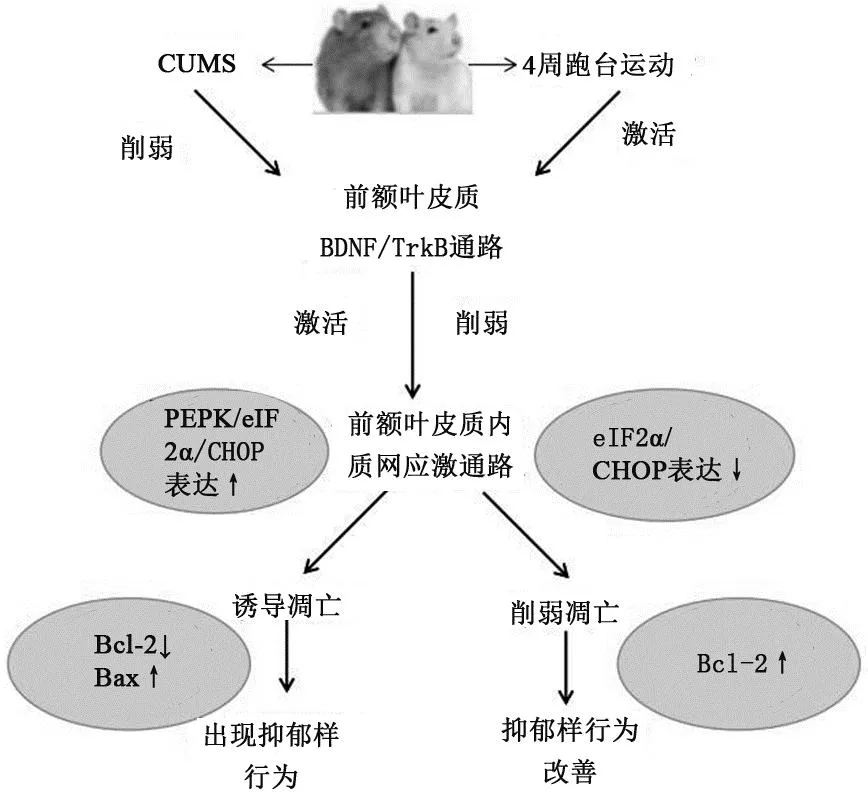
图7 跑台运动改善CUMS大鼠抑郁样行为的机制图Figure 7 The mechanism of treadmill exercise improving depressive-like behavior in CUMS rats
4 结 论
(1)4周 CUMS可导致大鼠抑郁样行为,前额叶皮质内质网应激PERK/eIF2α/CHOP通路相关蛋白及凋亡蛋白表达增加,BDNF 及 TrkB 表达下降,提示前额叶皮质可能是CUMS引起大鼠行为学改变的作用脑区之一,且这一作用可能是由前额叶皮质内质网应激PERK /eIF2α/CHOP通路诱导的细胞凋亡及BDNF-TrkB 信号通路下调共同介导的。
(2)跑台运动改善CUMS大鼠抑郁样行为可能与此运动激活前额叶皮质BDNF-TrkB 信号通路及降低内质网应激诱导的凋亡,提示跑台运动可能通过BDNF/TrkB信号通路抑制内质网应激PERK /eIF2α/CHOP通路介导的细胞凋亡发挥抗抑郁作用。
