电解水制氢耦合有机物氧化研究进展
2024-01-22栗振华邵明飞
夏 天,栗振华,2,邵明飞,2,段 雪,2
(1.北京化工大学化学学院,化工资源有效利用全国重点实验室,北京 100029;2.衢州资源化工创新研究院)
氢气是一种能够实现零碳排放的理想能源载体,在金属冶炼、工业合成氨等领域具有广泛的应用前景[1-2]。国家发展改革委、国家能源局联合印发的《氢能产业发展中长期规划(2021—2035年)》中明确提出氢能是战略性新兴产业和未来产业重点发展方向,是构建绿色低碳产业体系、打造产业转型升级的新增长点。工业制氢技术路线的发展主要分为3个阶段,包括:①灰氢时代,即通过化石燃料燃烧制氢,其特点是生产路径成本较低、工艺较简单、技术较成熟,但在生产过程中会伴随大量碳排放;②蓝氢时代,即在灰氢生产工艺的基础上引入碳捕获-转化-利用-储存(CCUS)过程实现碳中性,由于仍未摆脱传统化石燃料的桎梏,因此蓝氢被认为是一种技术过渡时期的产物;③绿氢时代,即利用可再生能源制取无碳氢气,是未来氢经济的主要战略方向,并且拓展了太阳能、风能、潮汐能等可再生能源的应用场景[3-5]。发展绿氢可以规避碳参与过程带来的能源损耗,符合国家提出的“安全为先,清洁低碳”氢能产业发展基本原则中“重点发展可再生能源制氢,严格控制化石能源制氢”的要求。
利用可再生能源发电驱动的电解水制氢技术是实现可再生能源制氢的重要途径之一,是推动氢能产业高质量发展的有效策略[6-16]。然而,目前电解水制氢技术仍面临能耗大和电解效率低等问题,其原因之一在于阳极析氧反应(OER)动力学过程缓慢,限制了阴极产氢效率,并且阳极产物氧气的附加值较低[17-25]。如何降低电解水体系中阳极的氧化能垒,并实现氧的综合利用是提高产氢效率、降低能耗、提升电解水制氢系统运行经济性的关键[26-28]。利用电解水过程中阳极产生的“活性氧”催化热力学上更有利的有机物氧化(替代OER过程),被证明是能够降低电解水反应电压、提高阴极产氢效率的有效策略,同时能够在阳极得到高附加值化学品以用于进一步分摊并降低制氢成本,最近受到科研界的广泛关注[29-47],电解水制氢耦合有机物氧化示意如图1(a)所示。近十年来,关于电解水制氢耦合有机物氧化的研究论文数量呈现逐年递增的趋势,尤其是自2019年起相关工作成果猛增[见图1(b)]。
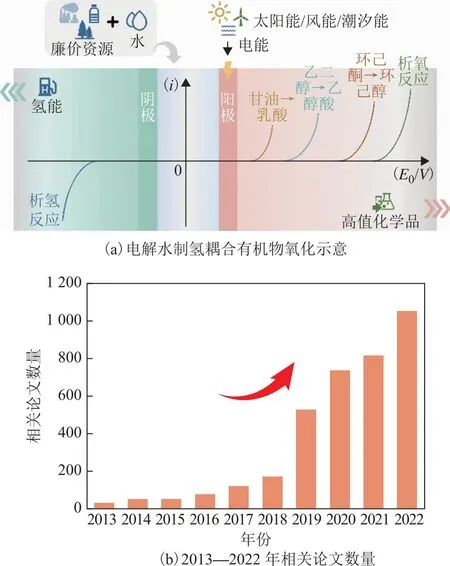
图1 电解水制氢耦合有机氧化示意及2013—2022年相关论文数量
本文综述近年来电解水制氢耦合有机物氧化方面的研究进展。首先,对阳极水氧化产生“活性氧”的种类及其催化有机物选择性氧化反应机理进行了总结,对比不同种类活性氧在各类反应中的典型应用。其次,重点讨论通过强化反应物吸附过程(包括构建多尺度有序的结构化催化剂、在催化剂表面构筑吸附-催化双活性位点、对催化电极进行表界面亲疏水/油改性等),以提升反应速率的研究进展。最后,对目前电解水制氢耦合氧化反应器设计、稳定电解技术开发、产物分离等方面的最新研究工作进行介绍,并且对该领域的未来发展前景和面临的挑战进行展望和概述。
1 阳极活性氧种类及反应机理研究

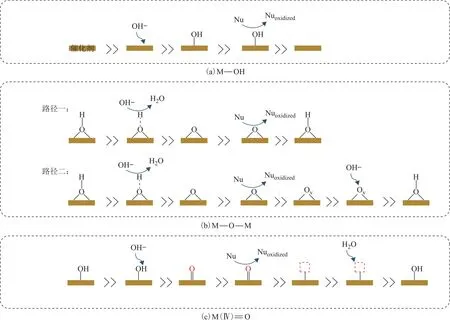
图2 活性氧形成及作用机制示意
1.1 吸附态羟基类型活性氧(M—OH)
吸附态羟基(M—OH)通常是指在电解水过程中,水活化第一步在金属(M)位点产生的吸附态活性氧物种[50]。如图2(a)所示,在碱性电解水过程中,溶液中的OH-可以吸附在催化剂的金属(M)位点上,并在电场作用下失去一个电子形成M—OH,M—OH可以被亲核有机分子进攻实现对有机分子的氧化以及M位点的再生,再生后的M位点可以与溶液中剩余的OH-进一步电化学结合形成M—OH,实现对有机分子的持续氧化。研究结果表明,贵金属基催化剂(Au,Pd,Ag等)能在较低电位[<1.0 V vs.RHE(可逆氢电极)]下形成M—OH型活性氧[66-67]。
对于贵金属表面M—OH型活性氧的认识,Zope等[68]于2010年利用同位素试验证实在碱性水溶液中Au对醇类物质进行氧化时,氧源来自于碱溶液中的OH-。理论计算结果表明,Au表面直接活化乙醇O—H键的能垒较高,而当Au与溶液中的OH-结合生成Au—OH活性氧时,可以通过质子转移有效活化乙醇的O—H键并进一步活化C—H键。Zhang Yanyan等[56]将原位液相二次离子质谱技术应用于乙醇电催化氧化研究,成功证实了Au电极表面的Au—OH吸附物种是乙醇电催化氧化的真实催化活性位。作者证明电解液中的OH-在氧化电位下能够化学吸附在Au电极表面形成Au—OH,同时乙醇在碱性环境中脱质子化形成醇盐阴离子并吸附在Au电极表面,Au—OH可以实现对吸附乙醇分子的脱氢氧化,并且通过调控反应电位可以精确控制乙醇在Au电极表面的氧化速率,该工作揭示了Au—OH电催化醇氧化的作用机制。另外,研究证明双金属合金可以调控M—OH的生成。例如,Pd用于乙醇电催化氧化已被广泛研究,其中一个重要步骤是通过Pd—OH的氧化作用去除吸附在Pd上的反应中间体Pd—(CH3CO)ads。Lü Hao等[58]通过向Pd中掺杂Ag合成了Pd2Ag1纳米线合金催化剂。该合金催化剂一方面可以提高Pd的利用率,产生更多Pd—OH用于乙醇高效氧化,另外形成的Ag—OH在动力学上可以协同推进乙醇的氧化过程。
目前,对M—OH型活性氧在碱性体系中的研究较为广泛。除碱性反应体系外,Ge Ruixiang等[53]提出在中性电解质中贵金属单原子Ru可以通过促进水分子解离产生Ru—OH活性氧物种,能够增强醇氧化反应的活性。该工作以中性条件下5-羟甲基糠醛(HMF)氧化反应为模型反应,利用Ru1-NiO催化剂上形成的Ru—OH活性氧物种,实现在1.283 V vs.RHE低电位下的反应。另外,中性电解液相比碱性电解液能够抑制反应过程中醛类产物的进一步氧化,成功实现将HMF高选择性氧化为2,5-二甲酰基呋喃(DFF)。
除了对贵金属表面M—OH型活性氧的研究,近期研究人员发现非贵金属催化剂也能够在较低电位下形成M—OH型活性氧。例如,本课题组与段昊泓团队[54]合作制备了一种锰掺杂CoOOH电催化剂,用于苯乙醇和苯乙酮等底物中C(OH)—C键的电化学氧化断裂。研究证明在碱性电解质中苯乙醇和苯乙酮会生成高反应活性的亲核中间体(分别是醇盐和碳负离子),继而被MnCoOOH催化剂表面产生的活性氧(Co—OH)氧化,最终发生C—C键的氧化断裂生成苯甲酸,理论计算也证实了亲核氧化相比于OER反应在能量上更有利。另外,研究发现通过在Co3O4中掺杂单原子Bi取代CoOh3+位点可以促进CoTd2+的氧化,产生Co—OH活性氧[55]。作者通过分波态密度(PDOS)计算结果对Bi-Co3O4中Co—OH形成能降低的原因进行了解释,即Bi-Co3O4具有更低的电荷转移能,使电子更容易从占据的O 2p轨道转移到未占据的Co 3d轨道,使Co—O键共价性增强,降低Co—OH的形成能垒。产生的Co—OH活性氧可以通过直接氧化机制催化甘油等分子中的羟基氧化和C—C键断裂,实现甲酸产物的高选择性制备。
本课题组[60]利用离子刻蚀和磷化法构筑了一种双功能CoNiP一体化电极(CoNiP-NIE),在1 mol/L KOH溶液中加入HMF,在CoNiP-NIE电极上施加1.46 V电压时的电流密度可达20 mA/cm2,析氢速率为41.2 L/(h·m2),2,5-呋喃二甲酸(FDCA)产率为85.5 g/(h·m2)。原位拉曼光谱表征证实,CoNiP在电催化HMF氧化过程中经历了自身氧化为羟基氧化物和原位还原的动态过程,并且证实了M—OH是催化HMF氧化的活性物种。Ni基催化剂是被研究得最为广泛的非贵金属电催化剂,大多数Ni基催化剂的活性层为NiOOH,NiOOH表面存在的羟基活性氧物种能够将甘油的伯醇氧化成相应的羧酸[59]。McGoetz等[57]设计了一种促进间接氧化、抑制直接氧化的机制,使NiOOH上的羟基活性氧物种在较低pH和较低电压下实现了对甘油仲醇的氧化,控制C—C键的裂解和C2、C1产物的生成,得到主产物1,3-二羟基丙酮(DHA)。
1.2 晶格氧类型活性氧(M—O—M)
晶格氧(M—O—M)是构成晶体结构体相的氧,其活性受晶格氧的特定性质及其配位环境的共同影响[52]。M—O—M的反应活性、迁移率和可转移性在有机物氧化中起着重要作用,合理地调节晶格氧的反应活性和迁移率可以调节产物的选择性分布。亲核试剂会在晶格氧的作用下发生质子和电子的转移,晶格氧的可转移性和氧化活性可以通过金属材料与OH-的结合实现循环再生,并且可以通过调节晶格氧的配位环境等策略影响有机物分子的吸附行为。
晶格氧作用于有机物氧化反应的路径之一是催化剂与溶液中的OH-反应脱H形成M—O—M,形成的M—O—M与亲核试剂反应并从亲核试剂上拔氢,再次与溶液中的OH-离子反应形成M—O—M[图2(b)路径一]。ChenWei等[62]以β-Ni(OH)2为模型催化剂,证明了在乙醇电催化氧化反应过程中β-Ni(OH)2催化剂上会形成亲电晶格氧(即Ni—O—Ni活性氧),可以与有机亲核试剂发生反应[β-Ni(OH)2+Nu→β-Ni(OH)O+Nu→β-Ni(OH)2+Nuoxidized]。作者对晶格氧参与有机分子氧化反应机理进行了揭示:首先,β-Ni(OH)2催化剂发生电化学脱氢形成β-Ni(OH)O(表面产生Ni—O—Ni活性氧);其次,有机亲核试剂在β-Ni(OH)O上自发氧化脱氢,同时将质子转移给催化剂实现β-Ni(OH)2的循环再生。此外,作者还通过掺杂Co2+或Mn2+来调节晶格氧的配体环境以降低第一步中β-M0.1Ni0.9(OH)2的脱氢能垒,实现亲核试剂氧化反应(NOR)活性的进一步提升。
晶格氧用于催化有机物氧化还存在另一种反应路径,即亲核试剂在被晶格氧氧化时会夺走晶格氧中的氧形成氧空位,溶液中的OH-回填到氧空位上使催化剂复原[图2(b)路径二]。例如,Chen Yan团队[61]通过向氢氧化镍中掺杂Co促进羟基氧化物形成过程并暴露出更多的晶格氧位点。首先,甘油分子被吸附到晶格氧位点上,羟基质子转移到催化剂表面形成甘油醛,甘油醛被晶格氧第一次进攻后脱氢形成甘油酸酯中间体(*OOC—CHOH—CH2OH);一部分甘油酸酯中间体拔除活性氧的质子形成甘油酸并留下氧空位,另一部分甘油酸酯中间体在活性氧上的吸附构型发生改变,将质子转移到相邻的晶格氧位点,再次或多次被晶格氧氧化成其他C3,C2,C1中间体或产物,产物从晶格中脱除时会在催化剂表面形成氧空位;最后,溶液中的OH-回填到氧空位将催化剂表面复原。
1.3 高价金属表面活性氧[M(Ⅳ)O]
2 反应物吸附过程强化提升反应速率研究
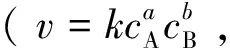
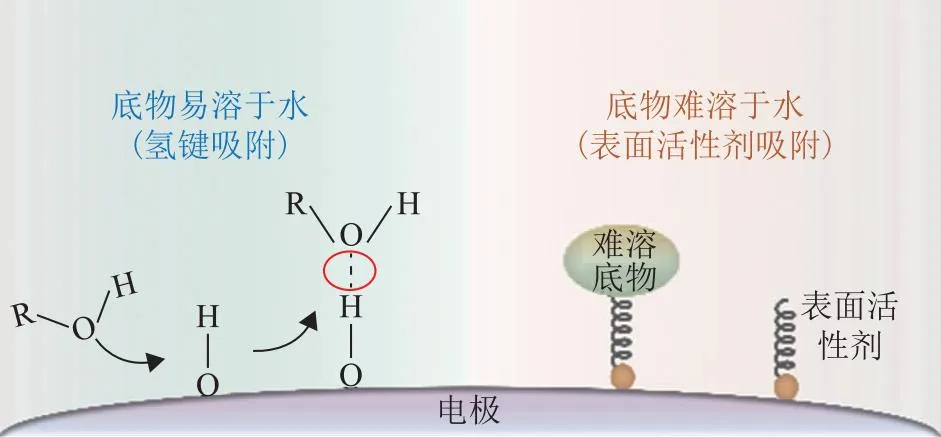
图3 反应底物吸附过程强化机制设计示意
针对易溶醇类反应底物,本课题组与清华大学段昊泓团队合作[67]设计了一种氢氧化镍负载Au纳米颗粒的复合电催化剂(Au/Ni(OH)2),实现了工业大电流下乙二醇/甘油的高选择性氧化制备乙醇酸。Au/Ni(OH)2催化剂在0.95 V vs.RHE时催化甘油氧化的电流密度达到317.7 mA/cm2,是纯Au的3.4倍(92.3 mA/cm2);在1.15 V vs.RHE时催化乙二醇氧化的电流密度达326.2 mA/cm2,是纯Au的两倍以上(149.8 mA/cm2)。系列原位表征及理论计算证实甘油和乙二醇分子(以醇盐形式存在)上的孤对电子能够与Au的6p轨道形成σ键,同时邻位羟基与Ni(OH)2表面羟基形成氢键,由此强化了界面处甘油/乙二醇分子的吸附作用,使醇分子吸附富集在Au—Ni(OH)2界面处;另外,在电场作用下,电解液中的OH-在Au表面被活化为Au—OH,实现对吸附态甘油/乙二醇的选择性氧化。
对于难溶于水的底物,如酮类物质等,虽然可以通过高速搅拌促进传质过程,但这种方式会增加设备投入成本,并且性能提升效果有限;通过对催化剂进行表面亲油改性来强化底物分子与催化剂表面的接触是解决难溶底物传质问题的有效策略之一。例如,本课题组与清华大学段昊泓团队合作[69],以单层反平行的方式将表面活性剂十二烷基磺酸钠(SDS)原位插层到Ni(OH)2催化剂层间,利用SDS和难溶底物分子间的亲和作用,成功将环己酮氧化为己二酸,反应速率相比单纯Ni(OH)2催化剂时提高了3.6倍,并且法拉第效率从56%提高到93%。结构表征结果发现插层SDS后的Ni(OH)2的层间距为2.9 nm,远大于环己酮分子大小(0.6 nm),为环己酮的吸附富集提供了空间。另外通过系列电化学原位试验和分子动力学模拟等证实了Ni(OH)2层间的SDS能够强化对环己酮分子的吸附,提高催化剂附近局部的环己酮浓度[即增加了Ni(OH)2与环己酮分子的有效接触],从而大幅提高了反应速率。
3 电解水制氢耦合氧化系统的放大设计
从实验室到工厂,反应环境的放大并非线性,将催化剂进行放大制备、开发设计新型电化学反应器是实现电解水制氢耦合有机物氧化工业化应用的必由之路。连续自动化制备工艺可以保证催化剂物理化学性质的均一和电化学性能的可控;而对于电解反应器的设计,细化到不同电极、电解液、隔膜的选用和匹配均会影响整体电催化性能(包括反应速率、产物选择性、反应能耗等)[70-73]。另外,电解器件性能优化中的一个重要环节是对产物的分离纯化和收集,为了降低能耗要考虑对能量的合理利用,包括对电力消耗的考量、焦耳热的影响、对高盐废水的利用等。
首先,实现电解水制氢与有机物氧化的真正耦合需要解决阴/阳极之间电势匹配的问题,否则就会导致电能的大量消耗。近期,本课题组[60]依据Nernst方程,通过改变电解质的pH进而灵活地调整阴/阳极两个半反应的过电位,成功设计了一种阳极(碱性)和阴极(酸性)不对称的流动式电解槽。通过将碱室(pH=14)甘油氧化与酸室(pH=0)产氢耦合,可将电解水的理论电压降低到0.401 V。将所设计的不对称电解池用于废甘油电催化氧化,成功将1 kg预处理后的废油转化为905.8 g生物柴油,674.6 g甲酸盐和27.3 g氢气;随后,通过中和结晶进一步得到高价值二甲酸钾(KDF,产率达到72.8%)。另外,本课题组与清华大学段昊泓团队合作[74]设计了一种零间隙膜电极组件(MEA)流动反应器来降低欧姆损耗的影响,成功将聚对苯二甲酸乙二醇酯(PET)塑料转化为甲酸盐耦合阴极产氢。经济技术分析的评估结果显示,在MEA电解池中1.8 V电压下电流密度达到500 mA/cm2,阳极产物甲酸的选择性大于80%。
在实际的生产过程中,除了考虑电解效率问题,还要考虑催化剂的耐久性。贵金属基催化剂对于电催化有机物氧化具有较高的催化活性,但贵金属自身容易被氧化导致失活。例如,Au基催化剂对于醇氧化具有优异的性能,但在反应过程中Au易被氧化成AuOx导致催化剂失活[75]。而在开路电压下,醇分子自身的还原性可将AuOx还原为Au。基于此,开发了一种间歇性电压输入(IP)策略使Au基催化剂能在250~400 mA/cm2电流密度下持续反应24 h,100~170 mA/cm2电流密度下稳定运行108 h。与常规的恒电压(CP)策略相比,使用IP策略能够使醇氧化速率和产氢速率分别提升10倍和9倍,并且在300 mA/cm2的电流密度下能耗降低了33%。在流动电解槽中,工况条件下对该策略的可行性进行了评价,结果显示利用IP策略,Au基电极可以在大电流下实现长时间稳定运行(在2.0 V槽电压下的绝对电流值高达4.8 A)。
4 结论与展望
利用可再生能源驱动的电解水制氢耦合有机物氧化是实现电解水制氢“提效降本”的有效途径之一,有望成为“双碳”目标下绿氢高效制备和化学化工绿色合成的重要发展方向。与传统电解水制氢相比,在阳极利用有机物氧化替代析氧反应可以降低整体电解水反应电压,降低能耗并提高阴极产氢速率,另外阳极耦合有机物氧化还为整个工艺流程提供了联产高附加值化学品的机会(能够进一步分摊并降低制氢成本)。近年来,对于电解水制氢耦合氧化的研究呈逐年递增的趋势,氧化产品也呈现出多样化态势。然而,该研究领域目前仍处于初始和基础研究阶段,尚未有工业化应用案例报道。电催化剂的合理制备、电解槽的创新设计和适合的电解策略等依然是该领域面临的挑战。结合当前电解水制氢耦合有机物氧化的发展趋势,从以下几个方向进行展望:
(1)虽然前人对电解水过程中阳极水活化产生活性氧的种类有了一定了解,但对于不同种类活性氧能量、寿命、离域性的判定尚待研究,另外如何实现活性氧与有机物氧化的匹配,实现产物高选择性仍是该领域面临的重大挑战之一。先进电化学原位/在线表征技术的开发[如原位电镜、拉曼光谱、红外光谱、X射线精细结构(EXAFS)、电子自旋共振谱(EPR)]是解决该关键问题的必要手段,可以实现对电解水过程中阳极催化剂表面活性氧种类和浓度进行原位监控;同时需要进一步结合密度泛函理论(DFT)模拟计算,从多个维度(时间、空间、电位等因素)研究活性氧在不同催化剂上的产生规律,以及对活性氧以及反应物、中间产物、目标产物分子的能级进行模拟,理论上实现电极表面活性氧与有机反应物和系列中间产物氧化反应能级的匹配。
(2)催化剂表面如表面结构、活性组分、反应活性位点等在整个电催化过程中不断变化,对单个氧化或还原反应的真正活性位点进行检测尚有难度,对氧化还原整个体系的原位检测更具挑战性。高效的催化剂是提升高值化学品选择性和产率的关键,在电催化剂设计时应考虑满足低成本、稳定性强、催化活性高的实用性要求,在对催化剂进行评价时,关注关键反应中间体的识别,评估催化剂和反应中间体的结合强度,调整催化剂设计以控制反应活性和选择性。此外,还需要发展自动连续化的生产工艺以实现催化剂到电极的均匀放大制备。
(3)合理地设计电解槽结构不仅可以提高所需化学品的产量,还可以实现在两个电极上同时产生高值化学品并对其进行分离(如选择性膜的设备)与检测。此外,当前电催化反应大多发生在水溶液中,反应体系受限,因此,有必要扩大溶剂的种类将其推广到其他更多的反应体系以满足工业化需求。利用外场辅助实现对反应过程的强化、促进传质将成为电解水制氢耦合氧化领域中的重要分支。
