度伐利尤单抗致糖尿病酮症酸中毒1例并文献复习
2024-01-22范晓慧刘中秋常德玉刘建芳
范晓慧,刘中秋,徐 丽,常德玉,赵 琳,刘建芳*
0 引言
度伐利尤单抗是人免疫球蛋白G1kappa (lgG1k)单克隆抗体,可靶向结合程序性死亡受体配体1(Programmed death ligand-1,PD-L1),并阻断PD-L1与程序性死亡受体1 (Programmed death-1,PD-1)和抗原分化簇80(CD80)的相互作用[1],激活和恢复效应T细胞的功能,特异性杀伤肿瘤细胞。2018年2月,FDA批准其用于治疗尿路上皮癌、不可切除的Ⅲ期非小细胞肺癌和广泛期小细胞肺癌。2019年12月,NMPA批准其用于不可切除的Ⅲ期非小细胞肺癌和广泛期小细胞肺癌的治疗。然而,过度激活的免疫细胞也可能攻击正常组织和器官,导致全身各个系统的自身免疫损伤,称为免疫相关不良事件(Immune-related adverse events,irAEs),最常发生于胃肠道、肝脏、皮肤和内分泌系统[2]。免疫相关内分泌毒性主要包括甲状腺功能异常和急性垂体炎,以及较为罕见的1型糖尿病等,不仅影响患者预后,严重者还会危及生命。本文报道1例患者使用度伐利尤单抗后引起糖尿病酮症酸中毒(DKA)的不良反应,结合文献分析度伐利尤单抗导致DKA的发生机制、临床表现、危险因素及治疗预后,以期为临床合理用药提供参考。
1 病例资料
患者,男,76岁,2022年9月15日无明显诱因出现胸痛、胸闷,急诊入院行胸腹部CT检查,结果显示,左肺上叶占位并阻塞性炎症,左肺门及纵隔多发肿大淋巴结,肝多发低密度灶,考虑肺恶性肿瘤并淋巴结转移、肝脏多发转移。行电子支气管镜活检明确诊断为“小细胞肺癌广泛期”。2022年9月25日,患者家属因拒绝化疗,行度伐利尤单抗1 000 mg免疫治疗;2022年10月17日,给予度伐利尤单抗1 000 mg+顺铂30 mg d1-3+依托泊苷0.1 g d1-5 联合方案治疗,本次治疗后患者出现IV度粒细胞缺乏伴发热;2022年11月17日、2022年12月11日、2023年1月13日,给予度伐利尤单抗1 000 mg单药治疗。患者住院期间多次出现心率、血压下降,呼之不应,意识丧失,每次持续约5~10 min自行缓解,考虑与副肿瘤综合征相关。患者既往心脏冠脉支架术后,长期服用硫酸氢氯吡格雷、瑞舒伐他汀、尼可地尔等治疗,否认糖尿病史。2023年1月30日,患者自觉乏力、胸闷、全身不适入院。
入院后,完善相关检查,中性粒细胞6.36×109/L,血红蛋白127 g/L,C反应蛋白16.5 mg/L,纤维蛋白原4.62 g/L,钾6.28 mmol/L,钠126 mmol/L,氯93 mmol/L,尿素氮10.39 mmol/L,血糖31.69 mmol/L,pH 7.087,二氧化碳分压19.7 mmHg,碳酸氢盐5.9 mmol/L,血酮体阳性,其他内分泌相关检验见表1。目前患者一般情况差,诉乏力,间断恶心、胃部不适,临床诊断为DKA,暂停免疫治疗,立即给予患者泵入胰岛素50 IU,同时给予患者心电监护,氧气吸入,补液、补钠、补碱等对症治疗,患者各项指标逐渐恢复正常。2023年2月12日,患者血酮体转阴性。2023年2月15日,调整胰岛素治疗:赖脯胰岛素早、中、晚3 IU皮下注射,睡前加用甘精胰岛素12 IU皮下注射,空腹血糖控制在3.9~11.7 mmol/L,餐后2 h血糖控制在9.4~21.5 mmol/L。发生DKA后,患者血pH、碳酸氢盐变化见图1;度伐利尤单抗治疗期间患者血糖、糖化血清蛋白变化见图2。
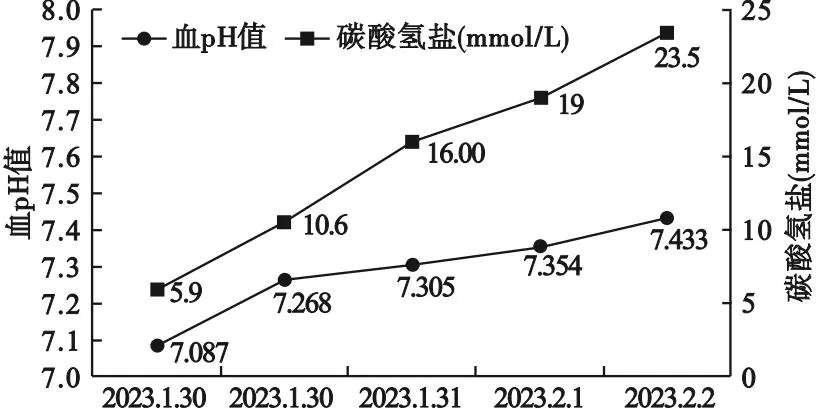
图1 发生DKA后患者血pH值、碳酸氢盐变化
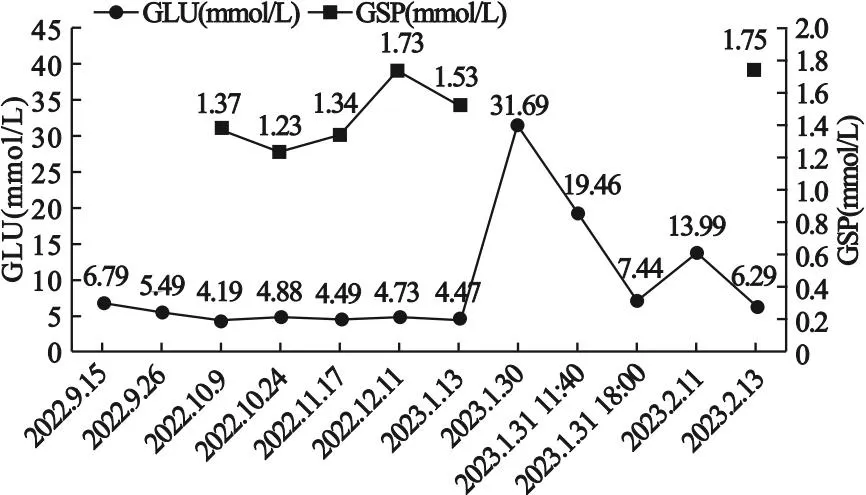
图2 度伐利尤单抗治疗期间患者血糖(GLU)、糖化血清蛋白(GSP)变化
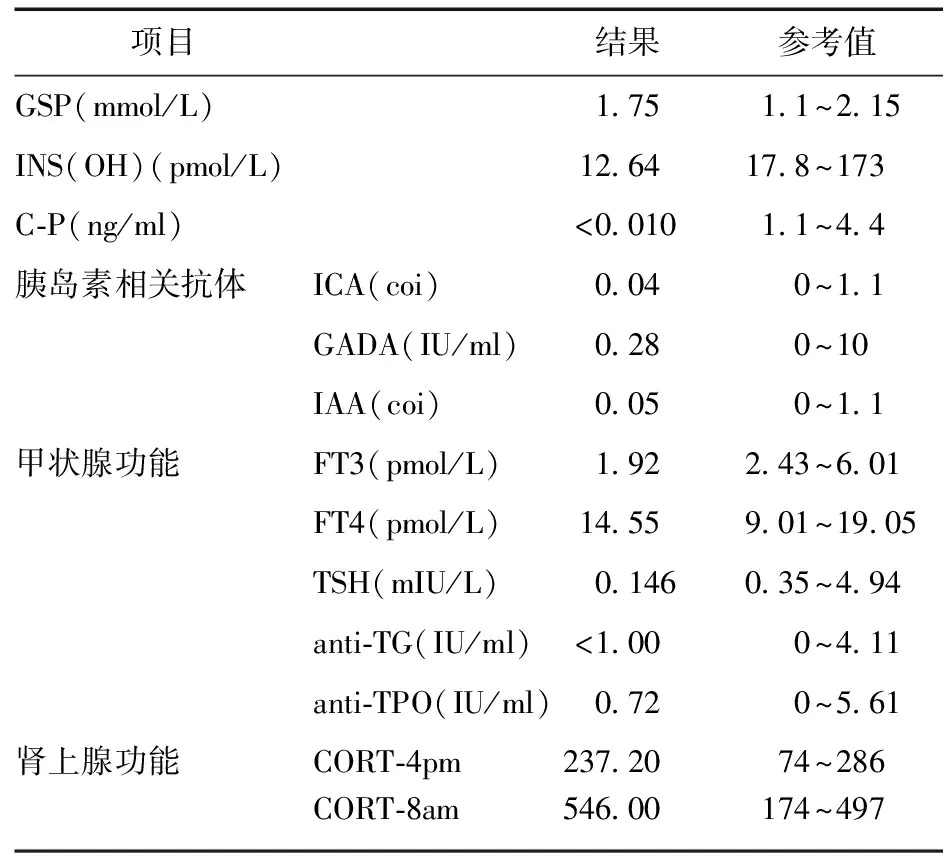
表1 其他内分泌相关检验结果
2 讨论
2.1 度伐利尤单抗导致DKA关联性评价 根据《药品不良反应报告和监测管理办法》中因果判定关联性评价标准,①患者否认既往糖尿病病史,使用度伐利尤单抗前血糖正常,使用度伐利尤单抗5个周期后出现DKA,有时间相关性;②度伐利尤单抗说明书中提示可能导致伴有DKA 1型糖尿病的不良反应,属于已知的不良反应;③患者治疗期间仅进行过1周期依托泊苷+顺铂的化疗,并且依托泊苷和顺铂说明书中未记载可致DKA不良反应;④停用度伐利尤单抗,经胰岛素治疗后,患者乏力、胸闷症状缓解,血糖水平得到改善。评价度伐利尤单抗导致DKA关联性评价结果为很可能。同时,使用诺氏评估量表对药物不良反应关联性进行评价[3],评分为7分,度伐利尤单抗导致DKA关联性评价为很可能。
2.2 免疫检查点抑制剂致糖尿病的机制 免疫检查点抑制剂相关糖尿病(Immune checkpoint inhibitor-induced diabetes mellitus,ICI-DM)是使用免疫检查点抑制剂(Immune checkpoint inhibitor,ICI)后出现的一种罕见但影响较为显著的不良反应[4]。其发生的主要机制与效应T细胞过度激活有关:PD-L1在B细胞中表达,而PD-1在T细胞中表达,PD-1/PD-L1抑制剂通过阻断PD-1通路激活T细胞,产生导致B细胞死亡的细胞因子,破坏胰岛B细胞,从而导致ICI-DM发生[5]。尽管PD-1和PD-L1抗体作用于同一途径,但在机制上存在差异,导致临床特点不同。在非肥胖糖尿病小鼠中,与PD-1抑制剂相比,PD-L1抑制剂导致糖尿病发生率更高[6]。ICI-DM发生机制与ICI抗肿瘤机制相同,因此,在使用PD-1/ PD-L1抑制剂过程中很难避免ICI-DM的发生。
2.3 免疫检查点抑制剂致糖尿病的流行病学及临床特点 ICI-DM发生率较低,在随机临床研究中报道为1%[7];在Antonia等[8]的研究中仅有1例患者在使用度伐利尤单抗后发生3级免疫介导的1型糖尿病(<0.1%,1/1 889)。
有报道,ICI-DM中位发病年龄为66岁,一般发生在治疗后1周~12个月,中位时间为8.5周,中位血糖为530 mg/dl[9]。ICI-DM发病突然,发展迅速[10],诊断时通常以严重急性临床表现为特征,76%的病例在最初临床表现时即发生DKA。其中,38.9%为严重DKA,20.4%为中度DKA,11.1%为轻度DKA[7],且伴发的高血糖更严重[4,10],血糖可高达1 000 mg/dl,而糖化血红蛋白(HbA1c)水平通常仅轻度升高(7.6%~8.0%)[7]。ICI-DM和经典T1DM均会导致C-肽水平降低和胰腺体积减小,然而,在ICI-DM早期发作时,C-肽水平即降至无法检测的水平[11]。部分患者在发病时胰腺脂肪酶水平升高[11],伴随着胰腺体积减小,提示胰腺外分泌功能也同时出现问题,可能在一部分ICI-DM的发病中发挥作用。90%以上的经典T1DM患者至少有1种胰岛自身抗体阳性,包括抗胰岛素细胞抗体(ICA)、血清抗谷氨酰胺脱羧酶抗体(GADA)、抗胰岛素抗体(IAA)、锌转运体8(ZnT8),然而,ICI-DM患者中只有49%对胰岛自身抗体呈阳性,其中GADA阳性占45%[12-13];由于ICI-DM发病迅速,胰岛自身抗体可能产生于irAE发生后,但在诊断为ICI-DM后1~32个月的延长随访中,部分患者胰岛自身抗体仍为阴性[12]。
本患者在度伐利尤单抗治疗4个月后出现严重DKA,血糖突然升高至31.69 mmol/L,C-肽降至不可测水平,而进行相关治疗后,糖化血清蛋白、ICA、GADA、IAA仍为阴性,提示患者出现显著高血糖的时间很短。该患者未监测脂肪酶等指标,无法确定胰腺是否损伤。
2.4 免疫检查点抑制剂致糖尿病的高危因素 Singh等[14]报道了1例患者一线使用度伐利尤单抗和曲美木单抗出现甲状腺功能减退,二线换用伊匹木单抗和纳武利尤单抗后出现DKA;1例2型糖尿病患者在接受ICI治疗后出现DKA和高血糖昏迷[15]。由此可见,先前出现免疫相关内分泌毒性和存在内分泌功能障碍的患者,在使用ICI后患糖尿病的风险更高。一项Meta研究显示,胰岛抗体阳性患者比胰岛抗体阴性患者发生糖尿病的时间更短(55 dvs.117 d,P=0.005),DKA的发生率也更高(86%vs.60%,P=0.02)[7];ICI-DM也可能与人类白细胞抗原(Human leukocyte antigen,HLA)相关,一项回顾性研究显示,76%的ICI-DM患者携带易感基因HLADR4[11]。因此,既往内分泌病史、胰岛自身抗体阳性和携带易感HLA基因型可能是ICI-DM发展的潜在危险因素。然而,由于临床很少检测胰岛自身抗体和HLA基因型,其作为糖尿病预测生物标志物的有效性和经济效益需要在未来的研究中进行更多的验证。
同一患者可同时或依次发生多个内分泌不良事件,Mengíbar等[1]报道,1例患者既往存在亚临床甲状腺功能亢进,使用度伐利尤单抗后2周出现DKA,2周后出现甲状腺功能减退;有个别患者使用度伐利尤单抗出现DKA后,又分别发生甲状腺功能减退和甲状腺炎[16-17];本例患者在发生DKA同时,出现FT3、TSH降低,后期发生甲状腺功能异常的风险较高,需继续监测患者甲状腺功能指标变化。
2.5 免疫检查点抑制剂致糖尿病的管理 与大多数irAEs不同,ICI-DM对胰岛B细胞功能的损害是不可逆的,并不能通过高剂量糖皮质激素改善[2],相反全身糖皮质激素的使用可能会恶化血糖控制,导致患者出现胰岛素抵抗[2,18]。根据专家共识[19]、CSCO指南[20],患者如果无症状或症状轻微、不伴DKA,可继续使用ICI,同时开始胰岛素治疗;对伴有DKA者暂停ICI治疗,并请内分泌科会诊,按照机构指南行DKA管理。本病例报告以DKA起病,发病突然迅速,暂停度伐利尤单抗,经过对症治疗后患者症状好转,但是患者胰岛功能损伤不可逆,需长期胰岛素治疗,临床药师对患者进行了饮食、生活方式以及血糖监测等方面的宣教,ICI重启问题需根据患者病情,由肿瘤专家、内分泌专家共同讨论。
2.6 免疫检查点抑制剂的药学监护 ICI治疗前筛查患者自身免疫功能障碍的危险因素,包括个人或家族性自身免疫性疾病史,对于具有明显自身免疫背景的患者,应准确评估抗肿瘤免疫治疗的风险-收益平衡[1,21]。在免疫治疗前和治疗过程中应监测HbA1c水平,由于ICI-DM大多发生于免疫治疗的3个月内,因此,治疗开始后应每周监测血糖水平;对于高危人群应增加监测频率,治疗结束后,每3~6周监测1次[17]。由于血糖和HbA1c在发病前可表现为正常,建议有条件者可进行胰岛自身抗体和HLA基因型检测,及早发现高危患者。除此之外,加强对患者宣教,告知ICI-DM临床症状并嘱其居家密切监测,若出现异常及时就医;加强医务人员对ICI-DM的认识,提高辨别、干预的能力。在使用ICI治疗后,可能同时或相继发生多种内分泌疾病,因此,对于易发生ICI-DM的患者,应持续监测是否存在其他irAEs。
3 小结
度伐利尤单抗导致的免疫相关性糖尿病总体发病率不高,但发病迅速。发病前期无特异性临床表现,发病时即出现酮症酸中毒,定期的临床特征评估和实验室检查有助于早期发现免疫相关性糖尿病。临床药师应加强对其认识,加强对患者的用药教育,保障患者用药安全。
