208例非瓣膜性心房颤动患者消化道出血后重启抗凝用药分析
2024-01-22孟竹青文海菠
孟竹青,王 宇,文海菠,熊 川
0 引言
心房颤动是一种发病率较高的室上性快速性心律失常,截至2019年,全球房颤患者约有5 970万例,以非瓣膜性心房颤动(Non-valvular atrial fibrillation,NVAF)为主[1]。NVAF发作时伴有不协调的心房电激动,这种心房无效收缩与心源性血栓形成相关,可使缺血性卒中风险增加4~5倍,并导致近20%的致死率及近60%的致残率,因此抗凝是至关重要的治疗策略[2]。与此同时,抗凝也带来了不容忽视的出血风险,每年约有2%~5%的患者在抗凝期间出现大出血,小出血事件则更多,其中消化道出血(Gastrointestinal bleeding,GIB)最常见[3-5]。GIB不属于关键部位出血[4],研究表明,GIB停止后恢复抗凝可降低死亡率并减轻医疗负担,且并不增加复发性消化道大出血风险[6]。因此,国内外指南及专家共识[1-5,7]均强调了房颤患者GIB后重新开始抗凝的必要性和重要性,建议一旦出血得到控制,就应尽快考虑恢复抗凝。尽管如此,国外文献报道,真实世界中抗凝通常不会重启,大约50%房颤患者在GIB后放弃抗凝[8-11]。国内目前尚无相关资料。本研究首次调查了NVAF患者GIB后抗凝情况,旨在了解我院抗凝重启率,并对重启抗凝中存在的不合理问题进行分析讨论。
1 研究对象及方法
1.1 研究对象 以绵阳富临医院心血管内科2020年3月至2023年3月抗凝期间发生GIB事件后停止抗凝的NVAF住院患者为研究对象,出血控制后筛选其中有明确抗凝指征的患者,同时无明显抗凝禁忌或抗凝临床获益不明等情况[2-5]。排除标准:①不符合CHA2DS2-VASC男性≥2分或女性≥3分;②因心肌炎、心包炎、甲状腺功能亢进等导致的暂时性房颤;③不适宜长期规范抗凝,如合并严重血小板减少(血小板数量<50×109/L)、血友病等;④合并抗凝药禁忌或抗凝临床获益不明,如近期大手术、其他活动性出血疾病、严重肝功能不全(Child-Pugh分级C级)、慢性肾脏病5期及透析等;⑤死亡病例、孕妇、年龄小于18岁的未成年人及随访失联患者。共253例患者入组本研究,排除不符合条件者,最终纳入208例。
1.2 研究方法
1.2.1 调查患者基本资料 收集患者基本资料,由于GIB后重启抗凝通常在2周内,故按照患者2周内是否恢复抗凝分为重启抗凝组及非重启组,分析并比较两组患者的年龄、性别、嗜酒(≥8个饮酒量/周)、房颤类型、既往出血史等指标。
1.2.2 分析出血事件 首先根据2020年美国心脏病学学会抗凝出血管理专家共识[3]中的出血分级标准,将本研究中GIB患者出血事件分为大出血及非大出血。大出血:至少满足以下其中1项:①关键部位出血;②血流动力学不稳定;③血红蛋白下降≥2 g/dl或需要输注≥2个单位浓缩红细胞的明显出血。非大出血:大出血以外的其他出血事件。血流动力学不稳定[3]:心率增快;收缩压<90 mmHg或下降>40 mmHg或体位性血压变化(站立时收缩压下降≥20 mmHg或舒张压下降≥10 mmHg),或平均动脉压<65 mmHg;器官灌注不足,如尿量<0.5 ml/(kg·h)。然后调查出血因素:收集分析出血原因并观察是否被积极纠正。
1.2.3 血栓/出血风险 CHA2DS2-VASC评分[12]:充血性心衰/左心室功能障碍、高血压、糖尿病、血管疾病及女性各占1分,卒中2分,年龄65~74岁1分、≥75岁2分,总分9分,其中男性≥2分或女性≥3分视为有明确抗凝指征。HAS-BLED评分[1]:未控制的高血压、肝功能异常、肾功能异常、脑卒中、出血、国际标准化比值(International normalized ratio,INR)不稳定、65岁以上、使用抗凝药物及酗酒各1分,共9分。0~2分为出血低危,≥3分为出血高危[13]。本研究均纳入有明确抗凝指征患者,然后统计并比较CHA2DS2-VASC<5分与≥5分组(CHA2DS2-VASC是房颤卒中风险评估重要工具,<5分年卒中风险在5%内,≥5分年卒中风险上升至6.7%~15.2%[12])、HAS-BLED出血低危组与高危组重启抗凝率,观察重启抗凝率与CHA2DS2-VASC/HAS-BLED评分是否存在相关性。
1.2.4 观察重启用药方案 记录并汇总重启抗凝药物选择、用法用量,并评价用药合理性。
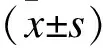
2 结果
2.1 患者基本资料 共选取208例GIB事件后停止抗凝的NVAF住院患者,男性95例(45.7%),女性113例(54.3%);年龄24~90岁,平均(71.6±15.4)岁。按照抗凝重启情况将208例分为2组,重启组51例(24.5%),非重启组157例(75.5%)。抗凝重启组较非重启组平均年龄更小(P<0.01),重启组患者主要为18~64岁青中年(62.7%),≥85岁高龄人群最少(3.9%);非重启组嗜酒率高于重启组(P<0.05);所有房颤类型中阵发性NVAF重启率最低(2/13,15.4%),永久性NVAF次之(27/126,21.4%),持续性NVAF最高(22/69,31.9%);非重启组与更高的既往出血史相关(P<0.05),见表1。
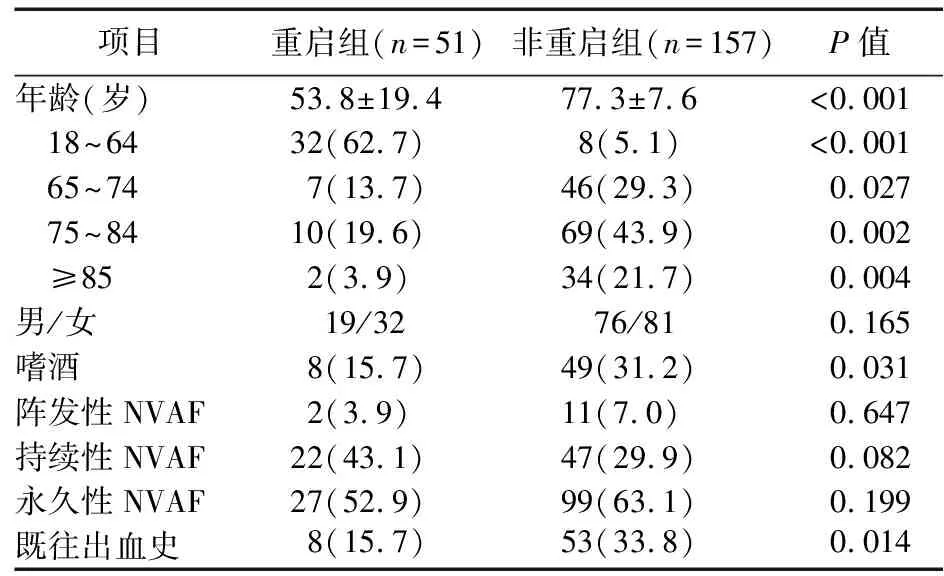
表1 208例NVAF合并GIB住院患者基础资料[例(%)]
2.2 GIB事件分析
2.2.1 出血类型 208例GIB事件以非大出血为主(165/208,79.3%),少数患者发生大出血;非大出血组重启率高于大出血组(28.5%vs.9.3%,P<0.01)。见表2。虽然临床对非大出血人群重启抗凝积极性更高,但对继续抗凝仍保持谨慎态度。其中,有9例患者因单纯一过性黑便、痔疮小出血等不需特殊医疗处理的滋扰性出血(Nuisance bleeding,NB)事件停药且放弃继续抗凝,主要原因在于患者害怕再出血不愿继续抗凝。

表2 208例NVAF患者GIB事件分类[例(%)]
2.2.2 出血因素分析 共追溯到53项GIB事件的可能诱因。合并幽门螺杆菌感染、胃溃疡、慢性胃炎等基础疾病是首要原因(35.8%);近期抗凝方案调整及合并用药变化各占13.2%,如停用华法林后未监测INR直接转换为新型口服抗凝药物(New oral anticoagulants,NOACs),肝素类药物与口服抗凝药桥接不规范,近期抗凝药物种类/剂量调整或因治疗需要联用抗血小板/非甾体抗炎药/糖皮质激素等。另外,患者依从性不佳也是重要的影响因素,表现为擅自改变用药间隔或剂量、未遵医嘱定期监测INR、漏服后补服双倍剂量、重复服药等,见表3。其中,仅有不到半数(25/53,47.2%)出血危险因素被积极纠正/消除。
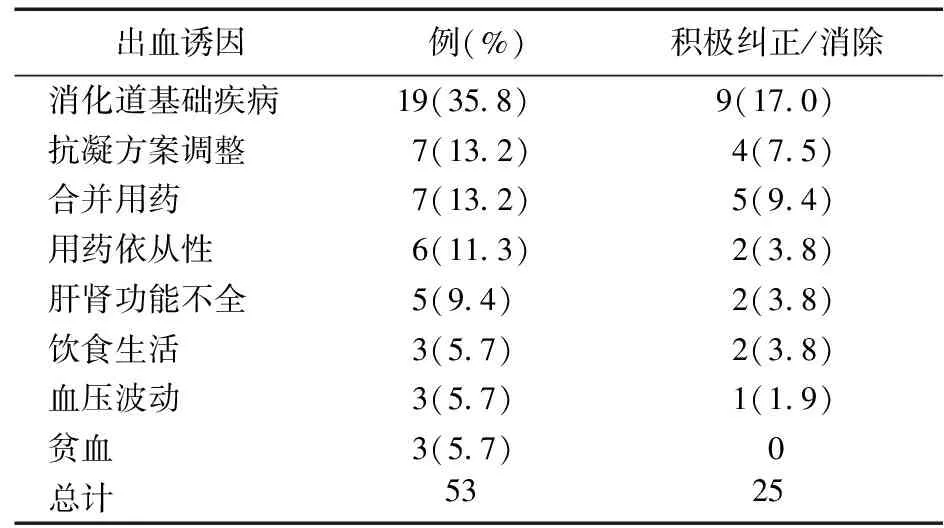
表3 53项出血可能诱因统计情况[例(%)]
2.3 缺血/出血风险与抗凝重启 208例患者中CHA2DS2-VASC<5分85例(40.9%)、≥5分123例(59.1%),HAS-BLED≥3分出血高危患者149例(71.6%),以上提示患者总体缺血/出血风险均较高。CHA2DS2-VASC<5分与≥5分两组抗凝重启率相当(22.4%vs.26.0%,P>0.05),显示缺血风险似乎并不是临床对重启抗凝重要考虑因素,而HAS-BLED出血低危组重启率高于高危组(40.7%vs.18.1%,P<0.01),提示在临床实践中出血风险可能是决定重启策略更重要的影响因素。然而,抗凝适应证应当取决于栓塞风险而非出血风险[1],CHA2DS2-VASC≥5分组在出血低危时半数以上没有重启用药,出血高危时非重启率超过80%。见表4。

表4 CHA2DS2-VASC/HAS-BLED评分情况[总例数(重启/非重启)]
2.4 重启药物方案 51例重启患者中,35例选用利伐沙班(68.6%),11例选用达比加群酯(21.6%),仅5例选用华法林(9.8%),大多数患者重新使用出血前服用的抗凝药,部分既往服用华法林的患者在GIB事件后换用NOACs。除1例合并肺栓塞患者采用常规剂量20 mg外,利伐沙班组绝大多数[34/35(97.1%)]患者选用低剂量方案(≤15 mg qd),其中3例采用<10 mg qd超低剂量;达比加群酯组全部选用110 mg bid。见表5。

表5 51例重启抗凝用药方案
3 讨论
GIB后重启抗凝是临床极具挑战性的高难度工作之一,GIB事件后应当重新抗凝,因为重启抗凝的卒中及死亡风险更低[5-6,8-11]。国外相关报道中,GIB后重启抗凝率约为40%~50%[9-10],本研究中重启率为24.5%,较国外数据低,可能与医疗环境及资源、医患关系、公众对房颤抗凝缺乏认知等多种复杂因素相关[14]。本研究显示,高龄、酗酒及既往出血史均与出血事件后不再重启抗凝相关,这些特征被广泛认为是出血增强因素[1],提示高出血风险可能是重启抗凝时的主要顾虑因素。本研究中,重启率随HAS-BLED评分升高而降低,而CHA2DS2-VASC评分可能不影响重启率,这与国外相关观察性研究结论相似[5],进一步证实了抗凝重启可能存在因担忧出血风险而忽略卒中风险的问题,这会严重影响重启抗凝积极性。本研究显示,无论出血事件严重程度如何,临床始终对继续抗凝保持谨慎态度,甚至对滋扰性出血患者也放弃抗凝。滋扰性出血与未来大出血或严重出血风险无关,不应导致抗凝策略改变[15],部分患者不愿配合是滋扰性出血后停药主要原因。出血风险是提醒加强对出血并发症的预防及监测,而不应被认为是抗凝禁忌证,因此,分析及纠正可能的出血因素是关键[13]。本研究显示,消化道基础疾病、抗凝方案调整、合并用药变化是GIB发生的主要原因,消化道基础疾病可能难以被完全纠正,但精细化的抗凝管理应当被积极推进,以减少不必要的GIB事件,如在进行药物转换/桥接时,应充分考虑药代动力学特征,谨慎处理合并药物及生活饮食变化,肝肾功能不全者应严密监测,并根据器官损害进展及时调整药物剂量或品种。尽量消除或纠正追踪到的出血因素是重点,而临床对出血原因的管控缺乏积极性,对部分可逆因素也未给予纠正或消除,这可能也间接导致了GIB事件后不再抗凝。
关于重启用药方案,指南未明确推荐。临床实践中通常不会选用华法林,因其引发消化道出血风险高于NOACs[16-17]。本研究中,绝大多数患者重新开始抗凝时选用低剂量NOACs,可能是希望通过降低药物剂量规避一定出血风险。荟萃分析显示,10 mg/15 mg利伐沙班在亚洲人中预防房颤卒中具有较好的有效性及安全性,故重启抗凝给予10 mg/15 mg利伐沙班可能是适宜的[18]。但低于10 mg/d的利伐沙班对房颤抗凝尚缺乏相应循证证据,这种超低剂量可能导致预防卒中效果欠佳,故不建议选用。而根据达比加群酯临床应用专家建议[19],110 mg达比加群酯的疗效不劣于华法林,而且大出血和致命性出血的发生率更低,故可能更适用于GIB后重启抗凝患者。除减量策略外,换用其他抗凝药物也是一种减少出血的治疗方案,如NVAF患者换用NOACs、胃肠道出血风险高的患者考虑选择阿哌沙班、艾多沙班或低剂量达比加群酯,肾功能不全的患者给予Xa 因子抑制剂/华法林,肝功能Child-Pugh B级的患者慎重选择阿哌沙班、达比加群和艾多沙班等[1,13]。重启抗凝后应寻求可能的监测方法,以了解抗凝情况,在一定程度上防止出血的再次发生。2022年抗栓出血诊疗专家共识[4]推荐使用凝血酶时间(Thrombin time,TT)/活化部分凝血活酶时间(Activated partial thromboplastin time,APTT)对达比加群进行定性评估,TT正常可排除高水平达比加群,APTT>2倍正常值上限(Upper limits of normal,ULN)提示出血风险增高,定量检测稀释凝血酶时间(Dilute thrombin time,DTT)及蝮蛇毒凝血时间(Ecarin clotting time,ECT)是更可靠的方式,DTT>200 ng/ml或ECT>3倍ULN时,应引起高度重视,警惕出血反应。此外,利伐沙班与凝血酶原时间(Prothrombin time,PT)存在较好的相关性,可以考虑使用PT观察其抗凝效果,但最好的监测方法是测定抗Xa因子活性[20-21]。
综上,我院NVAF患者GIB事件后存在重启抗凝率低、过于关注再出血风险而忽视卒中风险、不重视纠正出血危险因素、部分重启药物剂量不适宜等问题。近年研究显示,药师参与临床用药的模式能够极大提高抗凝综合管理质量[22]。Yao等[23]的研究表明,全程系统化药学服务可通过协助医生处理出血事件、提供抗凝用药建议、整合个体化用药方案、对患者实施全面的用药指导及监护等方式,减轻医患对出血的担心、增进医患沟通及信任、提高患者用药依从性。本研究团队已启动相关研究,将药学服务嵌入GIB事件后抗凝治疗管理,针对前述发现的问题与临床紧密协作,探讨药学服务能否在一定程度上提高GIB后抗凝药物合理安全应用。最后,出血事件后重启抗凝可能是一个广泛存在的临床问题,应引起关注。
