基于FAERS数据库的奈玛特韦/利托那韦片不良事件信号挖掘与分析
2024-01-22苏昊凡战寒秋
苏昊凡,战寒秋
0 引言
奈玛特韦/利托那韦片组合包装是辉瑞公司研发的口服小分子新型冠状病毒感染(COVID-19)治疗药物。其中奈玛特韦作为核心成分,抑制严重急性呼吸综合征冠状病毒2(Severe acute respiratory syndrome coronavirus2,SARS-CoV-2)3CL蛋白酶,阻止病毒复制;而利托那韦抑制奈玛特韦代谢,提高奈玛特韦的血药浓度,增强其抗病毒活性。
2021年12月,美国食品药品监督管理局(Food and Drug Administration,FDA)批准奈玛特韦/利托那韦片在成人和儿童患者(年龄≥12岁,体重≥40 kg)中紧急使用,用于治疗有进展为重症高风险因素的轻至中度COVID-19[1]。2022年2月,国家药品监督管理局按照药品特别审批程序,附条件批准奈玛特韦/利托那韦片进口注册[2]。就当前对COVID-19的认识和理解来看,其可能会与人类长期共存,抗新冠病毒小分子药物的临床应用日益广泛。有研究证实,奈玛特韦/利托那韦片能够降低COVID-19患者相关住院或全因死亡的风险[3]。然而有学者报道,患者服用奈玛特韦/利托那韦片后,出现腹泻、头晕、头痛、肌痛和复阳等反应[4-5]。由于多数研究所涉及的病例数少,探究其在真实世界中应用的安全性是必要的。
美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)数据库属于自发呈报系统,是评估药物在真实世界中应用风险的重要数据来源,不仅能挖掘出潜在的风险信号,还能探索新的或罕见的风险信号[6]。本研究回顾性分析FAERS数据库中的相关数据,挖掘奈玛特韦/利托那韦片的可疑不良事件(Adverse drug events,ADE)信号,以期发现新的潜在风险信号,为临床安全使用奈玛特韦/利托那韦片提供依据。
1 资料与方法
1.1 数据来源 本研究使用的数据来自FAERS数据库。利用OpenFDA平台,收集2021年第4季度至2022年第4季度(共5个季度)FAERS数据库中首要怀疑药物为奈玛特韦/利托那韦片的ADE报告。限定目标药物名称为通用名“nirmatrelvir/ritonavir”和商品名“Paxlovid”,同时提取患者性别、年龄、报告来源、报告日期、报告国家、药品信息(药品名称和适应证)、ADE信息(ADE名称、严重程度和结局)。删除重复、怀疑药物中含有2种及以上药物的报告后,得到本研究的原始数据。
1.2 数据处理 《监管活动医学词典》(Medical Dictionary for Regulatory Activities,MedDRA)是国际人用药品注册技术协调会开发的一个内容丰富且详细的医学标准术语集[7]。MedDRA的层级结构分为5级,其中系统器官分类(System Organ Class,SOC)为第1级,首选语(Preferred Term,PT)为第4级。本研究利用MedDRA中药物不良反应术语集的SOC和PT对ADE报告进行分类和描述,并将需要汉化的SOC和PT英文名导入,自动输出中英文映射表。
1.3 数据分析 比例失衡分析法(Disproportionality analysis,DPA)广泛应用于医疗保健数据库安全信号检测,其基于四格表(见表1)计算药品-事件对的观察值与期望值的比值,若超过预先规定阈值,则为失衡,提示生成可疑风险信号[8]。本研究采用DPA中的报告比值比法(Reporting odds ratio,ROR)和比例报告比值比法(Proportional reporting ratio,PRR)进行风险信号挖掘,2种检测方法联合使用,可以降低假阳性信号的数量,提高研究结果的可靠性。ROR法和PRR法的计算公式和阈值见表2,阳性信号的判断标准:a≥3,ROR的95%置信区间(Confidence interval,CI)下限>1,且PRR的95%CI下限>1,则生成1个潜在风险信号。数值越大,表示药物与ADE之间统计关联性越强。

表1 比例失衡分析法四格表
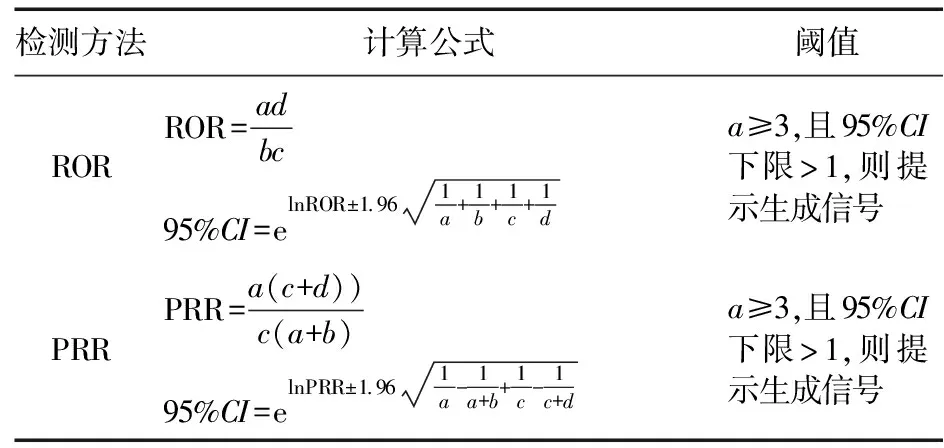
表2 ROR法和PRR法的计算公式和阈值
2 结果
2.1 ADE报告的基本情况 2021年第4季度至2022年第4季度,FAERS数据库共收到ADE报告2 896 145例,其中首要怀疑药物为奈玛特韦/利托那韦片的ADE报告为53 131例,经删除重复、怀疑药物中含有2种及以上药物的报告后为26 135例。26 135例ADE报告中,女性(57.42%)占比高于男性(33.22%);年龄主要分布于18~59岁(37.29%)和≥60岁(43.77%);上报人员多以患者(71.53%)为主;美国(80.91%)上报数量最多;报告日期多集中于2022年第2季度(32.75%)和2022年第3季度(44.38%);结局多为非严重ADE报告(84.47%)。见表3。
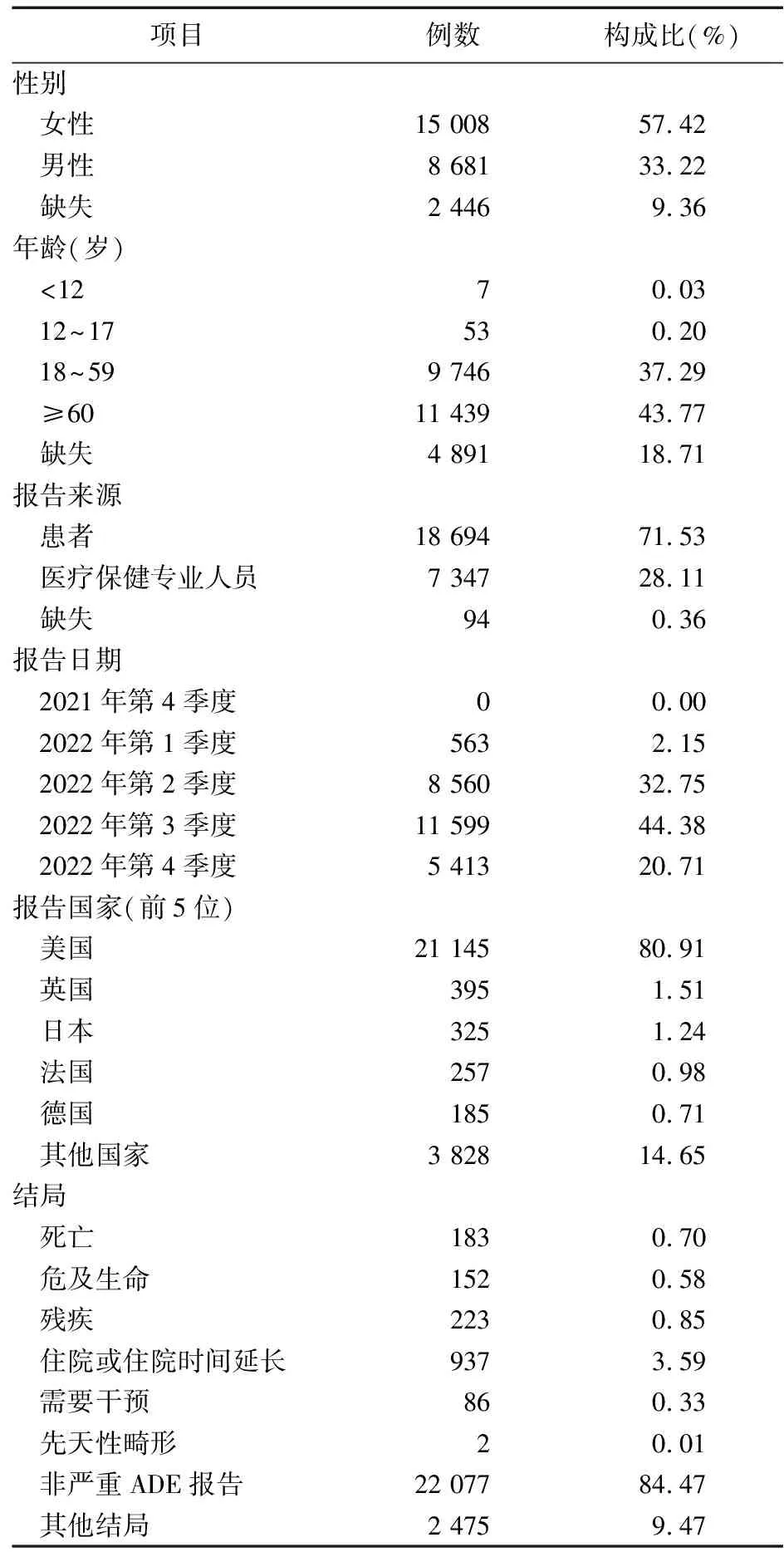
表3 奈玛特韦/利托那韦片相关ADE报告的基本信息(n=26 135)
2.2 ADE信号挖掘结果 对以奈玛特韦/利托那韦片为首要怀疑药物的ADE报告进行筛选,ADE信号总数为1 859个,经ROR法和PRR法计算分析获得阳性信号257个。为减少偏倚,本研究删除疾病本身及疾病症状(如COVID-19、SARS-CoV-2阳性)相关信号后,最终获得阳性信号246个。报告数(a值)和信号强度(ROR的95%CI下限)排名前30位的PT见表4和表5。
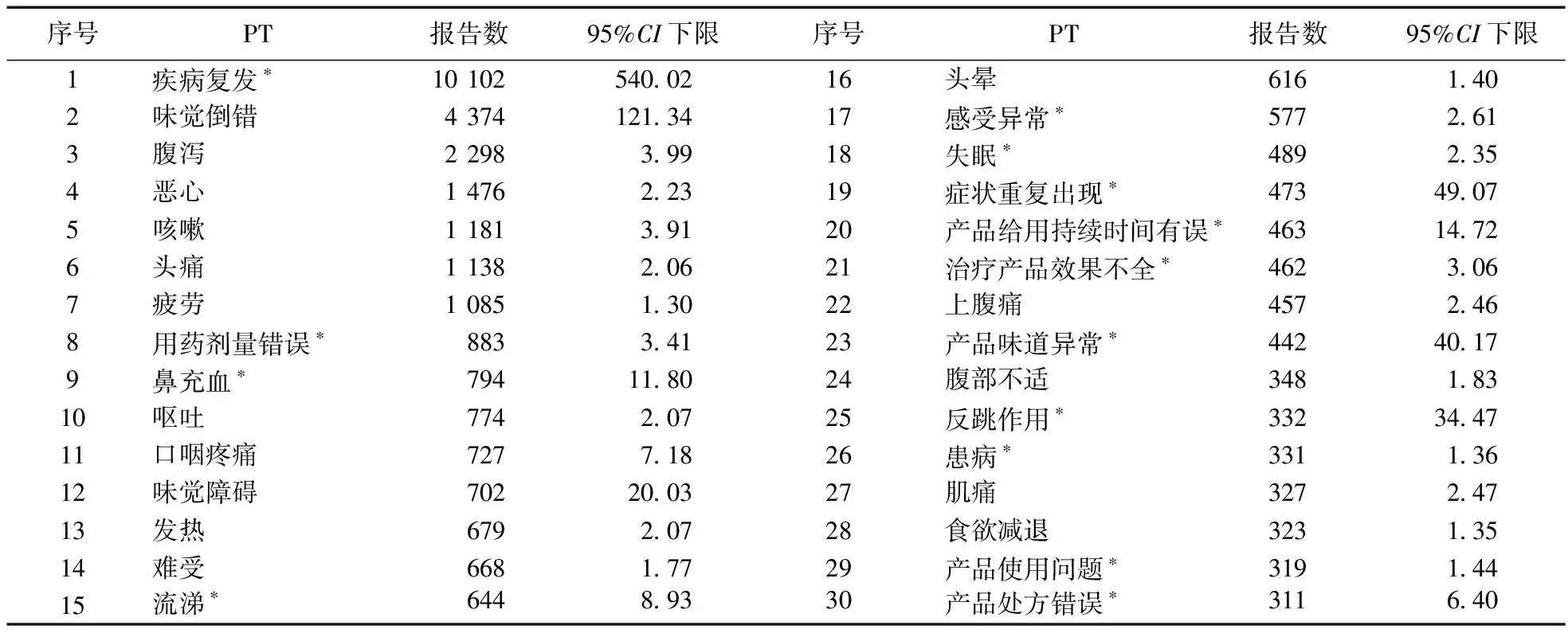
表4 奈玛特韦/利托那韦片ADE报告数排名前30位的PT
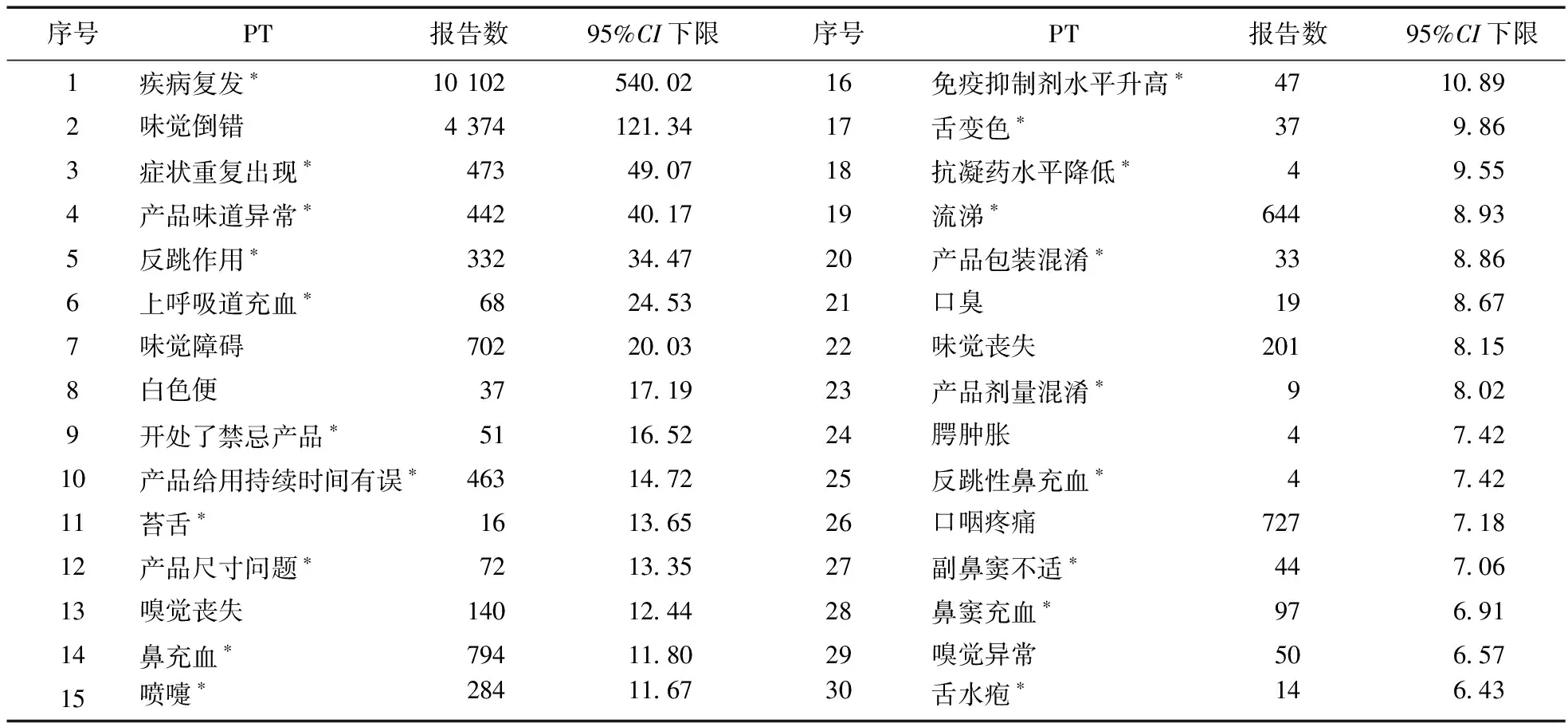
表5 奈玛特韦/利托那韦片ADE信号强度排名前30位的PT
报告数和信号强度均排名前30位的PT有10个,包括疾病复发、味觉倒错、鼻充血、口咽疼痛、味觉障碍、流涕、症状重复出现、产品给用持续时间有误、产品味道异常、反跳作用。此外,还挖掘到未列入药品说明书的新的潜在风险信号28个。
2.3 ADE信号累及的系统器官 利用MedDRA中药物不良反应术语集的SOC对获得的246个阳性信号进行分类排序,共涉及21个SOC,详情见图1。其中,胃肠系统疾病(65个)、呼吸系统、胸及纵隔疾病(40个)和各类损伤、中毒及操作并发症(30个)为信号数较多的SOC。ADE报告数较多的SOC包括全身性疾病及给药部位各种反应(15 817例)、胃肠系统疾病(7 671例)和各类神经系统疾病(7 477例)。
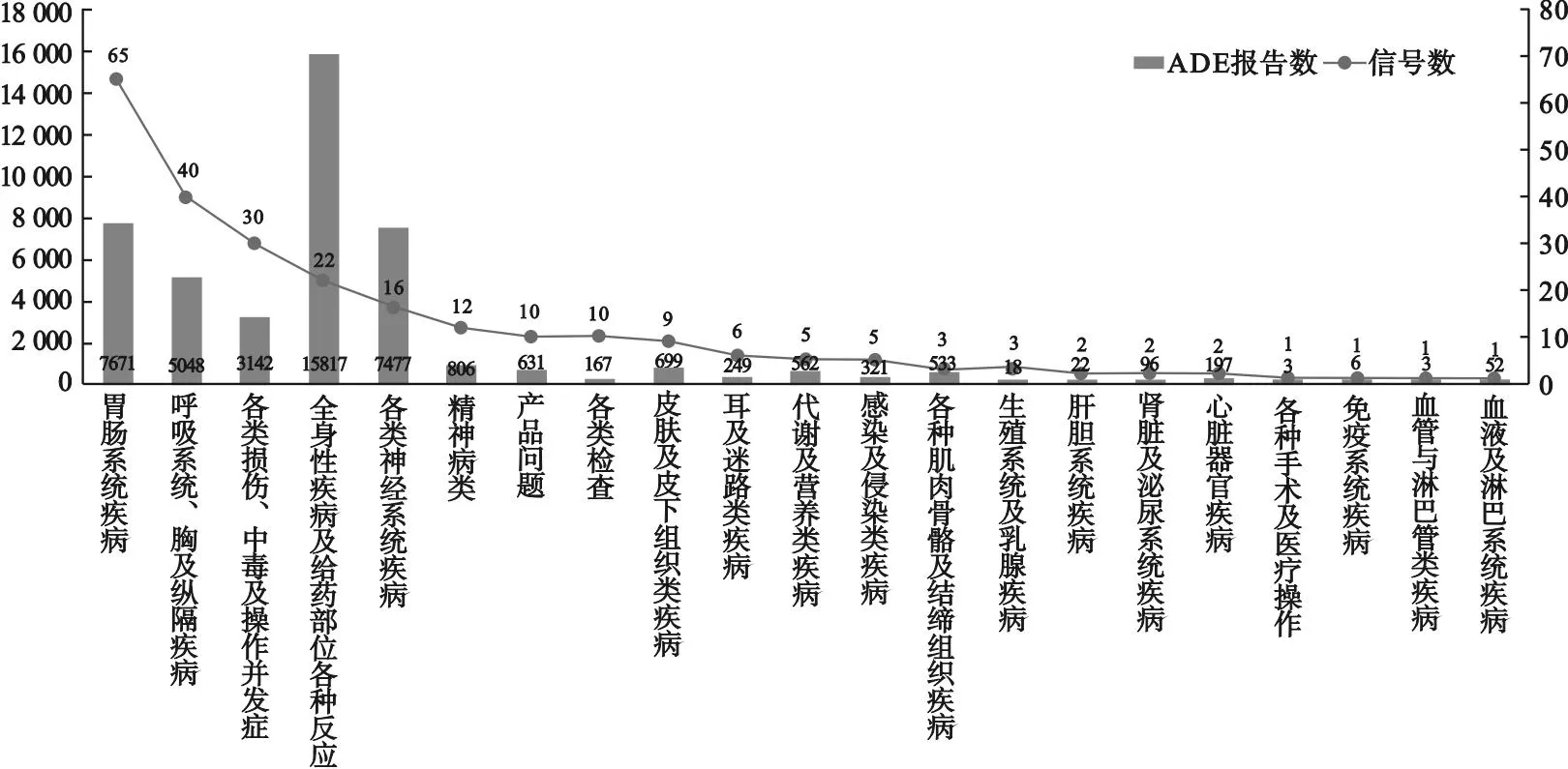
图1 奈玛特韦/利托那韦片导致的ADE信号累及的系统器官
3 讨论
3.1 药品说明书中已记载的ADE信号 恶心、呕吐、口臭、腹泻、头晕、头痛、味觉倒错、嗅觉异常、疲劳、咳嗽、口咽疼痛、食欲减退和肌痛是本研究中较为常见或相关性较高的ADE信号,主要涉及的SOC为胃肠系统疾病、各类神经系统疾病、全身性疾病及给药部位各种反应、呼吸系统、胸及纵隔疾病、代谢及营养类疾病和各种肌肉骨骼及结缔组织疾病。上述ADE信号与奈玛特韦/利托那韦片药品说明书记载一致[9-10],且与彭金娥等[4]探究奈玛特韦/利托那韦片安全性的研究结果类似,在一定程度上证实了本研究的可靠性。
3.2 药品说明书中未记载的新的潜在ADE信号
3.2.1 胃肠系统疾病与呼吸系统、胸及纵隔疾病(Gastrointestinal disorders and respiratory,thoracic and mediastinal disorders) 本研究结果显示,胃肠系统疾病与呼吸系统、胸及纵隔疾病是信号数最多的SOC,挖掘到的未列入药品说明书的新的潜在风险信号包括苔舌、舌水疱、鼻充血和流涕。COVID-19是一种由病毒引起的呼吸道疾病,咳嗽、鼻塞和流涕是其常见症状[11]。此外,有研究显示,COVID-19患者的口腔症状可表现为味觉丧失、苔舌、溃疡和水疱,且多发生于舌背部(72.4%)[12]。本研究中挖掘到的上述风险信号与COVID-19本身的症状类似,其可能并非奈玛特韦/利托那韦片真正的ADE,但我们仍建议将口腔和上呼吸道检查作为服用奈玛特韦/利托那韦片的患者的常规检查,以期探究药物与症状之间的相关性。
3.2.2 全身性疾病及给药部位各种反应(General disorders and administration site conditions) 在本研究中,ADE报告数最多的SOC是全身性疾病及给药部位各种反应,疾病复发是挖掘到的新的潜在风险信号,且相关性显著(ROR的95%CI下限为540.02)。有报道,一些服用奈玛特韦/利托那韦片治疗的患者在完成5 d的用药疗程后,于2~8 d出现复发,表现为COVID-19症状复发或病毒检测阴性后出现新的检测阳性[13-15]。
目前,奈玛特韦/利托那韦片治疗后疾病复发的机制尚不明确。美国疾病预防与控制中心指出,在一些患者中,症状复发可能是感染SARS-CoV-2的自然病史的一部分,与奈玛特韦/利托那韦片治疗无关,也与疫苗接种状态无关[15]。有学者提出,复发可能与治疗结束后SARS-CoV-2复制恢复引起的二次免疫有关[16]。Carlin等[17]对复发患者进行全基因组测序发现,复发不是由突变或感染不同的病毒株所致,并认为耐药性和缺乏中和抗体都不是引起复发的原因,最可能的原因是个体药代动力学导致的药物暴露不足或持续时间不足。此外,有研究显示,复发在服用莫诺拉韦治疗的患者中同样存在[18]。
虽然多数复发患者的临床结局并不严重,且往往不需要额外的抗病毒治疗[19],但仍不能忽视其重要性,提示医师与药师在开具与调剂奈玛特韦/利托那韦片处方时,应告知患者存在复发的可能性,且需严密监测自身症状,症状加重及时就诊。
3.2.3 各类检查(Investigations) 在各类检查中,免疫抑制剂水平升高和抗凝药水平降低是发现的新的潜在风险信号。奈玛特韦/利托那韦片是由2种药物组成的复方抗病毒药物,其中利托那韦抑制细胞色素P450 3A4(Cytochrome P450 3A4,CYP3A4)介导的奈玛特韦代谢,从而提高奈玛特韦的血药浓度。此外,利托那韦可显著抑制或诱导多种药物代谢酶,使得奈玛特韦/利托那韦片易与部分药物发生相互作用。例如,利托那韦是CYP3A4强抑制剂,与免疫抑制剂(环孢素、他克莫司或依维莫司)联合使用时,会增加免疫抑制剂的血药浓度,治疗期间应密切监测其疗效和不良反应[20]。利托那韦对CYP1A2和CYP2C9的诱导作用导致R-华法林水平降低,会减弱华法林的抗凝作用,联用时应严密监测INR[21]。此外,奈玛特韦/利托那韦片与调脂药、抗血小板药、降压药、镇痛药、镇静催眠药、降糖药和抗帕金森药等均存在药物相互作用[20-22]。因此,医师和药师应主动了解国内外奈玛特韦/利托那韦片治疗COVID-19的新进展,同时在临床应用中,应积极评估伴严重基础疾病的老年COVID-19患者奈玛特韦/利托那韦片治疗的风险与获益,并适当调整药物治疗策略。
3.2.4 各类损伤、中毒及操作并发症(Injury,poisoning and procedural complications) 在各类损伤、中毒及操作并发症中挖掘到的新的潜在风险信号包括产品给用持续时间有误、产品包装混淆和产品剂量混淆。
药品说明书推荐奈玛特韦/利托那韦片的使用剂量为奈玛特韦300 mg(150 mg×2片)联用利托那韦100 mg(100 mg×1片),每12小时1次口服给药,连续服用5 d[10]。有患者因不能耐受腹泻而提前终止治疗[14]。刘小林等[23]对其所在医院使用奈玛特韦/利托那韦片治疗的患者进行病例点评,发现用法用量不适宜为主要不合理用药类型,占65.00%,其中有患者存在用药疗程过长的问题。疗程不足可能会影响药物治疗效果与疾病预后,而延长疗程较标准疗程而言,可能并无有意义的额外获益[24]。
奈玛特韦/利托那韦片由椭圆形的粉红色奈玛特韦片剂(150 mg)和白色或类白色利托那韦片剂(100 mg)组成一个药品包装,以组合包装的形式向患者提供[10]。患者(尤其老年患者或合并肾损伤需要调整药物剂量的患者)在使用过程中容易发生包装或剂量混淆。因此,医师与药师在开具与调剂奈玛特韦/利托那韦片处方时应加强宣教,明确告知患者用药剂量、用药疗程及用药注意事项等。
3.3 我国已报道的奈玛特韦/利托那韦片相关不良反应 自奈玛特韦/利托那韦片获批紧急使用以来,我国有学者报道了本药相关的不良反应。彭金娥等[4]回顾性分析了364例使用奈玛特韦/利托那韦片治疗COVID-19的患者病历资料,发现其不良反应发生率为13.2%(48/364),不良反应多发生于开始治疗后1~7 d,主要包括腹泻、恶心、呕吐、食欲下降、头晕、头痛、咽痛、肌痛、皮疹、肾损伤和血尿酸升高等。石双等[25]分享了奈玛特韦/利托那韦片治疗COVID-19患儿的临床经验,发现1例患儿在用药期间出现皮疹,并在出院10 d后出现SARS-CoV-2病毒检测阳性。陈美平等[5]与郭贺冰等[26]先后报道了患者在完成第1个奈玛特韦/利托那韦片治疗疗程后,出现SARS-CoV-2病毒载量下降后再次升高,即SARS-CoV-2的“复发”或“再激活”。
上述不良反应与本研究数据挖掘结果基本一致,且大多数为奈玛特韦/利托那韦片药品说明书记载[9-10],在一定程度上证实了本研究的可靠性。本研究未挖掘到肾损伤和血尿酸升高相关的阳性信号,且奈玛特韦/利托那韦片药品说明书并未记载。但是,我们不能忽视奈玛特韦/利托那韦片引起肾损伤和血尿酸升高的不良反应,其发生情况可能与合并用药或我国人群特征有关,因此建议服用奈玛特韦/利托那韦片的患者定期监测肾功能与血尿酸水平,以降低患者出现相关不良反应的风险。
3.4 研究的局限性 本研究尚存在一定的局限性:①FAERS数据库属于自发呈报系统,无论是否为医疗保健专业人员均可自行上报。在本研究中上报人员多以患者为主(71.53%),可能存在漏报、错报和重复上报等偏倚。②本研究中,ADE上报数量最多的国家是美国(80.91%),而我国上报数量非常有限(0.11%),本研究结果是否适用于我国人群有待进一步确证。③虽然本研究联合使用2种检测方法挖掘风险信号,在一定程度上减少了假阳性信号的数量,提高了结果的可靠性,但是ROR法和PRR法作为信号检测工具,仅能说明药物与ADE是否存在统计学关联,两者之间是否存在因果关联还需大规模高质量的临床研究加以验证。
4 结论
临床在应用奈玛特韦/利托那韦片时,除了关注药品说明书中已记载的ADE信号,还应密切关注药品说明书中未记载的新的潜在ADE信号(如苔舌、舌水疱、鼻充血、流涕、疾病复发、免疫抑制剂水平升高、抗凝药水平降低、产品给用持续时间有误、产品包装混淆和产品剂量混淆等),同时还需积极收集相关安全性数据,密切监测不良反应,一旦发现应及时评估与上报,以便获得更多真实世界数据,保证患者用药的安全性。
