基于线粒体COⅠ和Cytb基因探讨北鲍南养对皱纹盘鲍群体遗传结构的影响
2024-01-22周丽青迟长凤孙秀俊刘志鸿郑言鑫
吴 宙, 周丽青, 迟长凤, 吴 彪, 孙秀俊,刘志鸿, 赵 丹, 于 涛, 郑言鑫
(1. 浙江海洋大学,国家海洋设施养殖工程技术研究中心,海洋生物种质发掘与利用国家地方联合实验室,浙江 舟山 316022;2. 中国水产科学研究院黄海水产研究所,农业农村部海洋渔业可持续发展重点实验室,山东 青岛 266071;3. 中国水产科学研究院长岛增殖实验站,山东 烟台 265800)
皱纹盘鲍(Haliotis discus hannai)属腹足纲(Gastropoda)前鳃亚纲(Prosobranchia)原始腹足目(Archaeogastropoda)鲍科(Haliotidae)鲍属(Haliotis),自然分布于朝鲜半岛、日本北部以及我国山东半岛、辽东半岛沿海[1-2],属于北方冷水物种。皱纹盘鲍具有很高的经济价值与营养价值,有“海洋软黄金”之称,是我国一种重要的水产养殖贝类。
在20世纪50年代,我国皱纹盘鲍的捕捞量超100 t,捕捞量过大使得自然资源遭受严重破坏,至70年代捕捞量仅有20~30 t。为恢复皱纹盘鲍资源,其人工繁殖、育苗、增殖放流试验也随之展开[3-4],并取得突破性进展,至20世纪90年代,我国开展了皱纹盘鲍“南北接力”的养殖试验,将北方培育的皱纹盘鲍苗种于11月运输至福建海区养殖,到次年5月再运回北方养殖,成功避免了皱纹盘鲍稚鲍在北方寒冷的冬季因水温过低生长缓慢、死亡率高和在南方水域夏季温度过高导致大量死亡的风险。20世纪90年代后期到2010年,皱纹盘鲍种群杂交技术的突破及应用推动了我国皱纹盘鲍养殖产业重心南移至福建省,“北鲍南养”使得皱纹盘鲍人工养殖产业得到迅速发展[3],也成为我国鲍鱼养殖的主要品种。
人工养殖与选育的进程会在一定程度上影响物种遗传多样性水平,或改变其原有的遗传结构,甚至使群体发生显著的遗传分化。张国范等[5]利用皱纹盘鲍中国群体和日本野生群体进行单自交与单正反杂交获得了4个F1家系,通过RAPD分析发现两个杂交组合家系的杂合度均高于自交组合,推测杂交产生杂种优势,使其遗传多样性水平有所提高。高祥刚等[6]采用AFLP标记技术对国内雌性皱纹盘鲍与日本野生雄性皱纹盘鲍杂交的F1群体遗传结构进行了研究,发现其遗传多样性水平显著高于日本野生群体,认为群体间的杂交可以有效提高遗传多样性。李莉等[7]通过微卫星标记分析发现,皱纹盘鲍养殖群体遗传多样性低于野生群体,但仍处于较高水平,认为选用野生皱纹盘鲍个体与遗传距离较大的个体作为亲本,可避免因近亲交配而导致的遗传多样性下降。Li等[8]利用7个微卫星标记,同样发现养殖群体的遗传多样性显著低于野生群体,且各群体之间发生显著的遗传分化,认为亲鲍数量少且雄雌性别比例低是造成养殖群体遗传变异显著减少的原因。
微卫星标记技术具有特异性PCR扩增、多态性丰富、突变量高、遵循孟德尔共显性遗传等特点[9],因此近年来我国研究人员主要采用微卫星标记的方法来研究皱纹盘鲍群体遗传多样性[10-12],但开发新的微卫星标记存在工作繁琐、费时、成本高等缺点[9]。而目前国内尚未见有基于线粒体DNA标记手段研究皱纹盘鲍群体遗传结构和遗传多样性比较详尽的相关报道。线粒体DNA (mtDNA)具有母系遗传、进化速率快、分子简单、几乎不发生重组等特点,已被广泛应用于群体遗传学、生物系统发育研究[9,13-14]。其中mtDNA细胞色素C氧化酶亚基(COⅠ)基因和细胞色素b (Cytb)基因进化速率适中,适合种群水平基因差异检测,是研究群体遗传结构、遗传多样性的理想标记[15-18]。本研究采集了我国南北沿海6个皱纹盘鲍群体样本,基于COⅠ、Cytb基因序列分析了各群体皱纹盘鲍的遗传结构与遗传多样性,为评估我国皱纹盘鲍遗传资源以及研究养殖模式对遗传结构的影响提供了科学依据。
1 材料与方法
1.1 样品采集
6个群体的皱纹盘鲍分别于2020年8月—2021年3月取自福建漳州(ZZ)、辽宁大连(DL)、山东荣成(RC)及长山列岛的南隍城岛(NH)、砣矶岛(TJ)、大钦岛(DQ)。其中ZZ群体为洋下群体,长期定殖于漳州,属累代养殖群体;DL群体为大连繁育至蓬莱越冬群体,属非累代养殖群体;RC群体为养殖公司繁育群体,属累代养殖群体;NH群体为累代养殖群体;TJ群体养殖方式为吊笼养殖,成长到一定规格后即全部售出,属非累代养殖群体;DQ群体为野生群体,6个皱纹盘鲍群体采样信息见表1。活体鲍采集至实验室解剖,取肌肉组织液氮速冻后置于−80 °C超低温冰箱保存备用。本实验严格按照中国水产科学研究院实验动物的护理和使用指南开展。

表1 皱纹盘鲍采样信息Tab. 1 Sampling information of H. discus hannai
1.2 DNA提取、PCR扩增与测序
取皱纹盘鲍肌肉组织,采用酚-氯仿抽提法进行DNA提取。提取完毕后以1.5%琼脂糖凝胶电泳检测、Gene finder染色,成像系统观察与拍照,并利用NanoDrop Lite超微量分光光度计测量DNA的浓度与纯度。取质量较好的DNA部分稀释至50 ng/μL,置于−80 °C超低温冰箱保存备用。
根据皱纹盘鲍线粒体基因序列(登录号:EU595789.1),利用Primer 3软件进行COⅠ、Cytb基因引物设计并交由北京擎科生物科技股份有限公司青岛分公司进行测序分析。引物序列分别为COⅠ-F:(5′-TTCTGACTCCTCCCACCATC-3′);COⅠ-R:(5′-GCGAATACGGCTCCTATTGA-3′);Cytb-F:(5′-CGTGAATTATGGGTGGCTCT-3′);Cytb-R:(5′-AGTAAACACACGCCCAATCC-3′)。PCR反应体系:2×TaqPlus Master Mix Ⅱ 25 μL,正反引物各2 μL,DNA模板浓度50 ng/μL,取1 μL,补充ddH2O至总体积为50 μL。PCR反应程序:95 °C预变性3 min,30个循环,每个循环包括95 °C变性15 s、58 °C退火20 s、72 °C延伸1 min,最后彻底延伸5 min。扩增产物经1.5%琼脂糖凝胶电泳检测,成像系统观察、拍照,选择具有单一明亮条带的PCR产物原液,交由北京擎科生物科技股份有限公司青岛分公司纯化、测通。
1.3 数据分析
所有序列均用Chromas 2.33软件观察峰图、校对数据,将有杂峰、双峰的样品重新测序。利用Bioedit 7.0.5软件对所有序列进行序列比对、剪切。利用DNAsp 5.10软件[19]计算核苷酸变异位点、单倍型数、各群体单倍型多样性(haplotype diversity,Hd)、核苷酸多样性(nucleotide diversity,π)、平均核苷酸差异指数k (mean pairwise difference)等遗传多样性参数。利用MEGA 6.06[20]以红鲍(H. rufescens)、新西兰鲍(H. iris)为外类群,通过邻接法(Neighbor-joining,NJ)构建皱纹盘鲍各单倍型的系统发育树。利用Arlequin 3.5软件[21]进行AMOVA[22]方差分析,分析皱纹盘鲍群体间遗传变异情况,采用分化固定指数(Fst)以1 000次重抽样检验方法来评估两两群体间的遗传分化程度。利用Popart 1.7软件[23]构建单倍型网络图。
2 结果
2.1 COⅠ基因序列结果分析与遗传多样性
PCR产物经纯化、测序、序列比对、剪切后得到730 bpCOⅠ基因部分序列。基于研究的6个群体259个个体的COⅠ基因序列中,发现碱基A、T、C、G比例为28.56%、31.05%、23.60%、16.79%。A+T碱基含量为59.61%,C+G碱基含量40.39%,具有明显的A+T碱基偏倚性。此外,共发现48个变异位点,碱基变异比例为6.6%。其中单一信息位点13个,简约信息位点35个。变异类型均为转换,无碱基的颠换、插入与缺失。
在259个个体中,共定义了30种单倍型,其中优势单倍型为Hap2、Hap3,分别占个体总数的17.4%、33.2%。Hap2、Hap3、Hap6为6个群体共有单倍型,Hap8、Hap11为DL群体特有单倍型,Hap15为ZZ群体特有单倍型,Hap17~19为NH特有单倍型,Hap20、Hap21为DQ特有单倍型,Hap25~30为TJ群体特有单倍型。TJ群体的单倍型种类最多(18个),RC群体的单倍型种类最少(6个)。以红鲍、新西兰鲍为外类群和所有检测的单倍型构建的NJ系统发育树见图1,结果显示,两外群的基因分布在NJ树的最末端,30个单倍型广泛分散在NJ树的各个分支,仅砣矶岛群体的单倍型Hap25独立为一支,可以明显看出单倍型与地理群体间不存在明确的对应关系。构建的单倍型网络图见图2,其与NJ发育树呈现了相同的结果,但在图中可以明显看出,不同单倍型之间具有显著的碱基差异。

图1 皱纹盘鲍COⅠ基因序列构建的NJ进化树及在6个群体中的分布Fig. 1 Neighbor-joining phylogenetic tree of COⅠ haplotypes and their distribution in 6 populations of H. discus hannai

图2 皱纹盘鲍线粒体COⅠ基因单倍型网络图Fig. 2 Network diagram of COⅠ haplotypes in H. discus hannai
皱纹盘鲍6个群体COⅠ基因的遗传多样性参数见表2,6个群体总体的Hd(0.586~0.897)、π(0.005 6~0.008 1)处于较高水平,其中TJ群体的Hd(0.897±0.028)与π(0.008 1±0.000 8)均为最高,NH群体的Hd(0.586±0.093)最低,DL群体π(0.005 6±0.000 6)最低,总体呈现高单倍型多样性与高核苷酸多样性的特征。
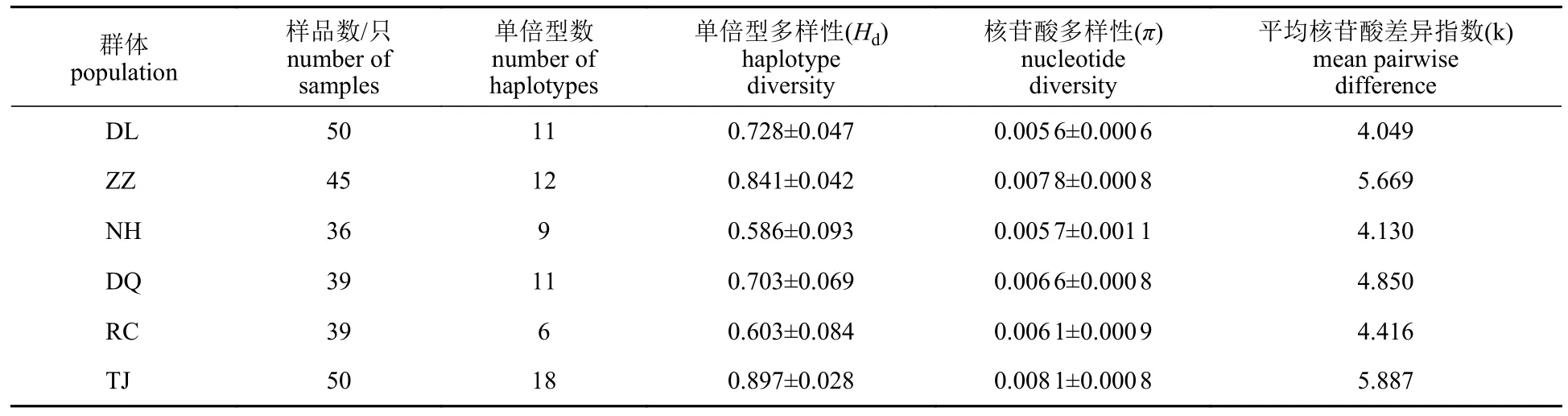
表2 基于COⅠ基因序列皱纹盘鲍6个群体的遗传多样性指数Tab. 2 Genetic diversity indices of six populations in H. discus hannai based on COⅠ gene sequence
群体间分化指数Fst值见表3,大部分群体间的分化指数达到了显著性水平(P<0.05),仅DL与TJ群体、DQ与NH群体之间的Fst未达到显著性水平(P>0.05),表明绝大多数群体间均存在遗传分化。RC群体与其余5个群体的分化指数范围为0.166 5~0.316 7;均达到高程度遗传分化,ZZ与TJ之外的4群体为中等程度及以上遗传分化(Fst:0.055 6~0.203 9),其余群体两两间的遗传分化均为低度分化(Fst<0.05)。

表3 基于COⅠ基因皱纹盘鲍6个群体间的分化指数FstTab. 3 The Fst value in six populations of H. discus hannai based on COⅠ gene sequence
由AMOVA分析可知,将6个群体均归为一个组群进行分析时,群体间的遗传变异占总变异的12.05%,群体内的遗传变异占总变异的87.95%,表明遗传变异主要来源于群体内,并且群体间遗传分化达到极显著水平(Fst=0.120 5,P<0.01) (表4)。

表4 基于COⅠ基因序列皱纹盘鲍6个群体分子变异分析(AMOVA)Tab. 4 Analysis of molecular variance (AMOVA) of all 6 populations of H. discus hannai based on COⅠ gene sequence
2.2 Cytb基因序列结果分析与遗传多样性
经序列比对、剪切后同样得到730 bp的Cytb基因部分序列。6个群体皱纹盘鲍的A、T、C、G组成比例分别为20.27%、40.2%、16.95%、22.58%。A+T出现频率为60.47%,C+G的出现频率为39.53%。同COⅠ基因类似,表现出明显的A+T碱基偏向性。共发现59个变异位点,其中单一信息位点21个,简约信息化位点38个。变异类型均为转换,无碱基的颠换、插入与缺失。
皱纹盘鲍259个个体中,共检测到了32个单倍型。其中优势单倍型为Hap2、Hap3,并为6个群体共有,出现频率分别为16.21%、33.20%,单倍型Hap9、Hap12仅在DL群体出现过1次,Hap17~22仅在NH群体出现过1次,Hap23仅在DQ群体出现过1次,Hap27~32仅在TJ群体出现了1次。其中TJ群体拥有最多的单倍型(19个),RC群体拥有最少的单倍型(7个)。基于Cytb基因以红鲍、新西兰鲍为外类群和所有检测的单倍型构建的NJ系统发育树见图3,构建的单倍型网络图见图4,结果与基于COⅠ基因构建的NJ树、单倍型网络图基本一致。

图3 皱纹盘鲍Cytb基因序列构建的NJ系统树及在6个群体中的分布Fig. 3 Neighbor-joining phylogenetic tree of Cytb haplotypes and their distribution in 6 populations of H. discus hannai

图4 皱纹盘鲍线粒体Cytb基因单倍型网络图Fig. 4 Network diagram of Cytb haplotypes in H. discus hannai
基于6个皱纹盘鲍Cytb基因序列分析得到的遗传多样性参数见表5,6个群体总体的Hd(0.605~0.909)和π(0.007 7~0.012 0)均处于较高水平。其中TJ群体Hd、π参数为6个群体中最高,分别为0.909±0.028、0.012 0±0.001 0,RC群体的Hd最低(0.605±0.084),DL群体的π最低(0.007 7±0.000 9)。与COⅠ基因序列分析结果一致,总体呈现出高单倍型多样性与高核苷酸多样性的特征。

表5 基于Cytb基因序列皱纹盘鲍6个群体的遗传多样性指数Tab. 5 Genetic diversity indices in six populations of H. discus hannai based on Cytb gene sequence
由群体间的分化指数Fst值可知,除了DL与NH、DQ,DQ与NH、TJ群体间的遗传分化未达到显著水平之外(P>0.05),其余群体间的遗传分化均达到了显著水平(P<0.05) (表6)。RC与其他群体(除TJ群体外)间的分化指数范围为0.303 0~0.382 5,均达到了极高程度遗传分化。ZZ与NH群体、 RC与TJ群体的分化指数分别为0.178 4、0.171 6,达到了高程度遗传分化。ZZ与DL、NH,TJ与NH群体的分化指数范围为0.063 1~0.132 3,达到中等的遗传分化程度,其余各群体间均为低程度遗传分化。
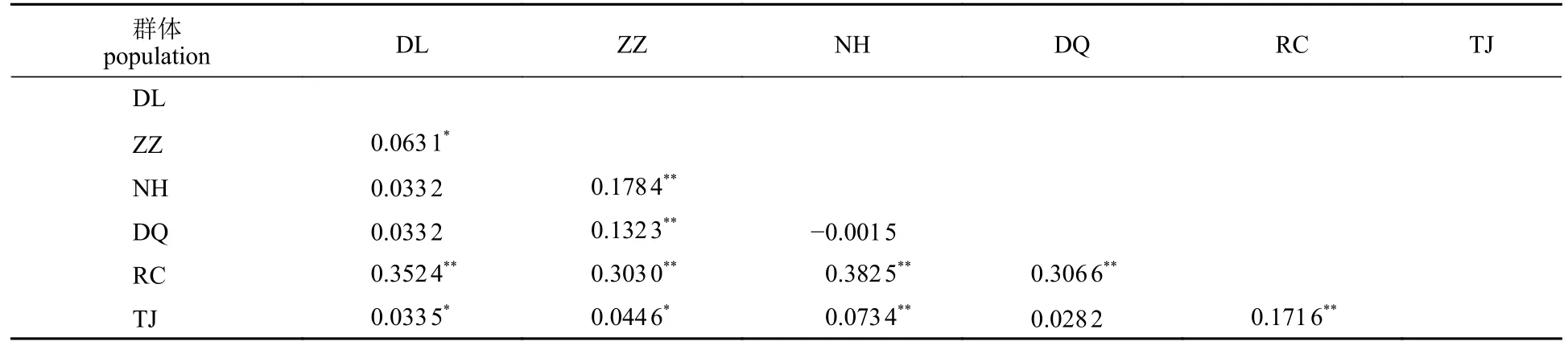
表6 基于Cytb基因序列皱纹盘鲍6个群体间的分化指数FstTab. 6 The Fst value of six populations in H. discus hannai based on Cytb gene sequence
AMOVA分析结果见表7,同COⅠ基因分析,将6个群体的皱纹盘鲍列为同一组群进行分析时,群体间遗传变异占总变异的14.89%,群体内的遗传变异占总变异的85.11%。结果表明主要的遗传变异来自于群体内,群体间的遗传分化达到极显著水平(Fst=0.148 9,P<0.01)。

表7 基于Cytb基因序列皱纹盘鲍6个群体分子变异分析(AMOVA)Tab. 7 Analysis of molecular variance (AMOVA) of all the 6 populations of H. discus hannai based on Cytb gene sequence
3 讨论
3.1 6个皱纹盘鲍群体遗传多样性
物种的遗传多样性是生物多样性的重要组成部分,是物种生存和发展的前提,丰富的遗传多样性有助于提升其适应环境变化的能力与进化潜力[24]。单倍型多样性指数与核苷酸多样性指数越高,代表物种的遗传多样性越丰富。本研究基于Cytb基因序列分析得到的遗传多样性参数较COⅠ基因高,认为这是由于Cytb进化速率较快所导致,这与柔鱼(Ommastrephes bartramii)[15]、波纹唇鱼(Cheilinus undulatus)[25]、北方磷虾(Meganyctiphanes norvegica)[26]等研究的结果一致。6个群体皱纹盘鲍具有高单倍型多样性与高核苷酸多样性的特征,Grant等[27]认为这是因为群体由大而稳定的种群构成,并拥有较长进化历史或者是不同遗传背景的种群二次接触造成的,本研究认为主要由以下2个原因导致:①皱纹盘鲍喜生活在水质清澈、水流畅通、富含海藻的几米至几十米深的岩礁上,其活动能力较弱,难以凭自身的移动能力与其他地域较远的种群进行基因交流。而近三十年来的皱纹盘鲍养殖模式已经发生巨大改变,从早期的“南北接力养殖”到现在的“北鲍南养”,皱纹盘鲍人工养殖的重心已经移至南方,这些养殖模式都加强了皱纹盘鲍不同群体间的基因交流,使各群体的遗传多样性指数都处于较高水平。②皱纹盘鲍北鲍南移养殖的成功,进一步提升了其环境适应能力,另外皱纹盘鲍性成熟年龄相对较短(3年),这些特性可能对群体的快速生长、新变异的保存、维持自身的高单倍型多样性具有一定作用[28]。因此,大规模的北鲍南养对我国皱纹盘鲍的遗传结构起到优化调整的作用,使该物种遗传多样性指数提高,相应的适应能力也得到充分锻炼,这对种质资源的开发利用具有积极的意义。
通常情况下,野生群体的群体遗传多样性指数会高于养殖群体,而DQ作为野生群体,其遗传多样性指数比个别养殖群体低。前人在利用RAPD、AFLP标记技术进行相关研究时,也出现了养殖群体遗传多样性高于野生群体的情况,推测是由于两个在遗传上有一定隔离的群体经过杂交之后获得了杂种优势,使其后代群体的遗传多样性升高[5-6]。在同属于累代养殖的群体中,NH、RC群体的单倍型多样性与核苷酸多样性都相对较低,推测这两个累代养殖群体均发生了近交衰退,使遗传多样性呈下降趋势,但是ZZ群体却仍保持着相对较高的遗传多样性,对于这种现象,后续还需以现有的群体样本通过其他标记方法获得更多的遗传数据,以作进一步的遗传分析。
3.2 群体遗传结构与遗传分化
由COⅠ、Cytb基因的群体间Fst值、AMOVA分析结果,发现大部分群体间存在显著遗传分化现象。由单倍型网络图可知,单倍型之间存在较大的碱基差异,是使得Fst和AMOVA计算出较高遗传分化的原因。存在较大差异的单倍型可能代表皱纹盘鲍养殖重心南移前的各个野生群体。由于鲍的幼体和成体随海流迁移的能力有限,群体间基因交流少,经过长时间的种群繁衍,群体中的优势单倍型与其他群体间的碱基差异逐渐增大,最终形成了群体间差异显著的单倍型。而皱纹盘鲍的大规模北鲍南移养殖人为地将差异较大的单倍型带入不同群体中,进而形成了本研究中的实验结果。
RC与其他所有群体间存在较高程度的遗传分化,除TJ之外,ZZ与其他所有群体均存在中度以上遗传分化。由于RC群体每年都会选育性状优良的皱纹盘鲍作为亲本继续繁育后代,而ZZ群体为洋下群体,长期定殖于漳州,其遗传背景较为复杂且也经过长期的选育,可能RC、ZZ群体与其他养殖群体的选育条件不同,导致群体发生了显著的遗传分化,也从侧面说明了人工选育对皱纹盘鲍不同群体的遗传分化有重要影响,这与张仪方[29]的研究结果一致。Li等[8]也证实了除人工选育外,养殖环境中的人工选择和自然选择也可能改变了养殖群体的总体等位基因组成;另外在育苗过程中采用的亲本数量过少,群体容易产生遗传漂变,使群体发生不同程度遗传分化[30-32]。DL、NH与DQ群体两两间为低度分化或者无分化,推测这3个群体的皱纹盘鲍均位于渤海湾内,地理位置接近,不同群体间的基因交流相对比较密切,从而降低了群体间的遗传分化。
(作者声明本文无实际或潜在的利益冲突)
