凡纳滨对虾白便综合征发生与环境因子、机体免疫酶活性和微生物的相关性
2024-01-22王印庚于永翔蔡欣欣王春元廖梅杰荣小军朱洪洋
王印庚, 于永翔, 蔡欣欣, 张 正, 王春元, 廖梅杰,李 彬, 荣小军, 朱洪洋, 戴 岩
(1. 中国水产科学研究院黄海水产研究所,青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;2. 连云港海洋源水产开发有限公司,江苏 连云港 222199)
凡纳滨对虾(Litopenaeus vannamei)生长速率快、耐高温、抗病力强,是我国对虾养殖的优良品种,同时也是世界养殖产量最高的3种优良虾种之一[1]。随着对虾养殖业的快速发展和不规范运作,在对虾养殖产业中细菌病、病毒病、寄生虫病等病害问题日趋严重,其中细菌性病害发生区域广、发病问题复杂、病原种类繁多,严重制约着对虾养殖业的健康稳定发展[2-4]。对虾白便综合征(white feces syndrome,WFS)在对虾养殖区频发,发病率高、传染性强,给世界范围内对虾养殖业造成巨大经济损失[5-6]。WFS的典型症状主要包括虾塘表面漂浮有细长、白色略带黄色、有黏性、易腐败且有恶臭散发的棉线状虾便,患病对虾表现出肝胰脏萎缩变小、后肠变白、肠内充满白色至金棕色物质以及甲壳松散等症状。
目前,国内外关于对虾WFS发病症状、流行特点、病原病理、预防治疗以及对虾肠道微生物群落相关变化已有诸多报道[7-10]。但目前对于WFS的病因仍存在认知不统一的问题,当前研究主要集中在两种观点:一种认为WFS是由病原菌感染引起的细菌性疾病,并与天气突变、水质恶化、饵料霉变、蓝藻暴发、消化机能受损等外界因素相关,现已报道的病原菌有霍乱弧菌(Vibrio cholerae)、溶藻弧菌(V. alginolyticus)、河流弧菌(V. fzuvialis)和大肠杆菌(Escherichia coli)等[11-12]。另一种认为WFS是由虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)感染引起[13-14]。同时,水生生物疾病的发生是由环境因子、病原微生物和宿主自身免疫能力综合作用的结果[15]。养殖环境变化往往是疾病发生的诱因,环境因子的变化影响病原体生存代谢及宿主的免疫力,是病害发生发展的重要调控因素,同时环境因子和生物因素的变化也会影响微生物群落结构组成变化[16]。目前,对于综合分析对虾WFS病原、宿主自身免疫力、水体环境菌群结构变化的研究还鲜有报道,而在对虾养殖实践中,整个养殖系统中的各种因子复杂多变,所以从生产实践中进行WFS发生相关病因的研究更具有重要意义[17]。
本研究以池塘养殖凡纳滨对虾为对象,通过持续采集典型池塘养殖模式下的水质指标、可培养细菌、对虾机体免疫指标,并结合宏基因组测序技术等分析方法,综合解析对虾养殖生产实践中WFS发生前后的水体环境、微生物、虾体自身免疫能力和养殖水体菌群结构的变化情况,深入分析WFS发生与各类因子的相互关系及其关联特性。相关研究结果为解析WFS的发生机制提供数据支撑和参考,并为WFS的临床防控奠定理论基础。
1 材料与方法
1.1 实验动物
本实验选取河北黄骅某池塘养殖的患有典型WFS的凡纳滨对虾进行持续性跟踪研究,同步采集同批次放苗且养殖管理条件相同的同场区内健康养殖池塘为对照。池塘面积均为3.33 hm2,水深1.3~1.5 m,放苗密度为30 尾/m2。实验池塘对虾为75日龄左右,体长(10±2) cm,体重(10.0±1.5) g,每日早晚各投喂1次颗粒饲料,投喂量为对虾体重的3%;患病池塘和健康池塘均未添加外源投入品;采样频率为隔日1次,健康组样品编号为C1、C2、C3、C4和C5,患病组样品编号为D1、D2、D3、D4和D5。实验过程中操作人员严格遵守实验动物福利伦理和动物实验安全规范,并按照中国水产科学研究院黄海水产研究所动物实验伦理委员会制定的规章制度执行。
1.2 样品采集
环境气候因子 每日上午7:00利用YSI水质检测仪对实验和健康虾池内3个位点的温度、盐度、pH、溶解氧等参数进行采集,并对饵料投喂、进排水、外源投入品等信息加以调查记录,同时依据中国气象网(http://www.cma.gov.cn/)公布的信息,对实验区域内的天气、温度等信息进行观察记录。
水样采集 使用采水器分别取患病和健康对虾养殖池塘内3个不同位点的水样2 L,其中1 L水样使用无菌纱绢过滤,去除水中较大颗粒性杂质,并经0.22 μm无菌纤维素滤膜抽滤后,将滤膜冻存于−80 °C冰箱用于高通量测序分析,剩余水样用于可培养细菌检测。
虾样采集 在患病和健康养殖池塘内的3个不同位点通过撒网随机捕捞对虾30尾,测定对虾总重量,并观察患病对虾比例。每个池塘随机选取10尾对虾置于塑料桶内,充氧运输至实验室进行样品处理与分析。
1.3 虾体和水体中可培养细菌检测
随机选取5尾鲜活凡纳滨对虾,剪取约0.2 g对虾肝胰腺组织,混匀后加入500 μL无菌1.5%NaCl溶液进行研磨,向研磨均匀的肝胰腺组织匀浆内继续加入4.5 mL无菌1.5% NaCl溶液,并通过10倍梯度稀释至10−2和10−3,吸取100 μL稀释液分别涂布于TSB和TCBS固体培养基内,28 °C培养24 h后观察记录并计算肝胰腺内可培养细菌和弧菌总量,每个样品3组平行。吸取100 μL池水原液和10倍稀释液涂布于TSB和TCBS固体培养基内,28 °C培养24 h后观察记录并推算水体中可培养细菌和弧菌总量,每个样品3组平行。
1.4 免疫酶活性检测
随机选取5尾鲜活凡纳滨对虾,剪取0.1 g对虾肌肉组织,混匀后加入0.9 mL无菌0.9% NaCl溶液进行冰水浴研磨,将研磨均匀的组织匀浆置于4 °C、4 000 r/min条件下离心10 min后取上清液。参照商品免疫酶活试剂盒(南京建成生物工程研究所有限公司)测定方法对患病和健康养殖池塘对虾肌肉中的碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)和酚氧化酶(PO)活性进行检测,每个样品3组平行。
1.5 高通量测序分析
采用环境样本DNA提取纯化试剂盒(FastDNA®Spin Kit for Soil, MP Biomedicals)对10份水样滤膜总DNA进行提取,以16SrDNA基因V3~V4可变区特异性引物进行扩增,每份样品设立3个生物学重复,PCR扩增产物用1%琼脂糖凝胶电泳进行检测,检测合格后纯化回收产物,委托上海美吉生物医药科技有限公司,使用Miseq PE300/NovaSeq PE250平台对检测合格的纯化回收产物进行建库测序分析。
1.6 数据分析
用Mothus结合Excel软件进行数据统计和分析,并通过SPSS 13.0软件通过单因素方差分析(One-Way ANOVA)对数据进行分析,使用Duncan氏检验进行多重比较,P<0.05表示差异显著。使用QIIME计算每个样本物种的α多样性指数和门属水平的相对丰度图,基于Bray-Curtis非相似性进行主坐标分析(principal coordinates analysis,PCoA),使用R语言vegan包中冗余分析(RDA分析)和作图。
2 结果
2.1 养殖池塘环境理化因子变化分析
患病组和健康组池塘环境理化因子波动趋势相似,健康组气温、水温、DO、pH和盐度波动范围分别为23.0~27.0 °C、26.4~29.0 °C、4.26~5.56 mg/L、8.39~8.73、40~43。患病组气温、水温、DO、pH和盐度波动范围分别为23.0~27.0 °C、26.1~28.7 °C、5.1~6.08 mg/L、8.41~8.67、44~49。其中患病组DO和盐度比健康组高,水温和pH差异不大(表1)。
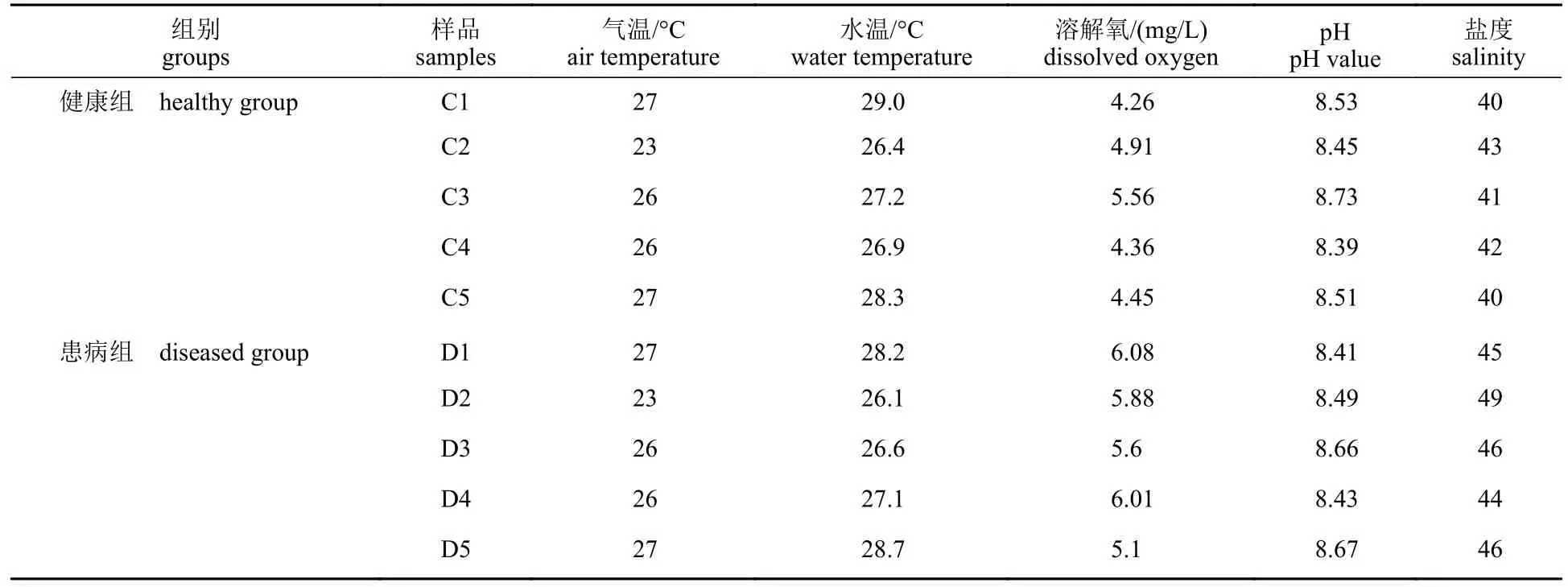
表1 健康组和患WFS组池塘环境理化因子检测信息表Tab. 1 Physical and chemical environment information of WFS pond and control pond
2.2 虾体和水体中可培养细菌变化分析
通过对虾体和水体中可培养细菌含量进行统计分析,发现健康组对虾肝胰腺内可培养细菌和弧菌含量分别为1.19×105~7.70×105和8.80×103~1.96×104CFU/g,弧菌占比2%~16%,弧菌占比处于较低水平。水体可培养细菌和弧菌含量为5.00×104~5.50×104CFU/mL和1.70~4.10×103CFU/mL,弧菌占比5%~34% (表2)。
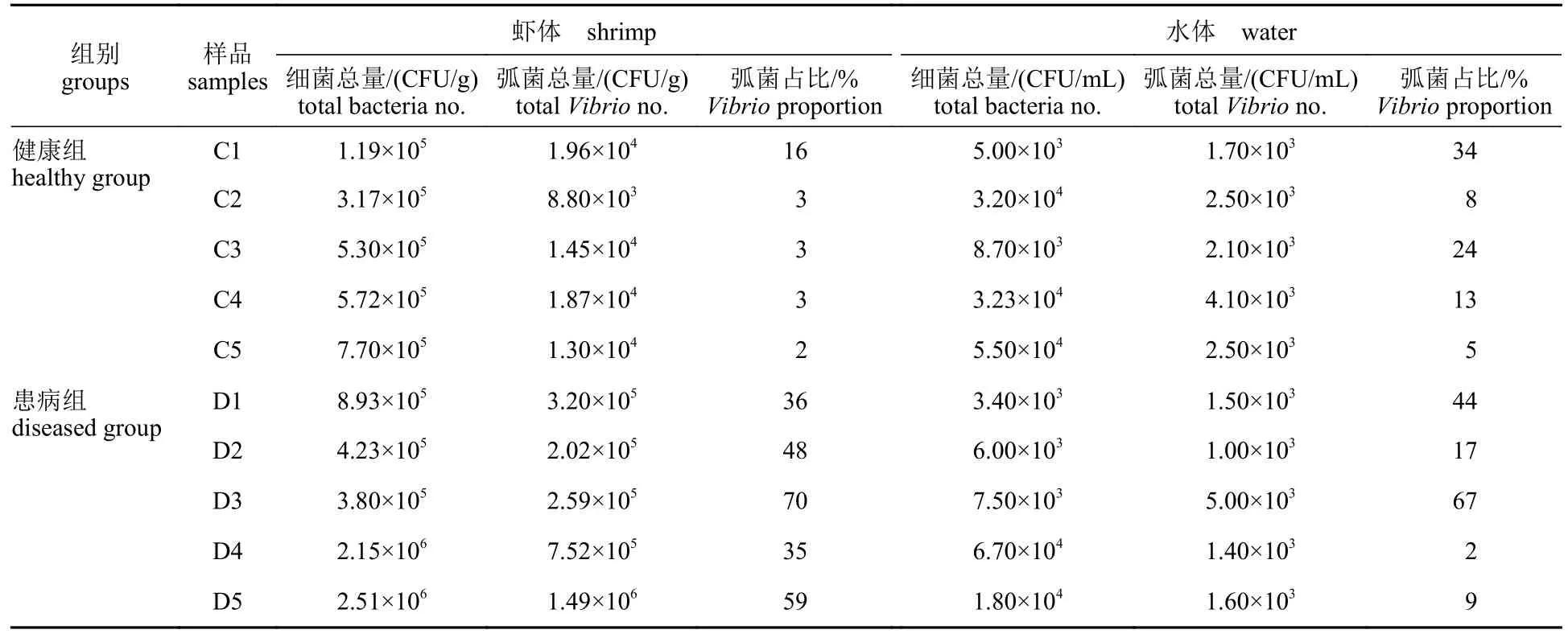
表2 水体和虾体肝胰腺组织中可培养微生物检测信息表Tab. 2 Culturable bacteria information in pond water and shrimp hepatopancreas
与健康组相比,患病组池塘凡纳滨对虾肝胰腺内可培养细菌、弧菌含量及占比普遍较高,数量分别为3.80×105~2.51×106CFU/g和2.02×105~1.49×106CFU/g,弧菌占比55%~70%,患病组虾体肝胰腺内弧菌数量比健康组高出1~2个数量级(15~113倍);水体可培养细菌和弧菌含量分别为3.40×103~6.7×104CFU/mL和1.00×103~5.00×103CFU/mL,弧菌占比为2%~67%,在可培养细菌含量和弧菌占比方面与健康组间未形成数量级别差异。
2.3 免疫酶活性变化分析
凡纳滨对虾免疫酶活性分析表明,AKP、ACP、LZM、SOD和PO等5种免疫酶活性的变化范围在健康组分别为1.21~5.64、9.17~15.25、3.56~7.43、4.83~6.70及3.10~4.55 U/mg。在患病组分别为2.12~5.39、19.22~26.96、19.73~26.85、3.00~4.14及7.76~9.21 U/mg。两组之间的ACP、LZM和PO等3种酶活性差异较大,同一天采样测试结果对比,患病组比健康组高出1~5倍;AKP、SOD等2种酶活性差异不大,波动幅度较小。结合凡纳滨对虾健康状况分析表明,凡纳滨对虾机体ACP、LZM、PO与WFS发生的相关性较强(表3)。
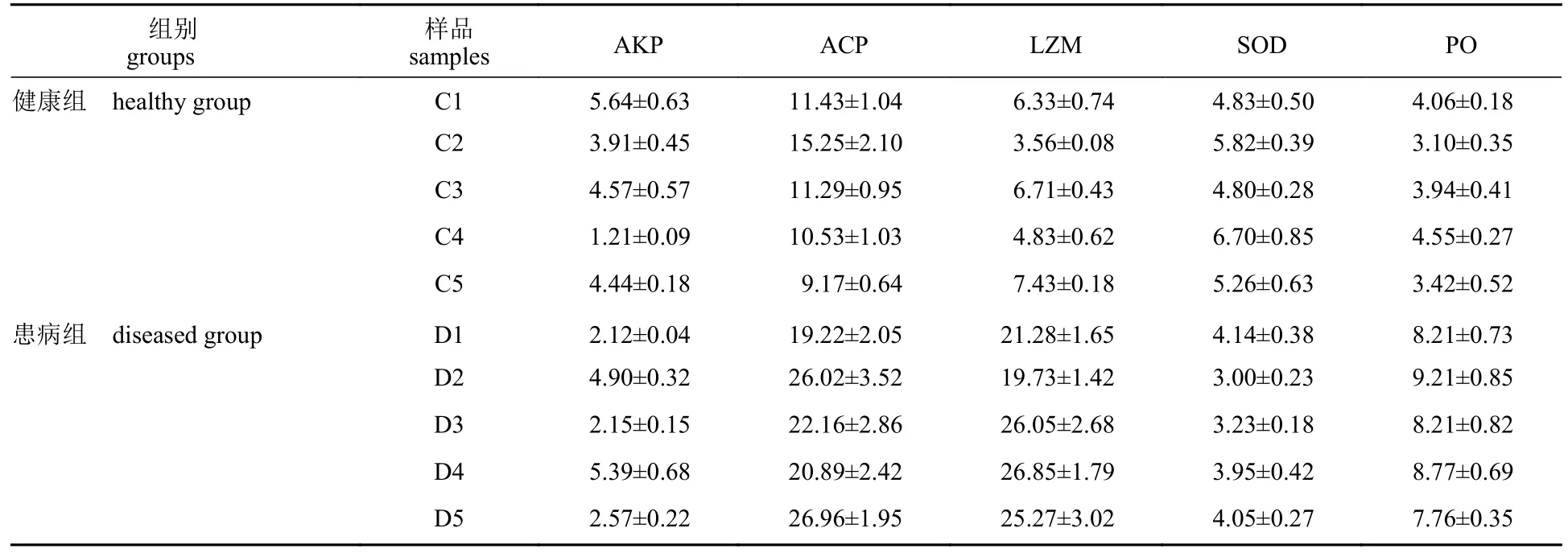
表3 凡纳滨对虾肌肉组织免疫酶活性检测信息表Tab. 3 Immune enzyme activity in muscle of L. vannamei U/mg
2.4 高通量测序结果
通过对实验周期内健康组(C1、C2、C3、C4、C5),患病组(D1、D2、D3、D4、D5)共10组样品进行高通量测序,获得的样本原始序列总数为1 695 662,为避免由于测序深度不同造成的偏差,每个样品随机选取,均一化至34 423条有效序列进行后续分析,经质控和优化后共得到1 032 690条有效序列。将一致性在97%以上的序列聚类成一个分类操作单位(OTU),共获得1 877个OTUs。10组样品的OTU数量范围为684~810个,其中健康组和实验组共有OTU 254个,特有OTU为41、34、43、41、62和82、54、38、90、56个。
对10组样品的OTU进行物种注释,构建α多样性指数的稀释曲线图和指数图(图1),分析可知,随着测序序列的增加,序列所对应样本的Shannon多样性指数曲线逐渐趋于平缓。样本测序覆盖率均在99.3%上,表明样品中序列未被检测的概率极低,测序数据合理充分,有效测序数量已经能够较好地覆盖菌群多样性(表4)。
图1 水体微生物在OTU水平的Shannon稀释曲线(a)和Coverage指数图(b)Fig. 1 Shannon dilution curve (a) and Coverage dilution index (b) at OTU level
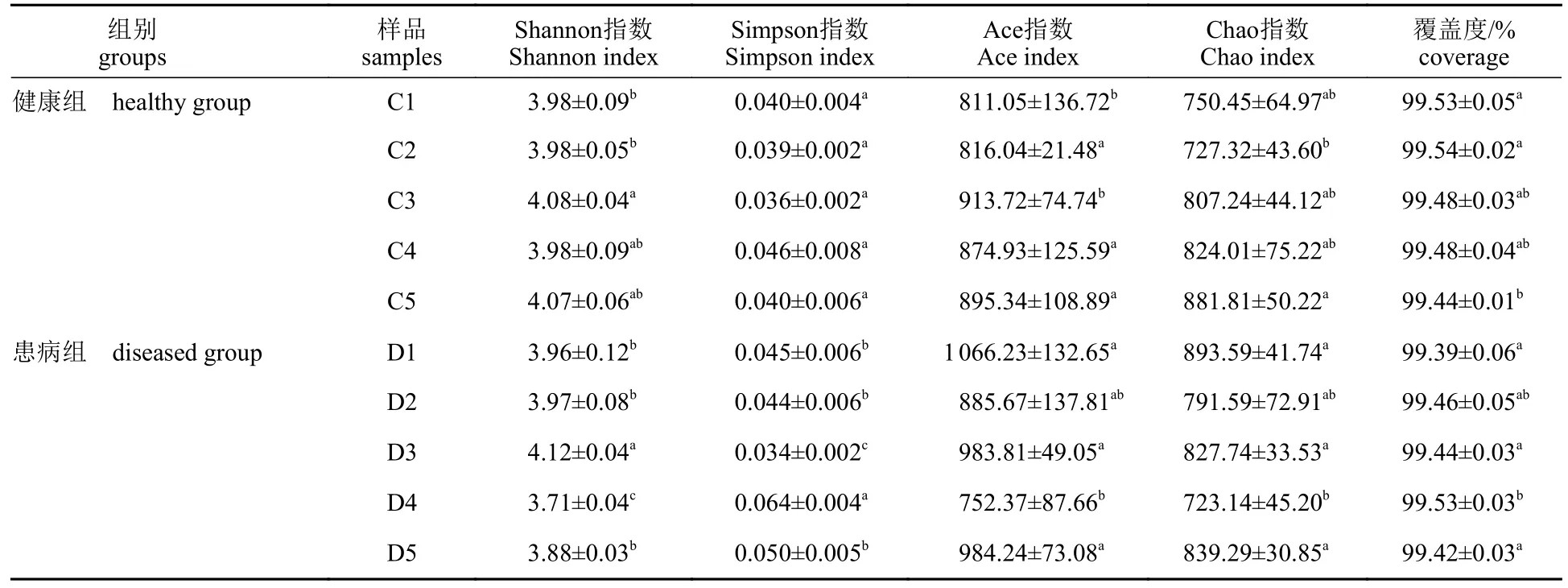
表4 水体微生物的α多样性指数分析Tab. 4 α - diversity index of microorganisms in pond water
2.5 白便综合征发生与水体微生物群落α多样性变化分析
α多样性指数分析表明,Ace、Chao、Shannon和Simpson指数在健康组分别为811.05~913.72、727.32~881.81、3.98~4.08和0.036~0.046;在患病组分别为752.37~1 066.23、723.14~893.59、3.71~4.88和0.034~0.064 (表4)。健康组池塘水体中微生物群落丰富度指数Ace和Chao随时间变化整体呈升高的趋势(P<0.05);患病组池塘水体中群落丰富度指数Ace和Chao指数波动幅度较大,整体呈下降趋势(P<0.05),且数值多高于健康组。
健康组池塘水体中有关微生物群落多样性指数Shannon随时间呈现一定升高趋势,Simpson指数无显著差异(P>0.05);患病组中Shannon指数和Simpson指数波动幅度较明显,均表现差异显著(P<0.05),且Shannon指数数值多低于健康组,Simpson指数多高于健康组。
基于Bray Curtis法在OTU水平上对10组样品间的群落差异进行主成分分析(PCoA)。结果显示,所有细菌群落主要沿第一轴分布,健康组和患病组的细菌群落结构差异明显,按照健康状况聚类,2个主坐标分别解释43.21%和21.4%的群落差异。健康组内样品(C1~C5)之间距离均相距较近,但和患病组间相距较远,表明组内样品之间群落组成较相似,组间群落组成差异性较大;患病组间样品(D1~D5)菌群结构离散程度随着疾病的发生逐渐拉大。此外,每个样本的3个平行之间距离相近,群落结构相似,表明每个样品的重复性足够好,能够充分支撑样品中微生物群落的相关分析结果(图2)。
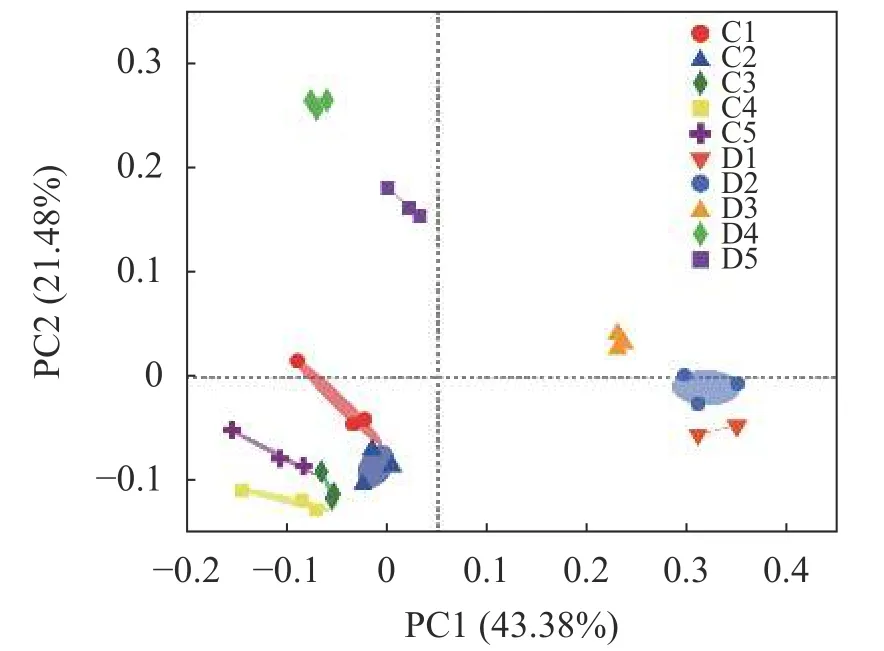
图2 水体微生物群落结构的主坐标分析(PCoA,基于Bray-Curtis距离)Fig. 2 Principal coordinate analysis of microbial community structure (PCoA, based on Bray Curtis distance)
2.6 白便综合征发生与水体微生物群落结构组成变化分析
通过对Miseq PE300/NovaSeq PE250平台所得有效序列在不同分类水平上进行物种注释和统计分析,所得有效数据共注释到35门609个属(图3)。在门水平上(相对丰度>0.2%),健康和患病水体中主要菌群为放线菌门(Actinomycetota)、拟杆菌门(Bacteroidota)、蓝藻门(Cyanobacteria)和变形菌门(Proteobacteria),其相对丰度在健康组分别为32.59%~40.42%、17.28%~29.25%、17.13%~26.71%和11.87%~14.49%;在患病组分别为25.97%~50.33%、14.75%~32.38%、7.50%~32.03%和13.55%~20.28%。随着患病周期延长,患病组中放线菌门、变形菌门相对丰度显著降低(P<0.05),拟杆菌门、蓝藻门相对丰度显著升高(P<0.05),γ-变形菌纲(Gammaproteobacteria)无显著变化。健康组中菌群结构整体在门水平相对丰度均未有显著差异(P>0.05),其中α-变形菌纲(Alphaproteobacteria)含量显著高于患病组(表5)。
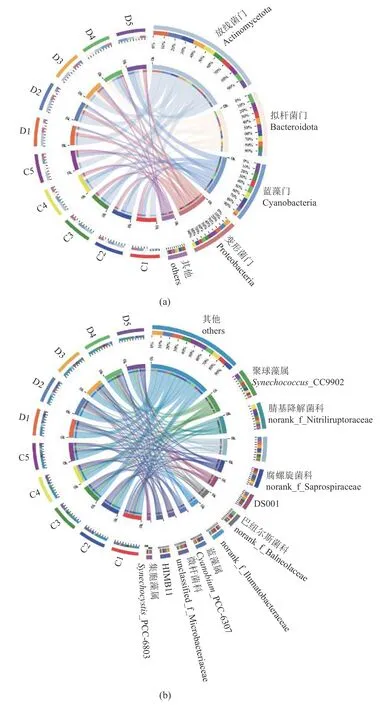
图3 水体微生物群落结构组成在门(a)和属(b)分类水平上的Circos图小半圆(左半圈)表示样本中物种组成情况,外层彩带的颜色代表的是来自某一分组,内层彩带的颜色代表物种,长度代表该物种在对应样本中的相对丰度;大半圆(右半圈)表示该分类学水平下物种在不同样本中的分布比例情况,外层彩带代表物种,内层彩带颜色代表不同分组,长度代表该样本在某一物种中的分布比例。Fig. 3 Circos diagram of microbial community structure at phylum and genus levelsThe small semicircle (left semicircle) represents the species composition, the outer ribbon represents the grouping, the inner ribbon represents the species,the length represents the relative abundance of the species in the corresponding sample; the large semicircle (right semicircle) represents the distribution proportion of species in different samples at the taxonomic level, and the outer ribbon represents the species, the inner ribbon represents different groups,and the length represents the distribution proportion of the sample in a species.
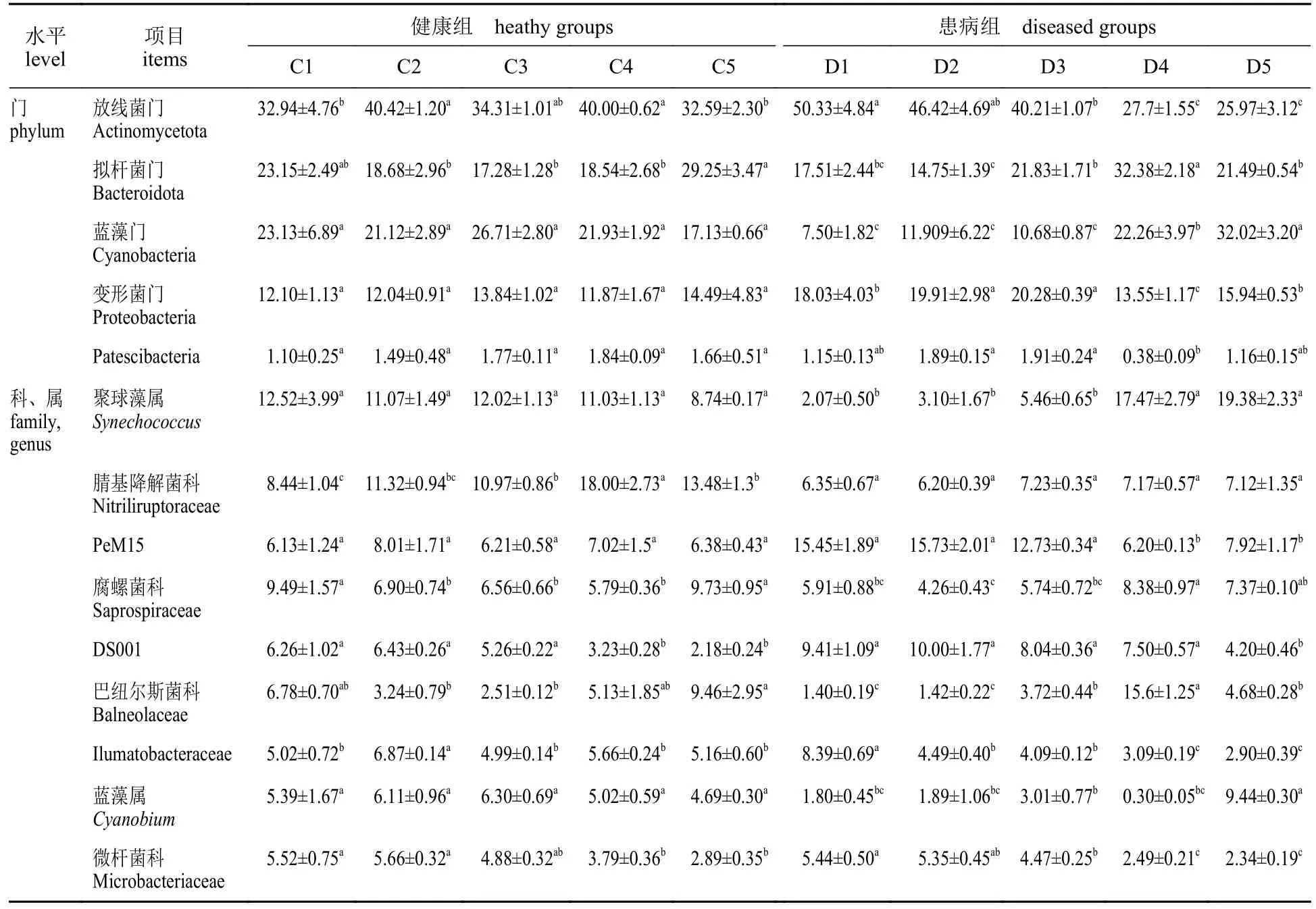
表5 池塘水体微生物群落在门和科、属水平上的相对丰度信息Tab. 5 Relative abundance information of microbial community at phylum, family and genus level in ponds%
在属、科水平上,10组中排名较高的优势菌群为聚球藻菌属(Synechococcus)、腈基降解菌科(Nitriliruptoraceae)、PeM15、腐败螺旋菌科(Saprospiraceae)、DS001、巴纽尔斯菌科(Balneolaceae)、Llumatobacteraceae、蓝藻属(Cyanobium)、微杆菌科(Microbacteriaceae)。其中患病组中聚球藻属、PeM15、腐螺菌科(Saprospiraceae)、巴纽尔斯菌科、蓝藻属显著降低,DS001、Llumatobacteraceae和微杆菌科(Microbacteriaceae)相对丰度显著升高,腈基降解菌科无显著变化;健康组中腈基降解菌科、DS001、微杆菌科相对丰度显著降低,其他菌群无显著变化(表5)。
2.7 水体微生物菌群组成与环境因子和生物因子的RDA分析
为了探究水体微生物群落组成与生物因子及非生物因子之间的关系,对微生物群落组成进行降趋对应分析(DCA),发现第1轴长度梯度为1.380 1,小于3,特征值为0.179 2,因此选用线性模型冗余分析(RDA分析)。采用Monte Carlo置换检验,即用permutest函数对T、DO、pH、盐度(Sat)、虾体细菌(SB)、虾体弧菌(SV)、水体细菌(WB)、水体弧菌(WV)等8个因子进行分析,共筛选出DO、Sat、SB、SV、WB等5个具有显著解释性的环境因子(P<0.05)。
RDA分析结果显示,轴1和轴2的解释贡献率分别为43.00%和15.95%,共累计解释了样本微生物群落空间分异的58.95%。与轴1相关性较强的因子主要有WB、Sat,其相关系数分别为–0.999 6和0.761 0,而与轴2相关性较强的因子为SV、SB、DO,相关系数分别为0.972 8、0.855 1和0.716 8。患病组D1、D2、D3水体样本群落分布与DO、Sat呈显著正相关,主要是OTU1213和OTU336丰度分布受到影响;患病组D4、D5与SV、SB、WB呈显著正相关,主要是OTU630丰度分布受到影响。健康组水体样本主要是OTU59丰度分布受WB显著影响,进而影响水体微生物群落分布(图4)。RDA分析结果显示,轴1和轴2共累计解释了微生物门类群落空间分异的61.03%。放线菌门和变形菌门类群与DO、Sat呈显著正相关,拟杆菌门和蓝藻门类群与SV、SB、WB呈显著正相关(图4)。
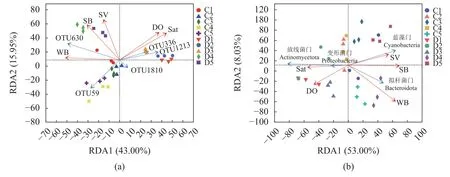
图4 基于不同水平的水体微生物群落组成与环境因子的RDA分析(a) OTU水平的RDA分析,(b) 门水平的RDA分析;红色箭头表示影响因子,蓝色箭头表示优势OTU或门类群。Fig. 4 RDA analysis of microbial community composition and environmental factors(a) RDA on OTU level, (b) RDA on phylum level; the red arrows indicate the influencing factors, and the green arrow indicates the dominant OTU group or phylum group.
3 讨论
水体中的pH、DO、温度、盐度等环境因子对虾类生长、发育、繁殖有着重要的调控作用[18]。研究表明,WFS的发生与天气突变、养殖水质和底质恶化有较大的关系[19]。但本研究发现,凡纳滨对虾池塘养殖模式下患病组与健康组池塘内pH、DO、温度、盐度波动趋势相似,水温和pH区别不大,只有DO和盐度比健康组高。自然环境中pH、DO、温度、盐度受环境气候和水源情况的影响较大,由WFS发生导致的环境因子的变化可能被弱化,进而未检测出明显的环境理化因子差异。对虾体内和养殖水体的细菌变化特别是弧菌丰度的增加是导致对虾病害暴发的主要原因之一。弧菌大量扩增及环境恶化是导致WFS发生的重要原因[7]。本研究发现,患病组对虾肝胰腺内可培养细菌和弧菌总量普遍比健康组高,其中弧菌数量比健康组高15~113倍,符合对虾WFS的病原为弧菌的特征。AKP、LZM、ACP、SOD、PO等非特异性免疫酶活性常被用作衡量凡纳滨对虾免疫能力的重要指标[20]。多项研究表明,对虾机体免疫酶活性会在外界环境因子、病原因子的作用下发生变化[21-23]。本研究表明,患病组对虾肌肉的ACP、LZM、PO等3种酶活性明显高于健康组,而AKP、SOD等2种酶活性在两组间差异性不大,波动幅度也较小。说明病原等外界刺激可能会调动机体自身的免疫酶活性而产生一定的免疫保护反应。
菌群结构组成与多样性很大程度上影响着养殖动物健康,已有研究发现,Ace、Chao和Shannon指数越高,Simpson指数越低,菌群丰度和多样性越高[24-25]。疾病发生后,稳定的微生物群落结构被改变,多样性降低[26]。吴金凤等[27]通过对凡纳滨肠道及其水体微生物多样性研究表明,患病对虾肠道多样性均低于健康组,且差异显著。本研究结果表明,患病组Shannon指数数值多低于健康组,Simpson指数多高于健康组,但差异不明显,这和郁维娜等[28]关于患病对虾肠道多样性均低于健康组但差异不显著的研究结果一致。健康组池塘水体中Ace、Chao、Shannon指数随时间变化整体呈升高的趋势(P<0.05),患病组中则呈降低趋势,且患病组池塘水体中Ace、Chao指数在患病初期的数值多高于健康组,分析原因可能是患病池塘初始的水体微生物群落多样性高于健康组,但随着WFS的持续,整体呈下降趋势。物种注释和统计分析结果表明,水体菌群组成在健康组和患病组池塘水体中优势种类相同,但组成比例变化存在显著差异。与健康组池塘水体细菌组成相比,患病组中放线菌门、变形菌门相对丰度降低,拟杆菌门、蓝藻门相对丰度显著升高(P<0.05)。健康组中菌群结构整体在门水平的相对丰度均未有显著差异(P>0.05)。Xue等[29]通过研究凡纳滨对虾育苗期水体菌群结构特征发现,苗池水体菌群主要以变形菌门和拟杆菌门、放线菌门为主。黄雪敏等[30]通过对健康与发病对虾池水中菌群结构比较发现,发病池水中放线菌门丰度显著低于健康池水。李卢国等[31]和吴越等[32]通过对水体微生物菌群分析发现,关于养殖水体的好坏与变形菌门菌群丰度存在正相关,表明水体菌群结构组成变化特征对对虾WFS发生具有一定的指示作用。
水体微生物的群落结构组成与水质环境因子和生物因素的变化密不可分[33]。闫苏苏等[34]通过对长寿湖浮游植物功能群季节变化与环境因子的关系研究发现,透明度、水温、电导率、光照强度、溶解氧和总氮是影响长寿湖浮游植物功能群变化的主要环境因子,郑诚等[35]通过对四明湖浮游植物群落结构的季节演替规律研究发现,水温、透明度、硝态氮、浮游植物生物量是影响浮游植物群落结构动态变化的主要因子,Yang等[36]通过探讨营养富集对浮游细菌群落组成和稳定性的影响研究表明,对虾养殖过程中营养物质的富集改变可以破坏群落的稳定性。为探讨水体微生物群落组成与生物因子及非生物因子之间的关系,本研究通过对微生物群落组成和环境因子进行RDA关联分析并采用蒙特卡洛置换进行显著性检验,结果显示,溶解氧、盐度、虾体细菌、虾体弧菌、水体细菌是影响患病对虾池塘水体中菌群结构组成的显著因子,溶解氧、盐度的变化影响放线菌门和变形菌门类群数量,虾体细菌、虾体弧菌和水体细菌的变化影响拟杆菌门和蓝藻门类群数量,且随着病害的持续,水体和虾体中的病原菌因子会超越环境因子成为水体微生物菌群结构组成的主导影响因子。
综上所述,本研究通过系统解析对虾WFS发生后水质理化因子、虾体和水体中可培养微生物、虾体自身免疫力及水体菌群结构变化情况,首次从环境因子、微生物和宿主免疫反应的角度结合宏基因组测序手段对池塘养殖环境下对虾WFS的发生进行系统性分析。研究表明,弧菌大量扩增是导致此次对虾WFS发生的主要致病因素,同时病害的发生会调动机体自身ACP、LZM、PO等免疫酶活性升高,进而产生免疫保护效应,高通量测序分析表明,水体微生物群落结构组成与多样性存在显著差异,且与溶解氧、盐度、水体和虾体中病原菌的相关性较强。相关研究结果对深入了解池塘养殖模式下对虾WFS的发生与环境、病原和机体免疫间的相互关系,建立疾病综合诊疗技术提供理论支撑。
(作者声明本文无实际或潜在的利益冲突)
