罗氏沼虾胞质锰超氧化物歧化酶的功能
2024-01-22李亚男陆霖青秦真东
李亚男, 陆霖青, 张 鹏, 张 博, 林 蠡*, 秦真东*
(1. 仲恺农业工程学院动物科技学院,广东省水环境与水产品安全工程技术研究中心,广州市水产病害与水禽养殖重点实验室,广东 广州 510225;2. 中国水产科学研究院南海水产研究所,广东 广州 510300)
罗氏沼虾(Macrobrachium rosenbergii)隶属于节肢动物门(Arthropoda)软甲纲(Malacostraca)沼虾属(Macrobrachium),原产于东南亚,自20世纪60年代从日本引进中国,现已成功实现人工繁育,目前在国内多省市均有养殖。罗氏沼虾因其生长快、肉质鲜美,经济效益明显,已成为我国重要的水产经济虾类之一[1]。然而近年来,随着养殖密度的加大,细菌性疾病、真菌性疾病、病毒性疾病和寄生虫病等不断暴发,严重危害沼虾养殖业,给该行业带来了巨大的经济损失[2-3]。
罗氏沼虾缺乏比较完善的获得性免疫系统,主要依靠凝血、凝集、吞噬、酚氧化酶原激活系统、抗菌肽以及呼吸爆发产生活性氧分子(ROS)等先天性免疫方式抵御病原入侵[4-6]。其中,持续高水平的ROS在发挥杀菌功能的同时,会增加机体氧化应激水平,引发氧化损伤,细胞凋亡等,降低机体防御能力[7-10],因此,合理的ROS水平对于维持机体稳态、提高抵抗力至关重要。研究表明,超氧化物歧化酶(SODs)是消除生物体内过量ROS的第一道防线,可特异性地将超氧阴离子自由基(O2−·)歧化为过氧化氢(H2O2),进一步由过氧化氢酶(CAT)转化为无毒的水分子[11],蛋白质[8-10]是无脊椎动物先天性免疫非常重要的组成部分[12-13]。但是,SODs在水产甲壳动物中的研究还处于初级阶段,详细了解其分子生物学特性和免疫功能对于良种培育和病害防控都有积极的意义。因此,本研究克隆了罗氏沼虾胞质MnSOD基因(MrcMnSOD),制备了多克隆抗体,对其在不同组织中的表达模式进行了转录水平和蛋白质水平的分析,此外,初步探讨了该蛋白质的免疫功能,旨在为深入研究罗氏沼虾SOD的功能奠定基础。
1 材料与方法
1.1 实验材料
实验所用罗氏沼虾购自广东金洋水产养殖有限公司,平均体长(10±2) cm,暂养于实验室28 °C充气循环水中,适应1周后开始实验,经麻醉后取样,样品置于−80 °C冰箱用于后续提取RNA。实验所用嗜水气单胞菌(Aeromonas hydrophila),使用前先于37 °C无抗LB培养基中过夜活化,后用无菌磷酸盐缓冲溶液(PBS)清洗菌体3次,使用无菌PBS重悬菌液至浓度为1×106CFU/mL[14]时进行腹部注射。本研究获得了仲恺农业工程学院动物科技学院实验动物管理和使用伦理委员会批准,实验过程中操作人员严格遵守相关规范,并按照伦理委员会制定的规章制度执行实验操作。
1.2 实验试剂
TRIzol Reagent、PCR Mix、大肠杆菌(Escherichia coli) DH5α、大肠杆菌 BL21 (DE3)感受态细胞、EcoRⅠ和XhoⅠ限制性内切酶、His标签特异性层析柱购于宝日医生物技术(北京)有限公司(TaKaRa)。逆转录试剂盒GoldenstarTMRT6 cDNA Synthesis Kit购自北京擎科生物科技有限公司。一步克隆试剂盒(ClonExpress MultiS One Step Cloning Kit)、凝胶回收试剂盒购于南京诺唯赞生物科技股份有限公司。实时荧光定量PCR (qRT-PCR)采用quantinova-SYBR-Green PCR试剂盒。Bradford蛋白质浓度测定试剂盒购于上海碧云天生物技术有限公司。小鼠(Mus musculus)抗His-tag抗体,HRP标记山羊抗小鼠Ig G购于北京博奥森生物技术有限公司。引物以及其他无特殊说明的试剂均购于生工生物工程(上海)股份有限公司。
1.3 总RNA提取和基因克隆
使用TRIzol法进行总RNA提取后,使用超微量分光光度计NP80 (IMPLEN,德国)检测RNA的纯度,当A260/A280达到1.8~2.0后进行下一步操作。根据逆转录试剂盒操作说明,逆转录合成单链cDNA。根据GenBank中MrcMnSOD开放阅读框序列(ABU55005.1,编码286个氨基酸),设计该基因一步克隆引物MrcMnSOD-32a S和MrcMnSOD-32a A(表1),以cDNA为扩增模板,扩增MrcMnSOD序列,扩增得到的基因序列需经胶回收纯化。
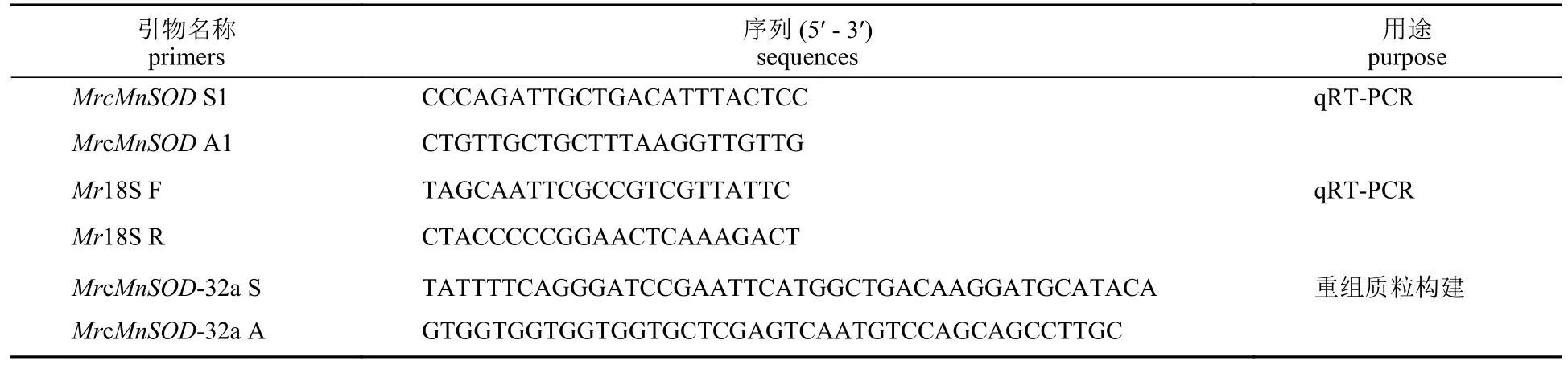
表1 引物序列Tab. 1 Primers used in this study
1.4 重组蛋白质表达与纯化
根据一步克隆试剂盒操作说明,将纯化后的基因扩增产物与线性化的PET-32a载体进行同源重组反应,构建重组质粒PET-32a-MrcMnSOD。将重组质粒转化入大肠杆菌 DH5α感受态细胞,进行阳性克隆子筛选。阳性克隆子经测序检验正确后,进一步提取质粒转化入大肠杆菌BL21 (DE3)表达菌株进行重组蛋白质表达。37 °C、200 r/min的条件下,表达菌在含有氨苄的LB培养基中培养至OD600达到0.6后,添加0.1 mmol/L 异丙基-β-D-硫代半乳糖苷在37 °C下继续振荡培养5~6 h,诱导重组蛋白质大量表达。离心收集菌体,PBS清洗菌体3次后,重悬菌体并在低温下进行超声波破碎,使用12%的变性聚丙烯酰氨凝胶电泳(SDS-PAGE)蛋白质检测融合蛋白质的表达情况。使用宝日医生物技术(北京)有限公司His标签特异性层析柱对上清蛋白质进行纯化回收,操作详见使用手册。
1.5 抗体制备与检测
收集纯化后的重组蛋白质送至武汉福因德公司免疫新西兰大白兔(Oryctolagus cuniculus),获得兔源性MrcMnSOD多克隆抗体。抗体制备完成后,采用酶联免疫吸附检测法(ELISA)检测抗体效价。为检测抗体特异性,采集罗氏沼虾新鲜组织样品0.5 mg制备组织蛋白质样品:加入1 mL RIPA裂解液,冰上研磨至组织充分裂解,4 °C下12 000 r/min 离心5 min,取上清液与蛋白质上样缓冲液混合煮沸10 min进行12% SDS-PAGE凝胶电泳。电泳后进行半干转膜,室温下5%脱脂奶粉封闭2 h,TBST清洗3次,每次5 min。5%脱脂奶粉稀释小鼠抗His-tag抗体至1∶1 000 (体积比),4 °C过夜孵育,TBST清洗3次,每次5 min。再用HRP标记山羊抗小鼠二抗Ig G (1∶10 000)孵育1 h后,TBST缓冲液洗涤3次,每次5 min。其中,脱脂奶粉溶于TBST中。最后ECL显色1 min,使用化学发光及荧光成像系统Chemi Scope 6 000拍照。
1.6 组织表达模式分析
将罗氏沼虾随机分为实验组和对照组。实验组每尾虾腹肌注射活化后的100 μL 1×106CFU/mL嗜水气单胞菌,对照组每尾注射等量无菌PBS。注射后0、3、6、12和24 h,采集肝胰腺和肠组织进行总RNA提取、cDNA逆转录和qRT-PCR,以18SrRNA为内参基因(表1),分析基因转录水平表达模式。每个时间点取3尾虾进行混样,平均取3次。20 μL qRT-PCR反应体系:2×SYBR Green PCR Master Mix QN 10 μL,RNase-free water 7 μL,cDNA模板(5倍稀释) 2 μL,引物MrcMnSOD S1/MrcMnSOD A1各0.5 μL。反应条件:95 °C 2 min;95 °C 5 s,60 °C 30 s,72 °C 40 s,40个循环。采用2−ΔΔCt法计算mRNA水平相对表达量。蛋白质水平表达模式分析取攻毒后12和24 h的肝胰腺、肠组织保存于4%的多聚甲醛中,后送至武汉赛维尔生物科技有限公司进行组织蜡片制备和组织免疫荧光分析。
1.7 抑菌实验
抑菌实验参照Zheng等[15]的方法进行,略作修改。选取3种革兰氏阴性菌[嗜水气单胞菌、大肠杆菌、副溶血性弧菌(Vibrio parahaemolyticus)]以及2种革兰氏阳性菌[无乳链球菌(Streptococcus agalactiae)和金黄色葡萄球菌(Staphylococcus aureus)],与MrcMnSOD进行共培养,检测重组蛋白质的抑菌效果。实验开始前,先将菌株过夜活化,使用无菌PBS清洗菌体3次后,重悬菌液调整浓度至2×107CFU/mL。培养实验在37°C下、96孔酶标板中进行,蛋白质终浓度分别设置为50和100 μg/mL,PBS作为空白对照,每组设置3个重复,每小时用酶标仪读取A630值。
1.8 数据分析
使用SPSS 21.0软件中单因素方差分析(ANOVA)进行数据处理,分析差异性。所有数据均以平均值±标准差(mean±SD) (n=3)表示。P<0.05和P<0.01分别被认为有显着差异和极显著差异。使用Graphpad prism 7.0软件进行作图。
2 结果
2.1 重组蛋白质表达与纯化
经0.1 mmol/L IPTG 37 °C诱导5~6 h后,重组蛋白质可在上清液中大量表达(图1)。MrcMnSOD蛋白质开放阅读框由286个氨基酸组成,分子质量约为31 ku,PET-32a载体标签蛋白质约为18 ku,因此推测表达的融合蛋白质约为49 ku,与SDSPAGE检测结果一致。纯化后的上清液重组蛋白质纯度可达95 %以上,浓度达到1 mg/mL,满足后续抗体制备送样要求。用制备的MrcMnSOD多克隆抗体作为一抗进行免疫印迹实验,检测罗氏沼虾组织样品中的MrcMnSOD (图1,第1泳道),在约31 ku 处检测到1条特异性蛋白质条带,大小和预测的MrcMnSOD蛋白质一致,说明制备的多克隆抗体特异性好。
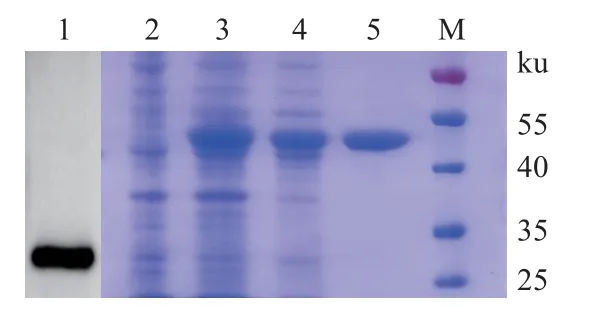
图1 MrcMnSOD的SDS-PAGE检测图M. 蛋白质marker,1. MrcMnSOD多克隆抗体鉴定,2. IPTG诱导前菌体总蛋白质,3. IPTG诱导后菌体总蛋白质,4. 诱导后上清液总蛋白质,5. 纯化后的重组蛋白质。Fig. 1 SDS-PAGE detection of MrcMnSODM. protein marker, 1. detection of polyclonal antibody of MrcMnSOD,2. total protein from E. coli BL21 (DE3) before IPTG induction, 3. total protein from E. coli BL21 (DE3) after IPTG induction, 4. total supernatant protein, 5. the purified recombinant protein.
2.2 抗体效价检测
ELISA效价检测结果显示,制备的MrcMnSOD多克隆抗体效价可达6 250 000倍(图2)。
2.3 转录水平表达模式分析
为了评估MrcMnSOD是否参与罗氏沼虾对嗜水气单胞菌的免疫反应,采用qRT-PCR分析了嗜水气单胞菌感染罗氏沼虾后肝胰腺和肠组织中的基因表达变化。结果显示,MrcMnSOD在肝胰腺中的表达量在感染后3 h达到峰值,随后逐渐恢复(图3-a)。肠组织中,MrcMnSOD表达量随着感染时间的延长不断增大,感染后6 h达到峰值,之后表达量虽有所降低,但依然显著高于对照组(图3-b)。该结果表明,嗜水气单胞菌感染可显著激活MrcMnSOD的基因表达水平。
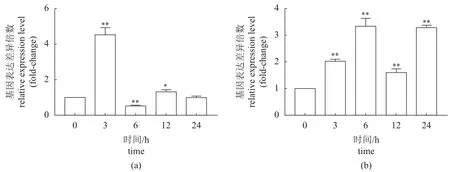
图3 嗜水气单胞菌感染后MrcMnSOD表达变化(a) 肝胰腺;(b) 肠。*. P<0.05,**. P<0.01。Fig. 3 Expression of MrcMnSOD after A. hydrophila infection(a) hepatopancreas;(b) intestine. *. P<0.05, **. P<0.01.
2.4 蛋白质水平表达模式分析
嗜水气单胞菌感染后,采用组织免疫荧光法检测罗氏沼虾肝胰腺和肠组织中MrcMnSOD表达变化。结果显示,肝胰腺中MrcMnSOD随着感染时间的延长表达水平持续增高,感染后24 h达到峰值(图版Ⅰ)。肠中MrcMnSOD表达水平在感染后12 h达到峰值,之后表达水平下降(图版Ⅱ)。结果表明,嗜水气单胞菌感染可显著激活MrcMnSOD的蛋白质表达水平。
2.5 抑菌实验
为了初步探究MrcMnSOD参与免疫反应的机制,本研究选取5种常见细菌与重组蛋白质进行共培养实验。结果显示,相比于对照组,MrcMnSOD可显著抑制3种革兰氏阴性菌和2种革兰氏阳性菌的生长。对于嗜水气单胞菌而言,100 μg/mL重组蛋白质的抑菌效果高于50 μg/mL,而在其他几种细菌的培养实验中,MrcMnSOD抑菌效果与蛋白质浓度的依赖关系不显著(图4)。
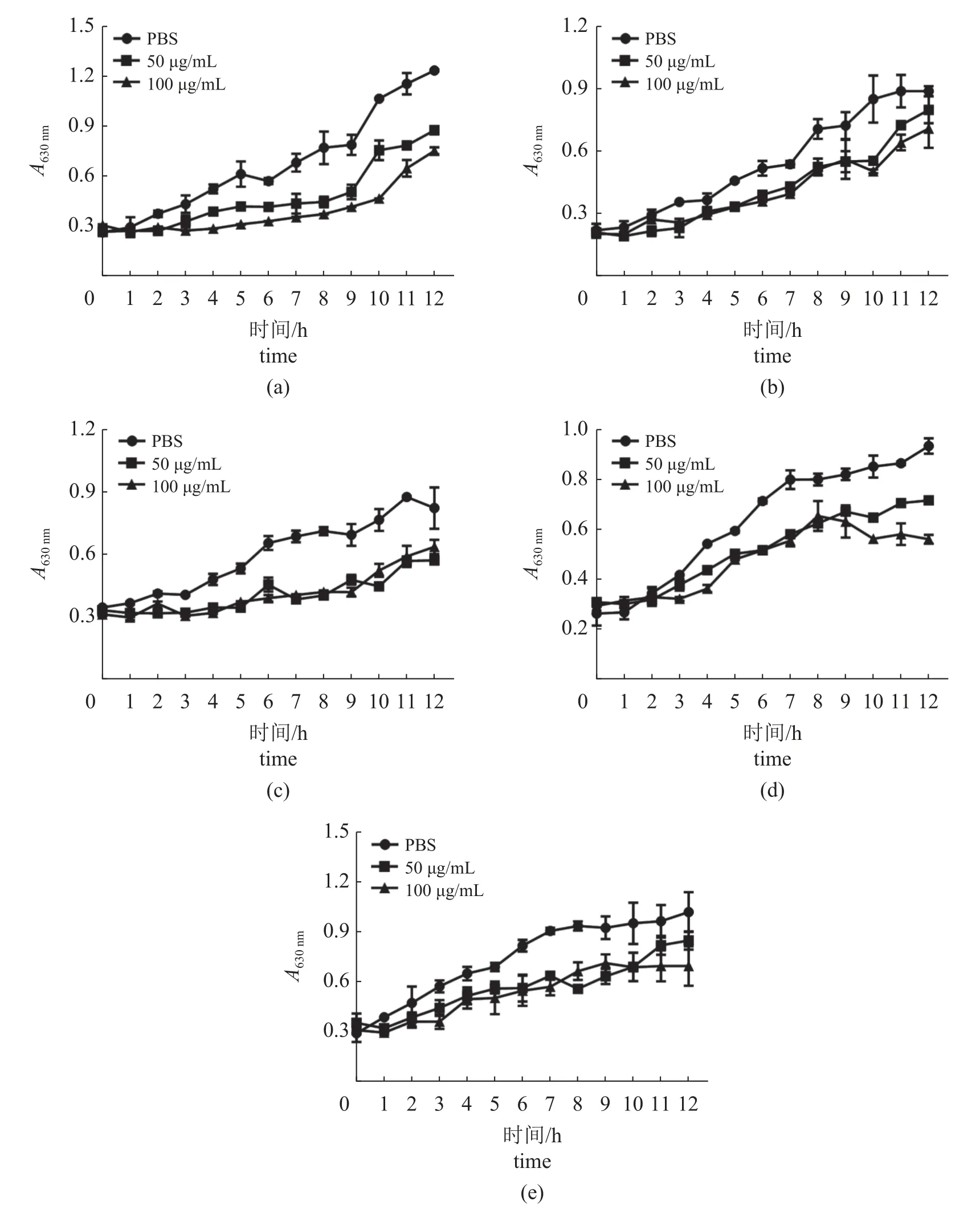
图4 MrcMnSOD抑菌效果检测(a) 嗜水气单胞菌;(b) 副溶血性弧菌;(c) 大肠杆菌;(d) 无乳链球菌;(e) 金黄色葡萄球菌。Fig. 4 Antibacterial effect detection of MrcMnSOD(a) A. hydrophila; (b) V. parahemolyticus; (c) E. coli; (d) S. agalactiae; (e) S. aureus.
3 讨论
罗氏沼虾口味鲜美,富含丰富的微量元素和氨基酸,受到消费者的喜爱。据统计,2020年中国罗氏沼虾的养殖产量接近14万t[16-17],是中国重要的经济水产养殖动物之一。但是,近年来随着养殖规模的扩大以及集约型养殖模式的推广,罗氏沼虾养殖业病害频发,严重危害该产业的健康发展[18-19]。嗜水气单胞菌是养殖水体中一类重要的条件致病菌,可感染罗氏沼虾肝胰腺,引起孵化期和生长期的较高死亡率[20-21]。研究发现,对虾黑斑坏死病与嗜水气单胞菌属和其他病原菌,如弧菌和假单胞菌的联合感染有关。因此,嗜水气单胞菌侵染过程中的免疫机制近年来也备受关注[14]。
SODs是无脊椎动物先天性免疫的重要组成部分[7,22]。在哺乳动物中,MnSOD被认为是一种应激因子,其表达水平可能受环境和生物刺激的影响[23]。本研究中,嗜水气单胞菌感染期间,罗氏沼虾MrcMnSOD在基因表达水平和蛋白质表达水平都被显著激活,表明该基因参与了细菌感染期间机体氧化还原稳态的调节与抗菌免疫,这与前人的研究报道相一致。如Lin等[24]克隆了日本囊对虾(Marsupenaeus japonicus)的cMnSOD,并发现在溶藻弧菌(V. alginolyticus)的刺激下,该基因能在血淋巴中异常高表达。有学者报导cMnSOD可在凡纳滨对虾(Litopenaeus vannamei) 感染白斑综合征病毒免疫应答中发挥作用[25]。Cheng等[26]虽克隆了MrcMnSOD,证实该基因参与格氏乳球菌(Lactococcus garvieae)的免疫应答,但并未对其免疫机制做进一步解释,硬骨鱼类、甲壳类和软体动物中也报道了类似的发现[7,27-30]。然而,以上研究主要集中在病原体入侵后该基因表达水平的变化,少有研究其蛋白水平的表达变化,对其抗菌免疫机制也未做进一步研究。
本研究通过抑菌实验,初步探究了MrcMnSOD参与免疫反应的可能机制。与对照组相比,实验组添加MrcMnSOD后,5种细菌生长明显受到抑制,提示MrcMnSOD可能作为一种免疫相关因子参与免疫应答。但对于不同细菌而言,抑菌效果不尽相同,如嗜水气单胞菌抑菌实验中,抑菌效果随着蛋白质浓度的增大而增强,这种现象在其他几种细菌中并不显著,推测这可能与不同细菌表面组成差异相关。有研究发现,鮻 (Liza haematocheila)的MnSOD可显著抑制格氏乳球菌、藤黄微球菌(Micrococcus luteus)和大肠杆菌的生长[31]。Zheng等[15]对魁蚶(Scapharca broughtonii) MnSOD抗菌功能研究表明,魁蚶MnSOD可抑制大肠杆菌、金黄色葡萄球菌和藤黄微球菌的生长,且抑制作用与蛋白质浓度关系不显著,与当前实验结果一致。另有报道称,罗氏沼虾CuZnSOD可通过凝集效应发挥抑菌效果[32],但MrcMnSOD是否具有和CuZnSOD同样的抑菌机制尚不清楚,有待进一步研究证实。总之,本研究阐释了MrcMnSOD可能作为免疫相关分子参与抗菌应答的依据,为今后罗氏沼虾病害防控相关研究奠定基础。
(作者声明本文无实际或潜在的利益冲突)
