响应面法优化长茎葡萄蕨藻多糖提取工艺及抗氧化活性
2024-01-22童艳梅陈秀荔胡庭俊刘青云李强勇冯鹏霏杨春玲朱威霖潘传燕曾地刚赵永贞
童艳梅, 陈秀荔, 胡庭俊, 刘青云,3, 李强勇,3, 冯鹏霏,杨春玲, 彭 敏, 朱威霖, 潘传燕, 曾地刚, 赵永贞,3*
(1. 广西大学动物科学技术学院,广西 南宁 530005;2. 广西壮族自治区水产科学研究院,广西 南宁 530021;3. 广西虾类繁育工程技术研究中心,广西 南宁 530021)
长茎葡萄蕨藻(Caulerpa lentillifera)属于绿藻门(Chlorophyta)羽藻目(Bryopsidophyceae)蕨藻科(Caulerpaceae)蕨藻属(Caulerpa),是一种多年生大型可食用海藻,因其直立茎球状体晶莹剔透、圆润饱满似葡萄,且藻体软嫩多汁,口感如鱼子酱般丰富,又有“海葡萄”和“绿色鱼子酱”的美称[1]。长茎葡萄蕨藻具有丰富的营养成分,含人体所需的多种氨基酸、维生素、多糖和脂肪酸等,是最符合人类食用的蕨藻之一[2]。研究表明,长茎葡萄蕨藻的粗多糖含量占干重的34.00%~64.97%[2-8],高于绝大部分的可食用海藻,如马尾藻(Scagassum)、羊栖菜(Hizikia fusifarme)、裙带菜(Undaria pinnatifida)[9]等,具有较高的经济价值。
目前长茎葡萄蕨藻多糖的提取方式主要有水提取法、碱提取法和超声波辅助提取法等方法,其提取率为3.22%~11.30%[10-14],表明仍有大量的长茎葡萄蕨藻多糖未被完全提取。王小兵等[15]采用速溶剂萃取技术(ASE)提取长茎葡萄蕨藻多糖,多糖提取率能达到51.03%,但该方法对仪器条件的要求较苛刻,成本较高。因此,研发一种温和、高效、低成本的长茎葡萄蕨藻多糖提取工艺对于促进长茎葡萄蕨藻深加工产业的发展意义重大。
酶解法是近年来使用最为广泛的植物多糖提取方法,郑朝阳等[16]研究表明,木瓜蛋白酶能水解植物中的游离蛋白质,减少多糖与蛋白质的结合,从而有效提高多糖提取率。为此,本研究将木瓜蛋白酶酶解法与目前已有的长茎葡萄蕨藻多糖提取方法进行对比筛选,确定提取多糖的最佳方法,并采用单因素和响应面法优化提取工艺,同时也探究了长茎葡萄蕨藻多糖的抗氧化活性,以期为长茎葡萄蕨藻多糖的开发利用提供理论基础和科学依据。
1 材料与方法
1.1 实验材料
药物 长茎葡萄蕨藻鲜藻委托杭州牧海食品经营有限公司从越南芽庄购入。
主要试剂 木瓜蛋白酶(G8431)、1,1-二苯基-2-苦基肼(DPPH)标准品(SD9360)、2,2-二氮-双(3-乙基苯并噻唑-6-硫酸)二铵盐(SA5340),北京索来宝科技有限公司。NaOH (天津博迪化工有限公司,批号:2019年8月23日)。正丁醇(天津市富宇精细化工有限公司,批号:2020年9月25日)。
主要仪器 恒温水浴锅(英国,Grant SUB6),电磁炉(九阳,JYC-19BE5),高速冷冻离心机(德国艾本德,Centrifuge 5810R),旋转蒸发仪(上海亚荣生化仪器厂,RE-52AA),冷冻干燥机(德国Christ, ALPHA 1-4 LD plus),电子天平(沈阳龙腾电子有限公司,ESJ110-48),电热恒温鼓风干燥箱(上海精宏实验设备有限公司,DHG-9240A),高速度功能粉碎机(永康市云达机械设备厂,JR-200),酶标仪(北京普朗新技术有限公司,DNM-9602G)。
1.2 实验方法
制备长茎葡萄蕨藻粉末 用海水清洗长茎葡萄蕨藻,然后用蒸馏水再洗涤3次,并在50 ℃的烘箱中干燥,随后粉碎过50目药典筛,并保存在干燥器中备用,按药典方法测定水分。
筛选提取方法 根据已有文献公布的研究方法,分别尝试5种不同的提取方法提取长茎葡萄蕨藻粗多糖(表1),根据多糖提取率、成本、便捷及可行性确定用于本研究的基础方法。

表1 五种提取长茎葡萄蕨藻粗多糖方法的简要流程Tab. 1 Summaries of five methods for extracting polysaccharides from C. lentillifera
按上述简要流程,具体方法如下。
①取308 g新鲜长茎葡萄蕨藻(通过预实验得知10 g藻粉=308 g鲜藻)洗净,手动榨汁得到的长茎葡萄蕨藻汁并加入5倍的95%乙醇,4 ℃醇沉12 h。3 500×g离心15 min弃去上层乙醇,收集沉淀溶解在50 mL蒸馏水中,弃去不溶性杂质,冷冻干燥36 h后收集多糖并称重,记为组1。
②取10 g长茎葡萄蕨藻粉末加入200 mL蒸馏水,在60 ℃下提取2 h。提取结束后3 500×g离心15 min收集上清液。将上清液置于旋转蒸发仪中50 ℃负压浓缩,得到10 mL浓缩提取液,加入5倍的95%乙醇,4 ℃醇沉12 h。3 500×g离心15 min弃去上层乙醇,收集沉淀溶解在50 mL蒸馏水中,弃去不溶性杂质,冷冻干燥36 h后收集多糖并称重,记为组2。
③ (多糖提取和醇沉步骤同②),3 500×g离心15 min弃去上层乙醇,收集沉淀溶解在50 mL蒸馏水中,加入Sevege试剂(氯仿:正丁醇为4∶1,体积比,现配现用),多糖溶液与Sevege体积比为4∶1,置于分液漏斗中,剧烈振荡15 min,静置30 min,弃去蛋白质层和有机溶剂层,重复以上操作,直至无蛋白质出现。冷冻干燥36 h后收集多糖并称重,记为组3。
④取10 g长茎葡萄蕨藻粉末加入200 mL蒸馏水,加入质量浓度为0.5%的木瓜蛋白酶,在60 ℃下提取2 h,pH为6。提取结束后沸水灭酶5 min,3 500×g离心15 min收集上清液。将上清液置于旋转蒸发仪中50 ℃负压浓缩,得到10 mL浓缩提取液,加入5倍的95%乙醇,4 ℃醇沉12 h。3 500×g离心15 min弃去上层乙醇,收集沉淀溶解在50 mL蒸馏水中,弃去不溶性杂质,冷冻干燥36 h后收集多糖并称重,记为组4。
⑤取10 g长茎葡萄蕨藻粉末加入200 mL质量分数为2%的NaOH溶液中,在60 ℃下提取5 h。提取后3 500×g离心15 min收集上清液,将上清液置于旋转蒸发仪中50 ℃负压浓缩,得到10 mL浓缩提取液,加入5倍的95%乙醇,4 ℃醇沉12 h。3 500×g离心15 min弃去上层乙醇,收集沉淀溶解在50 mL蒸馏水中,弃去不溶性杂质,冷冻干燥36 h后收集多糖并称重,记为组5。
单因素实验 根据预实验结果,确定使用方法④提取长茎葡萄蕨藻多糖,即木瓜蛋白酶酶解法。按照上述方法,探究料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取温度(30、40、50、60和70 ℃)、提取时间(1、2、3、4和5 h)、木瓜蛋白酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、提取次数(1、2、3和4次),这5个因素对长茎葡萄蕨藻多糖提取的影响。
响应面实验 在单因素实验的基础上,利用响应面分析法对提取工艺进一步优化。根据Box-Behnken实验原理,选择料液比(A)、提取时间(B)、提取温度(C)为自变量,长茎葡萄蕨藻多糖的提取率(Y)为响应值,应用Design-Expert. V 8.0.6软件进行三因素三水平的响应面实验分析,得到长茎葡萄蕨藻多糖提取的最佳工艺参数。
多糖标准曲线的绘制 精确称量10 mg标准葡萄糖置于100 mL容量瓶中定容。取7支具塞玻璃试管,分别加入0、0.1、0.2、0.4、0.6、0.8及1.0 mL的葡萄糖溶液,用蒸馏水补足体积至1.0 mL,充分混匀后迅速置于冰浴中冷却5 min。取出后加入4 mL现配的0.2%蒽酮硫酸溶液,摇匀,立即置于沸水浴中煮沸10 min。取出,冷却至室温,在620 nm波长下测定OD值。以标准葡萄糖含量(μg)为横坐标,以吸光值为纵坐标,绘制标准曲线,得到线性回归方程:y=0.003 4x+0.084 1,R2=0.999 2。
长茎葡萄蕨藻多糖提取率的测定 将长茎葡萄蕨藻粗多糖溶解于蒸馏水中,并将浓度调整至适合测定的范围。精确吸取1.0 mL于具塞玻璃试管中,按照绘制标准曲线的方法操作,每个样品3个重复,在620 nm处测定OD值,根据标准曲线计算多糖浓度,再按照式(1)计算长茎葡萄蕨藻样品中的多糖提取率(D,%):
式中,N代表多糖浓度(g/mL),V代表待测体积(mL),n代表稀释倍数,L代表多糖得率,M代表多糖样品的质量(g)。
长茎葡萄蕨藻多糖对 ABTS 自由基清除能力的测定 取ABTS二铵盐40.7 mg,加蒸馏水定容至10 mL,配置成7.4 mmol/L的ABTS二铵盐储备液。再取K2S2O87 mg,加蒸馏水定容至10 mL,配置成2.6 mmol/L的过二硫酸钾储备液。将上述两种储备液各取1 mL混合,黑暗环境下室温放置12 h,用pH值为7.4的磷酸盐缓冲液将混合液稀释10~20倍,直至吸光度为0.70±0.02,此溶液即为ABTS自由基工作液。精确称取5 mg维生素C于容量瓶中,用超纯水溶解后定容至100 mL,实验时稀释成浓度为20.84 μg/mL的阳性对照溶液。准确吸取不同体积的待测样品溶液于96微孔板中,再加入100 μL的ABTS工作液,用纯水补足体积至200 μL,振摇10 s以充分混匀后静置6 min。调节酶标仪波长为734 nm测吸光度,记为Asample;空白组以等体积的纯水代替ABTS工作液,记为Ablank;对照组以等体积的纯水代替样品溶液,记为Acontrol。清除率计算同式(2)。
长茎葡萄蕨藻多糖对DPPH自由基清除能力的测定 称取4 mg DPPH固体试剂,95%乙醇溶解并定容至100 mL,配为40 μg/mL溶液,避光保存备用。精确称取5 mg维生素C置于容量瓶中,用超纯水溶解后定容至100 mL,实验时稀释配制成浓度为20.84 μg/mL的阳性对照溶液。准确吸取不同体积待测样品溶液于96微孔板中,再加入100 μL的DPPH溶液,轻轻混匀后用95%乙醇补足体积至250 μL,避光反应30 min。调节酶标仪波长515 nm测吸光度,记为Asample;空白组以等体积的纯水代替DPPH溶液,记为Ablank;对照组以等体积的纯水代替样品溶液,记为Acontrol。清除率按下式计算:
2 结果
2.1 筛选提取方法
1~5组长茎葡萄蕨藻多糖提取率分别为0.72%、2.44%、3.69%、8.55%和3.32%,其中组4的提取率最高,且操作较为简便(图1)。因此,综合提取效率、操作便捷性以及多糖提取率等因素,确定以组4作为提取方法进行工艺优化,即使用木瓜蛋白酶酶解法提取长茎葡萄蕨藻多糖。

图1 不同提取方法对长茎葡萄蕨藻多糖提取率的影响1.鲜藻提取组,2.普通水提取组,3. sevege试剂处理提取组,4.添加木瓜蛋白酶提取组,5. NaOH碱提取组。Fig. 1 Effects of different extraction methods on the extraction rate of polysaccharides from C. lentillifera1. the fresh algae extraction group, 2. the water extraction group, 3. the sevege reagent treatment group, 4. the papain group, 5. the NaOH extraction group.
2.2 单因素实验
料液比对长茎葡萄蕨藻多糖提取率的影响 当料液比为1∶40时,长茎葡萄蕨藻多糖提取率达到最大,之后随着料液比的増高而降低(图2-a),因此将1∶40作为最佳料液比条件。

图2 单因素实验结果Fig. 2 Single factor test results
提取温度对长茎葡萄蕨藻多糖提取率的影响 当温度小于50 ℃时,长茎葡萄蕨藻多糖提取率随着温度的升高而增加(图2-b),温度为50 ℃时,多糖提取率达到顶峰,随温度的升高而逐渐降低。因此,选择最佳的提取温度为50 ℃。
提取时间对长茎葡萄蕨藻多糖提取率的影响 随着提取时间的延长,长茎葡萄蕨藻多糖提取率逐渐增加(图2-c)。但提取时间超过3 h后,多糖提取率降低。因此选择最佳的提取时间为3 h。
木瓜蛋白酶添加量对长茎葡萄蕨藻多糖提取率的影响 随着木瓜蛋白酶添加量的增多,长茎葡萄蕨藻多糖提取率呈上升趋势(图2-d)。在添加量达到2.0%之后,多糖提取率趋于平稳,因此为了控制成本,确定最佳的木瓜蛋白酶添加量为2.0%。
提取次数对长茎葡萄蕨藻多糖提取率的影响 提取次数提升至2次时,长茎葡萄蕨藻多糖提取率明显增高(图2-e)。当提取次数大于2次后,多糖提取率略有降低且基本保持不变。因此,为了节约成本,提高效率,提取次数确定为2次。
2.3 响应面实验
实验设计及结果 根据单因素实验结果,确定木瓜蛋白酶添加量为2.0%,提取次数为2次。随后应用Design-Expert. V 8.0.6软件探究料液比、提取温度和提取时间对长茎葡萄蕨藻多糖提取率的影响,实验设计及结果见表2。

表2 响应面实验设计及结果Tab. 2 Response surface design and results
建立回归方程方差分析 利用Design-Expert. V 8.0.6软件对表2中的数据进行多元回归拟合,得到二次项回归方程:
式中,Y为长茎葡萄蕨藻多糖提取率,A、B和C分别代表料液比、提取时间和提取温度。
方差分析 为了检验长茎葡萄蕨藻多糖提取工艺回归模型的有效性,对该模型进行方差分析(表3)。回归模型P<0.000 1,表明该回归模型具有统计学意义。矫正系数R2(Adj)=0.956 8,表明实验误差小,准确度高。模型确定系数R2=0.981 1,预测相关系数R2(Pred)=0.950 6,二者的数值接近,说明偏差在合理范围之内,实际测量值与预测值的拟合度程度较好,二者有高度相关性。失拟项P=0.953 0>0.05,结果不显著,说明选择的模型对该实验的拟合性良好。变异系数 C.V.%为3.16%,反映了模型具有较高的稳定性和可信度。信噪比(Adeq Precisior)为17.222,大于临界值4,表明模型的准确度高。以上指标均表明,可采用该拟合回归方程对长茎葡萄蕨藻多糖的最优提取工艺进行预测和分析。
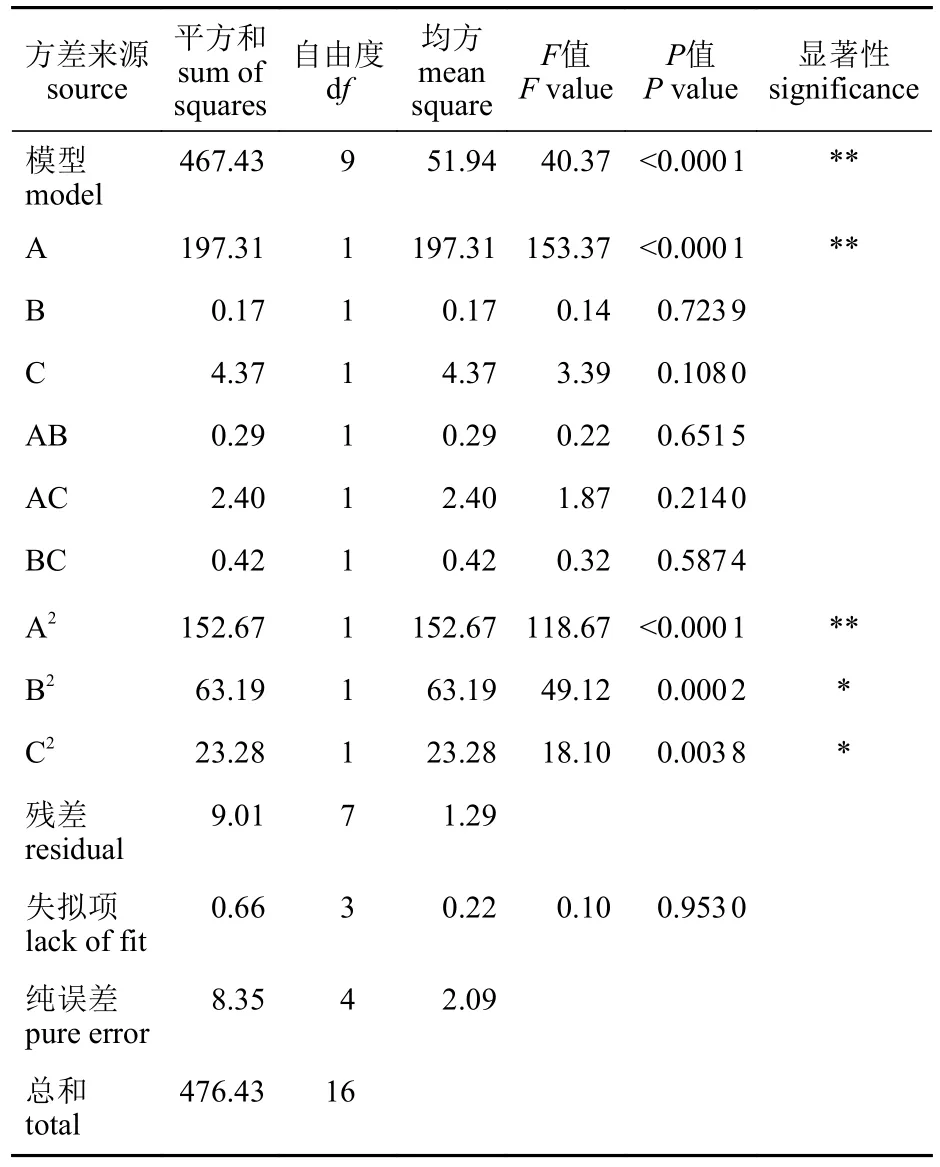
表3 响应面二次模型多糖得率的方差和回归系数分析Tab. 3 Analysis of variance and regression coefficient of polysaccharide yield in response surface quadratic model
自变量对多糖提取率的影响程度 该回归模型中的自变量一次项A和二次项A2、B2、C2对长茎葡萄蕨藻多糖提取率有显著影响(P<0.05)。由F值可知,三个因素对长茎葡萄蕨藻多糖提取率的影响程度的大小顺序为:料液比>提取温度>提取时间。
响应面分析及验证实验 曲线的走势越陡,说明该因素对长茎葡萄蕨藻多糖的提取率影响越大,曲线的走势越平缓则说明该因素对长茎葡萄蕨藻多糖提取率的影响越小。对长茎葡萄蕨藻多糖提取率影响最大的因素为料液比,其次为提取温度和提取时间(图3~图5),这与表3中的分析结果相一致。由回归模型预测的长茎葡萄蕨藻多糖最佳提取工艺参数为料液比1∶44.77,提取温度60 ℃,提取时间3.08 h,木瓜蛋白酶添加量2.0%,提取次数2次,最大提取率预测值为41.41%。为了方便操作,将优化的条件改为料液比1∶45,提取温度60 ℃,提取时间3 h,木瓜蛋白酶添加量2.0%,提取次数2次。在此优化条件下进行3次平行实验,长茎葡萄蕨藻多糖的提取率为41.24%±0.09%,这和预测值较接近,因此该模型可较好地预测和模拟长茎葡萄蕨藻多糖的产率及最佳的提取工艺。
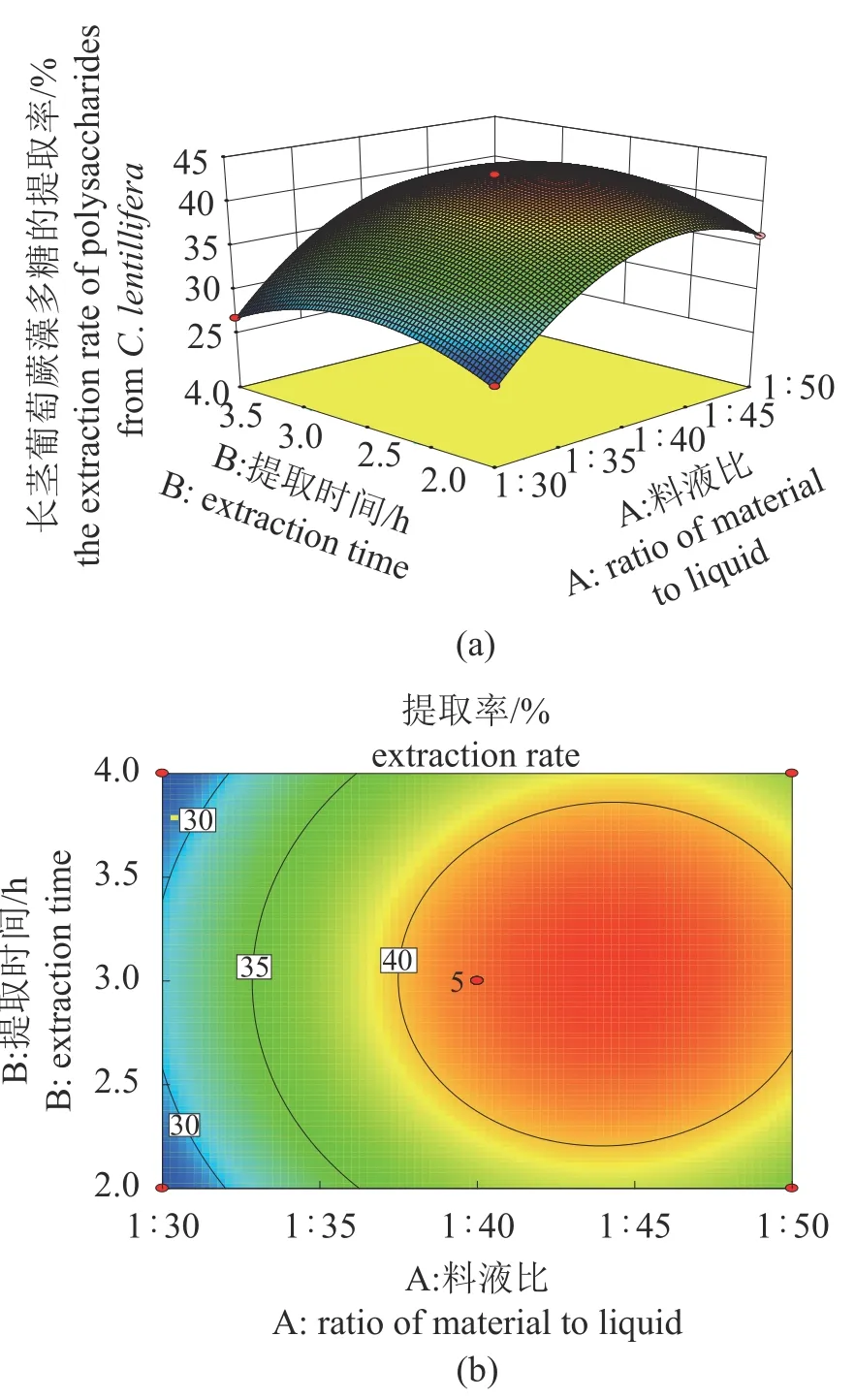
图3 料液比与提取时间对长茎葡萄蕨藻多糖提取率的影响(a)响应面图,(b)等高线图,下同。Fig. 3 Effects of material/solution ratio and extraction time on the extraction rate of polysaccharides from C. lentillifera(a) response surface figure, (b) contour figure, the same below.

图4 料液比与提取温度对长茎葡萄蕨藻多糖提取率的影响Fig. 4 Effects of material/solution ratio and extraction temperature on the extraction rate of polysaccharides from C. lentillifera

图5 提取时间与提取温度对长茎葡萄蕨藻多糖提取率的影响Fig. 5 Effects of extraction time and temperature on the extraction rate of polysaccharides from C. lentillifera
2.4 抗氧化实验
长茎葡萄蕨藻多糖对DPPH自由基的清除作用 随着长茎葡萄蕨藻多糖浓度的升高,对DPPH自由基的清除能力也不断增强(图6)。当长茎葡萄蕨藻多糖的浓度为3.00 mg/mL时,DPPH自由基的清除率达到52.98%,且随着多糖浓度的升高该清除率不再增加,维生素C和长茎葡萄蕨藻多糖的IC50分别为7.38 μg/mL和2.32 mg/mL,说明长茎葡萄蕨藻多糖对DPPH自由基有一定的清除作用,但清除率较差。

图6 对DPPH自由基的清除作用Fig. 6 Scavenging effect on DPPH free radicals
长茎葡萄蕨藻多糖对ABTS自由基的清除作用 随着长茎葡萄蕨藻多糖浓度的升高,对ABTS自由基的清除率也不断增加(图7)。当长茎葡萄蕨藻多糖浓度为2.00 mg/mL时,ABTS的清除率达到93.8%,且不再随多糖浓度的增加而升高,维生素C和长茎葡萄蕨藻多糖的IC50分别为7.07 μg/mL和0.67 mg/mL,说明长茎葡萄蕨藻多糖对ABTS自由基具有较强的清除作用。

图7 对ABTS自由基的清除作用Fig. 7 Scavenging effect on ABTS free radicals
3 讨论
植物中的多糖常与蛋白质紧密结合,因此用传统的水提取法不易完全提取。木瓜蛋白酶是一种含巯基肽链内切酶,具有蛋白酶和酯酶的活性,能水解长茎葡萄蕨藻中的游离蛋白和结合蛋白,减少多糖与蛋白的结合,增加植物多糖的溶出[16]。
本研究在前人的实验基础上,尝试了5种不同的提取方法,以期探索高效提取长茎葡萄蕨藻多糖的制备工艺。预实验结果表明(图1),组1的长茎葡萄蕨藻多糖提取率仅为0.72%,这表明采用普通的物理处理方法无法完全破坏植物细胞,大量多糖仍未溶出。组2多糖水提取后不经过任何处理,提取率为2.44%,可能是由于此方法提取的多糖中蛋白质等杂质含量高,导致多糖浓度低,提取率随之下降。组3多糖在水提取后采用sevege试剂除蛋白,提取率高于组2,但此法操作过程中蛋白质多出现在两液面交界处,分离时多糖损耗较大,且需要取多糖层多次进行重复实验,操作较为繁琐。组4多糖的提取率最高,达到8.55%,相比于组3的sevege试剂法,此组添加木瓜蛋白酶能在提取过程中一并水解植物细胞膜中的结合蛋白,从而更大限度地使长茎葡萄蕨藻多糖溶出,且反应温和易操作。长茎葡萄蕨藻多糖是酸性多糖,因此组5采用碱提取法,但此法会溶出大量色素,导致多糖浓度降低,故使用此法时需提前将藻粉进行除色素处理。因此,综合提取效率、操作便捷性以及多糖提取率等因素,本研究确定以木瓜蛋白酶酶解法作为长茎葡萄蕨藻多糖的基础提取方法并进行工艺优化。
由式(1)可知,多糖提取率主要取决于多糖得率和多糖浓度,因此优化长茎葡萄蕨藻多糖提取工艺需重点从这两方面着手。本研究发现,长茎葡萄蕨藻的含水量可达96.76%,高含水量的特性导致长茎葡萄蕨藻的干燥藻粉具有一定的吸水性。因此,在单因素优化实验中,过低的料液比会导致长茎葡萄蕨藻藻粉无法完全溶于水中,溶液呈米糊状且接近饱和,多糖可溶出空间变小,从而降低多糖提取率。另一方面,过高的料液比会使杂质含量增高,多糖浓度降低,也不利于提高多糖提取率(图2-a)。温度是酶能否充分发挥活性的重要因素,当提取温度达到50 ℃时,木瓜蛋白酶达到最适作用温度,酶与底物完全接触反应,多糖提取率达到顶峰。温度大于50 ℃时,酶结构在高温下被破坏,酶活性随着温度的升高而降低,多糖提取率也随之逐渐降低(图2-b)。在其他因素固定的情况下,长茎葡萄蕨藻多糖提取率在提取时间为3 h时最高,之后随着时间的延长而降低,其原因可能由于提取时间过长而导致多糖结构的改变或者糖苷键的裂解(图2-c)。木瓜蛋白酶添加量是控制工艺成本的重要因素之一,当酶用量刚好与反应底物完全结合时,即为酶的最适用量。本次实验中,木瓜蛋白酶添加量达到2.0%之后,长茎葡萄蕨藻多糖提取率趋于平稳,表明木瓜蛋白酶浓度已饱和,即最适添加量为2.0% (图2-d)。此外,适当增加提取次数能提高藻粉利用率、降低工艺成本、并大幅提高多糖提取率。当提取次数为2次时,长茎葡萄蕨藻多糖提取率明显提高了2.2%,随后趋于平稳,表明该工艺的最佳提取次数为2次(图2-e)。
单因素实验进行的前提是假定各因素间没有交互作用,但在实际问题中,各因素相互独立的情况是极为少见的,因此研究因素间的交互作用尤为重要[19]。考虑到成本与实际可行性,实验将木瓜蛋白酶添加量和提取次数分别固定为2.0%和2次,并应用Design-Expert. V 8.0.6软件探究料液比、提取时间和提取温度三因素间的相互作用。方差分析中模型的P<0.000 1,表明本研究建立的回归模型具有统计学意义,且各项系数均反映该模型具有较高的稳定性和可信度。F值、响应面图和等高线图的结果显示,料液比对长茎葡萄蕨藻多糖提取率的影响最大,这可能也与长茎葡萄蕨藻藻粉具有吸水的特性有关。通过该回归模型预测的提取长茎葡萄蕨藻多糖最佳工艺为料液比1∶45、提取温度50 ℃、提取时间3 h、木瓜蛋白酶添加量2.0%,在此条件下,长茎葡萄蕨藻多糖的实际提取率为41.24%,与理论值相差0.17%,表明该模型可较好地预测和模拟长茎葡萄蕨藻多糖的产率及最佳的提取工艺。王小兵等[15]采用ASE技术结合正交实验对长茎葡萄蕨藻多糖提取工艺进行优化,发现优化后的多糖提取率可达到51.03%,高于本实验的实际提取率。究其原因:一是长茎葡萄蕨藻的产地具有差异,王小兵等[15]采用的实验材料取自海南,而本实验的藻体取自越南芽庄,不同地区的光照、水体盐度等因素具有差异性,从而导致不同地区藻体积累的营养活性物质含量具有差异[20]。二是两者对鲜藻的干燥方式有差异。有研究表明,在其他因素相同的情况下,冷冻干燥处理的长茎葡萄蕨藻中活性物质的含量明显高于热风干燥处理[7]。三是两者提取方式有差异。王小兵等[15]采用的加速溶剂萃取仪能快速地将萃取物从基质活性部位解吸出来,大大提高多糖提取率,但此法需要高温高压的条件,成本高,不利于大规模投产。
此外,本实验还探究了长茎葡萄蕨藻多糖的体外抗氧化活性,发现该多糖对DPPH和ABTS清除率的IC50分别为2.32和0.67 mg/mL,最高清除率分别可达52.98%和93.80%,表明长茎葡萄蕨藻多糖对ABTS的清除作用优于DPPH。但宋伟康[10]研究发现,长茎葡萄蕨藻多糖对ABTS自由基的清除作用弱于DPPH,与本研究的结果相反,其原因可能是二者的提取方法有差异,从而导致多糖产物的活性不同。
综上,本研究为长茎葡萄蕨藻多糖的开发利用奠定了理论基础,后续将探究该酶解法提取的长茎葡萄蕨藻多糖的分子结构,阐明木瓜蛋白酶对长茎葡萄蕨藻多糖结构和活性功能的影响,以期促进长茎葡萄蕨藻多糖的深度开发利用。
(作者声明本文无实际或潜在的利益冲突)
