三疣梭子蟹受精卵离体孵化技术
2024-01-22牛雪莹任志明吴佳颖母昌考王春琳
牛雪莹, 任志明, 吴佳颖, 母昌考*, 王春琳
(1. 宁波大学海洋学院,水产生物技术教育部重点实验室,浙江 宁波 315211;2. 宁波大学机械工程与力学学院,浙江 宁波 315211)
三疣梭子蟹(Portunus trituberculatus)是一种重要的海洋经济甲壳类动物,广泛分布于印度洋和西太平洋沿海水域[1],其肉质鲜美、营养丰富,深受大众喜爱,是中国沿海地区的特色海鲜[2]。2020年全国梭子蟹养殖产量达到10.09万t,全国海洋捕捞产量42.46万t,全国海水养殖面积20 671 hm2,产量和养殖面积均比2019年有所下降[3],养殖技术急需改进。优质的苗种是养殖成功的关键,而三疣梭子蟹苗种的培育受多种病害的制约[4],如弧菌病、固着类纤毛虫病、发光病,黑鳃病和蜕壳障碍病等[5]都会在三疣梭子蟹幼体培育阶段产生严重危害。现有育苗生产过程,都是将抱卵蟹(携带受精卵的亲体)直接放入育苗池进行幼体孵化,这种操作方式会导致极高的污染率,以上病原生物大部分是由抱卵蟹直接接触育苗水体及初孵幼体(Z1)进行传播的。
胚胎离体培养技术将受精卵和亲体分离,能够有效避免来自亲体病原生物感染幼体的风险,但是关于甲壳动物胚胎离体孵化的研究进展缓慢。Cheng等[6]发现,如果采用合理的消毒、SPF检测和病原分离方法,利用最佳的卵密度和孵化体系,就可以实现红螯光壳螯虾(Cherax quadricarinatus)的规模化离体生产。但离体孵化的效果往往与胚胎离体的时间呈负相关[7]。本研究以孵化率、孵化时间和幼体活力为评价指标,开展三疣梭子蟹离体孵化技术研究,可为三疣梭子蟹的苗种繁育提供新的技术手段,也将为基因编辑辅助育种等技术的实施奠定基础。
1 材料与方法
1.1 实验蟹饲养与管理
本研究中三疣梭子蟹亲体(260±50) g来自宁波市奉化区臭皮匠水产养殖场,挑选附肢健全,活力好,无机械损伤的亲蟹暂养于宁波大学海洋学院中试基地,采用帆布池作为培育池(长1.5 m,宽1.0 m,高0.6 m),占池底面1/2位置铺上厚15 cm 经过消毒处理的海沙作为栖息区;其余1/2作为投饵与亲蟹摄食区,水位40 cm,日换水50%。亲蟹的饵料主要是活沙蚕,每日换水后投饵料,日投饵量为亲蟹总体重的10%~15%。实验过程中操作人员严格遵守实验动物福利伦理规范。
1.2 实验设计
最适受精卵块分离液的筛选 亲蟹抱卵后,用无菌手术剪从亲蟹腹部剪下受精卵约3 000颗,用消毒海水清洗3遍后,在消毒海水中充气暂养8 h,再进行分离实验。实验设置4个酶液处理组,分别为中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和混合酶液(中性蛋白酶∶碱性蛋白酶∶木瓜蛋白酶 = 1∶1∶1,体积比)。酶液均由消毒海水配制,每组设置3个平行,每个平行放入成串的受精卵(200±20)颗,将受精卵和不同浓度的酶液放入一次性培养皿中,置于25 °C摇床中,转速40 r/min。第一步,以酶浓度0.03 g/mL,处理2 h后测定分离率(分离率=单粒状态受精卵数/受精卵总数),依据分离率筛选出最适酶液种类。第二步,选取最适酶液种类,均设置3个浓度梯度:0.03、0.06和0.09 g/mL,处理2 h后测定分离率,依据分离率筛选出最适酶液浓度。第三步,选取最适酶液种类,在最适作用浓度下,进行最适处理时间的测定。最终确定最适分离液的种类及处理条件。
透射电镜观察分离液作用后卵膜的变化实验分组三组,以没有处理过的受精卵作为对照组,处理组1为0.09 g/mL木瓜蛋白酶作用30 min的受精卵,处理组2为0.09 g/mL混合酶液作用30 min的受精卵。采集样品后立刻用戊二醛进行固定,然后用常规方法制备电镜超薄切片(Lee H T, 2009),用日立透射电镜(H-7650)型透射电子显微镜,对超薄切片进行观察,对卵细胞结构拍照,着重观察卵膜结构。
不同时期受精卵离体孵化情况 亲蟹抱卵后,剪取卵裂期、囊胚期、原肠胚、卵内无节幼体期、卵内溞状幼体期的受精卵置于已筛选的最佳分离液中进行处理。用消毒海水冲洗5次后,将分离后的单粒受精卵放入离体孵化装置。每天换水1次,海水经0.22 μm滤膜过滤后使用,控制pH在8.0~8.5,水温25~26 °C,盐度为25,溶解氧含量为8 mg/L,光环境为室内自然光照,每组实验重复3次。
幼体活力测试 ①干露耐受力测试,从离体孵化器(原肠期)和亲蟹育苗池中随机选取Ⅰ期溞状幼体,置于垫有吸水纸的100目筛绢上。设置时间间隔为5、10、15、20和25 min。每个时间间隔组取10只Ⅰ期溞状幼体,设置3个平行。干露结束后,立即将幼体放入盛有消毒海水的烧杯内,对强光没有反应的幼体可判定其死亡,随后观察并记录存活率。实验分组包括对照组(不经分离液处理卵巢孵化幼体)、0.09 g/L木瓜蛋白酶组、0.09 g/L混合酶液组和母体孵化组。
②福尔马林耐受测试,从离体孵化器(原肠期)和亲蟹育苗池中随机取10只Ⅰ期溞状幼体,分别放入100 mL的烧杯中,设福尔马林分为30、40、50、60和70 mg/L共5个浓度梯度(使用质量分数为40%的甲醛配置),每个浓度组取10只Ⅰ期溞状幼体,设置3个平行,3 h后观察幼体的活动以及存活情况。实验分组同干露耐受力测试。
③行为学观察,从离体孵化器和亲蟹育苗池中各随机取10只Ⅰ期溞状幼体置于行为拍摄室内拍摄观察(全暗)。行为拍摄室为一个全部遮黑玻璃缸(长10 cm×宽3 cm×高12 cm),在缸的顶部正中央放置光源,缸的正前方放置拍摄相机,缸后垂直放置1 cm×1 cm的刻度板。
针对获取的视频进行分析统计,记录以下行为参数。趋光响应时间(s):开灯瞬间到幼体开始游动的时间。运动速度(cm/min):幼体游向光源的速度。运动距离(cm):幼体游向光源的路径长度。
1.3 数据分析
所有的实验数据均以平均值±标准误 (n=3)表示,用 Levene 氏法确定是否符合正态分布和方差齐性,之后再采用 SPSS 22.0 软件对所有数据进行双因素方差分析 (Two-Way ANOVA),若存在显著差异,则用 Tukey氏检验对数据进行多重比较分析,当P<0.05 时,则认为组间在统计学上具有显著差异。使用 GraphPad Prism 8.0.2 软件 (美国) 进行图形处理。
2 结果
2.1 不同分离液及其浓度对受精卵块的分离效果
设定酶液作用时间为2 h,随着浓度的增加,不同处理组的分离率均有所提升,组间分离率存在显著差异。酶液浓度为0.03 g/mL时,碱性蛋白酶液、中性蛋白酶液、木瓜蛋白酶液和混合酶液的分离率分别为11.67%、23.34%、100.00%和100.00%。酶液浓度为0.06 g/mL时,碱性蛋白酶液、中性蛋白酶液、木瓜蛋白酶液和混合酶液的分离率分别为24.33%、36.00%、100.00%和100.00%;酶液浓度为0.09 g/mL时,碱性蛋白酶液、中性蛋白酶液、木瓜蛋白酶液和混合酶液的分离率分别为55.00%、64.67%、100.00%和100.00% (图1)。结果显示,酶液处理2 h,木瓜蛋白酶液和混合酶液在三个浓度下分离率均可达到100%,将作用时间缩短至30 min,在0.03、0.06 和0.09 g/mL的浓度下进行分离实验。结果显示,酶液作用时间为30 min,浓度为0.09 g/mL的酶液处理组,木瓜蛋白酶液和混合酶液的分离率也为100% (图2)。随后,选取木瓜蛋白酶液和混合酶液,酶液浓度为0.09 g/mL,作用时间为30 min,进行最适作用时间测定。结果显示时间与分离率呈正相关,在酶液浓度为0.09 g/mL,作用时间为30 min时,可以达到最佳的分离效果(图3)。
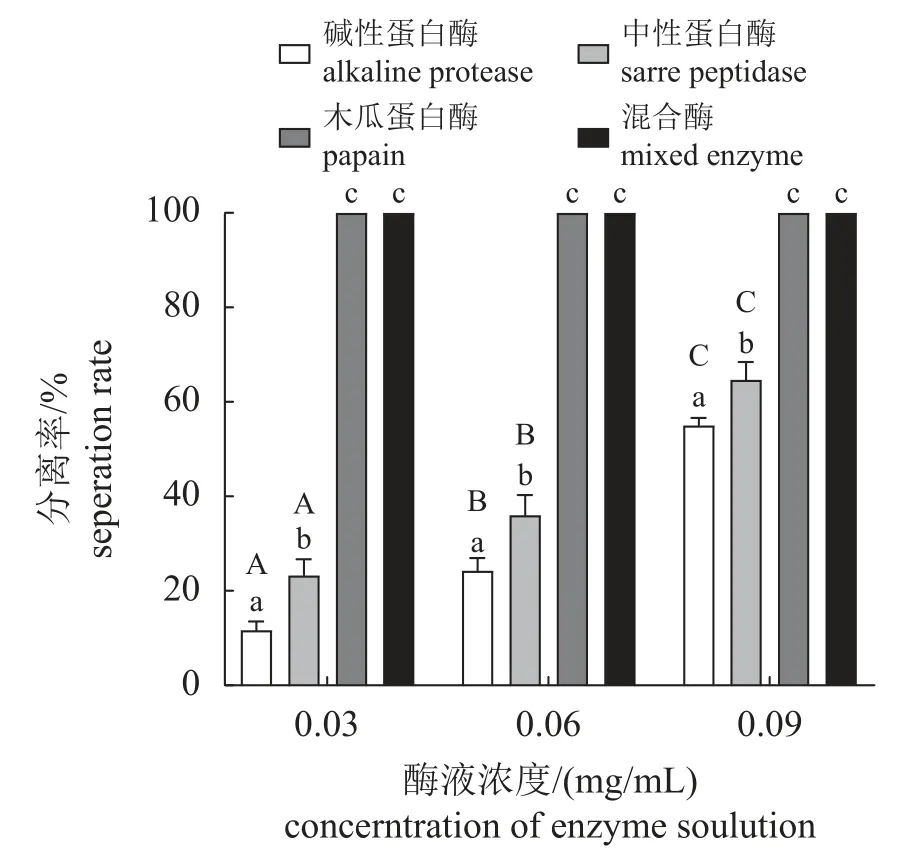
图1 不同浓度酶液处理2 h的三疣梭子蟹卵块的分离率不同小写字母表示相同酶液浓度下,不同酶液之间卵块分离率存在显著差异(P<0.05);不同大写字母表示相同酶液在不同浓度下卵块分离率存在显著差异(P<0.05),图2~3同。Fig. 1 Effect of enzyme solution treatment on separation rate of P. trituberculatus egg block after 2 hDifferent lowercase letters indicate that under the same concentration of enzyme solution, there is significant difference in egg mass separation rate between different enzyme solutions (P<0.05); different capital letters indicate significant difference in egg mass separation rate under different concentrations of the same enzyme solution (P<0.05), the same as Figs.2-3.
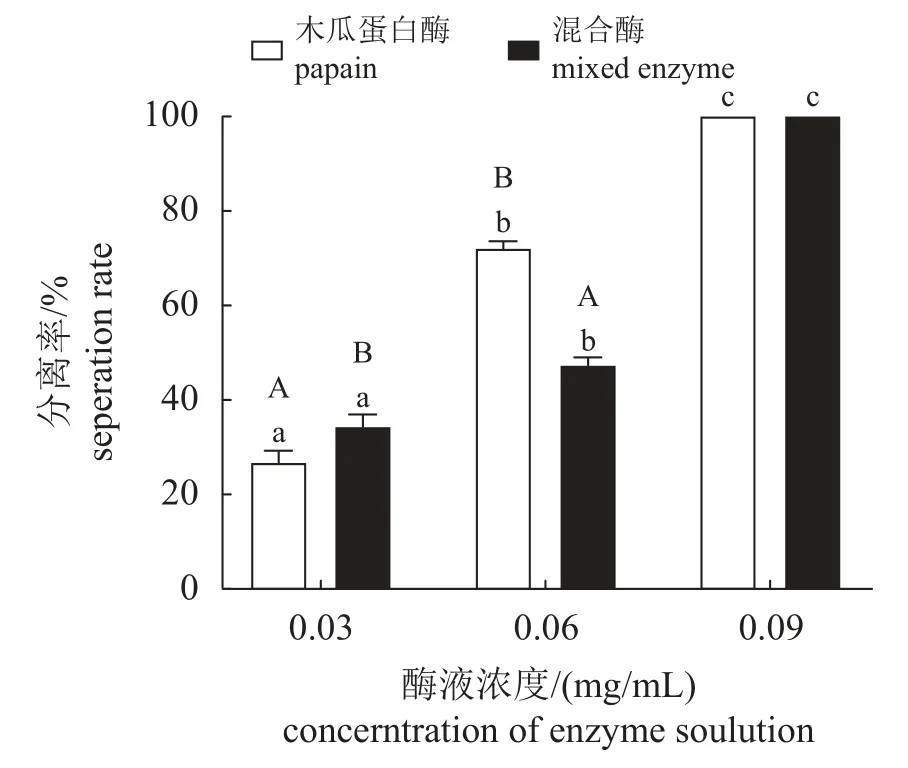
图2 不同浓度的木瓜蛋白酶液和混合酶液处理30 min的三疣梭子蟹卵块的分离率Fig. 2 Effect of enzyme solution treatment on separation rate of P. trituberculatus egg block after 30 min
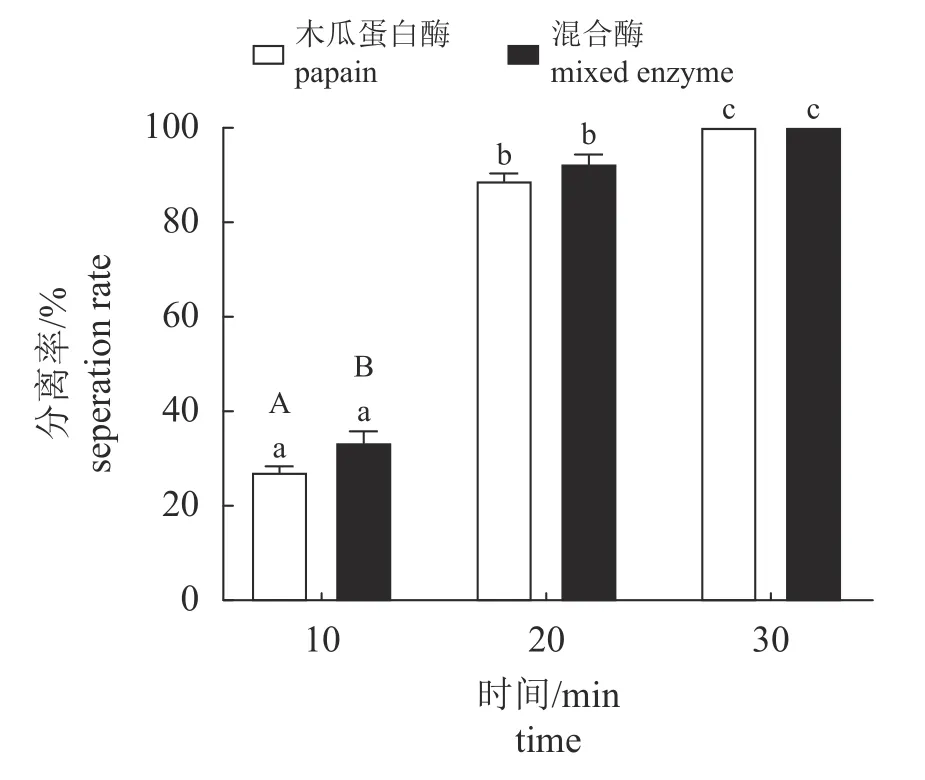
图3 0.09 mg/L木瓜蛋白酶液和混合酶液处理三疣梭子蟹卵块30 min的分离率Fig. 3 Effect of enzyme solution treatment on separation rate of P. trituberculatus egg block after 30 min
2.2 透射电镜观察分离液作用后卵膜的变化
透射电镜观察结果显示,与对照组相比,经过酶液处理的受精卵的外卵膜结构稀疏,与内卵膜出现明显的分层(图4-a)。其中,木瓜蛋白酶处理的受精卵的外卵膜在厚度上减少至对照组的一半(图4-b),混合酶液处理的受精卵的外卵膜出现分层,但厚度没有明显变化(图4-c)。

图4 卵膜的透射电镜观察(a)对照组;(b)处理组1,为0.09 g/mL木瓜蛋白酶作用30 min的受精卵;(c)处理组2,为0.09 g/mL混合酶液作用30 min的受精卵。im.内卵膜,om.外卵膜。Fig. 4 Transmission electron microscopy transverse sections of the outer egg membrane(a) control group; (b) treatment group 1, the concentration of the papain was 0.09 g/mL and the separation time was 30 min; (c) treatment group 2, the concentration of the mixed enzyme was 0.09 g/mL and the separation time was 30 min. im. inner egg membrane, om. outer egg membrane.
2.3 不同发育阶段受精卵离体孵化情况
在孵化水温为(25±1) °C时,不同发育时期的离体胚胎在对照组、处理组1与处理组2处理后均能孵化出幼体,但孵化率存在显著差异(图5)。卵裂期受精卵块的孵化率为31%,处理组1的孵化率为58%,处理组2的孵化率为64%。囊胚期受精卵块的孵化率为42%,处理组1的孵化率为72%,处理组2的孵化率为72%。原肠期受精卵块的孵化率为57%,处理组1的孵化率为76%,处理组2的孵化率为75%。卵内无节幼体期受精卵块的孵化率为59%,处理组1的孵化率为89%,处理组2的孵化率为85%。卵内溞状幼体期受精卵块的孵化率为70%,处理组1的孵化率为89%,处理组2的孵化率为87%。对照组受精卵块的孵化率比处理组低,且差异显著(P<0.05),两个处理组孵化率差异不显著(P>0.05),且发育期越靠后,胚胎的孵化率越高。
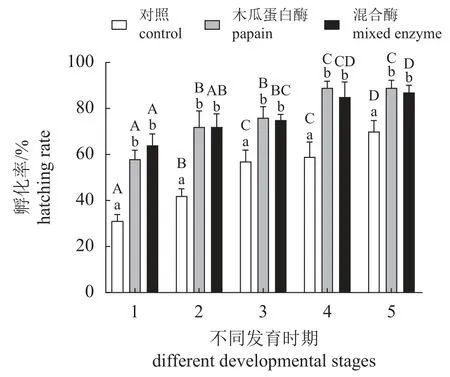
图5 不同发育时期三疣梭子蟹胚胎的的离体孵化效果1.卵裂期,2.囊胚期,3.原肠期,4.卵内无节幼体期,5.卵内溞状幼体期。不同小写字母表示相同发育时期,不同酶液之间孵化率差异显著;不同大写字母表示相同酶液在不同发育时期孵化率差异显著。Fig. 5 Effects of P. trituberculatus embryo incubation in vitro at different developmental stages1. cleavage stage, 2. blastula stage, 3. gastrula stage, 4. nauplius stage, 5.zoea stage. Different lowercase letters indicate that there are significant differences in hatching rate between different enzyme groups at the same development stage; different capital letters indicate that the hatchability of the same enzyme group is significantly different at different developmental stages.
2.4 幼体活力测定
耐干露测试 孵化后的幼体进行耐干露试验,包括对照组、木瓜蛋白酶组、混合酶液组、母体孵化组,4个组幼体耐干露能力无显著差异(P>0.05),5 min内幼体的死亡率在5 %以下,15 min后幼体死亡率显著上升(图6),在干露20 min后,幼体全部死亡。
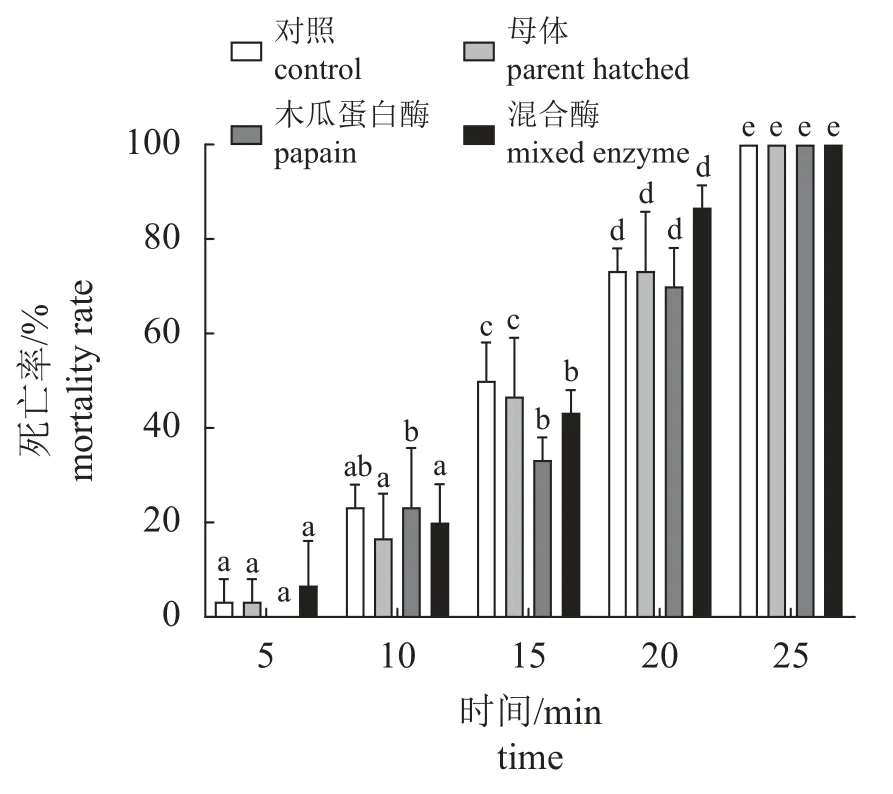
图6 干露对三疣梭子蟹幼体死亡率的影响不同字母表示在同组内,不同酶液之间死亡率存在显著差异(P<0.05),图7同。Fig. 6 Effects of exposure to air on the mortality rate of larval P. trituberculatusDifferent letters indicate that in the same group, there is significant difference in mortality rate between different enzyme solutions (P<0.05),the same as Fig.7.
福尔马林耐受测试 幼体的存活率受福尔马林浓度的影响较为显著,在浓度为30 mg/L的条件下,幼体在3 h时的死亡率在10%以下(图7),4个组无显著差异(P>0.05)。随着福尔马林浓度的升高,幼体的死亡率显著升高。
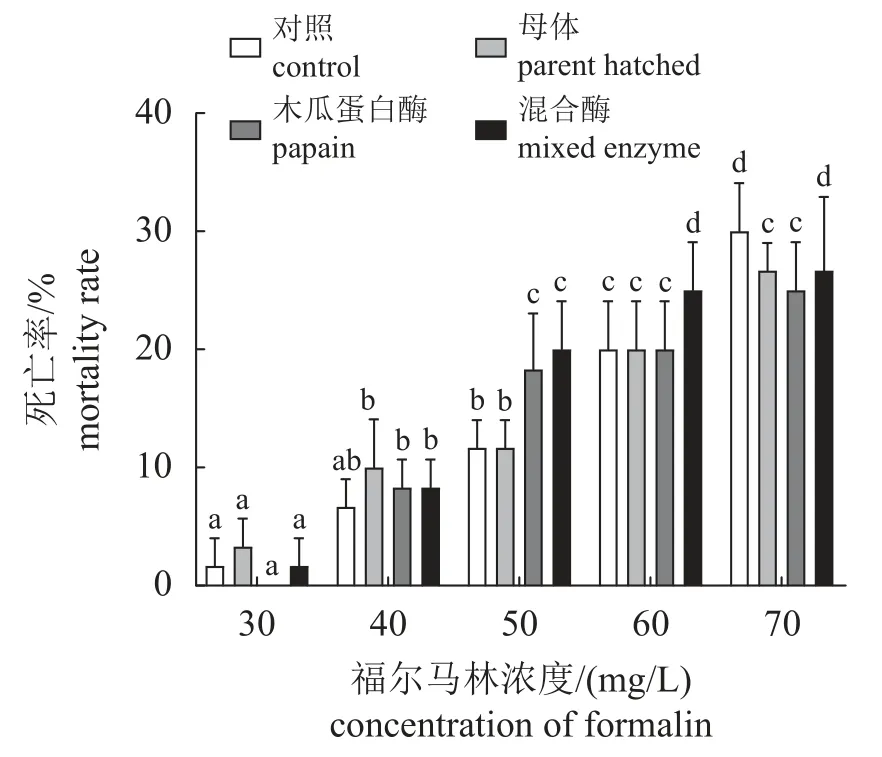
图7 不同浓度福尔马林胁迫3 h后对三疣梭子蟹幼体存活率的影响Fig. 7 Effects of formalin on the survival rate of larval P. trituberculatus
行为学观察 在完全黑暗的条件下,出现光源时,4个处理组的幼体响应时间没有显著差异(图8),平均响应时间为2.43 s;平均运动距离和平均运动速度分别为8.34 cm和1.65 cm/s,均无显著差异(P>0.05)。

图8 离体和母体培养条件下三疣梭子蟹幼体的行为观察(a)响应时间,(b)运动速度,(c)运动距离;1.混合酶,2母体,3.木瓜蛋白酶,4对照。Fig. 8 Observation of larval P. trituberculatus under the conditions of in vitro incubation and parental hatch(a) reaction time, (b) speed, (c) movement distance; 1. mixed enzyme, 2.parent hatched, 3. papain, 4. control.
3 讨论
3.1 不同分离液对受精卵块的分离效果
三疣梭子蟹产卵后,受精卵通过黏液腺分泌的黏液形成卵柄和外层卵膜,将其固着在腹肢的刚毛上,直到孵化[8]。但是甲壳类在离体培养时,受精卵之间黏连的黏液会附着大量的病原生物,例如聚缩虫[9]、丝状细菌[10]等病原体。此外,污染和死亡的受精卵会影响到周围健康的受精卵,有时甚至导致100%的死亡率[11]。所以为提高受精卵的离体孵化率,不少研究者使用药物或者清理死卵的方式来处理。Carral等[12]在白螯虾(Austropotamobius pallipes)的离体培养中通过定期的清理死卵,可以有效地降低受精卵的死亡率。廖永岩等[13]则通过使用药物来提高孵化率,使用0.2 mg/dm3的孔雀石绿处理远海梭子蟹(P. pelagicus)离体卵效果显著。鲍鹰等[14]在中华绒螯蟹(Eriocheir sinensis)胚胎离体孵化中发现,福尔马林与孔雀石绿联用比其单独使用的效果明显。虽然使用药物处理离体胚胎取得了一定效果,但规模化生产中将增加生产成本,且孔雀石绿等药物已被禁用。本研究采用酶液使受精卵分离的方法,极大地避免了连接性污染,进而提高孵化率,通过酶的分解作用消化了受精卵之间黏连的蛋白,减少了受精卵黏连带来的污染。结果显示,在时间为30 min,浓度为0.09 mg/mL时,受精卵块的分离率最高,可达100%,一定程度上减少了病原微生物造成的危害,还避免了药物使用带来的环境污染,为虾蟹人工育苗技术创新提供新的参考。
3.2 分离液作用后卵膜的变化
在许多动物中,成熟卵子外有一层或多层被膜,它们对受精和胚胎发育具有十分重要的作用。在中华绒螯蟹[15]、普通滨蟹(Carcinus meanus)[16]、锐脊单肢虾(Sicynia ingensis)[17]、日本沼虾(Macrobrachium nipponense)[18],锯缘青蟹(Scylla serrata)中均观察到有两层卵黄膜组成的结构。孵化膜为胚胎提供了良好的发育环境,一方面保护胚胎免受外界物质侵扰,另一方面又是胚胎与外界进行物质交换的筛选膜。本研究中,分离液处理过的受精卵孵化率增加,进行透射电镜观察后发现,酶液处理过的受精卵膜与对照组相比结构疏松,且厚度减少了将近一半,与日本绒螯蟹(E.japonica)[19]的报道一致,去除体外人工受精卵外膜后孵化率从10%上升到90%以上,认为卵膜的厚度能够影响受精卵的孵化率,随后Lee[20]利用水的张力将卵膜的厚度减少至原来的三分之一,正常孵化率从10.69%提高到66.67%。在本研究中,通过分离液的酶分解作用使得外卵膜的厚度变薄,外卵膜的变薄不仅可以提高氧的交换率,而且可以提高代谢物质的排出率,进而提高受精卵的孵化率。
3.3 不同时期受精卵离体孵化情况
本研究中,三疣梭子蟹未分散的卵块在原肠期和原肠期之前的胚胎离体培养时期的孵化率普遍低于50%。原肠期之后的胚胎孵化率提高到50%以上,分离处理的受精卵孵化率可提高至75%以上。可见原肠期是离体培养的一个关键时期。在锯缘青蟹[21]中也存在相似的现象,青蟹在原肠期和原肠期之前的胚胎离体培养时的孵化率普遍较低而且相近,都未超过40%。原肠期之后的胚胎孵化率大大提高,达到80%以上。并且不同步发育的胚胎一般也停滞在原肠期,而且流产卵离体培养的胚胎死亡通常大量出现在原肠期[22]。推测原肠期是整个胚胎发育过程中的关键时期,其间众多细胞有规律地迁移、排列和分化而形成胚层,各胚层细胞开始分化形成各种组织和器官。此外,原肠期胚胎内基因组也由最初的母型调控进入胚胎自身合子型调控[23]。所以,原肠期之前,胚胎比较脆弱,发育处于相对不稳定时期。一旦过了原肠期,胚胎就比较容易脱离母体而独立生存。本研究结果充分证实了这一点,并且经过分离液处理后的受精卵,由于减少了受精卵膜的厚度和黏连带来的污染,孵化率在原肠期之前就突破了50%。由此可见,尽管原肠期的受精卵容易大量死亡,但是将受精卵块分离之后就可以有效地避免离体孵化在原肠期的大量死亡,提高孵化率。
3.4 离体孵化对幼体活力的影响
离体培养可以解决许多生产问题,例如孵化率低、孵化不同步、抱卵蟹死亡连带造成受精卵的浪费[24]等。离体孵化还可以更精确地控制环境条件,可以减少由于母体的侵略性接触、疾病或死亡而造成的损失[25],此外,离体孵化节省空间和成本,可以提高生产效益。但是可能会产生一个问题,离体条件下孵化的幼体与母体孵化的幼体质量有无差异。胁迫实验发现,经过分离液处理后,离体孵化的幼体与母体孵化的幼体没有显著差异。陆家平等[26]认为虾苗包埋于拧干的湿毛巾中5 min,取出放回原育苗池水中,成活率无影响的即为优质虾苗。在本研究中,刚孵化的幼体在干露5 min时死亡率在10%以下,随着干露时间的增加,死亡率逐渐上升,以15 min为节点,死亡率达50%以上,这与斑节对虾的实验结果基本一致[27]。Quinitio等[28]把福尔马林的耐受性作为一种评判拟穴青蟹(S. serrata)幼体活力的指标,在40 mg/L的福尔马林中胁迫暴露3 h,如果Z1在3 h内的死亡率仅在0%~8%,则该批幼体质量较好,如果死亡率为>38%,则其质量较差,育苗可在Z1时期终止。本研究中,离体孵化与亲体抱卵孵化幼体的福尔马林耐受性无显著差异,初步说明离体孵化不影响幼体质量。
另外,对于水产动物的生存(生活)状态,能够从行为学和生理学两个方面进行评估、监测和衡量,相比利用生理学的方法,使用行为学方法的实用性和可操作性更强,并且行为学的方法作为一种非侵入性的技术手段,几乎不会对水产动物造成伤害,同时更为直观,能在较短的时间内作出定性和定量的判断[29]。在动物的各种行为活动中,运动作为水产动物最基本的行为,是其他行为发生的基础[30]。所以为进一步比较离体和亲体抱卵条件下幼体活力的差异,本研究选取响应时间、运动速度和运动距离3个参数对离体孵化幼体的行为进行了分析,结果显示离体和亲体抱卵条件下孵化的幼体运动能力差异不显著,再次证明离体培养是可行的。
综上,本研究确定了三疣梭子蟹受精卵块合适的分离液配方及处理方法,即0.09 g/mL的木瓜蛋白酶,分离时间30 min,明确了三疣梭子蟹各阶段胚胎均能够离体孵化出幼体,并且其与亲体孵化方式所孵出幼体活力无显著差异,表明本研究所采用的胚胎离体孵化方法对幼体质量无负面影响。因此,该受精卵酶法分离与离体培养技术可进一步开发完善,作为三疣梭子蟹受精卵培养和幼体孵化的全新技术方法,为三疣梭子蟹及其他甲壳动物受精卵的离体孵化提供参考。
(作者声明本文无实际或潜在的利益冲突)
