丹酚酸B抑制HuH-7细胞的Hippo/YAP通路机制研究
2024-01-22余新梅李利利
余新梅, 李利利, 张 傲, 邓 洁, 杨 雁
(安徽医科大学 1.基础医学院、2.第一临床医学院、3.第二临床医学院,安徽 合肥 230032)
肝癌是最常见的原发性恶性肿瘤之一,是一种高度异质性疾病。近年来,肝癌的死亡率和发病率都呈上升趋势[1]。在肝癌的治疗药物中,中药由于其毒副作用小、安全经济等优点受到了越来越多的关注。丹酚酸B(salvianolic acid B,Sal B)是丹参中含量最丰富、生物活性最强的活性成分。它是一种酚类化合物,含有多种酚羟基,因此具有很强的抗氧化活性[2]。Sal B的抗氧化和抗纤维化特性已在先前的研究中得到证实[3]。并且Sal B已被证实能抑制肝癌细胞(HepG2)的迁移和侵袭,促进肝癌细胞(Bel-7404 和SK-Hep-1)的自噬并诱导其凋亡[4-5]。为了进一步明确Sal B的抗肝癌作用,本研究选择了HuH-7 细胞探究Sal B是否通过Hippo/YAP信号通路抑制HuH-7 细胞。
Hippo/YAP信号通路是20年前在黑腹果蝇组织生长筛选中首次发现的。它是抑制果蝇组织生长的关键信号通路[6]。作为Hippo/YAP信号通路的核心,转录共激活因子Yes相关蛋白(transcriptional co-activators Yes-associated protein,YAP)和带有PDZ结合基序的转录共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)是Hippo/YAP信号通路的关键效应因子[7]。一旦Hippo/YAP信号通路被激活,其上游分子丝/苏氨酸蛋白激酶(mammalian sterile 20-like kinase 1/2,MST1/2)就会被激活而磷酸化,从而磷酸化其下游分子大肿瘤抑制因子1/2(large tumor suppressor 1/2,LATS1/2)。最后导致YAP和TAZ被磷酸化并滞留在细胞质中,从而抑制组织和细胞的生长和增殖。相反,Hippo/YAP信号通路一旦关闭,YAP和TAZ就被去磷酸化并转移到细胞核中,与TEAD结合激活细胞增殖、生存和迁移的转录程序[8]。结缔组织生长因子(connective tissue growth factor,CTGF)作为YAP/TAZ/TEAD的关键靶基因,在肝癌组织中过表达[9]。近年来,Hippo/YAP信号通路已成为抑制肝细胞增殖、存活和肝癌形成的重要途径之一[10]。
1 材料与方法
1.1 细胞株HuH-7细胞由中国科学院细胞库提供。
1.2 试剂TGF-β1粉末(货号:100-21)购自美国PeproTech公司。Sal B (纯度≥ 98%,货号:PS0054-0020)购自成都普思生物科技公司。MST1/2抑制剂XMU-MP-1(货号:T4212)购自TargetMol Chemical 公司。p-TAZ(#59971)、TAZ(#72804)、MST1(#3682)、CTGF(#86641)、Smad2(#5339)、p-Smad2C(Ser465/467)(#18338)和PAI-1(#49536)等抗体购自美国CST公司。p-MST1(#AF2367)、YAP(#AF6328)、p-YAP(Ser127)(#AF3328)、c-Myc(#AF6054)和GAPDH(#AF7021)等抗体购自江苏亲和生物科技有限公司。p-Smad2L(Ser250/255)抗体由日本关西医科大学Koichi Matsuzaki教授赠送。
1.3 仪器Axio Observer 3型倒置荧光显微镜(ZEISS);ImageXpress MicroConfocal高内涵细胞成像分析系统平台(Moleculaf Devices);DYY-10电泳仪(北京六一仪器厂);BX-53型正置荧光显微镜(日本OLYMPUS公司)
1.4 细胞培养和药物处理以含10%胎牛血清的DMEM培养HuH-7细胞,置于37 ℃、5%CO2的培养箱中。在细胞培养瓶中将HuH-7细胞培养至可传代的密度时,使用胰酶消化,将细胞悬液接种在培养皿或孔板中。实验分组如下:对照组、TGF-β1组、TGF-β1+Sal B组、5 μmol·L-1XMU-MP-1组、5 μmol·L-1XMU-MP-1+Sal B组、10 μmol·L-1XMU-MP-1组、10 μmol·L-1XMU-MP-1+Sal B组。根据实验分组分别加入TGF-β1 (9 pmol·L-1)、Sal B (50 μmol·L-1)、5 μmol·L-1XMU-MP-1和10 μmol·L-1XMU-MP-1处理24 h。随后,根据不同的检测指标分别对细胞进行相应的处理。Sal B和XMU-MP-1储备液的配置:将适量的Sal B和XMU-MP-1粉末溶解在DMSO溶液中,制成50 000 μmol·L-1Sal B和10 000 μmol·L-1XMU-MP-1溶液,分装后放入-80 ℃冰箱中保存。TGF-β1溶液的配置:将10 μg TGF-β1粉末溶于100 μL柠檬酸盐缓冲液,并用900 μL PBS缓冲液稀释,制成10 mg·L-1TGF-β1溶液,分装后放入-80 ℃冰箱中保存。
1.5 CCK-8法检测细胞活力将HuH-7细胞以每孔100 μL细胞悬液接种在96孔板中,每孔细胞数约为5×103个,每组设立3个复孔。培养结束后,每孔分别加入10 μL CCK-8溶液,继续置于37 ℃,5%CO2的培养箱中孵育3 h。用酶标仪在吸光度为450 nm处检测HuH-7细胞的吸光度,并记录各组的吸光度值。
1.6 EdU实验检测细胞增殖将HuH-7细胞以每孔500 μL细胞悬液接种在24孔板中,每孔细胞数约为2.5×105个。用BeyoClick cells EdU细胞增殖试剂盒检测HuH-7细胞的增殖情况。将EdU溶液以适当比例用DMEM稀释,加入弃掉一半培养液的24孔板中。孵育2 h后,用4%多聚甲醛固定细胞30 min,用含0.3% TritonX-100的PBS溶液通透细胞15 min,用click reaction solution避光孵育细胞30 min,用Hoechst33342对HuH-7细胞核进行染色,同样在避光条件下孵育10 min。孵育结束后用PBS溶液彻底洗涤细胞,用高内涵细胞图像分析系统采集图像。用ImageJ软件对EdU染色检测结果进行分析。
1.7 细胞划痕实验检测细胞迁移将HuH-7细胞以每孔2 mL细胞悬液接种于6孔板中,每孔细胞数约为1.2×106个。用无菌枪头在细胞贴壁部分划出一块空白区域,用PBS洗掉脱落的细胞,置于倒置显微镜下拍照记录0 h的细胞划痕宽度。培养24 h后,用PBS洗掉漂浮的细胞,置于倒置显微镜下拍照记录24 h的细胞划痕愈合情况。根据划痕宽度计算划痕愈合率,划痕愈合率=(W0 h-W24 h)/W0 h×100%。W0 h、W24 h分别表示0、24 h的细胞划痕宽度。
1.8 免疫荧光染色实验检测YAP和TAZ的表达将HuH-7细胞接种于置有细胞爬片的12孔板中,每孔接种1 mL细胞悬液,每孔细胞数约为5×104个。培养结束后,用4%多聚甲醛溶液固定细胞30 min,用0.3% Triton X-100溶液通透细胞15 min,用quickblock 封闭液封闭细胞60 min,然后与一抗(YAP和TAZ抗体)在4 ℃下孵育过夜。第2天,加入二抗(Cy3标记),在室温下避光孵育1 h,然后与DAPI溶液在室温条件下避光孵育10 min。最后用PBS溶液充分洗净,取出细胞爬片,将细胞生长面置于滴加抗荧光猝灭剂的载玻片上,并于荧光显微镜下采集图像。采用Image J软件对免疫荧光染色结果进行分析。
1.9 Western blot检测Hippo通路相关因子的表达将HuH-7细胞以每孔2 mL细胞悬液接种于6孔板中,每孔细胞数约为2×106个。培养结束后,每孔加入100 μL裂解液(RIPA ∶蛋白酶抑制剂 ∶磷酸酶抑制剂 ∶EDTA=100 ∶1 ∶1 ∶1),置于冰上裂解30 min,离心取上清液。用BCA试剂盒测定蛋白样品浓度后进行SDS-PAGE电泳,然后用印迹技术将整个细胞蛋白转移到PVDF膜上。5%脱脂乳液室温下封闭PVDF膜1 h,一抗孵育PVDF膜,置于4 ℃冰箱中孵育过夜。使用以下一抗:YAP(1 ∶5 000),p-YAP(1 ∶5 000),TAZ(1 ∶1 000),p-TAZ(1 ∶1 000),p-MST1(1 ∶1 000),MST1(1 ∶1 000),CTGF(1 ∶1 000),GAPDH(1 ∶5 000)。将PVDF膜与二抗在室温下孵育1 h(稀释比例1 ∶5000)。用增强型化学发光ECL试剂覆盖PVDF膜后用ChemiDocTMMP成像系统采集图片。采用ImageJ软件对免疫印迹结果进行分析。
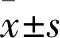
2 结果
2.1 Sal B对HuH-7细胞增殖能力的影响CCK-8实验结果表明,与对照组相比,TGF-β1和XMU-MP-1均能刺激HuH-7细胞的增殖。与5 μmol·L-1XMU-MP-1相比,10 μmol·L-1XMU-MP-1对HuH-7细胞的作用更为明显。而Sal B的干预则可以逆转TGF-β1和XMU-MP-1的促增殖作用(Fig 1B),差异具有统计学意义(P<0.05)。同时, EdU实验结果也显示,经TGF-β1和XMU-MP-1处理后,EdU荧光标记的增殖的细胞核数量明显增加。但是,Sal B则抑制了这一趋势(Fig 2),差异具有统计学意义(P<0.05)。
2.2 Sal B对HuH-7细胞迁移能力的影响细胞划痕实验结果表明,与对照组相比,TGF-β1能够明显地刺激HuH-7细胞的迁移,Sal B则抑制了TGF-β1的促迁移作用,差异具有统计学意义(P<0.05)。但是XMU-MP-1对HuH-7细胞的迁移功能几乎没有影响,并且10 μmol·L-1XMU-MP-1对HuH-7细胞迁移功能的影响与5 μmol·L-1XMU-MP-1相比,这两种浓度对HuH-7细胞迁移功能的影响差异不大(Fig 3)。
2.3 Sal B对YAP和TAZ荧光表达的影响免疫荧光染色结果显示,与对照组相比,TGF-β1和XMU-MP-1显著促进YAP和TAZ的荧光表达,差异具有统计学意义(P<0.05)。并且与5 μmol·L-1XMU-MP-1相比,10 μmol·L-1XMU-MP-1对YAP和TAZ荧光表达的促进作用更为明显。但是,TGF-β1和XMU-MP-1对YAP和TAZ荧光表达的促进作用均被Sal B逆转(Fig 4A-B)。
2.4 Sal B对Hippo/YAP信号通路相关蛋白的影响Western blot结果显示,与对照组相比,TGF-β1显著增加了YAP、TAZ和CTGF的蛋白表达水平,而降低了p-MST1、MST1、p-YAP和p-TAZ的蛋白表达。而Sal B则抑制了TGF-β1的诱导作用,增加了p-MST1、MST1、p-YAP和p-TAZ的蛋白表达,降低了YAP、TAZ和CTGF的蛋白表达(Fig 5-7)。
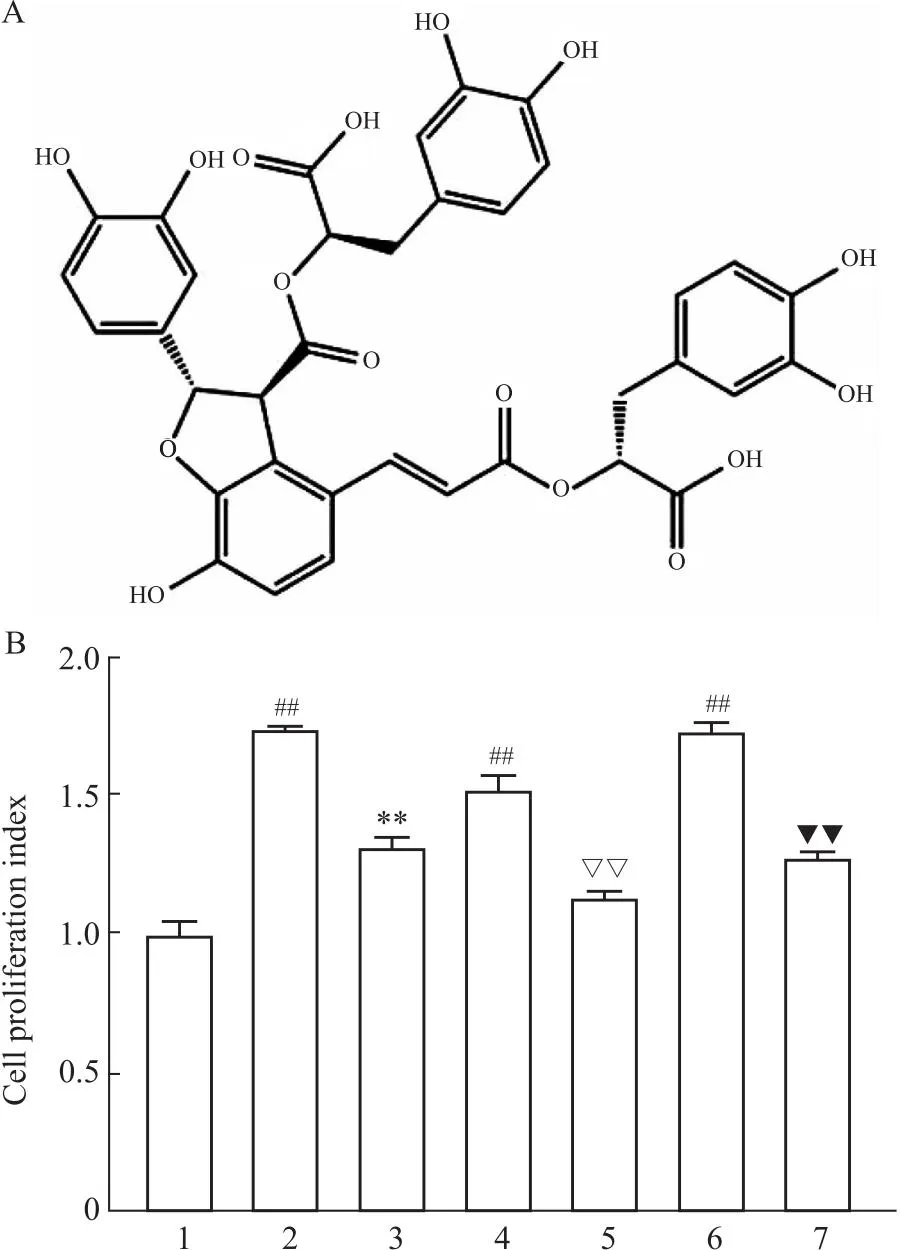
Fig 1 Effect of Sal B on viability of HuH-7 cells n=3)
如Fig 5所示,与对照组相比,XMU-MP-1处理明显降低了p-MST1和MST1的蛋白表达,成功地验证了XMU-MP-1的作用,差异具有统计学意义(P<0.05)。同时,与对照组相比,XMU-MP-1作用后,YAP、TAZ和CTGF的蛋白表达增加,而p-YAP和p-TAZ的蛋白表达降低。并且与5 μmol·L-1XMU-MP-1相比,10 μmol·L-1XMU-MP-1对上述蛋白的作用更为明显(Fig 5-7)。
3 讨论
以上实验结果表明,Sal B能有效地抑制TGF-β1刺激的HuH-7细胞的增殖和迁移。此外,本研究还证实了Sal B对HuH-7细胞的抑制作用可能与Hippo/YAP信号通路有关。
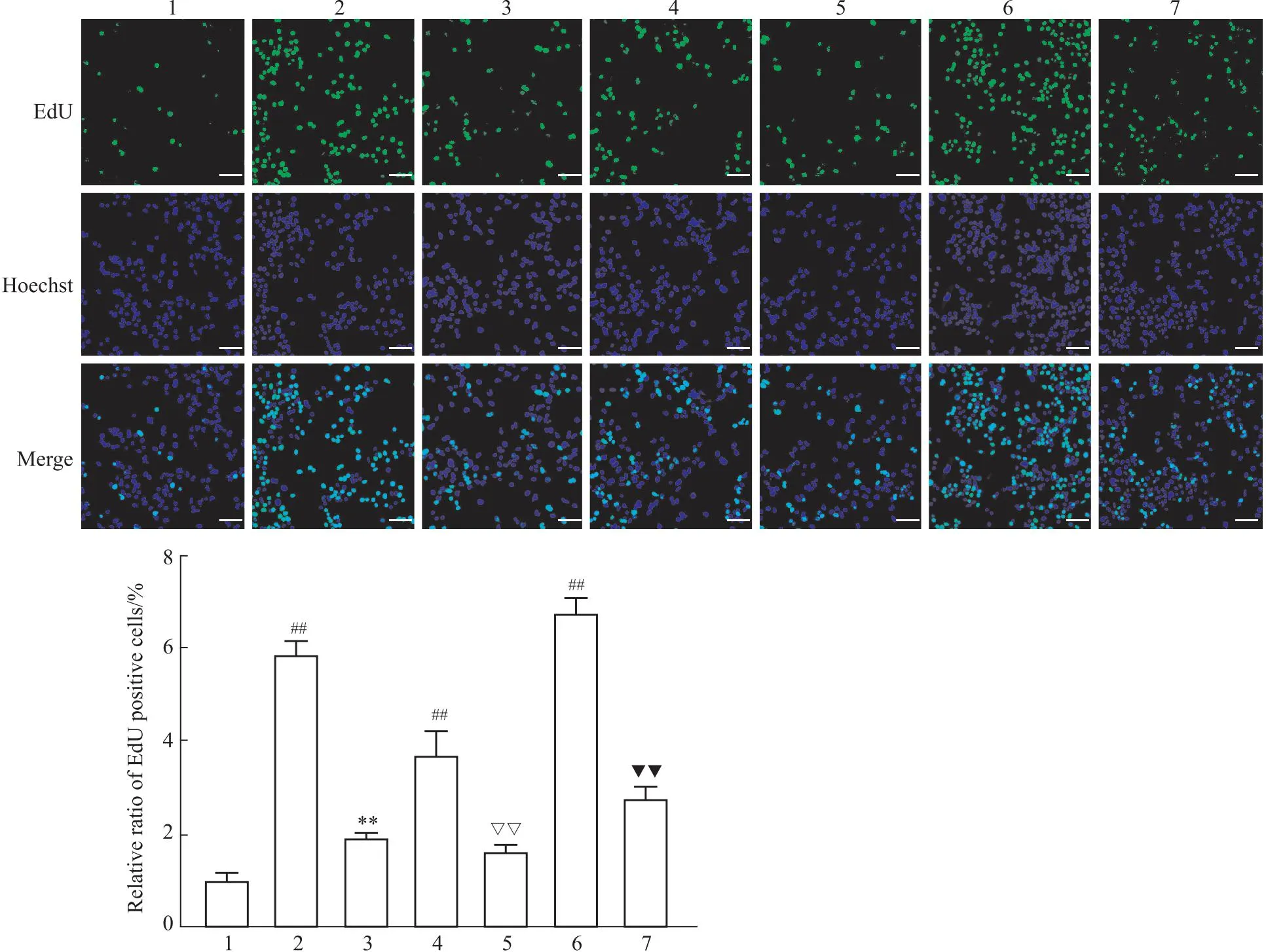
Fig 2 Effect of Sal B on proliferation of
Fig 3 Effect of Sal B on migration of HuH-7 cells n=3)
HuH-7细胞系最早是在一名携带丙型肝炎病毒的日本男子身上发现的。从那时起,HuH-7细胞为丙型肝炎病毒的详细分子研究提供了一条新的途径[11]。已有研究证明[4],Sal B可以通过调节Hippo/YAP信号通路抑制肝癌HepG2细胞。但一种药物可能对不同的细胞系有不同的影响。例如,抗病毒药物奥司他韦可以促进HepG2细胞的凋亡,但不能促进HuH-7细胞的凋亡[12]。Takuma等[13]对几种肝癌细胞系(包括HuH-7和HepG2细胞)进行体外细胞增殖实验,发现了HuH-7细胞对雷戈拉非尼最敏感。此外,我们还发现,在铁代谢、药物筛选和肝毒性研究方面,HuH-7细胞可能比HepG2细胞具有更大的优势[11,14]。可能是Lin等[15]对几种肝癌细胞进行了肝毒性测试,发现HuH-7细胞与人类原代肝癌细胞具有最高的相似性。因此,本研究选择了HuH-7细胞,为Sal B抗肝癌作用的研究提供更全面的证据。并且本研究也发现了Sal B对TGF-β1和MST1/2抑制剂刺激的HuH-7细胞的迁移能力的影响与HepG2细胞相比,确实存在一些差别。在先前的研究中[4],MST1/2抑制剂可以很明显的促进HepG2细胞的迁移,并且受到不同浓度的MST1/2抑制剂的影响,Sal B则可以抑制MST1/2抑制剂的促增殖作用。但是经过我们多次的实验论证,MST1/2抑制剂对HuH-7细胞迁移能力的影响很微弱,就算加大MST1/2抑制剂的浓度,也无法起到很明显的作用。我们猜测HuH-7细胞迁移能力对MST1/2抑制剂的不敏感可能与HuH-7细胞的高分化特性有关。
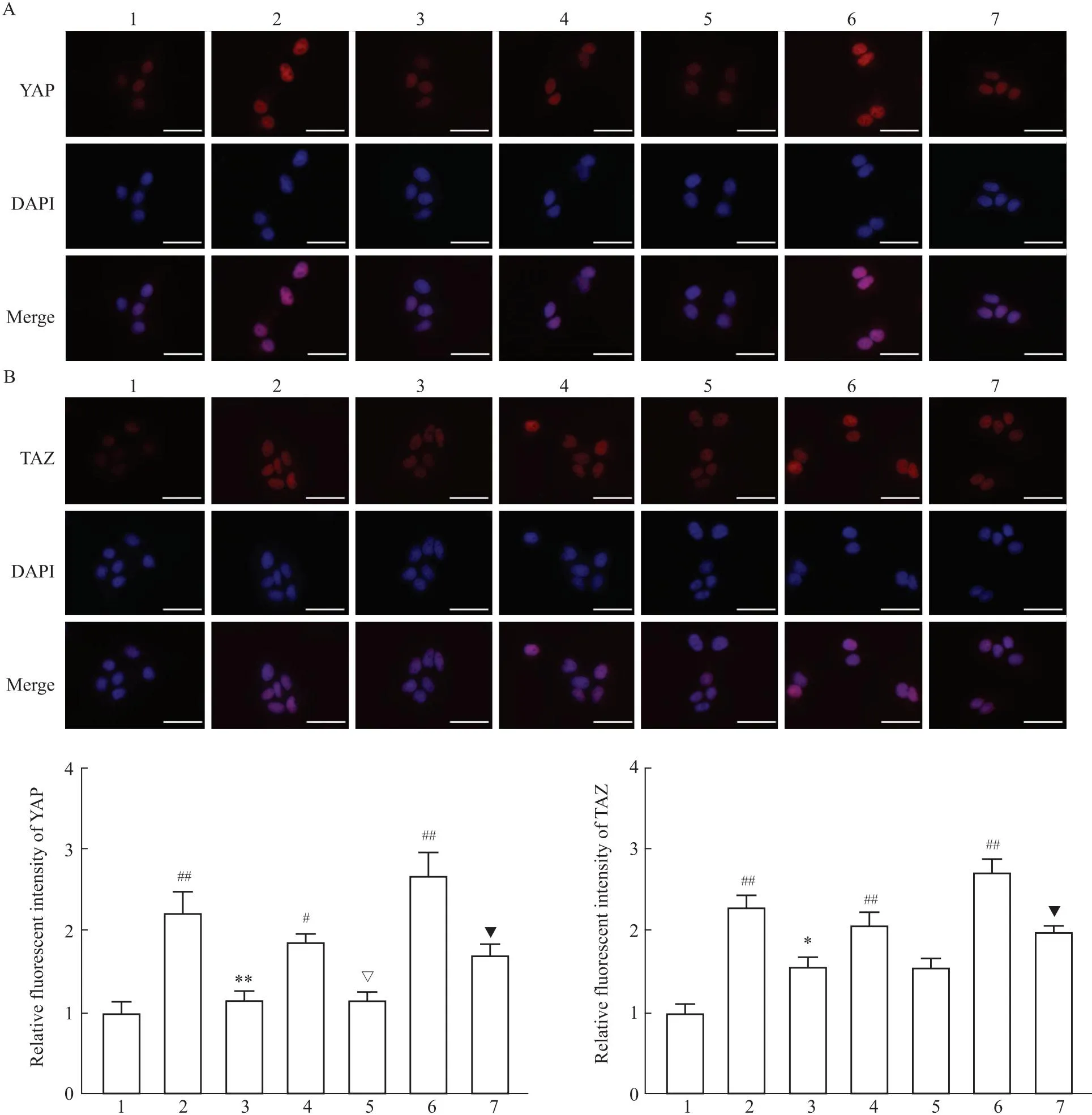
Fig 4 Effect of Sal B on YAP and TAZ expressions in HuH-7 cells n=3)

Fig 5 Effect of Sal B on expressions of p-MST1 and MST1 proteins in HuH-7 cells n=3)
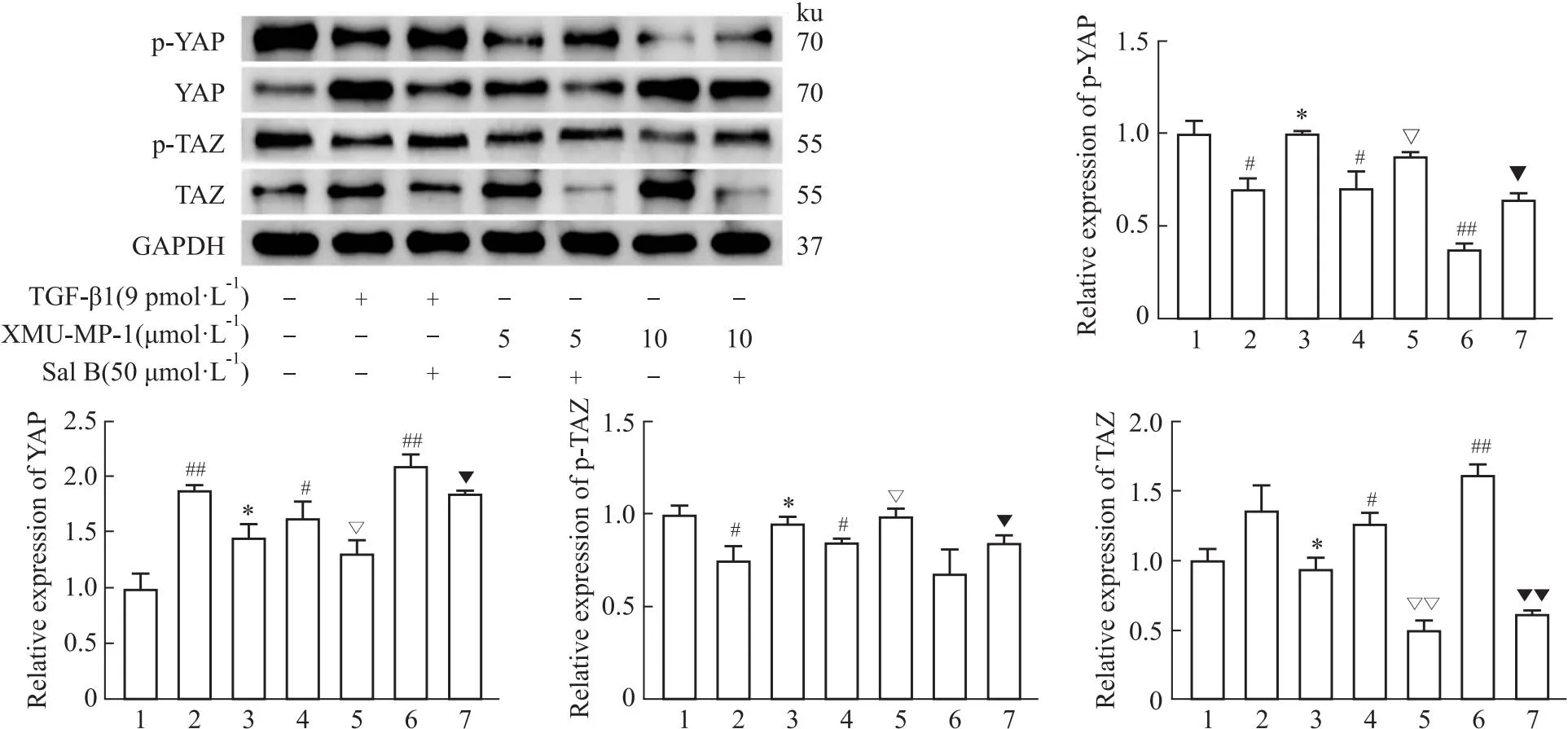
Fig 6 Effect of Sal B on expressions of p-YAP, YAP, p-TAZ, and TAZ proteins in HuH-7 cells n=3)
TGF-β1与肝纤维化、肝癌等肝病的发生发展密切相关。近年来,它在肝癌组织和癌旁基质中的上调表达引起了研究人员的兴趣[16]。因此,本实验选择TGF-β1诱导HuH-7细胞建立体外肝癌模型。MST1/2是Hippo信号通路的上游分子。当细胞受到外界信号的刺激时,MST1/2被激活从而激活Hippo信号通路。LATS1/2受激活的MST1/2的影响而被磷酸化,从而促进YAP和TAZ的磷酸化和降解。相反,当MST1/2缺失或被抑制时,YAP和TAZ进入细胞核并与TEAD结合,激活增殖和抗凋亡基因,如CTGF基因,以加速肝癌的增殖和发展[17]。因此,本实验采用5 μmol·L-1和10 μmol·L-1MST1/2抑制剂来探讨在当MST1/2被抑制,Sal B对HuH-7细胞的抑制作用是否通过调节Hippo/YAP信号通路。
YAP/TAZ是Hippo信号通路的下游效应器,在动物发育过程中调节器官生长,促进受损器官的再生。然而,YAP/TAZ的过度激活可能导致小鼠癌症的发生[18]。本研究发现,在HuH-7细胞中,TGF-β1和XMU-MP-1明显降低了p-MST1、MST1、p-YAP和p-TAZ的蛋白表达水平,而增加了YAP、TAZ和CTGF的蛋白表达水平,其中10μmol·L-1XMU-MP-1的作用更为明显。而Sal B可抑制TGF-β1和XMU-MP-1的刺激作用,降低YAP、TAZ和CTGF的蛋白水平,增加p-MST1、MST1、p-YAP和p-TAZ的蛋白水平。免疫荧光染色同样显示,Sal B可抑制YAP和TAZ的表达。这些结果都表明,Hippo信号通路的上游分子MST1被XMU-MP-1抑制,失活的MST1促进YAP和TAZ去磷酸化后入核,进而介导靶基因CTGF的表达,促进肝癌的发生。而Sal B可减弱XMU-MP-1的作用,提示Sal B可能通过增强MST1/2的活性,激活YAP/TAZ的磷酸化,从而减少YAP/TAZ入核。
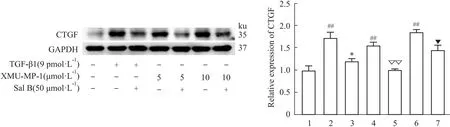
Fig 7 Effect of Sal B on expressions of CTGF protein in HuH-7 cells n=3)

Fig 8 Diagram of regulatory mechanism of Sal B and XMU-MP-1 in Hippo/YAP pathway in HuH-7 cells
在以上讨论的基础上,我们进一步提出了Sal B除了上调MST1/2的活性外,是否还有其他途径来减轻MST1/2抑制剂的影响,如抑制MST1/2的蛋白酶体活性或减少MST1/2的泛素化降解。这些问题需要我们在不久的将来进一步探索。
综上所述,本研究证实了Sal B能够抑制TGF-β1诱导的HuH-7细胞的增殖和迁移。我们推测Sal B的抗肝癌作用可能与激活Hippo/YAP信号通路有关。然而,关于Sal B激活Hippo/YAP信号通路具体的分子机制还没有明确的证据,需要进一步研究。本研究为Sal B的抗肝癌作用提供了一些数据,为其抗肝癌机制提供了新的见解。
