海藻玉壶汤对甲亢大鼠Bax、Bcl-2 mRNA表达的影响
2024-01-20苏炳华蔡萧君陈星海李树延杨羽飞
苏炳华,蔡萧君,陈星海,李树延,杨羽飞
(黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
甲状腺功能亢进症(甲亢)在中医学归属于瘿病的范畴,“瘿病”一词最早来源于隋朝巢元方的《诸病源候论》,并提出该病的病因主要是情志内心和水土因素。明朝陈实功在《外科正宗》瘿瘤门的章节中指出 “夫人生瘿瘤之症,非阴阳正气结肿,乃五脏淤血、浊气、痰凝而成”,采用了“行气散血”“行痰顺气”“活血消坚”的治法。西医认为甲亢是由于甲状腺分泌过多的甲状腺激素而引发的一种内分泌性疾病,主要临床特征有机体代谢亢进和交感神经兴奋,引发出汗、心悸、进食和大便次数增多、体质量减少,严重者可出现甲状腺肿大、眼球突出、手舌颤抖等症状。目前,临床上对甲亢的治疗一般采用口服药物(丙基硫氧嘧啶(PTU)、甲巯咪唑(MMI))、放射性131I治疗和手术治疗[1]。应用口服药治疗甲亢疗程长,缓解率一般,而且可能会出现严重的药物不良反应(白细胞减少或粒细胞缺乏、血管炎、肝功能损害等)[2];131I治疗极易出现永久性甲减的副作用,或者因甲状腺激素进入血液导致甲亢危象,TRAb水平增加导致眼病发生或加重[3];手术治疗风险较大,术后可能会有喉返神经、甲状旁腺暂时性或永久性损伤及甲状腺危象[4]。因此,具有较轻副作用的中药方剂在甲亢治疗中值得关注。
海藻玉壶汤作为治疗瘿病的经典方剂,方中海藻、海带、昆布化痰软坚,消瘿消结,为君药;配以半夏、贝母化痰散结;陈皮、青皮疏肝理气;川芎、当归辛散活血;独活通经活络;连翘清热解毒,消肿散结;甘草调和诸药[5]。由于中药汤剂所含成分较多,治疗靶点广泛,因此,本研究从Bax、Bcl-2一对关于凋亡的正负调节因子的表达变化出发,探讨海藻玉壶汤对甲亢大鼠的作用,为进一步探讨海藻玉壶汤治疗甲亢提供理论基础。
1 材 料
1.1 动 物
SPF级5~6周龄SD大鼠(哈尔滨医科大学实验动物部,动物合格证号SCXK(黑)2019-001),体质量150~170 g,雌鼠80只,雄鼠70只,所有动物均在黑龙江省中医药科学院中药研究所按照动物使用和护理的指导原则和有关规定饲养,适应性喂养1周,之后从中选出状态较好的大鼠60只(雌雄各半)进行实验。所有动物实验程序均由通过黑龙江省中医药科学院动物伦理委员会批准,并符合《实验动物管理和使用指南》相关要求。
1.2 药 物
甲巯咪唑片(批号010001853,默克公司,德国),海藻玉壶汤由海藻30 g、昆布15 g、浙贝母15 g、半夏10 g、青皮6 g、陈皮10 g、当归15 g、川芎10 g、连翘10 g、 炙甘草6 g组成,所有药材都为中药免煎颗粒剂(江阴天江药业有限公司),按比例换算备齐药材后研钵碾细,在100 ℃恒温水浴后玻璃棒搅拌至完全溶解,得到溶液1 440 mL,每日每只大鼠一般灌胃量为1 mL/100 g。
1.3 试 剂
Trizol RNA提取试剂(批号15596026,Invitrogen公司,美国);UltraSYBR One Step RT-qPCR Kit(CW0659S,康为世纪生物科技股份有限公司);DNase/RNase-Free Water(批号R1600,索莱宝生物科技有限公司);异丙醇、氯仿(分析纯,天津富宇试剂有限公司);大鼠三碘甲状腺原氨酸(T3)、四碘甲状腺原氨酸(T4)、促甲状腺激素(TSH)酶联免疫吸附分析(ELISA)检测试剂盒(南京建成生物有限公司);OCT包埋剂、iF488-Tyramide、CY3-Tyramide、iF647-Tyramide、FITC-Tyramide、柠檬酸抗原修复液(pH6.0)、EDTA抗原修复液(pH9.0)、PBS缓冲液、组织自发荧光淬灭剂、牛血清白蛋白 BSA、DAPI染色试剂、抗荧光淬灭封片剂、通用型组织固定液(中性)(赛维尔生物科技有限公司);3%过氧化氢消毒液(安捷高科消毒制品科技有限公司);Bax鼠单克隆抗体(GB114122)、Bcl-2鼠单克隆抗体(GB114830)、HRP标记的山羊抗兔IgG(Servicebio GB23303)、Alexa Fluor488 标记的山羊抗兔IgG(Servicebio GB25303)。
1.4 仪 器
全自动样品冷冻研磨仪(上海净信实业发展有限公司);MX-S可调式涡旋仪(北京大龙兴创实验仪器有限公司);冷冻离心机(赛默飞世尔科技公司,美国);超净台(北京东联哈尔仪器制造有限公司);LINEGENE 9600型Real-time PCR仪(大和博日科技有限公司,日本);JA31002型电子精密天平(上海舜宇恒平科学仪器有限公司);CRYOSTAR NX50冰冻切片机(赛默飞世尔科技公司,美国);M200型多功能酶标仪(Tecan公司,瑞士);HD-100型恒温金属浴(杭州博日科技股份有限公司);BX41型荧光显微镜(Olympus公司,日本);Pannoramic MIDI扫描仪(3D HISTECH 有限责任公司,匈牙利)。
2 方 法
2.1 动物模型建立、分组及给药
将60只SPF级SD大鼠(雌雄各半)随机分为空白组(10只)、模型组(50只)。所有大鼠均12 h/d光照,自由进食进水,普通饲料适应性喂养1周后,模型组大鼠使用皮下注射L-左旋甲状腺素钠造模,1次/d,造模时间1周,单次给药剂量0.35 mg/kg。造模期间观察大鼠的外观情况和整体行为,造模结束后,应用眼眶静脉丛采血法取血,通过酶联免疫吸附分析(ELISA)检测T3、T4、TSH,然后将其分为模型对照组、甲巯咪唑(MMI)组、海藻玉壶汤高中低剂量组。分组后对照组给予0.9%的生理盐水,甲巯咪唑(MMI)组剂量0.187 5 mg/kg,海藻玉壶汤高、中、低剂量组剂量42.86、21.43、12.44 g/kg,连续灌胃8周(1次/d)。
2.2 ELISA法检测T3、T4、TSH水平
在造模结束后,眼眶静脉丛采血法取血,应用酶联免疫吸附(ELISA)法检测大鼠T3、T4、TSH指标,验证造模是否成功。在灌胃第8周最后一次灌胃结束后,所有大鼠禁食12 h,然后将大鼠用100 g/L水合氯醛0.3 mL/100 g腹腔注射进行麻醉,腹主动脉采血,采血完成后应用ELISA法检测大鼠T3、T4、TSH指标。
2.3 样本采集
大鼠腹主动脉取血完成后将大鼠甲状腺解剖取出,一侧甲状腺组织样本放置于液氮速冻15 s,然后放于-80 ℃保存,等待冰冻切片HE染色和免疫荧光检测,取另一侧甲状腺组织置于液氮中保存,等待进行实时荧光定量PCR法(qPCR)检测。
2.4 实时荧光定量PCR法(qPCR)检测甲状腺中Bax、Bcl-2 mRNA表达
精密天平称取甲状腺组织约50 mg,使用Trizol一步法提取组织的RNA,用酶标仪检测RNA的浓度及260 nm和280 nm处OD值,得OD值(1.8~2.0)。按照UltraSYBR One Step RT-qPCR Kit试剂说明书配制反应体系25 μL,目的基因及内参分别平行加到3个孔中(相当于做了3个平行样本检测),加样后应用迷你离心机500 r/min,离心30 s,然后放置在96孔PCR反应板中,启动PCR扩增仪进行扩增循环。以GAPDH为内参,PCR中内参及目的基因引物由生工生物工程(上海)股份有限公司合成。见表1。

表1 引物序列Tab.1 Primer sequence
2.5 甲状腺组织冰冻切片HE染色
将甲状腺组织用手术刀修切平整,后切面朝上放于包埋台上,组织周围滴上OCT包埋剂,快速冷冻包埋;OCT变白变硬后进行切片,切片厚度8~10 μm;切片完成后进行HE染色,脱水,中性树胶封片;扫描后观察甲状腺形态学变化。
2.6 免疫荧光检测
将甲状腺组织冰冻切片在37 ℃烘箱烘烤10~20 min,控干水分,置于固定液固定30 min,于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,5 min/次;使用EDTA进行抗原修复,重复脱色摇床上的步骤;用免疫组化笔在组织周围画圈,切片放入3%双氧水溶液,室温避光孵育25 min,将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,5 min/次;使用3% BSA封闭,封闭30 min;加入第一种一抗(稀释比1∶5 000)去掉封闭液,4 ℃孵育过夜;次日加对应HRP标记的二抗,室温孵育50 min;滴加TSA,避光室温孵育10 min;孵育后,将玻片置于TBST中在脱色摇床上晃动洗涤3次,5 min/次;微波处理:中火8 min停火8 min转中低火7 min;加第二种一抗(稀释比1∶500),4 ℃孵育过夜;滴加对应的荧光二抗,避光室温孵育50 min;滴加DAPI染液,避光室温孵育10 min;在圈内加入自发荧光淬灭剂B液,孵育5 min,流水冲洗10 min;用抗荧光淬灭封片剂封片,通过荧光显微镜观察,Bcl-2显红光,Bax显绿光。
2.7 统计学分析
3 结 果
3.1 各组造模结束后T3、T4、TSH检测结果
本研究结果显示,造模结束后,与空白组比较,模型组与用药组T3、T4升高,TSH下降(P<0.05)。见表2。灌胃第8周,与空白组比较,模型组T3、T4升高,TSH下降(P<0.05)。与模型组比较,甲巯咪唑(MMI)、海藻玉壶汤中高剂量组T3、T4下降,TSH升高(P<0.05)。见表3。
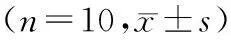
表2 造模结束后各组大鼠T3、T4、TSH检测结果Tab.2 Test results of T3,T4 and TSH in each group after the completion of modeling
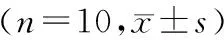
表3 灌胃第8周各组大鼠T3、T4、TSH检测结果Tab.3 Test results of T3,T4 and TSH in each group at week 8
3.2 各组大鼠甲状腺Bax mRNA和Bcl-2 mRNA的2-ΔΔCt表达量
本研究结果显示,模型对照组与空白组比较,Bcl-2 mRNA的表达明显增多(P<0.05);与模型组比较,甲巯咪唑(MMI)、海藻玉壶汤中、高剂量组经过灌胃后,各组Bcl-2 mRNA的2-ΔΔCt表达量明显下降(P<0.05);海藻玉壶汤低剂量组Bcl-2 mRNA的2-ΔΔCt与模型对照组比较无明显变化(P>0.05);Bax在各组均无明显变化(P>0.05)。见表4。
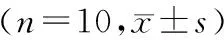
表4 各组甲状腺Bax mRNA和Bcl-2 mRNA的2-ΔΔCt表达量Tab.4 Expression levels of Bax mRNA and Bcl-2 mRNA about 2-ΔΔCt in thyroid gland of each group
3.3 冰冻切片HE染色结果
HE染色结果显示,对空白组、模型组、给药组的大鼠甲状腺组织进行冰冻切片及HE染色,冰冻切片HE染色扫描图显示,空白组甲状腺组织滤泡腔形态正常,滤泡内胞质分布均匀,滤泡上皮细胞呈扁平状,未见增生及滤泡间质水肿;模型组甲状腺组织与空白组比较,部分区域内甲状腺滤泡上皮增生,滤泡增大,大小形态不一,有炎性浸润;与模型组比较,给药组除海藻玉壶汤低剂量外,甲状腺滤泡上皮无明显增生,滤泡大小形态不一,滤泡肿大较轻,炎性浸润减少。见图1。

图1 海藻玉壶汤对甲亢大鼠甲状腺组织病理影响Fig.1 Pathological effect of Haizao Yuhu Tang on thyroid tissue in hyperthyroidism rats
3.4 Bax、Bcl-2免疫荧光结果
本研究结果显示,空白组、模型组、给药组的大鼠甲状腺组织免疫荧光Bax、Bcl-2扫描图显示,模型组与空白组比较,模型组Bcl-2表达增多(P<0.05);与模型组比较,海藻玉壶汤中高剂量组与甲巯咪唑(MMI)组甲状腺组织Bcl-2表达减少(P<0.05),海藻玉壶汤低剂量组甲状腺中Bcl-2表达无明显变化(P>0.05);各组甲状腺的Bax表达量无明显变化(P>0.05)。见图2。


图2 Bax、Bcl-2免疫荧光结果Fig.2 Immunofluorescence display of Bax and Bcl-2
4 讨 论
目前,普遍认为甲亢作为一种自身免疫性疾病,其中凋亡在维持甲状腺组织的稳态中具有重要的作用[6],Bax与Bcl-2均属于凋亡相关基因Bcl-2家族,且两者通过聚合反应形成不同的二聚体调节细胞存亡。凋亡的途径有外在途径(Extrinsic Pathway)、内在途径(Intrinsic Pathway)[7],外在途径与内在途径都在执行阶段结束,为细胞凋亡的最终途径。执行途径以半胱天冬酶的激活开始,半胱天冬酶-3(Caspase3)、半胱天冬酶-6(Caspase6)和半胱天冬酶-7(Caspase3)作为效应器起到“刽子手”的作用,切割各种底物,包括细胞角蛋白、PARP、质膜细胞骨架蛋白α-fodrin、核蛋白NuMA等,最终导致凋亡[8]。内在途径包括线粒体途径和内质网途径,线粒体途径是由癌基因活化、氧化损伤等因素激活Bcl-2家族促凋亡因子,进而增加线粒体通透性,使线粒体内促凋亡因子释放到胞质中,激活Caspase家族,最终导致细胞凋亡[9]。内质网途径是通过泵出钙离子激活Caspace12最终导致细胞的凋亡。在线粒体途径中,线粒体膜上的Bcl-2通过对细胞色素C(Cyt C)进行抑制而发挥抗凋亡作用[10],Bax蛋白和Bcl-2蛋白结合形成异源二聚体,造成Bcl-2蛋白失活,进而减少Bcl-2的抑制作用;Bax也可以自己形成同源二聚体直接促进细胞凋亡[11]。外在途径为死亡受体配体途径,死亡配体激活死亡受体并与之结合,进而激活Caspase8,再由Caspase8激活Caspase3,最终导致细胞凋亡。研究[12]发现,甲亢患者的甲状腺组织中会出现Bcl-2的水平升高。有研究[13]利用FRTL细胞刺激甲状腺抗体(TSAb),可以使Bcl-2表达增加,Bcl-2/bax水平上升;TSAb还可以持续刺激胞膜TSHR,激活腺苷酸环化酶,使甲状腺细胞内环磷酸腺苷(cAMP)含量增加,从而促进甲状腺细胞过度增殖。
海藻玉壶汤在古代作为治疗瘿病的主要方剂,现已成为治疗甲状腺疾病的基础方剂。在一项中医药对甲亢治疗用药规律的研究[14]中发现,海藻的使用频次为第三,药物的配伍以夏枯草为主,配以牡蛎、浙贝母、玄参等,在应用于甲亢模型大鼠的治疗中能够显著降低大鼠的甲状腺功能水平[15]。有临床研究[16]联合应用海藻玉壶汤与甲巯咪唑治疗甲亢,其疗效优于单药甲巯咪唑。海藻玉壶汤中海藻、昆布为富碘中药,虽然富碘中药在甲亢的治疗中存在一定的争议;但有学者认为,富碘中药治疗甲亢不应被摒弃,更不应作为禁忌用药[17]。有研究[18]发现,高浓度碘比低浓度更能促进细胞凋亡,有一定的临床应用价值。在浙贝母对甲亢大鼠治疗作用的研究[19]中发现,浙贝母可以显著降低甲亢大鼠T3、T4水平,抑制甲亢大鼠基础代谢率升高,提高甲亢大鼠耐缺氧能力,降低甲亢大鼠cAMP水平。因cAMP水平与Bcl-2水平具有相关性[20],因此,浙贝母可通过降低cAMP水平发挥降低Bcl-2水平的作用。
综上所述,海藻玉壶汤可以有效改善甲亢指标,对抑制凋亡因子Bcl-2产生抑制作用。本研究使用的是皮下注射方式造模,虽然可以快速有效引起甲功指标变化,但与人体甲亢发生的机制有一定差距,需在后期研究中进一步改进。
