干化对粗枝云杉体胚解剖结构及细胞壁重塑基因表达的影响
2024-01-20凌娟娟胡继文王军辉安三平王丽芳朱天擎
凌娟娟,胡继文,王军辉,安三平,王丽芳,许 娜,朱天擎
(1.中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,国家林木种质资源平台,北京 100091;2.林木遗传育种全国重点实验室,中国林业科学研究院,北京 100091;3.甘肃省小陇山林业科学研究所,甘肃省次生林培育重点实验室,甘肃 天水 741022)
体细胞胚胎发生(体胚发生)是规模化繁育林木良种的一项重要技术,相较其他无性繁殖方式,体胚发生具有彻底幼化、繁殖数量大及速度快等优点,至今已被广泛应用于云杉优良无性系繁育中。云杉(Picea asperataMast.)是构成低纬度高海拔群落的主要针叶树种,在陆地生态系统中占有重要生态地位。此外,云杉具有单位面积蓄积量高,木质纤维长而柔软的特点,是高产优质的建筑及纸浆材原料。然而在实际生产中,云杉体胚的快繁技术仍面临萌发率和转换率低的问题。因此,解决云杉体胚萌发率低,实现高效的云杉规模化繁育体系对生态文明建设及木材可持续利用均具有重要意义。
植物体胚与合子胚均具有转变为完整植株的能力。通常合子胚,即种子发育的最后会经历成熟脱水阶段,获得脱水耐受性,提高萌发能力[1]。例如苜蓿(Medicago sativaL.)种子从果实中分离需处于成熟脱水阶段才能萌发[2],表明了脱水过程对于胚萌发的重要性。以合子胚获得脱水耐受性可提高萌发能力为参考,早期研究发现将云杉体胚置于干燥或高渗透压条件下,降低其含水量能够有效提高体胚萌发率,该方法被称为干化[3-5]。干化对体胚的整体外观和微观形态都有着显著影响,整体观察,干化能使云杉体胚颜色发生改变,根据色素沉积的多少可将干化体胚分为绿色子叶胚(胚根为红色,胚轴和子叶为绿色)和非绿色子叶胚(胚根、胚轴和子叶与干化前变化不大)两类。其中绿色子叶胚的萌发率要远远高于非绿色子叶胚,这种表型差异也被用以简单快捷地判断干化是否成功[6-7]。此外,可以观察到云杉体胚表层在干化后呈皱缩状[8],暗示了在干化过程中体胚细胞结构的变化。有研究表明,当裸子植物合子胚经历脱水时,细胞收缩产生的张力可能导致干燥敏感的细胞受到不可逆的损伤,但细胞壁折叠在整个脱水过程中能保持质膜和细胞壁的连接,从而确保细胞完整性[9-10]。这也是植物在生长发育过程中依赖改变细胞壁构象来应对各种环境刺激的机制。体胚和合子胚高度相似,如白云杉成熟体胚,其形态上除了胚的大小、子叶的取向和表面起皱等方面与合子胚存在一定差异外,其总体形态与发育阶段一致的合子胚非常相似[8]。然而,至今还没有可靠的科学证据表明细胞壁构型的动态变化是云杉体胚响应干化的一种模式。最近关于挪威云杉干化体胚解剖观察的研究显示,干化后体胚解剖结构变化显著,表现为细胞积累大量的脂质体和显著降低的淀粉粒[7],然而限于显微结构放大倍数的,该研究并未观察到干化细胞明显的细胞壁结构变化。
综合早期研究的证据,本课题组认为干化后云杉体胚特定的解剖结构,特别是细胞壁的可塑性可能是萌发率提高的原因之一。为了证实这一假设,本研究通过光学显微和电子显微观察精准地分析干化对体胚解剖结构的影响,建立了细胞形态变化与萌发的关系,同时分析了干化体胚子叶和胚根的差异表达转录本,旨在揭示干化影响粗枝云杉的关键表型和基因表达模式,最终为全面解析干化促进体胚萌发的机理奠定基础。
1 材料与方法
1.1 研究材料与试验设计
本研究以实验室保存的粗枝云杉(Picea asperataMast.)胚性细胞系a 为材料进行云杉体胚发生,再以诱导形成的体胚进一步开展关于干化促进体胚萌发的研究。将继代培养14 d 的高胚性细胞系a 组织团块接种至装有80 mL 液体增殖培养基(调整过的Litvay 基本培养基[11]+ 10 μmol·L-12,4-D + 5 μmol·L-16-BA + 10 g·L-1蔗糖 + 1 g·L-1酶解酪蛋白,培养基冷却至室温时加入过滤灭菌的谷氨酰胺至终浓度为0.5 g·L-1)中,23 ± 1 ℃,110 rpm 震荡暗培养,每7 d 继代一次。将获得的胚性组织接种至分化培养基(1/2 LM + 26 mg·L-1ABA + 50 g·L-1PEG4000 + 30 g·L-1蔗糖 + 活性炭1 g·L-1+ 凝胶4 g·L-1,附加1 g·L-1水解酪蛋白,0.5 g·L-1过滤灭菌的谷氨酰胺)上诱导获得成熟的体细胞胚。具体步骤为:用吸头剪口的移液器吸取4 mL 左右的悬浮培养液到装有定性滤纸(Whatman)的布氏漏斗上,使用真空泵真空抽滤,得到吸附有胚性组织的滤纸。将滤纸转接到固体分化培养基上。于23 ± 1 ℃ 下暗培养6~8 周。挑选形态基本一致的成熟子叶胚,采用“滤纸法”[6]进行干化处理。具体步骤为:将发育完全的体胚置于铺有两层滤纸的培养皿(35 mm × 12 mm)上,随后将培养皿置于大规格培养皿(87 mm ×15 mm)内,大培养皿中加入10 mL 无菌水,用封口膜密封,最后置于15 μmol·m-2·s-1的弱光下培养。
1.2 研究方法
1.2.1 体胚萌发状况和萌发率统计 将干化处理1、7、9、12、14、20 和28 d 后的体胚分别接种至萌发培养基(1/2 LM + 20 g·L-1蔗糖 + 2 g·L-1活性炭,附加6 g·L-1凝胶,1 g·L-1酶解酪蛋白,0.5 g·L-1过滤灭菌的谷氨酰胺)上进行萌发,萌发条件设置为16 h 光照,18~20 μmol·m-2·s-1光照强度,24 ± 1 ℃。通过目测统计每份培养皿中体胚的生根情况,以根系分化露白为萌发指标,计算萌发体胚占总体胚数的比例,以此作为体胚的萌发率,每个处理统计3 个重复,每个重复统计约50个体胚。使用超景深3D 显微镜DVM6A(Leica,Germany)观察干化0、1、7、9 和14 d 的体胚形态。
1.2.2 扫描电镜样品制备 (1)将未干化和干化14 d 的体胚对半切开,置于10 倍样品体积的0.1 mol·L-1PB(pH7.2~7.4) 配制的 2.5%的戊二醛固定液(4 ℃预冷)中,抽真空两次,每次10 min(第一次抽完之后,样品沉底,将浮在上面的样品弃掉),更换固定液4 ℃避光固定48 h。(2)使用PB 缓冲液冲洗两次,每次15 min。(3)梯度乙醇(70%、80%、90%、95%、100%)4 ℃条件下脱水,每次15 min。(4)使用全自动临界点干燥仪(Leica EM CPD300,USA)进行临界点干燥。(5)使用高真空镀膜机(Leica EM ACE600,USA)镀铂金4 nm。(6)样品置于高新场发射扫描电子显微镜(日立SU8230,Japan)下观察体胚的超微结构。
1.2.3 半薄切片制作和显微观察 (1)将体胚切成小块,放入2.5%戊二醛固定液中,0~4 ℃固定3 h 以上;经0.1 mol·L-1的磷酸缓冲液清洗3 次,丙酮逐级脱水,Epon 树脂浸透包埋;最后在60 ℃烘箱中聚合。(2)通过超薄切片机(Lecia EM U7,Germany)切取1~2 μm 左右的切片。(3)然后将切片置于烤片机上45 ℃烤片,随后使用甲苯胺蓝染液进行染色,随后用50%乙醇冲洗,并再次把切片烘干。切片样品在光学显微镜(Olympus BX51,Japan)下进行观察。
1.2.4 透射电镜样品制备和观察 (1)将0.5~1 mm 见方的样品块置于0.1 mol·L-1PB(pH7.2~7.4) 配制的 2.5% 的戊二醛固定液(4 ℃预冷)中固定(与扫描电镜观察所用样品固定方法一致)。(2)PB 缓冲液清洗4~8 遍,每次0.5~1 h。(3)1%锇酸4 ℃避光固定2~8 h,双蒸水清洗4 遍,每次15~30 min。(4)2%UA,2 h 避光,更换新的2 mL 管,双蒸水清洗4 遍,每次20 min,用柠檬酸铅和醋酸双氧铀染色。(5)44 ℃条件下梯度乙醇逐级脱水。(6)室温下乙醇梯度脱水。(7)丙酮树脂逐级渗透。(8)将样品转移至500 μL 管,将切面与管底部平行,45 ℃放置2 h,再60 ℃,静置24~48 h。(9)用钻石刀在超薄切片机下切片,制作好的切片置于透射电镜下(HITACHI HT-7700, Japan)观察。
1.2.5 转录组数据分析 转录组数据来自课题组之前的研究基础,详细数据存入PICEAdatabase(http://www.piceadb.com/)[12]。本研究利用干化处理14 d 和未处理的体胚子叶和胚根的测序数据进行后续分析。将readcount 数据上传到OmicShare Tools 平台(https://www.omicshare.com),使用DEseq2 工具来进行差异分析,差异基因必须满足以下条件: 差异倍数fold change(FC)≥ 2, 显著性值Q value < 0.05。
1.2.6 数据分析和图表制作 采用SPSS 22.0 统计软件进行单因素方差分析和Duncan 法多重比较。使用GraphPad Prism 8 和 Adobe Illustrator CS6 软件生成图形。
2 结果与分析
2.1 粗枝云杉体细胞胚的分化、干化和萌发
本研究所采用的粗枝云杉体胚由胚性组织(图1 a)分化而来,详细的分化过程如图1 所示。将胚性组织置于分化培养基上培养,随着培养天数的增加体胚的形态逐渐显现(图1 b),数量逐步增加。未成熟子叶胚的胚根处呈半透明状,子叶未完全形成(图1 c)。大约分化50 d 后会形成大量的成熟子叶胚(图1 d),成熟子叶胚具有完整的子叶和胚根(图1 e)。
分化形成的成熟子叶胚(图2 a)通常需要经过干化处理来提高萌发率。本研究中干化处理能使粗枝云杉体胚在形态上产生显著的改变,相比于未干化的体胚,干化7 d 后体胚的胚根处逐渐变红,随着干化时间增加红色随之加深(图2 b),而在干化14 d 后体胚形成绿色子叶(图2 c)。干化处理后的体胚在萌发培养基中具有较高的萌发率,如图2 d 所示,萌发20 d 后胚轴伸长明显。体胚苗转接至培养瓶后胚根继续萌发(图2 e),子叶逐渐展开,随后逐渐形成针叶(图2 f)。

图2 粗枝云杉体胚干化和萌发过程Fig.2 Somatic embryo desiccation and germination of P.asperata
2.2 干化时间对云杉体胚萌发的影响
为探究干化对体胚的形态影响,本研究观察了不同干化时间粗枝云杉体胚的形态变化,研究对比了干化0、1、7、9 和14 d 的体胚以及其萌发6 d的形态特征。结果发现,未干化和干化1 d 体胚胚根处均没有明显的红色色素沉积,其中未干化的体胚(图3a)萌发后容易形成玻璃化体胚,胚轴伸长缓慢,子叶分化停滞(图3f)。干化1 d 的体胚诱导萌发后可以形成较为明显的绿色子叶,且胚轴伸长显著,然而胚轴和胚根呈半透明状(图3b,g)。干化7 d 和9 d 的粗枝云杉体胚胚根处呈明显红色,萌发后的胚轴伸长显著,但胚轴和胚根处仍呈半透明状(图3c,d,h,i)。而干化14 d 的体胚胚根红色最为明显,子叶呈浅绿色,萌发后发育正常,几乎不再出现玻璃化现象,子叶进一步分化,逐渐形成针叶的雏形(图3j),胚轴和胚根紧实,不再具有半透明特征。
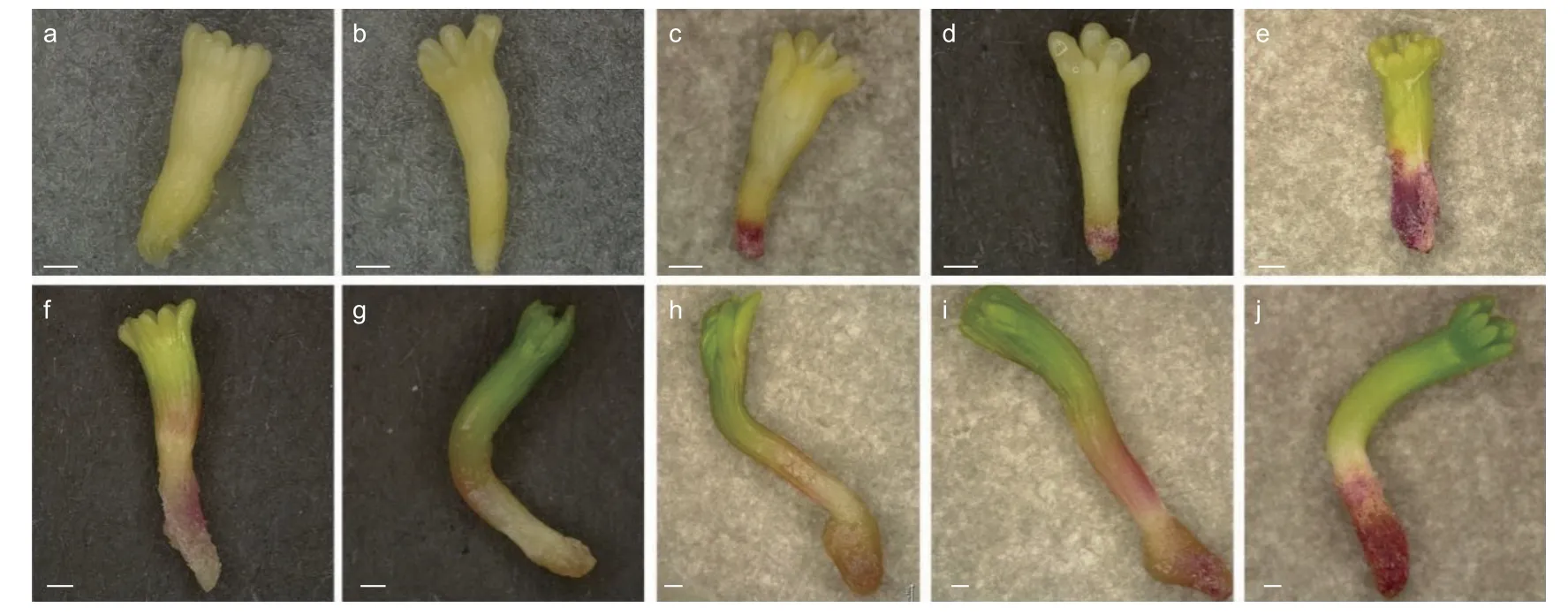
图3 干化处理不同时期粗枝云杉体胚的萌发状态Fig.3 The germination state of somatic embryos of P.asperata at different periods under desiccation
为了高效地利用干化技术促进云杉体胚萌发,本研究探究了不同干化时间对体胚萌发率的影响,统计了未干化、干化1、7、9、12、14、20 和28 d 的粗枝云杉体胚萌发30 d 的生根率。结果发现随着干化时间的增加体胚的萌发率逐渐提高,干化7 d 体胚的萌发率便能显著高于未干化体胚,且为未干化体胚的3 倍左右。而干化14 d 体胚萌发率达到最高,约72%,显著高于其他干化时间的体胚。之后干化时间的增加不再显著提高萌发率,干化28 d 时体胚萌发率降低至55%左右(图4)。
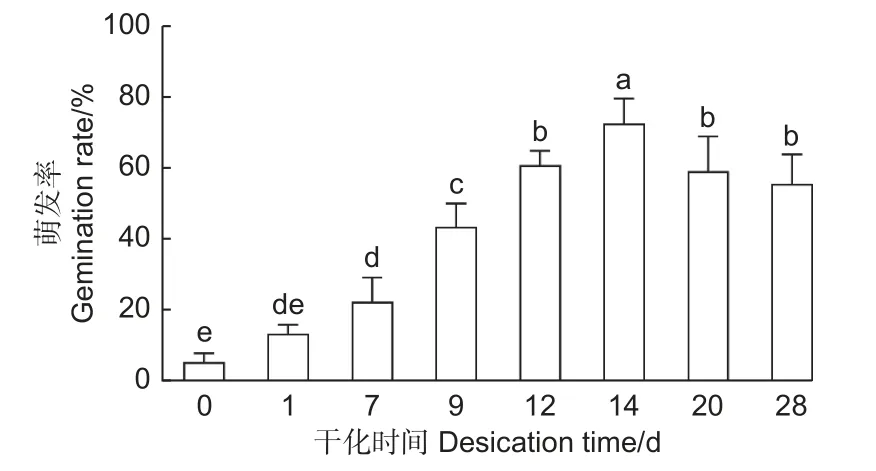
图4 不同干化处理时期粗枝云杉体胚生根情况Fig.4 Rooting of somatic embryos of P.asperata at different desiccation stages
2.3 干化处理云杉体胚的显微结构变化
为深入探究干化对云杉体胚形态造成的影响,研究利用了光学显微镜、扫描电镜和透射电镜分别观察了并对比了未干化和干化14 d 粗枝云杉体胚表面和细胞内的显微和超微结构。扫描电镜观察结果发现未干化体胚(图5a)和干化14 d体胚(图5d)表面存在显著差异,干化14 d 后体胚的表面呈皱缩状。高倍视野下观察可见,体胚子叶表面细胞因干化失水出现离散现象,组织表面呈皱缩状(图5b、e)。相对未干化体胚下胚轴(图5c),干化体胚下胚轴表面(图5f)的细胞同样表现出皱缩状,呈不规则排列。

图5 干化体胚外表面超微结构Fig.5 Ultrastructure of outer surface of somatic embryo after desiccation
研究通过光学显微观察了未干化和干化14 d粗枝云杉体胚的显微结构,结果发现未干化体胚(图6a)和干化14 d 体胚(图6e)之间解剖结构存在显著差异。干化处理后体胚(图6f)的顶端分生组织较未干化体胚(图6b)明显凸起,细胞数量增多。此外,干化14 d 体胚上胚轴(图6g)和下胚轴(图6h)的细胞均变得皱缩且分布不规则,不同于干化前(图6c,d)整齐饱满的细胞特征。特别是下胚轴部分,干化后组织结构呈现出明显的空洞(图6h),但并未破坏根顶端分生组织。这种细胞皱缩的现象与扫描电镜观察的结果相一致,我们推测这种结构变化可能与干化体胚萌发率提高有密切关系。
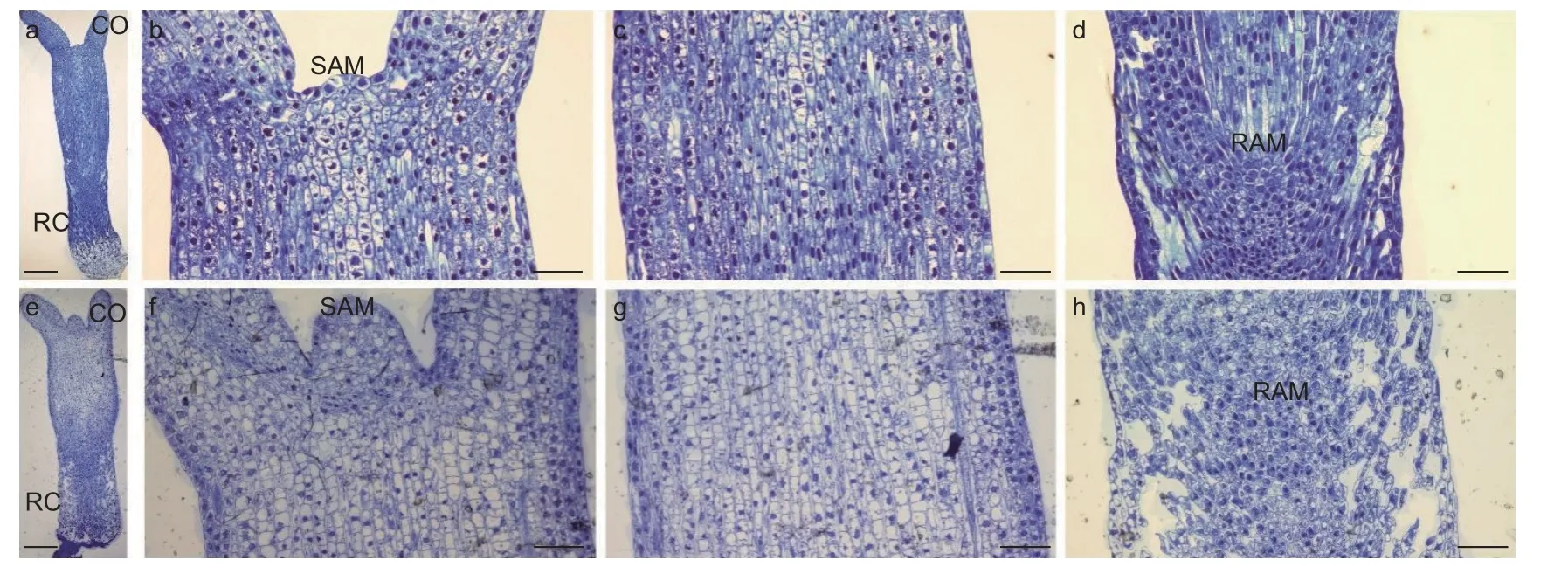
图6 干化体胚显微结构Fig.6 Microstructure of somatic embryo after desiccation
透射电镜的结果发现未干化体胚上胚轴和下胚轴的细饱形态饱满,其中上胚轴细胞呈规则的多边形,能观察到明显的初生壁和细胞角隅(图7 a,c);下胚轴细胞呈椭圆形,细胞壁分化程度相对较低(图7 b,d)。不同的是,干化14 d 体胚胚轴处细胞的形态受到破坏,呈现出明显的皱缩状(图7 e,g),高倍视野下细胞壁不再具有刚性,且表现出松弛的扭曲状(图7 f,h),特别是下胚轴细胞基本已经无法观察到细胞壁分层结构(图7 h)。此外,未干化的成熟体胚细胞中富含淀粉粒(SG)(图7 i),而经过干化处理后体胚细胞中淀粉粒基本消失,但脂质体(LPS)的数量显著增多(图7 j)。

图7 干化体胚细胞超微结构Fig.7 Ultrastructure of cells of somatic embryo after desiccation
2.4 干化处理云杉体胚差异表达转录本分析
为了探究导致干化后粗枝云杉体胚表型变化的内在分子调控因素。本研究分析了干化处理前后粗枝云杉体胚子叶和胚根的转录本表达数据,其中未干化体胚子叶检测到20 512 个转录本(CD0)、未干化体胚胚根检测到20 802 个转录本(RD0)、干化处理14 d 体胚子叶含有21 867 个转录本(CD14)以及干化处理14 d 体胚胚根检测到22 032 个转录本(RD14)(Lu 等,2019)。其中CD14 含有299 个特异的转录本,RD14 含有435 个特异转录本(图8a)。差异表达分析发现,CD14 vs CD0 比较组中分别检测到4 977 和1 683 个转录本显著上调和下调(图8b)。而在RD14 vs RD0 比较组中,共发现4 284 个转录本显著上调,1 571 个转录本显著下调(图8c)。这些转录本是挖掘响应干化候选基因的主要目标。

图8 干化粗枝云杉体胚子叶和胚根的差异表达转录本分析Fig.8 Analysis of differentially expressed transcripts in cotyledon and radicle of somatic embryo after desiccation
本研究已通过解剖结构观察发现干化导致粗枝云杉体胚细胞壁松弛,细胞不再具规则多边形形态,排列疏松。细胞壁松弛和重塑与膨胀素基因(Expansins,EXPA)、木葡聚糖内转糖苷酶/水解酶基因( Xyloglucar endotransglucosylase/hydrolase,XTH)及葡萄糖基水解酶基因(βglucosidase,BGLU)等相关。转录组分析(图9)显示29 个影响细胞壁微纤丝构型的XTHs转录本中大部分显著上调2 倍以上,仅MA_144503g0010成员在干化子叶和胚根中均显著下调。类似的,发现16 个细胞扩展的EXPAs转录本在干化后体胚中差异表达,MA_467939g0010 和MA_10425823g 0010 表达量(RPKM)均超过50,具有较高的表达水平,且在干化胚根中表达分别为未干化胚根的5.54 和2.75 倍,暗示了它们可能是响应干化影响细胞延展性的关键转录本。此外,研究还发现了9 个干化后显著上调和3 个干化后显著下调的PMEs转录本。该类基因参与细胞壁果胶的甲酯化过程,影响细胞壁的刚性,它们的差异表达可能是干化体胚细胞壁机械强度和流动性改变的潜在原因之一。由此可见,这些细胞性质决定基因的差异表达可能共同导致了干化体胚细胞壁重塑,促使其表现出松弛状态。

图9 干化体胚细胞壁重塑转录本差异表达分析Fig.9 Differential expression analysis of cell wall remodeling transcripts of somatic embryo after desiccation
3 讨论
体细胞胚与合子胚的发育过程高度相似,合子胚在成熟过程中往往会经历脱水耐受和后熟阶段,以促进新陈代谢的重组和贮藏化合物积累(蛋白质、脂肪和碳水化合物)为萌发作准备。如果未达到适宜的条件,即使形态上完整的胚也不能够保证正常的萌发[13]。研究人员参照合子胚获得脱水耐受性能促进萌发的模式,采用干化处理来促进体胚的萌发[3]。
干化对体胚的影响类似于大多数合子胚萌发需经历的后熟过程,其诱导的分子和生物学变化不是单纯的延长成熟阶段[14]。干化就像起到了一种使胚从“发育模式”转向“萌发模式”的“开关”作用。有研究发现,形态成熟的体胚在干化处理后进一步改变了状态,比较明显的例子是粗枝云杉体胚在干化后胚轴和子叶呈深绿色,胚根转变为深红色[6],这也成为了鉴别粗枝云杉干化成功与否的标志。在此基础之上,本研究观察并比较了干化后粗枝云杉体胚微观解剖特征的变化。扫描电镜超微结构观察发现粗枝云杉体胚干化14 d 后体胚外表皮呈皱缩状,该结果与白云杉干化体胚表皮皱缩结果一致[8]。光学显微和透射电镜的细胞超微结构进一步发现干化后粗枝云杉体胚细胞排列疏松表现出明显的形变特征,细胞壁不再具有规则刚性结构,表现为松弛状态。随着研究的深入,研究人员发现植物细胞的生长和分化与细胞壁延展性的变化有关[15],也逐渐意识到细胞分化过程中,细胞壁的组成、机械性质等发生改变不再只是细胞分化的“结果”,也可能会反过来调控细胞分化[16],例如,细胞壁果胶甲酯化程度降低利于叶原基的分化[17];Tabernaemontana catharinensisA.DC.的乳汁管分化和生长始于茎尖细胞壁的分解和松散[18]。纤维素细胞壁的正确构建对于植物细胞的塑造和分化至关重要[19]。因此,我们推测干化导致的体胚细胞壁松弛可能解除了细胞壁对细胞分化和伸长的束缚,利于器官的形成,提高体胚萌发率。
细胞壁的松弛主要由多种蛋白质介导,包括EXPA、XTH 和BGLU[20]。其中EXPA 是一类最早被发现作为细胞壁pH 依赖性延伸的介质蛋白,可分为EXPA、EXPB、EXLA 和EXLB 四个亚家族[21]。在酸性条件下被激活,并通过改变纤维素微纤维和木葡聚糖之间的交联而诱导不可逆的壁延伸[15,20]。这种细胞壁的延展性变化直接影响植物器官的发育,有研究表明拟南芥(Arabidopsis thaliana(L.)Heynh.)种子萌发前EXPA2 能调节胚乳细胞扩张辅助胚的生长[22]。本研究发现多个EXPAs在干化体胚中显著上调表达,可能是导致细胞壁松弛的主要因素,驱动了胚胎细胞的扩张,这可能也是导致干化粗枝云杉体胚萌发过程中胚轴显著伸长的原因。类似的,XTH 负责围绕着纤维素微纤丝的木葡聚糖分子的裂解和连接,导致细胞壁松弛和重塑,该基因的表达直接与细胞扩展性和胚轴伸长相关[23-24],因为木葡聚糖是通过氢键与纤维素微纤丝结合,该结构变化有助于细胞伸长过程中细胞壁的松动或硬化[25]。本研究中多个XTHs在干化粗枝云杉体胚中显著差异表达,且大部分上调表达,可能进一步改变了干化粗枝云杉体胚细胞壁的物理性质,促进了组织分化和生长。细胞壁中果胶能够在水合作用和硬度方面发生巨大变化,从而改变细胞和组织的表型,例如,增加细胞壁果胶的硬度可能会导致细胞生长下降。另一方面,果胶的甲酯化程度决定了细胞壁的刚性、流动性等物理性质,通常果胶甲酯化程度越低细胞壁机械强度越高[26],这一过程由果胶甲酯酶(Pectin methylesterase,PME)介导完成,PME 主要行使去甲酯化的作用[27],调节细胞壁中果胶的甲酯化程度来影响细胞的生长和发育。已有报道表明果胶的去甲酯化是欧洲栓皮栎(Quercus suberL.)体胚发生所必需的[28]。粗枝云杉体胚干化后9 个显著上调,3 个显著下调的PMEs可能也参与了体胚细胞壁强度调控,PMEs抑制表达是细胞壁流动性增强的因素,而多个PMEs上调表达理论可能限制细胞的生长,这不符合干化降低细胞壁对细胞生长限制的假设,推测下调表达的PMEs可能才是真正在干化过程中行使功能的,此外,该过程可能还存在果胶甲酯酶抑制因子(Pectin methylesterase inhibitor,PMEI)等基因参与其中,类似与花粉管伸长由PME 和PMEI 两类分子合作完成[29]。值得注意的是,在细胞扩展整个过程中,细胞壁的松弛、重塑和合成必须协调进行,使细胞壁在适应生长的同时,维持完整性[30]。这其中涉及多种基因的共同调控作用。介于此,我们认为EXPAs、XTHs以及PMEs等影响细胞壁性质的基因差异表达,降低了粗枝云杉体胚下胚轴细胞壁刚性,解除了胚根细胞伸长的结构限制,最终协同调控了体胚细胞生长和分化,最终为萌发创造了条件。
4 结论
干化14 d 能有效提高粗枝云杉体胚萌发率。显微和超微结构观察发现干化后体胚子叶和胚根细胞离散分布,细胞壁刚性结构消失,呈松弛形态。多个影响细胞壁性质和参与细胞壁重塑的基因,如EXPAs、XTHs和PMEs在干化体胚中显著高表达是这一现象产生的潜在原因。本研究认为干化导致的体胚细胞壁松弛可能解除了细胞壁对细胞分化和生长的限制,从而促进了云杉体胚萌发。
