不同培养基、生长调节剂浓度对4 个尾巨桉无性系组培生根的影响
2024-01-20黄安瀛陈铭秋卢万鸿王楚彪罗建中
黄安瀛,陈铭秋,林 彦,卢万鸿,王楚彪,燕 青,罗建中*
(1.中国林业科学研究院速生树木研究所,广东 湛江 524300;2.西南林业大学,云南 昆明 650224;3.中国热带农业科学院湛江实验站,广东 湛江 524013)
随着木材需求的日益增加、生态文明建设推进及国际木材保护性贸易政策实施力度的不断加强,木材供应与需求间矛盾日趋严峻,可持续经营已成为我国林业发展的重要要求[1-2]。尾巨桉(Eucalyptus urophylla×E.grandis),是尾叶桉(Eucalyptus urophyllaS.T.Blake) 与巨桉(Eucalyptus grandisW.Mill ex Maiden)的杂交种,融合了亲本速生丰产、树干通直等特点,还具有适应性好、抗逆性强、病虫害少等优点,在我国南方已广泛作为纸浆、造纸、纤维板等生产原材料[3]。良种尾巨桉的大面积种植,可以降低本土木材在市场供应上的压力,减少我国对进口木材的依赖性,对我国森林资源的培育、木材供应的安全均具有保障作用[4]。
我国桉树新品种的开发主要采用“有性改良,无性利用”的模式,即在获得优异的有性改良个体后,通过组织培养来扩繁、利用。组织培养(组培)具有诸多优点,但作为决定其成败的分化、增殖及生根等过程均受多种因素影响,由各种因素导致的无法分化出根或生根质量差等,直接影响后续移栽存活率[5-7]。植物生根过程中细胞需经历脱分化、再分化等阶段,部分植物由于细胞内信号传递限制,相关转录因子基因表达受阻,次生代谢物质抑制等问题导致生根率低、生根质量差、移栽难以成活等问题[8]。因此,提升组培苗生根率,提高不定根质量在植株无性繁殖方面具有十分重要的意义。目前对尾巨桉生根已有较多研究,主要是通过改变外源生长调节剂来促进其脱分化与再分化,常用到的生长调节剂有吲哚乙酸(IBA)、萘乙酸(NAA)及ABT1。研究表明:DH32-26、DH32-28、DH32-29 等尾巨桉的最适生根培养基中添加的生长素以IBA 与ABT1 为主,当IBA 的浓度在0.2~0.3 mg·L-1,ABT1 浓度为0.3~1.5 mg·L-1时,诱导获得的最佳生根率均在95% 以上[9-11]。以IBA 及NAA 为主的常规生长调节剂诱导生根研究中,当IBA 与NAA 的浓度分别为1 mg·L-1与0.2 mg·L-1时生根率最高可达82.5%[12],然而,尽管许多研究中试验材料及生长调节剂种类相同,最佳配方的浓度及成分却不尽相同。此外,ABT1生根粉作为复合配方,目前仅清楚NAA 含量20%,IBA 含量30%,其余成分未知,难以定量分析各成分对生根影响。
植物难以生根应主要受自身基因与代谢物影响,不同浓度的生长调节剂及培养基也会对其造成不同程度的影响。以几种表型较优但生根能力不同的尾巨桉无性系为材料,通过研究不同生长调节剂种类、浓度、无性系、培养基类型对4 个尾巨桉无性系组培苗生根的影响程度,判断这几个因素对其不同生根阶段的影响大小,分析其中的主效因子,为难生根木本植物的根系发育调控研究提供理论和实践参考。
1 材料与方法
1.1 试验材料
试验的尾巨桉无性系均由中国林科院速生树木所遗传育种团队自主研发,为对5 年生杂交子代测定林中长势优良的个体环割、组培而成。取来自同一杂交组合的4 个无性系(EC262、EC264、EC269和EC272)继代增殖瓶苗,进行不同培养基、生长调节剂处理,以研究其生根差异。
1.2 试验方法
选取生长调节剂种类、浓度、培养基及无性系为4 个因素,设计4 因素4 水平正交试验(表1)。预实验中IBA 与NAA 浓度超过5 mg·L-1时4 个无性系均无法生根,故设浓度范围1~4 mg·L-1。其中试验组合中的A、B、C、D 分别代表培养基类型、IBA 浓度、NAA 浓度、无性系4 个因素,1、2、3、4 代表各因素不同处理水平。
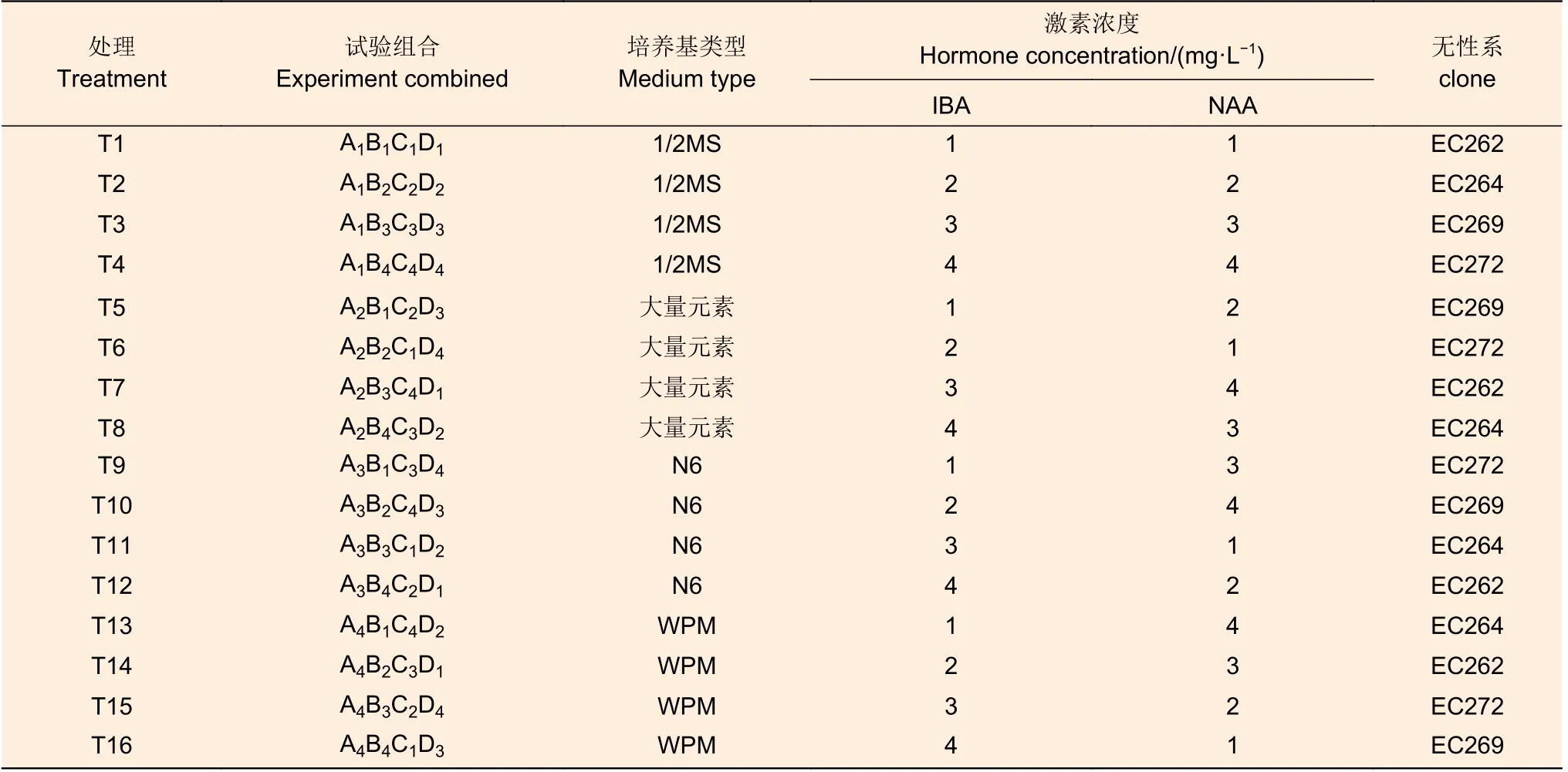
表1 正交试验设计的因素与水平Table 1 Factors and levels for orthogonal design
1.3 培养基配置
选取1/2 MS 培养基、大量元素培养基、WPM、N6 培养基为基础培养基,大量元素培养基配方参照王楚彪[13]提出的根诱导最适配方。培养基中添加15 g·L-1蔗糖、0.5 mg·L-1的半胱氨酸及7 g·L-1的卡拉胶,pH 值为5.8,121 ℃、20 min 高压灭菌后取出加滤膜过滤后的植物生长调节剂。
1.4 接种与培养
选取继代培养20~25 d,高度在4 ± 0.5 cm,生长健壮的丛生苗,剪取2 cm 以上带顶芽部分进行生根诱导试验[14]。暗培养7 d 后转光照培养,培养环境为光照强度为2 000~2 500 lx,光照时长12 h,温度28 ℃,湿度80%~90%。
1.5 测定方法
每周对植物的生长情况进行一次检测,以评估根系的生长状态。培育30 d 后,参考张沛建[15]的分析方法,统计各个试验组生根情况,以生根率、平均根长、最长根长与根数等作为评价标准。生根性状评分参考王艺[16]等方法评估,基部只有一级根及二级根,根系生长局限明显的(图1A),评定为1 分;基部一级根数少于3,存在二级及以上根的(图1B),评定为2 分;基部一级根数大于3,有二级根及以上根,根系发育较好的(图1C),评定为3 分;基部根系发育较为完善,存在三级以上侧根,扎入培养基基质较为扎实的(图1D),评定为4 分。公式计算获得最终分数,

图1 生根性状评分示例Fig.1 The example of rooting trait scoring
其中:N1、N2、N3、N4 均为相应评分的苗数。
1.6 数据统计与分析
利用Microsoft Excel 2016 对获得的不同试验数据进行汇总,并利用SPSS 21.0 进行方差分析,进行多重对比研究(Duncan 法)[17]。
2 实验结果
2.1 尾巨桉生根情况
2.1.1 生根过程 4 个尾巨桉无性系组培苗均属于综合生根类型,总生根数为158 株,其中皮质生根数为114(72.2%),愈伤生根数为44(27.8%)。大量元素培养基中皮质生根植株比例最高,达到86%,相对而言,皮质生根的幼苗叶片及植株生长更健壮(图1C),而愈伤生根的根系通常侧根发育更加健全,根系的扩展能力强,与培养基基质结合更加紧密,但与茎段的连接性较差,叶片及植株生长受限(图1D)。
尾巨桉无性系生根大致分为4 个阶段:(1)0~7 d,茎末端出现小型愈伤团(图2A);(2)7~10 d,愈伤组织陆续出现小根点(图2B );(3)10~15 d,小根点不断膨大且数量不断增加(图2C);(4)15~30 d ,不定根长度快速抽长,出现二级及以上侧根(图2D);(5)30 d以上,不定根数量趋于稳定,根长持续伸长,侧根持续生长 。
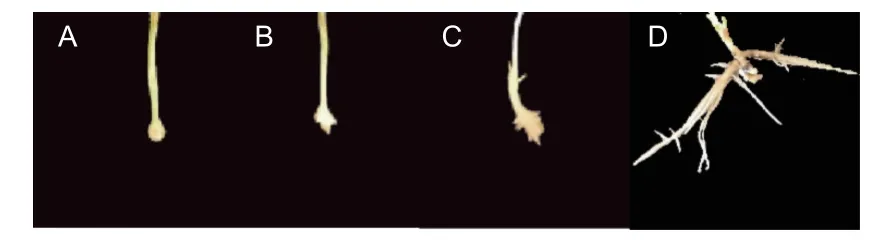
图2 皮质生根不定根形成过程Fig.2 The formation of adventitious roots of E.urophylla x grandis
愈伤生根过程的主要差异体现于7~15 d,愈伤组织不出现小根点,而是持续膨大约3~5 倍,形成愈伤球。在此阶段,从愈伤球中抽出根的组培苗最终会形成愈伤生根,剩余停留在愈伤阶段的植株则会缓慢至停止生长。
2.1.2 不同处理对尾巨桉组培苗生根效果的影响
4 个尾巨桉无性系的根系发育情况如下表(表2),不同处理组合对无性系的生根情况影响不同,方差分析结果表明:植物生长调节剂种类和浓度、培养基类型及无性系均对植株生根的效果均具有极显著影响。4 个无性系在不同处理下均可生根,生根率在7.5%~55%之间,其中,T2 及T6 的生根率显著高于其它处理,其根数也同样高于大部分处理,然而根长与生根性状却与这两种生根情况的关联性不大。各处理下4 个尾巨桉的平均根数介于1~3.27 之间,平均根长在1.95~5.02 cm 之间,最长根长在2.17~7.03 cm 之间, 生根性状评分介于27.78%~75.75%之间。

表2 各因素对尾巨桉生根的影响Table 2 Effects of different treatments on rooting of E.urophylla×E.grandis
2.2 不同处理对尾巨桉生根效果的极差分析
2.2.1 尾巨桉组培苗生根率及平均根数极差分析
结合4 个尾巨桉无性系的生根率(表3)及平均根数极差分析(表4)表明,无性系间差异是这两种生根效果的最主要差异来源。其中,通过生根率的极差分析结果可见,无性系对生根的影响远大于其余3 种因素,其极差达到24.5,而其余3 种因素均在7~8 之间;此外,这4 种因素在处理水平间均存在极显著差异,其中,无性系的4 个处理中的K3(EC269)的生根率(3.5)在极显著水平低于其余无性系(11.5~28.0)。

表3 尾巨桉生根率极差分析Table 3 Range analysis of the rooting rate of rooting for E.urophylla×E.grandis
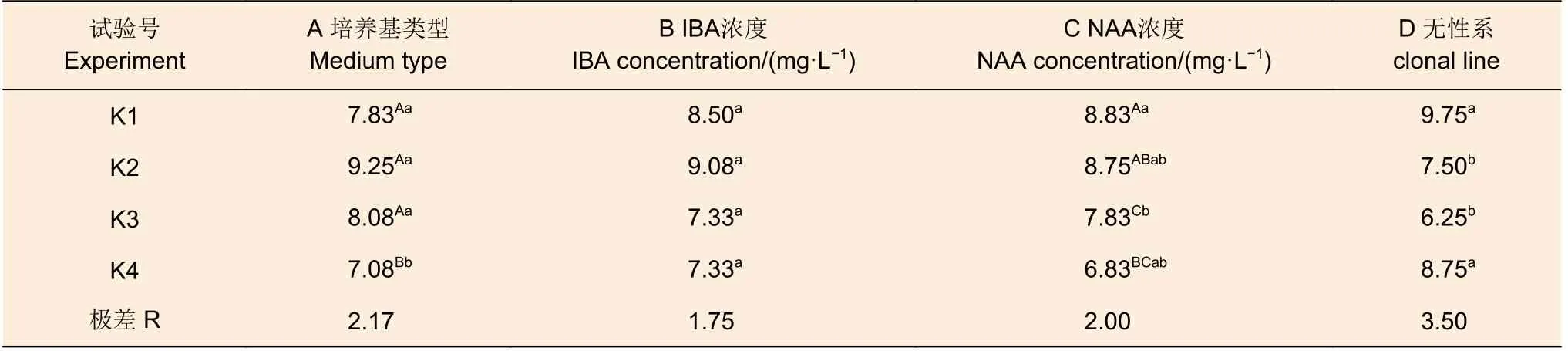
表4 尾巨桉平均根数极差分析Table 4 Range analysis of the mean number of rooting for E.urophylla × E.grandis
平均根数中几种因素的极差较为接近,极差的范围在1.75~3.50 间。从结果而言无性系的影响最大(3.50),其次是培养基类型(2.17)及NAA浓度(2.00)。此外,培养基类型、NAA 浓度的不同处理水平间存在0.01 水平的极显著差异,无性系间存在0.05 水平的显著差异,IBA 各处理间则无显著差异。
2.2.2 尾巨桉组培苗平均根长、最长根长及生根性状评分率极差分析 对4 个尾巨桉无性系平均根长(表5)、最长根长(表6)及生根性状评分率(表7)的极差分析结果表明,所有因素的影响都达到显著或极显著水平,但各因素的重要性与生根率、平均根数中不尽相同。平均根长的极差结果显示,培养基类型对平均根长的影响最大,极差为7.15,且处理K2(大量元素)及K3(N6)在极显著水平上均高于其余处理。而无性系、NAA 浓度、IBA 浓度的极差分别为4.55、3.07 和2.20,重要性依次递减;同时,在平均根长中,除无性系间存在显著差异外,其余均为极显著差异。

表5 尾巨桉平均根长极差分析Table 5 Range analysis of the longest root length of rooting for E.urophylla × E.grandis

表7 尾巨桉生根性状评分率极差分析Table 7 Range analysis of the root effective traits rate of rooting for E.urophylla × E.grandis
对于最长根长,各因素的影响大小排序与平均根长的相同(表6),也是培养基类型影响最大,极差为9.06 , 且处理K2 ( 大量元素)及K3(N6)的平均值分别为18.48 和18.75,极显著地高于其余处理。而无性系、NAA 浓度、IBA 浓度的极差分别为7.26、5.09 和3.17,重要性依次递减。
生根性状评分率(表7)也是判定植株根系发育的重要指标。极差分析结果表明,培养基类型是在这个方面影响最大的因素,其极差为1.59,显著大于无性系的0.43、NAA 浓度的0.30、IBA 浓度的0.22。4 个因素中,也仅培养基类型间的差异达到极显著水平,其他因素内的差异均不显著。
3 讨论
3.1 不同因素对尾巨桉生根效果的影响
影响桉树生根的原因有很多,无性系、生长调节剂浓度及培养基等均会对生根造成影响。本研究综合考虑了这几种因素对4 个尾巨桉无性系组培苗生根效果的影响,结果表明,植株生根不同阶段的主要影响因子不同,在生根初始阶段,主要是遗传因素(无性系间差异)决定其生根差异,而在根系发育的后续阶段,环境因素(培养基类型)的影响超过了遗传因素。有研究表明,生长素与细胞分裂素是植株脱分化的必备条件,在前期预实验中,无生长素、细胞分裂素或极高浓度(5 mg·L-1)的生长素和细胞分裂素均导致植株难以生根,说明一定浓度的生长素及细胞分裂素确是植物生根不可或缺的因素[18]。在本研究中,生长素及细胞分裂素虽是生根必须但其对植株生根的影响小于无性系或培养基类型。研究还发现,4 个尾巨桉无性系生根生长调节剂浓度及培养基适应范围较大,1~4 mg·L-1生长调节剂浓度及4 种培养基培育下均有生根现象,生根植株均从类根愈伤组织开始生长,皮质生根在10 d 左右从茎侧端生长出不定根幼根,剩余则发展为愈伤团,部分可形成愈伤生根,剩余则会逐渐褐化后死亡。
3.2 不定根形成过程影响因素
植物的基因控制着植物内源激素、信号传导,次生代谢产物的水平,而这些产物又反过来控制基因重编程,进而控制如细胞分裂,扩大和分化等细胞过程,以此来影响植物根系的生长[19]。有研究表明,生长素IAA(Indole acetic acid)与其受体蛋白TIR1/AFB ( Transport Inhibitor Response 1/Auxin Signaling F-Box)及ARF(Auxin Response Factor)互作,在调节植物根部分生区大小及早期胚胎根形成阶段,发挥了极为重要的作用[19-22]。ARF 还参与控制生长素外排因子PIN(PINFORMED)的活性[23],该蛋白通过极性运输改变细胞间生长素流动的方向[24-26],参与介导生长素转运的其它3 种转录因子PLT(PLETHORA),SHR(Short-Root)及SCR(SCARECROW),同样被证实在影响细胞分裂,控制细胞增殖及大小等方面发挥重要作用[27-30]。在本研究中,生根率及根数受到遗传因素的影响最大,因此,无法生根的植株可能在基因调控的某个模块存在问题影响植株的脱分化或再分化过程,从而阻碍后续胚胎根的形成。此外,NAA 在生根阶段的影响大于除无性系外的其余因素,研究表明:细胞分裂素通过表达水平和信号通路的修饰导致PIN 家族中几种生长素外排载体基因的转录发生特异性变化,从而影响生长素外排和生长素在根尖的分布以此来调节生长素极性转运控制根分生组织的活性和大小[27-28]。以此推测,生根受阻可能与生长素的转运或与生长素转运相关的几种转录因子PIN、PLT、SHR、SCR等有关,外源添加细胞分裂素在一定程度上弥补遗传因素缺陷,但补救能力有限。
3.3 不定根发育过程影响因素
在后续根伸长及生根性状方面培养基占据了更为重要的地位,大量元素培养基及N6 培养基更适合尾巨桉生长,对比4 种培养基配方后发现,大量元素培养基及N6 培养基内的大量元素KH2PO4高于其它两种培养基约3 倍,微量元素MnSO4·4H2O及ZnSO4·7H2O 含量低于其它两种培养基约4 倍。
磷和钾是植物生长过程中不可缺少的重要物质[29],有研究表明:磷缺乏对拟南芥(Arabidopsis thaliana(L.) Heynh.)初生根的生长具有抑制作用,而对水稻(Oryza sativaL.)及番茄(Solanum lycopersicumMill)的初生根生长却有促进作用。GRAS 家族成员DELLA 及SCARECROW-LIKE 3(SCL3)均被证实在下胚轴和根伸长过程中发挥重要作用[30-31]。DELLA 可通过抑制光敏色素互作因子(Phytochrome-Interacting Factors,PIF)家族丰度阻止PIF 靶基因的表达来抑制下胚轴伸长[32],赤霉素通过参与的GA-GID1-DELLA 途径参与控制根系细胞及组织伸长[31],磷缺乏导致拟南芥中赤霉素(Gibberellin,GA) 水平下降,GADELLA 信号通路的核心DELLA 蛋白累积,进一步导致编码其代谢酶的基因转录物水平发生相关变化,抑制拟南芥初生根生长[33]。而在番茄中,赤霉素在其根系处于低磷环境中时起积极作用,推测GA - PRO(PRO 为番茄中DELLA 家族成员)系统可能在响应番茄磷缺乏时发挥重要作用[33]。而磷元素缺乏会导致苹果分生细胞外质体中铁离子积累,导致铁毒性从而抑制初生根生长[34-35]。
此外,赤霉素信号调节在拟南芥侧根分生组织的侧根萌发率,密度及初生根生长等方面也同样发挥重要作用,外源施用GA 可挽救侧根(LR)短表型,K+缺乏同样通过调控GA 信号和DELLAs相关转录因子调控LR 生长[36-37]。本研究推测,大量培养基及N6 培养基中充足的钾离子及磷酸盐可能通过赤霉素所介导的GA-DELLA 途径及铁离子累积方面,影响尾巨桉根的生长。
研究表明:在硫缺乏的情况下,水稻根能够识别并诱导根产生独脚金内脂,而在其它情况则不会[38]。独脚金内脂被证实通过降低PIN 蛋白在木质部薄壁组织细胞质膜上的积累从而阻碍生长素的运输,并以此影响初生根的伸长及细胞增殖[39-40]。独脚金内脂的缺失促进了侧根的形成,说明独脚金内脂对根毛伸长也有一定影响[41]。这或许为本研究中,硫酸根缺乏的培养基反而在根系的生长上更具优势提供一定理论参考。综上所述,环境因素在4 个尾巨桉无性系的发育过程中发挥极为重要的作用,高浓度的磷酸根离子和钾离子,低浓度的硫酸根离子环境更适合4 个尾巨桉无性系组培苗不定根的产生,这或许与赤霉素及独脚金内脂两种生长调节剂的功能相关。
4 结论
尾巨桉的生根大致分为4 个阶段:0~7 d,茎末端出现小型愈伤团;7~10 d,愈伤组织陆续出现小根点;10~15 d,小根点不断膨大且数量不断增加;15~30 d ,不定根长度快速抽长,出现二级及以上侧根;30 d 以上,不定根数量趋于稳定,根长持续伸长,侧根持续生长。不同激素及培养基组合对不同无性系的生根情况影响不同,方差分析结果表明:植物生长调节剂种类和浓度、培养基类型及无性系均对植株生根的效果均具有极显著影响。此外,极差分析结果表明:无性系是造成4 个尾巨桉的生根率及平均根数这两种生根效果差异的最主要来源,而平均根长、最长根长及生根性状等生根效果则受到培养基类型的影响更大。
