儿科人群嵌合抗原受体T细胞免疫疗法临床研究现状与分析Δ
2024-01-18梁宇光郭春彦
丁 倩,王 谦,张 怡,梁宇光,郭春彦
(国家儿童医学中心,首都医科大学附属北京儿童医院临床研究中心,北京 100045)
细胞治疗是继小分子靶向药、单抗药物之后生物医药产业新的热门领域。细胞治疗是一种将活细胞注入患者体内以治疗疾病的治疗方法,如在免疫治疗中将T细胞移入患者体内后通过细胞介导免疫以对抗恶性肿瘤细胞,或移植干细胞至患者体内促使病变组织再生。细胞治疗一般可分为干细胞治疗、免疫细胞治疗等类型。免疫细胞治疗是利用患者自身或供者来源的免疫细胞,经过体外培养扩增、活化或基因修饰、基因编辑等操作,再回输到患者体内,激发或增强机体的免疫功能,从而达到控制疾病的治疗方法,包括过继性细胞治疗、治疗性疫苗等[1]。常见的过继性细胞治疗包括嵌合抗原受体T细胞(CAR-T)、肿瘤浸润淋巴细胞、工程化T细胞受体修饰的T细胞、自然杀伤细胞和树突状细胞等。根据Nature Reviews上发表的治疗肿瘤的细胞疗法临床研发管线数据,2019—2021年CAR-T疗法相对其他细胞疗法的在研项目数量最多[2]。可见CAR-T疗法的研发热度最高。目前,全球已有8款CAR-T治疗产品获批上市,美国食品药品监督管理局(FDA)批准了6款CAR-T产品,我国国家药品监督管理局批准了2款CAR-T产品,其中只有美国FDA批准的1款适用于儿童。本研究以美国临床试验数据库(ClinicalTrials.gov)作为平台,从CAR-T临床研究每年新增项目数、临床阶段和适应证等方面进行讨论分析,揭示CAR-T在儿科人群临床研究的情况,为我国研究者在儿科人群中开展CAR-T临床研究提供参考。
1 资料与方法
1.1 资料来源
通过美国ClinicalTrails.gov网站,输入关键词“CAR-T”,年龄选择“Child(Birth-17)”,完成筛选。截至2022年12月6日,按照纳入与排除标准,筛选出涉及儿科人群年龄阶段的CAR-T临床研究共190项。纳入标准:研究中目标人群年龄包含<18周岁;研究目的与CAR-T治疗相关;研究状态显示为“Recruiting”“Active not recruiting”“Completed”和“Enrolling by invitation”。排除标准:研究中目标人群年龄仅≥18周岁;研究状态显示为“Not yet recruiting”“Suspended”“Terminated”“Withdrawn”和“Unknown status”。
1.2 方法
通过检索网站登记内容,包括CAR-T临床研究每年新增项目数、国家分布、临床阶段、申办者、适应证、研究靶点和研究设计等方面,进行统计分析。
1.3 统计学方法
采用Excel 2016软件进行CAR-T临床研究的逐条录入、内容分析和数据统计;采用频次和构成比进行数据的表述。
2 结果
2.1 临床研究项目国家分布和年份情况
根据纳入与排除标准,最终纳入儿科人群CAR-T临床研究共190项。研究数量排序居第1位的为我国,登记研究有122项,其次为美国,见表1。190项儿科人群CAR-T临床研究按开始年度分布情况见图1。由图1可见,在2020年和2021年项目数达到高峰。涉及儿科人群的CAR-T临床研究项目最早是由美国登记从2012年开始,我国第1个登记开始的研究是2015年。我国和美国儿科人群CAR-T临床研究各年增长情况见图2。由图2可见,美国的临床研究从2017年开始以每年5~7个项目增长,比较平稳,我国从2019年开始出现显著增长。
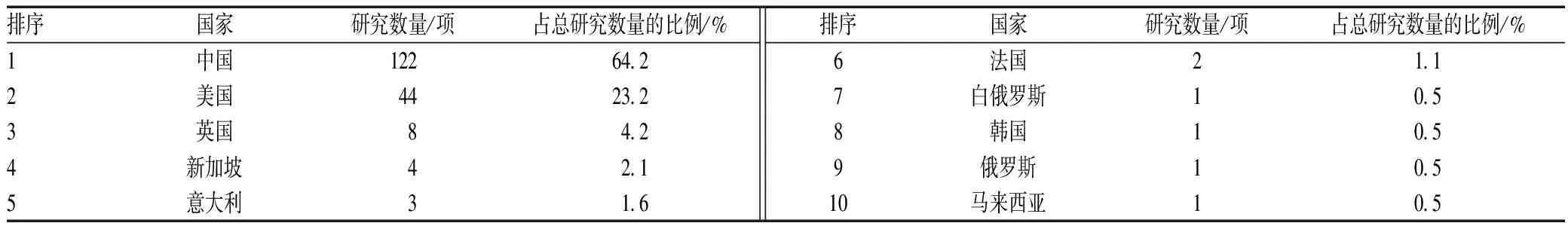
表1 儿科人群CAR-T临床研究数量排序居前10位的国家Tab 1 Top 10 countries in terms of the number of CAR-T clinical studies in the pediatric population

图1 各年儿科人群CAR-T临床研究数量变化趋势Fig 1 Trend of clinical studies on CAR-T in pediatric population by year
2.2 临床研究设计情况
儿科人群CAR-T临床研究设计分类方面,干预性研究181项,观察性研究9项。干预性研究中,以单组设计研究占主导地位(154项,占85.1%),其次分别为平行设计研究(14项,占7.7%)、序贯设计研究(13项,占7.2%)。我国的122项研究中,干预性研究有121项,其中单组研究占92.6%(112项),平行设计研究占3.3%(4项),序贯设计研究占4.1%(5项)。美国的44项研究中,干预性研究40项,其中单组研究占65.0%(26项),平行设计研究占22.5%(9项),序贯设计研究占12.5%(5项)。根据预期样本量分析发现,儿科人群CAR-T临床研究预期样本量≤20例的有66项,21~49例的有50项,50~99例的有40项,≥100例的有34项。我国和美国临床研究样本量各阶段数量对比见图3。我国的122项研究中,样本量≤20例的研究占41.0%(50项),21~49例的占19.7%(24项),50~99例的占20.5%(25项),≥100例的占18.9%(23项);美国各阶段占比分别为22.7%(10项)、38.6%(17项)、27.3%(12项)和11.4%(5项),相对来说,我国≤20例受试者样本量的临床研究占比较多。

图3 中美临床研究样本量各阶段数量对比Fig 3 Comparison of sample size in different phases between China and the United States
2.3 临床研究阶段分布
190项儿科人群CAR-T临床研究所处临床阶段,以早期Ⅰ期、Ⅰ期、Ⅰ/Ⅱ期临床研究为主,共151项;27项CAR-T临床研究登记所处临床阶段为不适用或未填写,其中9项为观察性研究,见图4。我国80.3%(98项)的儿科人群CAR-T临床研究项目都处于早期探索阶段,没有项目进入Ⅲ期研究;美国处于早期探索的项目占86.4%(38项),有1项研究进入Ⅱ/Ⅲ期,见图5。

图4 儿科人群CAR-T临床研究阶段分布Fig 4 Phase distribution of clinical studies on CAR-T in pediatric population

图5 中美儿科人群CAR-T临床研究各阶段项目数对比Fig 5 Phase distribution of clinical studies on CAR-T in pediatric population between China and the United States
2.4 临床研究申办者情况
190项儿科人群CAR-T临床研究的申办者主要为大学或研究机构,其次为医疗机构、企业;我国的122项研究中,由企业发起的研究数量最多;美国的44项研究中,由大学或研究机构发起的研究数量最多,可见现阶段儿科人群CAR-T临床研究均以科研探索为主要目的,见表2。

表2 儿科人群CAR-T临床研究申办者情况Tab 2 Sponsors of clinical studies on CAR-T in pediatric population
2.5 临床研究疾病类型及靶点情况
190项儿科人群CAR-T临床研究的疾病类型方面,主要集中于肿瘤及肿瘤样疾病,共183项(占96.3%)。从适应证分布来看主要为血液肿瘤,尤其是白血病和淋巴瘤,目前临床研究项目数最多,共156项(占82.1%);其他为实体瘤项目,主要涉及成神经细胞瘤、骨肉瘤和胶质瘤等;还有4项风湿性疾病,1项消化系统疾病,1项免疫性疾病,1项神经系统疾病。我国的122项研究中,肿瘤及肿瘤样疾病共116项(占95.0%),另有3项风湿性疾病,1项消化系统疾病,1项免疫性疾病和1项神经系统疾病。美国的44项研究中,肿瘤及肿瘤样疾病共43项(占97.7%),另有1项风湿性疾病。
190项儿科人群CAR-T临床研究的靶点方面,单靶点研究116项(占61.1%),双靶点研究49项(占25.8%),3个及以上靶点的研究11项(占5.8%),未提及靶点的研究14项(占7.4%)。单靶点研究中的靶点类型见表3。双靶点研究以CD19和CD22最多(23项),其次为CD19和BCMA、CD19和CD20(均6项),最后是CD4和CD8(5项)。我国的122项研究中,单靶点研究69项(占56.6%),双靶点研究37项(占30.3%),3个及以上靶点的研究11项(占9.0%),未提及靶点的研究5项;美国的44项研究中,单靶点研究33项(占75.0%),双靶点研究8项(占18.2%),未提及靶点的研究3项。血液肿瘤领域CAR-T项目靶点较为集中,白血病和淋巴瘤细分领域我国和美国都主要集中在靶向CD19,目前儿科人群CAR-T血液肿瘤领域形成了以CD19单靶点为主流、双靶点和多靶点齐头并进的研究格局。
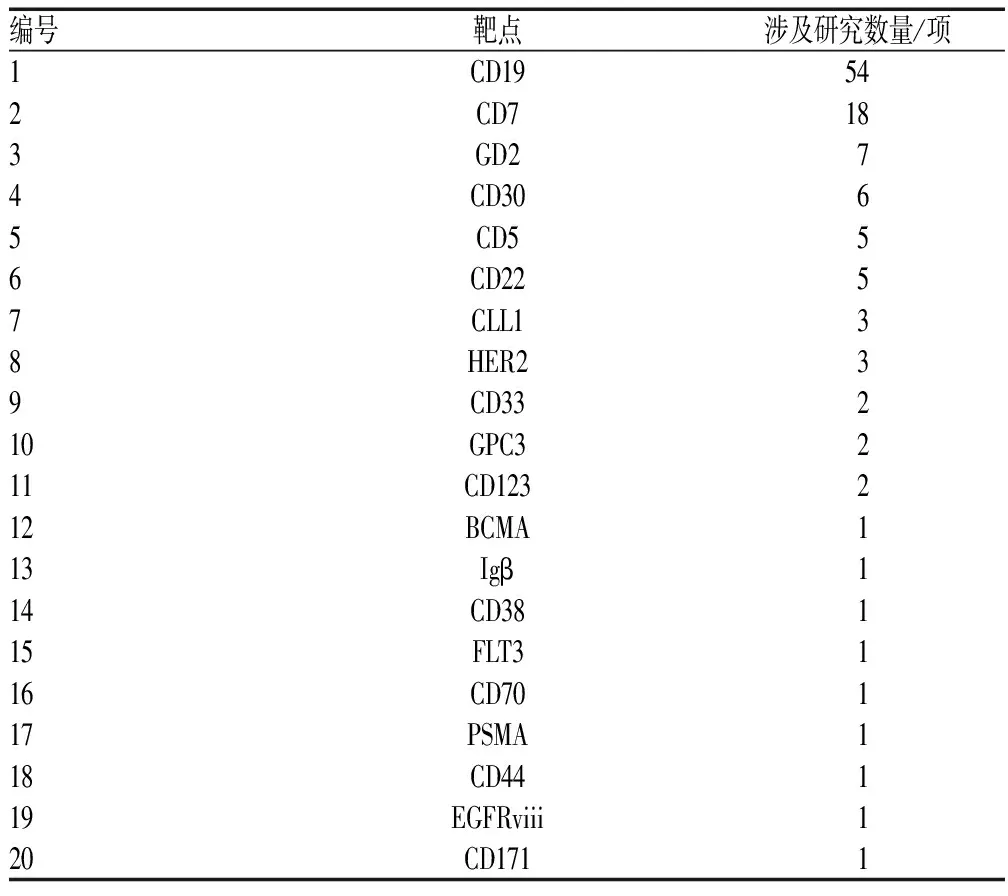
表3 儿科人群CAR-T临床研究单靶点类型Tab 3 Single target type of clinical studies on CAR-T in pediatric population
2.6 临床研究结果情况
190项儿科人群CAR-T临床研究中,没有结果的为188项(占98.9%),仅2项有研究结果。(1)一项为在B细胞急性淋巴细胞白血病中某CD19和CD22双重靶向的CAR-T细胞的安全性和有效性Ⅰ期研究。研究结果显示,该药物表现出良好的安全性,未报告剂量限制性毒性或相关的严重细胞因子释放综合征或神经毒性病例。治疗后1个月,缓解率为86%[3]。(2)另一项研究为评价GD2-嵌合抗原受体T细胞方案治疗复发或难治性神经母细胞瘤的可行性。该研究结果证明,用GD2 CAR-T细胞靶向成神经细胞瘤是一种有效和安全的策略,但需要进一步修改以促进CAR-T细胞的寿命[4]。
3 讨论
目前,白血病是我国儿童中最常见的恶性肿瘤,其次为中枢神经系统肿瘤和淋巴瘤;在青少年中,恶性上皮肿瘤和黑色素瘤的发病率居第1位,其次为白血病和中枢神经系统肿瘤[5]。急性白血病患儿Emily Whitehead于2012年接受了CAR-T治疗并获得了成功,成为全球首例CAR-T疗法治愈的白血病儿童[6]。
CAR-T治疗白血病缓解率高,但有近50%的患者可能复发[7]。靶点阳性的复发可能与体内CAR-T细胞数量及功能的耗竭有关,靶点阴性的复发则与肿瘤细胞抗原丢失有关[8]。目前研究提高CAR-T效果、减少复发的策略包括:改进CAR-T细胞的设计和构建;设计能分泌白细胞介素18(IL-18)等细胞因子的CAR-T;双靶点、多靶点的联用以及去除免疫检查点分子[9-10]。
儿童同成人一样,CAR-T疗法的短期不良反应主要有细胞因子释放综合征、神经毒性血细胞毒性,中长期不良反应为血液毒性、继发性免疫功能低下[7]。研究人员正试图找到降低不良反应的方法,以增强患者对该疗法的耐受性,中长期不良反应需更长时间的研究[11]。CAR-T疗法在治疗儿童实体瘤方面,研究最多的是肿瘤细胞选择性高表达CD2。目前的研究尚未取得理想疗效,还需要更多的研究[12]。
目前,我国对于细胞治疗的管理分为由卫生管理部门备案管理的研究者发起的临床试验研究和药品管理部门批准的细胞治疗产品的临床试验及审批两大类[13]。双轨制的管理模式在某种程度上推动了我国细胞治疗的快速发展,本研究发现,我国儿科人群CAR-T临床研究同样增长迅猛。两种模式相互交错,产品或技术的质量评价标准和监管要求均缺乏一致性,监管路径一直存在争议[14]。
2022年11月,查询国家药品监督管理局的“药物临床试验登记与信息公示平台”,显示按药品注册的儿科人群CAR-T临床研究只有7项,说明很多国内企业和研究机构主要通过要求相对较低的“备案制”在医疗机构开展临床研究,没有通过“注册制”开展研究,虽然在一定程度上推动了细胞治疗产品和行业在临床应用方面的发展,但在很大程度上阻碍了细胞治疗产品的注册[15]。
在美国,CAR-T作为一类风险相对较高的产品,无论产品是否以上市为目的,一旦用于临床研究或申请上市,就必须经过美国FDA的批准,经过严格的临床试验验证产品的安全性、有效性及质量[15]。为了完善和支持我国细胞与基因治疗行业的发展,国家发布了一系列法规指南,出台的文件更多集中于非临床研究方面,对于临床研究和商业化生产较少涉及[16]。2022年,为了鼓励行业发展,北京市、上海市、深圳市、天津市、河南省、湖南省、四川省、浙江省和吉林省等均在细胞治疗和免疫疗法方面出台了支持政策。目前,国内已有2款成人CAR-T产品上市(瑞基奥仑赛注射液和阿基仑赛注射液),CAR-T疗法正在迅速发展,以改善血液肿瘤患者的预后和生活质量[17]。CAR-T疗法虽然仍存在许多不可忽视的问题,如高成本、耗时的生产过程、制造失败的固有风险和免疫相关不良事件等[18],现行的基因和细胞治疗产品监管体系也需要进一步改进和完善[19],但是,CAR-T治疗优势显著,市场潜力巨大[20]。儿科人群CAR-T临床研究处于早期,以科研探索为主,小样本量研究较多,需要更多的支持来进一步探讨如何增强细胞免疫疗法的疗效,扩大适应证范围,降低其成本,期待我国的CAR-T产品或疗法为患儿带来更多的可能性。
