基于FAERS数据库的达雷妥尤单抗相关药品不良反应信号挖掘Δ
2024-01-18龚福恺吴建华
焦 敏,滕 威,沈 皓,龚福恺,吴建华#
(1.新疆维吾尔自治区人民医院药学部,乌鲁木齐830001; 2.新疆维吾尔自治区临床药学研究所,乌鲁木齐 830001)
达雷妥尤单抗是国内首个获批的人源化、抗CD38 IgG1κ单克隆抗体,能与CD38特异性结合,诱导多发性骨髓瘤(multiple myeloma,MM)细胞快速死亡,导致MM细胞溶解[1]。达雷妥尤单抗分别在2015年、2016年和2019年被美国食品药品监督管理局(FDA)、欧洲药物管理局和我国国家药品监督管理局批准为复发/难治性MM的单药治疗方案。达雷妥尤单抗在我国上市时间短,临床医师使用经验和安全性数据较少。FDA不良事件报告系统(FAERS)包含所有美国上市药物的用药详细信息,是具有较多用药人群的数据库[2-3]。因此,基于为医师、药师等医务工作者提供来自真实世界的药品不良反应(ADR)数据,本研究利用FAERS数据库挖掘达雷妥尤单抗的ADR信号,以补充药品说明书中的ADR信息,为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
以“daratumumab”“达雷妥尤单抗”“达拉木单抗”和“达雷木单抗”为检索词,检索FAERS数据库中达雷妥尤单抗自2014年1月在美国上市后连续32个季度的数据。将所得资料导入数据库中,删除重复数据。
1.2 数据提取和筛选
由于自发呈报系统的ADR描述用语具有多样性,为统计分析,需要使用特定的术语集或字典(如《药品不良反应术语使用指南》)将ADR描述用语加以规范,并将属于同名ADR首选术语(PT)下的描述用语进行合并,分别统计。去重,保留最新记录。
1.3 数据挖掘
采用报告比值比法(ROR)和比例报告比值比法(PRR)[4]。目标药物与ADR之间计算结果>给定阈值,提示失衡,说明目标药物与目标ADR存在统计学关联[5]。
2 结果
2.1 ADR基本情况
经过检索统计分析,得到达雷妥尤单抗相关ADR报告17 757例,由达雷妥尤单抗引起的目标ADR(死亡)报告772例,患者平均年龄为(57.05±23.49)岁,其他基本信息见表1。
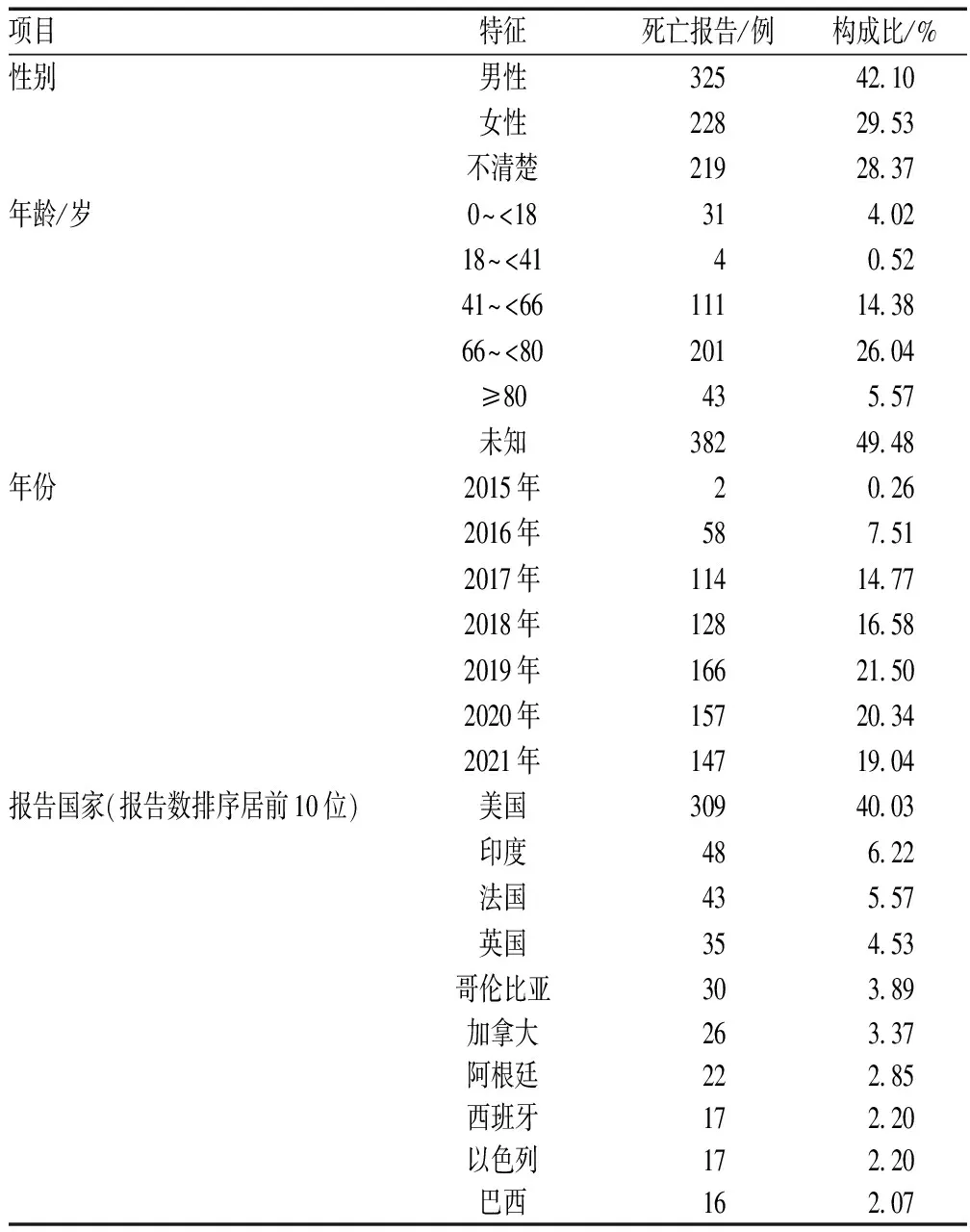
表1 达雷妥尤单抗相关死亡事件基本信息Tab 1 Basic information of death events related to datatumumab
2.2 信号检测结果
将检索到的17 757例ADR报告用ROR法和PRR法进行计算,合并同名并删除非ADR的PT,再根据阈值为筛选条件,将其按信号强度(ROR,PRR)进行排序,得到ADR发生频次和信号强度排序居前50位的PT,见表2。

表2 发生频次和信号强度排序居前50位的PTTab 2 PT in the top 50 places ranked by occurrence frequency and signal strength
2.3 相关死亡事件分析
死亡事件报告772例,ROR和PRR法信号检测结果有所差异,PRR=1.09(<2),ROR=1.09(<2),提示未生成可疑信号,但是χ2=6.03(>4),ROR的95%CI下限为1.01(>1),提示生成可疑信号,几种方法检测结果不一,需进一步关注,见表3。
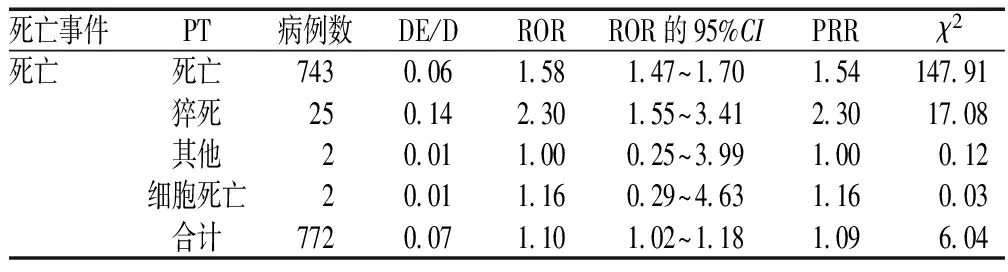
表3 相关死亡事件的信号检测结果Tab 3 Results of signal detection of related death events
2.4 死亡事件中的联合用药分析
死亡事件报告中,与达雷妥尤单抗联合应用的药物主要为皮质类固醇激素受体激动剂、蛋白酶抑制剂,见表4。
2.5 适应证分析
浆细胞骨髓瘤、预防、高血压、疼痛等疾病的患者死亡病例平均诊断率相对较高,见表5。
3 讨论
达雷妥尤单抗能够通过多种机制诱导骨髓瘤细胞快速死亡,一方面,与MM浆细胞表面的跨膜胞外酶CD38分子结合,使细胞裂解,具有广谱杀伤活性和抗肿瘤活性。此外,有研究结果显示,达雷妥尤单抗能有效延长MM患者的生存期[6]。另一方面,可以消耗CD38+髓样来源的抑制细胞、增加辅助性T细胞和细胞毒性T细胞的产生,发挥免疫调节作用[7]。达雷妥尤单抗在我国上市较晚,缺乏其治疗MM的疗效及安全性资料。
本次FAERS数据库挖掘发现,达雷妥尤单抗相关ADR报告数从2017年开始逐年升高。772例达雷妥尤单抗相关死亡事件报告中,上报例数排序居前3位的国家分别为美国、印度和法国,其中美国上报例数最多,为309例(占40.03%)。国家发达程度可能与药品安全性重视程度存在关联性,因此,提示其他国家也应加强达雷妥尤单抗相关ADR的监测与上报。
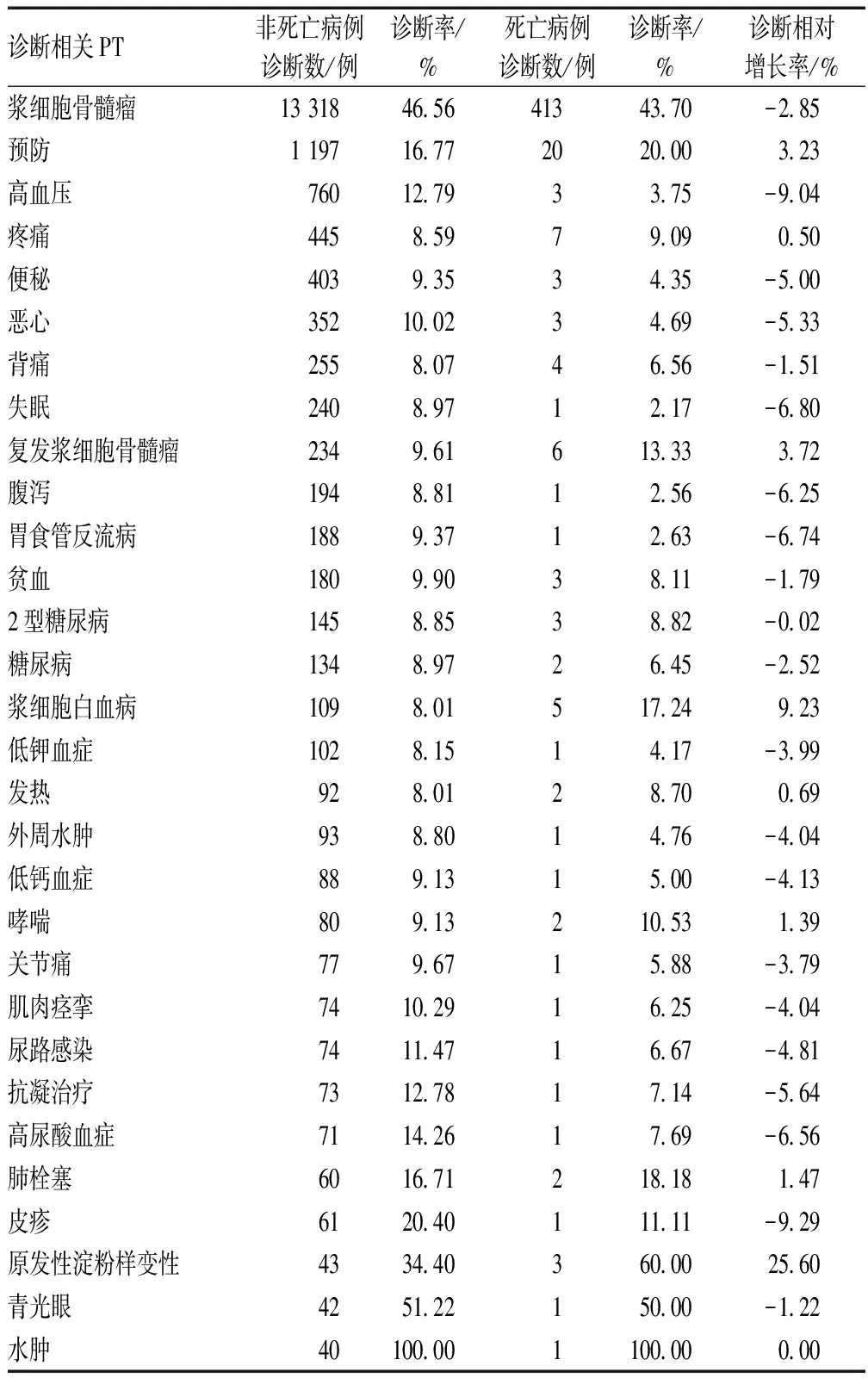
表5 适应证分析Tab 5 Analysis of indications
输注反应(IRR)是应用达雷妥尤单抗最常见的ADR之一,文献报道其发生率高达45.3%[8];1—2级IRR发生率为5%~47%,3级IRR发生率为0~10%,常见的IRR包括胸闷/呼吸困难(49%)、咳嗽(30%)、鼻塞/流涕(24%)、眼部不适(18%)和恶心/呕吐(18%)[9-12]。本研究中,排序居第1位的ADR为输液相关ADR,报告例数为1 695例,与上述文献结果一致,提示本研究结果相对可靠。达雷妥尤单抗属于外源性蛋白生物制剂,容易出现输液反应。有研究结果表明,输注达雷妥尤单抗前加用非甾体抗炎药、抗组胺药可减少IRR[13]。输注前可给予患者抗组胺药、退热药和皮质类固醇类药物进行预防,可选择首次输注孟鲁司特钠进行预防[14]。
达雷妥尤单抗对MM的疗效已得到公认,不管是单药还是联合用药方案。一项达雷妥尤单抗单药治疗MM患者的疗效和安全性Ⅰ/Ⅱ期的临床研究结果表明,患者对达雷妥尤单抗具有良好的耐受性,有2例出现Ⅲ级毒性(1例贫血及1例天冬氨酸转氨酶水平升高),且均未达到最大耐受剂量。一项采用达雷妥尤单抗+来那度胺+地塞米松(DRd方案)的临床研究结果表明,ADR主要表现为中性粒细胞减少、贫血及血小板减少[15]。一项研究在传统的三药联合方案(硼替佐米+环磷酰胺/阿霉素+地塞米松,对照组)的基础上加用达雷妥尤单抗(观察组),两组患者ADR发生率的差异无统计学意义(P>0.05),提示达雷妥尤单抗未增加ADR,患者耐受性良好;但贫血、血小板减少和中性粒细胞减少等血液学不良反应在两组患者中仍有较高比例[10]。本研究,中性粒细胞减少症、血小板减少症和贫血分别为735、611和521例,提示临床医师在使用达雷妥尤单抗时应注意上述ADR的发生和预防。
药品说明书中报道,达雷妥尤单抗可引起乙型肝炎病毒再激活[16]。一项研究结果显示,使用达雷妥尤单抗注射导致肝损伤、氨基转移酶升高[17]。达雷妥尤单抗引起的肝炎病毒再激活可能与抑制细胞免疫反应有关。肝炎病毒再激活可导致氨基转移酶异常。2项临床研究[18-19]没有报道乙型肝炎病毒的检测结果,上市后的研究[20]也没有阐明乙型肝炎病毒再激活和氨基转移酶异常的发生顺序。达雷妥尤单抗相关氨基转移酶异常的机制有待探索。危险因素可能包括自体干细胞移植、MM患者存在免疫抑制。达雷妥尤单抗等病毒激活药物可能促进乙型肝炎病毒的再激活,尤其是在乙型肝炎高发的我国,因此,为了患者和输血安全,患者应在达雷妥尤单抗治疗前后进行乙型肝炎五项标志物检测。当使用有肝炎病毒再激活风险的化疗药物时,如在前次化疗期间发生药物相关性肝损伤,再次暴露药物时应进行预防性肝保护[21]。达雷妥尤单抗致肝损伤、氨基转移酶升高的ADR较少,只有个别报道,在本次挖掘的数据库也未提及,可能由于FAERS系统是免费开放的数据库,数据来源较广,可能存在数据缺失和不规范的情况。
综上所述,本研究通过开放FAERS数据库对达雷妥尤单抗相关ADR进行信号挖掘,结果与药品说明书和文献报道基本一致。但本研究存在一定的局限性:(1)报告数据分析存在一定误差,有个别性别不清楚、年龄未知等不规范报告,对数据分析造成影响;(2)数据来源于欧美国家,与我国存在一定差距,但本研究为大样本的数据挖掘,可以为我国药物安全性探索提供方向。
