基于网络药理学和数据挖掘探讨中药调控铁死亡干预肝硬化的用药规律研究Δ
2024-01-18周佳林李文杰黄雪云李伟阁
周佳林,李文杰,黄雪云,刘 翔,饶 颖,李伟阁,戴 琦#
(1.广州中医药大学深圳医院(福田)肿瘤三科,广东 深圳 518000; 2.江西中医药大学研究生院,南昌 330000; 3.江西中医药大学附属医院肝胆科,南昌 330000)
2012年,Stockwell首次提出铁死亡为一种不同于细胞凋亡、自噬、焦亡的细胞死亡机制,铁死亡的发生机制主要是细胞内游离的Fe2+与H2O2发生反应生成Fe3+,使得不饱和脂肪酸发生脂质过氧化,最终介导细胞氧化损伤,促进细胞死亡[1]。铁死亡的特征表现为细胞内铁和活性氧(ROS)的大量堆积,以及谷胱甘肽过氧化物酶4(GPX4)的铁依赖性消耗和过度失活,产生过度氧化应激和膜脂质过氧化反应[2]。肝硬化是指由各种慢性肝病逐渐进展至以肝脏组织弥漫性纤维化、假小叶形成、肝内外毛细血管增生为特征的病理阶段[3]。肝硬化的发病和进展过程中受到多种细胞因子及信号通路的调控及影响。近年来,大量研究结果表明,铁死亡与肝纤维化、肝硬化密切相关。与正常肝脏相比,发展至肝硬化的肝脏细胞的铁离子水平和脂质过氧化水平显著升高,因此,铁死亡可能是肝硬化疾病治疗及预防的重要机制[4]。目前的科学研究已证实许多中药可以直接诱导肝星状细胞(HSC)铁死亡,以达到治疗肝纤维化的效果。如Wang等[5]研究了蒿甲醚可以促进HSC发生铁死亡,改善肝纤维化和肝硬化,延缓其进展速度。但是,很多中草药及其活性成分调控铁死亡的作用机制仍值得进一步研究。本研究借助网络药理学方法探讨肝硬化、铁死亡交集靶点与相关化合物、中药之间的关联,并借助分子对接技术验证化合物与靶蛋白的结合稳定性,以期为中药调控铁死亡干预铁死亡的实验研究、临床应用及药物研究提供理论依据。
1 资料与方法
1.1 铁死亡强相关靶点获取
通过FerrDb(http://www.zhounan.org/ferrdb/index.html)、GeneCards(https://www.genecards.org/)和GeneCLiP3(http://ci.smu.edu.cn/genclip3/analysis.php)数据库,以“Ferroptosis(铁死亡)”为关键词搜索,3个数据库获取的靶点合并后剔除重复项,得到铁死亡强相关靶点。
1.2 肝硬化疾病靶点获取
通过GeneCards(https://www.genecards.org/)和DisGeNET(https://www.disgenet.org/search)数据库,以“肝硬化”为关键词搜索,2个数据库获取的靶点合并后剔除重复项,得到肝硬化疾病靶点。
1.3 肝硬化中与铁死亡发生机制相关靶点及靶点的机制分析
将上述得到的铁死亡相关靶点与肝硬化疾病靶点映射,将映射成功靶点利用STRING数据库(https://www.string-db.org/)进行string分析,导入Cytoscape 3.7.2软件绘制蛋白质-蛋白质相互作用(PPI)网络,并通过network analyzer插件进行网络拓扑计算Degree值,选取Degree值≥2倍中位数的靶点,利用R语言x64 4.1.2软件对其靶点进行基因本体(GO)和京都基因与基因组百科全书(KEGG)可视化分析。
1.4 筛选候选化合物及构建靶点-化合物网络
将肝硬化铁死亡潜在靶点导入UniProt数据库(https://www.uniprot.org/)获取其uniprot号,再导入RCSB PDB数据库(https://www.rcsb.org/)获取靶点蛋白全称,将其输入中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php),以类药性(DL)≥0.18且口服生物利用度(OB)≥30%为筛选标准,获取靶点相关化合物和MOL ID等信息,将潜在靶点和候选活性成分导入Cytoscape 3.7.2软件构建靶点-化合物网络。
1.5 筛选候选中药及构建靶点-化合物-中药网络
利用TCMSP数据库筛选符合DL≥0.18且OB≥30%的化合物相关中药,并根据《中华人民共和国药典:一部》(2020年版)和《中药学》对候选中药进行规范,利用中医辅助传承平台V2.5对中药进行性味归经及功效分析,导入Cytoscape 3.7.2软件构建靶点-化合物-中药网络。
1.6 分子对接验证
为初步验证肝硬化铁死亡潜在靶点与候选化合物、候选中药的核心成分的结合活性,根据肝硬化铁死亡相关靶点的PPI网络、靶点-化合物网络及靶点-化合物-中药网络分析,选取PPI网络中Degree值排序居前3位的靶点、靶点化合物网络中Degree值排序居前3位的靶点与靶点化合物网络中Degree值排序居前3位的化合物、靶点-化合物-中药网络中Degree值较高且与肝硬化临床应用密切相关的3味中药的核心成分进行分子对接验证。通过RCSB PDB数据库(https://www.rcsb.org/)和Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)分别获取靶点蛋白和配体结构,运用AutoDockTools 15.7将靶点与化合物一一进行分子对接,并运用PyMol 2.4.0绘制对接模式图。
2 结果
2.1 肝硬化铁死亡相关靶点
通过数据库检索得到铁死亡强相关靶点319个,肝硬化疾病靶点9 735个,两者映射成功靶点即是肝硬化铁死亡相关靶点,共有225个靶点,导入Cytoscape 3.7.2软件并计算其Degree值,其中Degree值≥36(2倍中位数)共有47个靶点,见表1;绘制其PPI网络图,Degree值越大,颜色越深,表明其在肝硬化铁死亡发生机制中越重要,见图1。
2.2 肝硬化铁死亡潜在靶点机制分析
将肝硬化铁死亡相关靶点中Degree值≥36的47个靶点视为肝硬化铁死亡的潜在靶点,利用R语言x64 4.1.2软件对肝硬化铁死亡潜在靶点进行GO和KEGG可视化分析,见图2。肝硬化铁死亡潜在靶点GO富集分析结果提示,生物过程主要与内在凋亡信号通路、肽基丝氨酸修饰和细胞对化学应激的反应相关;细胞组成主要与膜筏、膜微域和囊腔相关;分子功能主要与磷酸酶结合、蛋白丝氨酸/苏氨酸激酶活性和丝裂原激活的蛋白激酶(MAPK)活性相关。KEGG富集分析结果显示,肿瘤坏死因子(TNF)信号通路、白细胞介素(IL)17信号通路、磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)信号通路、晚期糖基化终末产物(AGE)-AGE受体(RAGE)信号通路、人巨细胞病毒感染和癌症中的蛋白多糖等。
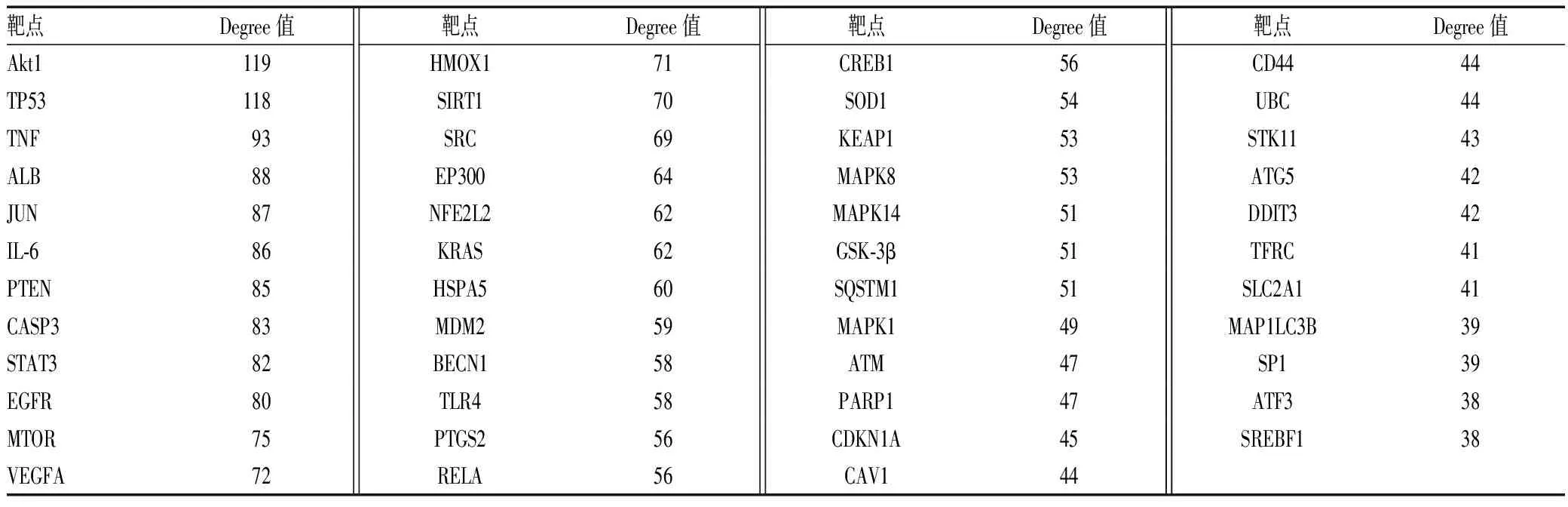
表1 肝硬化铁死亡相关靶点中Degree值≥36的靶点Tab 1 Targets with Degree value ≥36 associated with ferroptosis in liver cirrhosis

图1 肝硬化铁死亡相关靶点中Degree值≥36的靶点PPI网络图Fig 1 PPI network diagram of targets with Degree value ≥36 associated with ferroptosis in liver cirrhosis
2.3 构建靶点-化合物网络
将47个肝硬化铁死亡潜在靶点,通过TCMSP匹配到DL≥0.18且OB≥30%的靶点有21个,视为肝硬化铁死亡的核心靶点,共得到146个化合物,将其定义为肝硬化铁死亡的候选化合物,将肝硬化铁死亡的核心靶点和候选化合物导入Cytoscape 3.7.2软件构建靶点-化合物网络,见图3。图中共有167个节点,319条边,Degree值排序居前5位的靶点依次为糖原合成酶激酶3β(GSK-3β)、MAPK14、胱天蛋白酶3(CASP3)、TNF和肿瘤蛋白p53(TP53),分别与111、94、20、16和12个化合物相关,Degree值排序居前5位的化合物依次为槲皮素、木犀草素、汉黄芩素、漆黄素和雷公藤多苷,分别与13、11、9、9和9个靶点相关。
2.4 构建靶点-化合物-中药网络
将146个化合物通过TCMSP数据库筛选出319味中药,共有284味中药收录于《中华人民共和国药典:一部》(2020年版)、《中药学》中,将其定义为肝硬化铁死亡的候选中药,并将肝硬化铁死亡的核心靶点、候选化合物和候选中药导入Cytoscape 3.7.2软件构建靶点-化合物-中药网络,并筛选Degree值≥4的节点展示网络图,见图4。Degree值排序居前7位的中药依次为甘草(37)、鸡血藤(11)、苦参(9)、桑叶(9)、山豆根(9)、丹参(8)和黄芪(8)。
2.5 候选中药的性味归经及功效分析
将肝硬化铁死亡的候选中药导入中医辅助传承平台V2.5,统计分析候选中药的四气、五味、归经及功效的频次和频率,结果见图5。候选中药以寒性[频次109次(频率39.9%)]、苦味[157次(39.7%)]、入肝经[141次(22.3%)]、清热类[65次(32.7%)]、补虚类[33次(16.6%)]及活血化瘀类[25次(12.6%)]为主。
2.6 分子对接验证
将Akt1、TP53、TNF、GSK-3β、MAPK14和CASP3分别与槲皮素、山柰酚、木犀草素、黄芪甲苷、丹酚酸B和刺芒柄花素进行分子对接。结果显示,山柰酚与Akt1的结合能最大,为-6.1 kJ/mol;MAPK14与刺芒柄花素的结合能最小,为-10.2 kJ/mol;其中黄芪甲苷与GSK-3β、Akt1和丹酚酸B与TNF的对接过程均形成6个氢键数,提示其结合更稳定。详细对接结果见表2;选择部分分子对接结果进行展示,见图6。
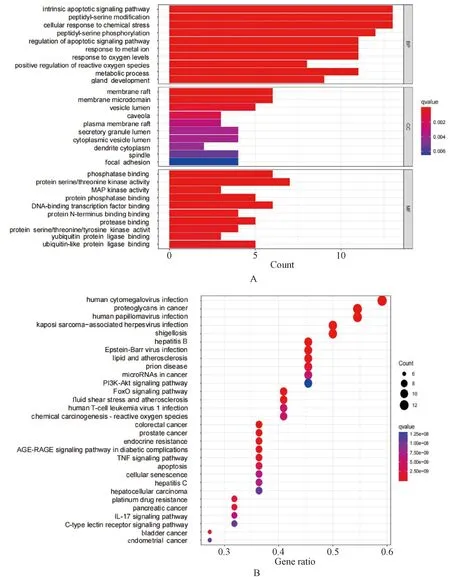
A.GO富集分析;B.KEGG富集分析(前30条)。A.GO enrichment analysis; B.KEGG enrichment analysis (top 30).图2 肝硬化铁死亡潜在靶点机制分析Fig 2 Mechanism analysis of potential target of ferroptosis in liver cirrhosis

橘色椭圆形为靶点、紫色长方形为化合物、绿色六边形为中药。The orange oval is the target, the purple rectangle is the compound, and the green hexagon is the traditional Chinese medicine.图4 肝硬化铁死亡潜在靶点的靶点-化合物-中药网络(Degree值≥4)Fig 4 Target-compound-traditional Chinese medicine network of potential targets of ferroptosis in liver cirrhosis (Degree value ≥4)
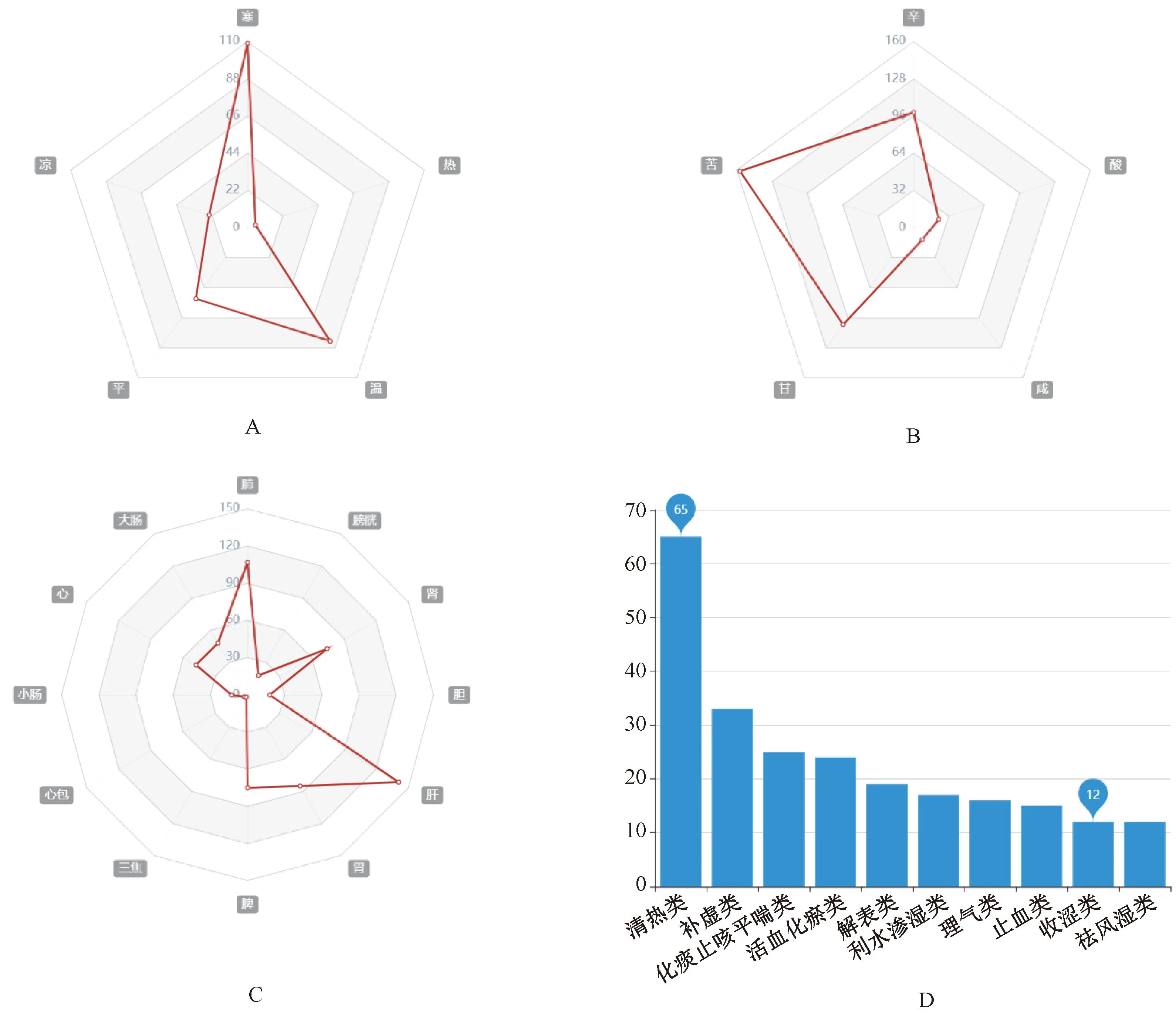
A.四气统计雷达图;B.五味统计雷达图;C.归经统计雷达图;D.功效统计。A.statistical radar chart of four Qi; B.statistical radar chart of the five flavor; C.statistical radar chart of the meridian transformation; D.efficacy statistics.图5 肝硬化铁死亡的候选中药的四气、五味、归经、功效统计分析Fig 5 Statistical analysis of the four Qi, five flavor, meridian transformation and efficacy of candidate TCM for ferroptosis in liver cirrhosis

表2 肝硬化铁死亡部分核心靶点与部分核心化合物分子对接结果Tab 2 Results of molecular docking between some core targets and some core compounds of ferroptosis in liver cirrhosis
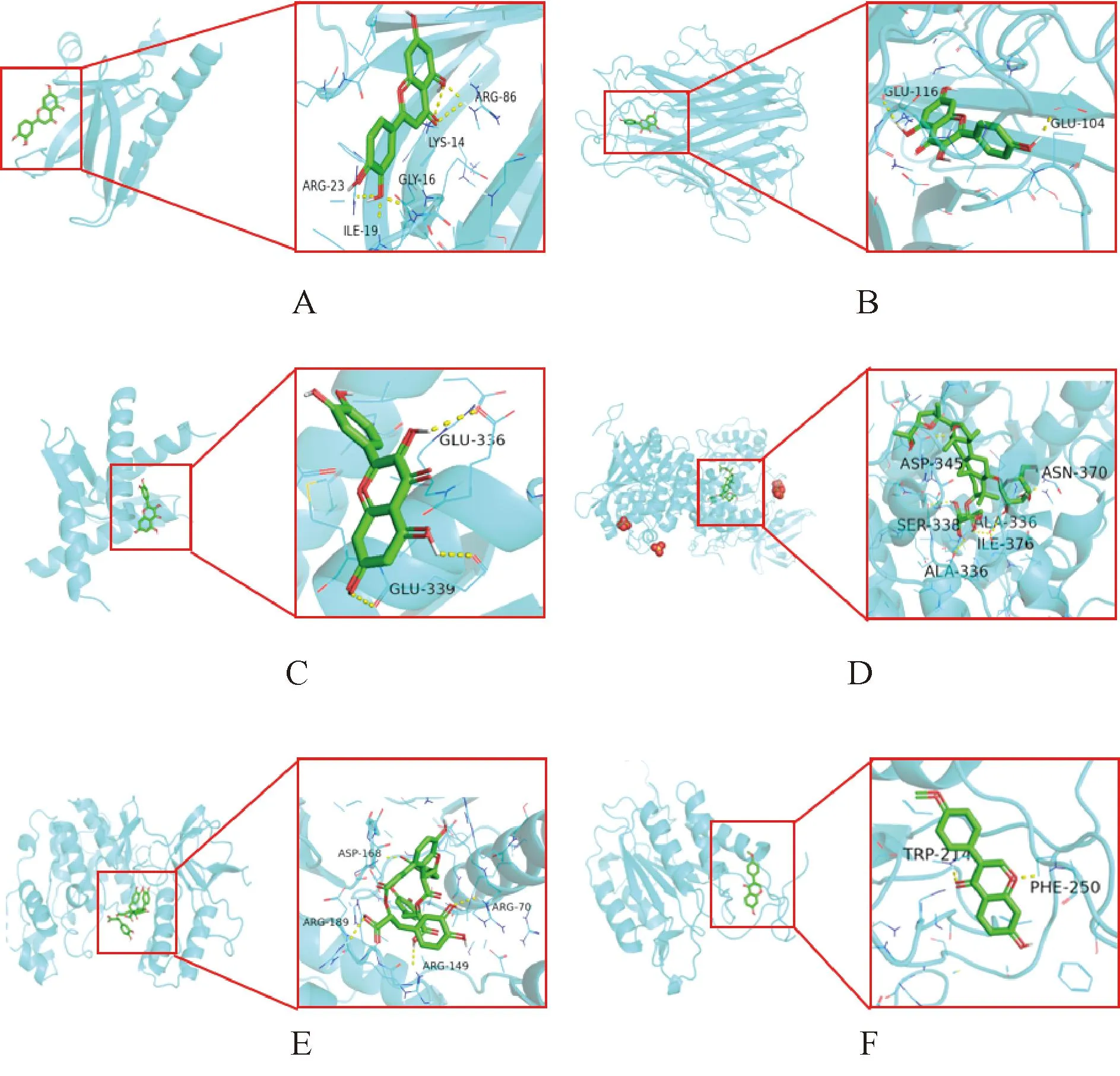
A.Akt1与木犀草素;B.TNF与山柰酚;C.TP53与槲皮素;D.GSK-3β与黄芪甲苷;E.MAPK14与丹酚酸;F.CASP3与刺芒柄花素;黄色虚线表示氢键。A.Akt1 and luteolin; B.TNF and kaempferol; C.TP53 and quercetin; D.GSK-3β and astragaloside; E.MAPK14 and salvianolic acid; F.CASP3 and onononin; the dashed yellow lines represent hydrogen bonds.图6 肝硬化铁死亡核心靶点与中药化合物的对接结果(部分)Fig 6 Docking results of core target of ferroptosis in liver cirrhosis and traditional Chinese medicine compounds (part)
3 讨论
肝硬化是肝纤维化的终末阶段,表现为假小叶的形成和血液循环的重新建立。研究结果表明,HSC有大量的铁离子,铁死亡机制可以调控铁离子代谢及脂质过氧化而改善肝纤维化、肝硬化[4]。
KEGG富集分析显示,肝硬化铁死亡的潜在靶点主要相关信号通路为TNF信号通路、IL-17信号通路和PI3K-Akt信号通路等。研究发现,加入铁死亡抑制剂(去铁胺)组血清的TNF-α含量明显低于不加去铁胺的模型组,其相关机制可能与Toll样受体4/核因子κB信号通路有关[6]。铁死亡与炎症之间是密不可分的,铁死亡是一种细胞调节性的程序性死亡,促进大量炎症因子产生,研究表明,铁死亡可能是炎症的诱导因素,抑制铁死亡可以减少炎症因子的生成和释放以及炎症细胞浸润[7]。TNF信号通路在炎症和氧化应激中发挥重要作用。TP53可以通过抑制乳腺癌中的溶质载体家族7成员11(SLC7A11)来增强铁死亡,但TP53通过在结直肠癌中以转录非依赖性方式阻断二肽基肽酶4活性来抑制Erastin诱导的铁死亡[8]。Erastin已经被研究证实为铁死亡的诱导剂,Erastin可以调控Th17细胞分化和IL-17信号通路,因此认为Erastin是通过调控IL-17信号通路以诱导铁死亡[9]。有研究证实布比卡因可以通过拮抗PI3K-Akt信号通路促进膀胱癌细胞铁死亡[10]。
本研究结果发现,肝硬化铁死亡相关中药主要有甘草、鸡血藤、苦参、桑叶、山豆根、丹参、黄芪、青蒿、降香、菊花、延胡索、半枝莲、马鞭草、败酱草、半边莲和大血藤等。其中黄芪、丹参和鸡血藤为国医名师陈崑山教授治疗肝纤维化和肝硬化的名方——益气活血利水汤的核心组成部分,也是临床上治疗肝硬化的常用药物。黄芪甲苷可能通过下调肿瘤蛋白53,上调铁蛋白重链1(FTH1)、SLC7A11和GPX4的mRNA及蛋白表达抑制棕榈酸诱导的肝脏巨噬细胞铁死亡,减轻小鼠肝脏巨噬细胞脂质沉积[11]。研究发现,丹酚酸B组的肾脏组织中核转录因子红系2相关因子2(Nrf2)、GPX4的mRNA和蛋白表达水平较模型组显著升高,铁死亡途径被抑制,氧化损伤及纤维化均被缓解;在丹酚酸B基础上添加Nrf2抑制剂,肾组织中Nrf2、GPX4的mRNA和蛋白水平降低,铁死亡增加;提示添加丹酚酸B后可能通过激活Nrf2-GPX4通路,抑制铁死亡,减轻氧化损伤,改善肾脏组织纤维化,进而实现对肾脏间质纤维化的改善作用[12]。研究结果表明,丹酚酸B抑制骨髓间充质干细胞铁死亡并能够显著提高骨髓间充质干细胞移植后的存活率及治疗急性肝衰竭的疗效[13]。鸡血藤乙醇提取物能显著缓解四氯化碳引起的小鼠急性肝损伤,能明显拮抗四氯化碳引起血清丙氨酸转氨酶、天冬氨酸转氨酶水平升高和肝组织超氧化物歧化酶、谷胱甘肽过氧化物酶活性降低,升高丙二醛水平,改善肝脏组织结构的变化[14];刺芒柄花素是鸡血藤的主要成分,鸡血藤提取物可抑制由二甲基亚硝胺诱导的肝纤维化肝细胞的增殖,抑制Ⅰ型胶原纤维合成,其作用机制可能与抑制转化生长因子β1/p38 MAPK信号通路活化有关[15]。
现代医家大多认为,肝硬化是由肝脾肾三脏功能失调,气滞、血瘀、水停瘀结腹中所致[16]。在肝硬化早期,肝脾先病,肝失疏泄,脾失健运,而致气滞血瘀,水湿内停,壅滞中焦。久则及肾,肾阳衰微则无以温熏脾土,肾阴亏虚则肝木失荣,肝脾俱疲,水湿血瘀亦甚。因此,气滞、血瘀、水停相因为患,病情日益加重。发展到肝硬化腹水,血不利则病水,便出现腹大胀满,甚则青筋暴露等表现[17]。国医名师陈崑山教授认为,黄芪在治疗肝硬化体虚明显、白蛋白水平很低的患者,其用量可增加至数百克,重在益气健脾,脾土得以敦实,即是“见肝之病,知肝传脾,当先实脾”的发挥,又寓“培土制水”之意,临床应用上能有效提高患者血清白蛋白水平[18];肝“主藏血”“体阴而用阳”,肝血即肝之阴,治疗肝病中,丹参与鸡血藤共用,既能活血又能补血,且临床应用上能有效改善肝内血管循环;“血为气之母,气为血之帅”,气是血液生成和推动的动力,血又是气的化生基础和载体,故黄芪能加强丹参、鸡血藤的去瘀生新之效,丹参、鸡血藤又能加固黄芪补气行滞生血之效,三者合用,共奏补气健脾、活血养血祛瘀之功。肝硬化的病理表现为细胞外基质的堆积、假小叶的形成、肝血窦结构和循环的重新建立,以至于肝脏的代谢、分泌、解毒等多种功能逐渐丧失,患者出现凝血、营养等障碍。铁死亡机制的核心在于过氧化脂质在肝内的堆积,肝硬化病理也体现在细胞外基质在肝内的大量堆积,从中医角度,可统一称为病理产物。痰饮、血瘀积聚于体内,可致气机失常,久则致脾失健化,肝失疏泄;病理产物的排泄又离不开脾的运化水湿痰饮和肝的疏泄功能,即气血的推动作用和濡养。
综上所述,本研究从肝硬化和铁死亡的靶点为出发点,得出Akt1、TP53、TNF、GSK-3β、MAPK14和CASP3等可能是肝硬化铁死亡的关键基因,有望成为治疗肝硬化的主要靶点;槲皮素、山柰酚、木犀草素、黄芪甲苷、丹酚酸B和刺芒柄花素等为治疗调控铁死亡肝硬化的重要化合物,可为治疗肝硬化的新药研发提供参考;黄芪、丹参和鸡血藤等是调控铁死亡治疗肝硬化的主要中药,可为中医药临床治疗肝硬化提供参考。
