昼夜节律基因与结直肠癌关系的研究进展*
2024-01-17张曼茹
张曼茹,赵 静,朱 华
[1扬州大学临床医学院(江苏省苏北人民医院)药学部,江苏 扬州 225001;2大连医科大学,辽宁 大连 116000]
昼夜节律(circadian rhythm)是生物体为适应地球自转所形成的周期约为24 h 的内源性计时系统[1]。生物钟基因调控昼夜节律的正常运行,在调节人体激素水平、免疫功能、睡眠、代谢等多种生理活动中发挥重要作用,同时还参与调控细胞增殖、分化和代谢等过程[2]。昼夜颠倒、睡眠和进食模式紊乱会干扰正常人体的昼夜节律系统,长期昼夜节律紊乱会诱发许多慢性疾病,并且也是肿瘤发生的重要致病因素之一[3]。结直肠癌(colorectal cancer,CRC)是胃肠道中常见的恶性肿瘤,全球发病率和死亡率均位于消化系统疾病的首位。多项研究表明,生物钟基因的异常表达会影响CRC 的进展和预后。因此,揭示生物钟基因对CRC 的分子调控机制可为寻找新的恶性肿瘤防治方法提供参考资料[4-6]。
1 生物钟系统及生物钟基因
哺乳动物生物钟系统包括中枢生物钟系统和外周生物钟系统两个部分[6],其中,中枢生物钟系统位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN),由中央振荡器、输入通路和输出通路3个要素组成[7]。SCN不仅参与自身的组织节律调节,还通过调节细胞周期、代谢、神经递质和内分泌等途径对外周生物钟系统产生影响[7-8]。外周生物钟系统存在于多个组织器官中,包括肝脏、肾脏和心脏等,与中枢生物钟系统共同维持昼夜节律并调节生物钟基因的特异性表达。此系统还参与营养物质的合成和代谢途径。据报道,哺乳动物组织中超过40%的蛋白质编码基因的RNA 在外周组织器官中呈现昼夜转录节律[9]。外部信号,如光源、热源等,通过中枢生物钟系统输入,影响生物体的昼夜节律。同时,情绪、激素分泌、代谢变化等机体内在因素也呈现出节律性变化,以适应不同的环境。这些变化在基因调控下进行,为生物钟基因的特异性表达奠定分子基础。
哺乳动物昼夜节律的调控因子包括:CLOCK(circadian locomotor output cycles kaput)基因、脑和肌肉组织芳香烃受体核转位因子样蛋白1(brain and muscle aryl hydrocarbon receptor nuclear translocatorlike protein 1,BMAL1)、period (PER)基 因 家 族(PER1、PER2和PER3)、隐花色素(cryptochrome,CRY)基因家族(CRY1和CRY2)、孤儿核受体REVERBα、视黄酸受体相关的孤儿受体α(retinoic acid receptor-related orphan receptor α,RORα)、酪蛋白激酶1ε(casein kinase 1ε,CK1ε)、CK1δ、神经元PAS 结构域蛋白2(neuronal PAS domain protein 2,NPAS2)和timeless (TIM)基因等。生物钟的正负反馈通路能够维持昼夜节律的稳定。其中,BMAL1 与CLOCK蛋白结合形成BMAL1/CLOCK 异二聚体,在白天转位进入细胞核中,并与PER、CRY等通过上游启动子E-box 元件结合,从而激活基因的转录和翻译。同时,细胞质中PER 蛋白和CRY 蛋白逐渐积累,在夜间达到临界值后由胞质转移到细胞核中,抑制BMAL1/CLOCK 二聚体介导的转录,发挥负性调控作用。经过磷酸化和泛素化后,体内大量积累的PER蛋白和CRY 蛋白被降解,进而消除它们对BMAL1和CLOCK 蛋白的负反馈抑制作用。BMAL1/CLOCK 异二聚体可重新积累并表达,从而启动新的昼夜节律周期[10]。BMAL1/CLOCK 二聚体还可激活REV-ERBs(α/β)/RORs(α/β/γ)基因的转录。在这个过程中,REV-ERBα和RORα相互竞争结合E-box 元件,分别抑制或激活BMAL1基因的表达,通过REV-ERB和ROR基因的辅助反馈回路来稳定昼夜节律。进一步研究显示,蛋白激酶CK1ε介导CK1δ的磷酸化作用,可以破坏PER 蛋白的结构,从而影响其功能。生物钟蛋白质的转录后调控可以使PER 蛋白的含量趋于正常水平,从而维持昼夜节律的有序运行[11]。
2 结直肠癌及其发病机制
CRC 是一种高度侵袭性的恶性肿瘤,包括结肠癌和直肠癌两大类,是常见的消化道恶性肿瘤之一,2018 年数据显示全球CRC 新发病例达180 万例,在各类癌症中的全球发病率居于第三位(10.2%),病死率居于第二位(9.2%)[12]。2020 年统计数据显示,CRC 已跃居消化系统癌症发病率与病死率首位,严重威胁人类生命健康[4]。CRC发病较为隐匿,约25%的CRC 患者初诊时即晚期,转移性CRC 患者五年内的存活率仅为12%,患者的1 年和5 年相对生存率分别为83.4%和64.9%[13]。CRC 的发病机制高度复杂和多样化,具有散发性、家族性和遗传性的特点。散发性病例约占全部病例的70%,受环境和饮食因素(吸烟、过度饮酒、久坐、肥胖及高脂肪低纤维饮食)影响,家族性CRC病例仅占总病例的25%左右,遗传性病例占比较小,仅为5%[14]。
CRC 发展进程较为复杂,由结肠上皮细胞和周围微环境中积累的遗传修饰共同驱动[15]。肿瘤发生的第一阶段是形成肠道病变,即腺瘤性息肉病,机体内癌基因KRAS和P53突变导致健康上皮细胞转变为腺瘤,具有很高的癌变几率。CRC 形成的其中一种途径是基因突变促进癌变进程。CRC 中常见Wnt/β-联蛋白(β-catenin)信号通路失调,导致β-catenin积累,引起多个基因靶点激活[16],促进癌变表型突变发展为致癌基因,肿瘤抑制基因APC基因突变是大多数散发性CRC 的关键起始条件[17-18];另一种途径是启动子CpG 岛(CpG island,CGI)的DNA 甲基化水平异常,CGI DNA 甲基化是一种在正常细胞过程中抑制基因转录的表观遗传机制,在许多肿瘤中通常会异常表达导致CRC的发展[19]。CRC主要的病理途径亚组包括:染色体不稳定性(chromosomal instability,CIN)、微卫星不稳定性(microsatellite instability,MSI)和CGI 甲基化表型(CGI methylator phenotype,CIMP)[20]。CIN 约占所有CRC 病例的85%,染色体稳定性受到破坏引起细胞遗传学变化,APC、P53和KRAS等基因发生突变,是癌症发展的主要推进因素[21]。MSI 是由DNA 错配修复基因如MLH1(MutL homolog 1)、MSH2(MutS homolog 2)、MSH6和PMS2的DNA 错配修复缺陷后微卫星变化所导致的,对MSI 进行检测可以判断高危患者的预后情况[22]。CIMP是一种基于某些肿瘤抑制基因启动子区的CGI高甲基化而导致癌基因异常表达的途径。此外,CIMP 还被证明对非转移性CRC 患者有预后价值[23]。多数CRC 病例表现为CIN 途径,其特点是广泛的杂合子缺失和染色体异常,这构成了CRC 发病机制的复杂性。
目前,CRC 主要采用化疗、手术及靶向治疗等综合措施。化疗药物通过干预肿瘤细胞的增殖及阻碍肿瘤细胞的DNA、RNA 及蛋白质合成,发挥治疗作用。靶向治疗主要应用于晚期转移性CRC 的患者,可以延长患者的生存周期。然而,肠癌干细胞是导致肿瘤复发、耐药及转移的关键因素,因此根除肠癌干细胞是目前CRC治疗的重要方向之一[24]。
3 生物钟基因异常与结直肠癌的关系
研究显示,节律紊乱与心脏病、糖尿病、高血压、脂肪肝等疾病有关,并且参与了人类恶性肿瘤如乳腺癌[3]、肺癌[1]、卵巢癌[25]、前列腺癌[26]、CRC[27]、子宫内膜癌[28]、肝癌[29]和肾癌[30]等的致病过程。流行病学研究表明,基于CRC患者的生活方式调查,CRC的发病率与现代人的生活作息方式紧密联系。长时间在人造光下工作、熬夜、夜班等生活环境会导致人体内源性节律紊乱,增加患病风险[31]。生物钟基因通过调节细胞周期调节基因、癌基因等基因表达以及组织代谢、DNA 损伤、凋亡等细胞功能来维持生物体内细胞正常代谢过程。临床数据表明,PER、BMAL1、CLOCK、CRY和TIM等生物钟基因的异常表达和突变会增加CRC 发病率、肿瘤细胞增殖速度和转移能力,影响肿瘤细胞对化疗药物的敏感性和预后,这些基因可作为肿瘤的潜在诊断标志物[32-34]。
3.1PER生物钟基因PER基因家族包含PER1、PER2和PER3,是最早被分析和鉴定出DNA 序列的生物钟基因[35]。PER基因通过抑制基质金属蛋白酶抑制肿瘤转移,与健康黏膜相比,肿瘤组织及CRC肝转移病灶中PER的表达下调[36-37],表明PER基因在CRC 中可能作为肝转移的预测指标。抑癌基因P53与生物钟基因PER2的启动子E-box 序列有部分重合,因此生物节律紊乱后P53可通过占用PER2的Ebox 位点抑制PER2的表达,P53由细胞质转移到核内,胞质中可发挥调控作用的P53数量降低,对肿瘤抑制作用减弱,进而影响CRC 上皮-间充质转化(epithelial-mesenchymal transition,EMT)[38]。PER1过表达加剧DNA 损伤从而诱导细胞凋亡[39],当CRC 患者血液中部分PER发生甲基化后,CRC 发生前体病变至结直肠腺瘤[40],推进肿瘤发展进程。检测CRC 组织样本中PER基因表达水平并对Wnt 和TGF-β 通路激活的肿瘤组织中昼夜节律标志物进行富集分析,结果显示PER在癌组织与癌旁组织中的表达降低且IV 期比例更高[41-42]。β-catenin 是Wnt 通路的主要信号传感器,Wnt/β-catenin 信号通路失调促进细胞增殖及侵袭,诱导PER2突变并抑制表达,肠壁组织中β-catenin 含量升高,促进结肠息肉的形成[43]。对肿瘤组织中17种miRNA进行分析并筛选出miR-34a与PER2相互调节作用,实时荧光PCR 结果显示miR-34a 的低表达激活Wnt/β-catenin 信号通路,引发PER2表达上调[44-45]。PER3的过表达抑制Notch 和β-catenin 蛋白信号传导途径降低CRC 干细胞生长能力及抗药性,也印证了PER3在维持结直肠肿瘤干细胞干性中发挥作用[46]。
3.2BMAL1生物钟基因BMAL1作为哺乳动物昼夜节律的重要基因之一,调控昼夜节律的正反馈环节。体外敲除BMAL1通过调节HIF-1α/VEGF 信号通路增加CRC 细胞对放疗的敏感性,相反过表达的BMAL1会增加CRC细胞对化疗药物如奥沙利铂的敏感性[47-48]。BMAL1通过阻断PI3K-AKT-MMP-3 通路抑制肿瘤细胞入侵及EMT[49],CRC 细胞中BMAL1表达显著降低,增加细胞株增殖速度和小鼠体内移植瘤的生长速度,G1/M期调节因子细胞周期蛋白B1同样会受到抑制,导致细胞周期延长,抑制肿瘤细胞凋亡[50-51]。体外敲低BMAL1对AKT/mTOR 活化影响程度相同,对P53的影响因为CRC 不同的病理情况(野生型P53,部分功能性突变型P53及突变型P53)而不同[52]。BMAL1的异常表达促进糖酵解基因HKDC1表达并增强其活性,同时驱动APC基因杂合性缺失从而激活Wnt信号通路,上调c-Myc靶点驱动糖酵解的代谢活性增强[8]。与单独破坏APC相比,肠道APC和BMAL1基因的缺失会显著增加息肉的形成,从而加速CRC的发展[53]。
3.3CRY生物钟基因CRY是生物钟节律调控中的负反馈调节基因之一,由植物光解酶结构的研究过程中检测出,虽然哺乳动物体内没有感知光线的功能,但仍然参与调控昼夜节律及细胞组织的代谢。肿瘤细胞转移与侵袭过程中糖酵解是重要的一环,miR-181d 直接作用于CRY3和FBXL2稳定c-Myc的表达,敲低miR-181d 通过抑制糖酵解活性来抑制CRC 细胞的生长及转移浸润[54]。CRY1和CRY2的缺失使WEE1 水平升高,延长细胞周期的M 期,CRC 细胞的增殖速度加快,推进肿瘤的发生进程[55]。另外,50 例CRC 及癌旁组织基因表达的qPCR 结果分析显示CRC组织中CRY1和CRY2的mRNA 水平均低于正常组织,且在60~74 岁患者横结肠部位高发[32]。CRY1在CRC 组织中的异常表达促使癌细胞的增殖与迁移,与淋巴结转移TNM 分期及CRC 患者不良预后有关,CRY可能会成为CRC 的治疗靶点及治疗预后的判断标准[56]。
3.4CLOCK生物钟基因CLOCK基因在生物钟节律调控中扮演着正向调控的角色。CLOCK/BMAL1复合物结合到E-box上,进而促进PER和CRY基因的转录[57]。此外,它还抑制了癌基因c-myc启动子的Ebox 转录活性,从而导致细胞周期在G0/G1期间延长。肿瘤组织中新生血管与癌症的发展进程及肿瘤组织的转移能力有关,CLOCK通过增强血管内皮生长因子VEGF 的表达促进CRC 细胞发生EMT[58]。通过细胞迁移模型及肿瘤转移模型检测出CRC 细胞中CLOCK的mRNA 及蛋白水平越高,CRC 细胞的转移能力越强,相比于癌旁组织TNM 晚期和淋巴结转移阳性病例数量越多[59]。CLOCK基因在体内和体外上调增加抗凋亡基因AKT活性,抑制促凋亡基因Bcl-2表达,从而促进CRC 细胞系SW480 增殖并抑制细胞凋亡[60],且肿瘤组织浸润程度越深,分期更晚[33]。
3.5TIM生物钟基因 与上述几个生物钟基因相比,TIM的研究相对较晚,生物体内H3K27 乙酰化激活生物钟基因TIM,TIM与肌球蛋白-9结合可以进一步激活β-catenin 信号通路,增加β-catenin 下游蛋白周期蛋白D1的表达水平,从而促进CRC 的发生发展及淋巴结的转移[61]。TIM表达缺失促进细胞分化迁移基因ZEB1表达,诱导CRC 发生ETM 并增强侵袭转移能力[62]。CRC中TIM的表达失调影响DNA损伤标志物γH2AX 的合成,激活CHK2 和CDK1 磷酸化诱导细胞生长周期的G2/M 期停延长,促进恶性肿瘤的发展进程[63]。
其他生物钟基因如REV-ERB、NPAS2等与CRC的发病及转移也有一定的影响。作为转录抑制因子的REV-ERBα 在生物节律上的调控作用比REVERBβ 更为显著,REV-ERBα 的异常表达增加P53 的活化程度,靶向诱导肿瘤细胞的凋亡而对正常的细胞无影响,REV-ERBα 在化学诱导的CRC 模型中表达显著降低[51]。肠道菌群的微生物可以通过REVERBα 来调控肠道上皮的昼夜节律促进NFIL3 表达和调节肠道上皮细胞的脂质代谢与吸收。菌群平衡破坏或感染幽门螺杆菌及大肠感菌等其他菌属会增加CRC 的风险,大肠杆菌及其代谢物抑制NFIL3 表达,促进CRC细胞生长并增加对化疗药物的抗性[64]。NPAS2的低表达促进CRC患者癌细胞生长及加速淋巴结转移进程,相反NPAS2 高表达患者5 年内生存率较高,检测NPAS2 对CRC 患者预后具有指向性预测价值[65]。
4 时辰化疗与结直肠癌的关系
事实上,在深入了解生物钟分子机制之前,就有研究尝试对患者进行药物时间疗法。20 世纪60 年代,研究者们发现早餐服用糖皮质激素对哮喘患者有明显的临床疗效。此后的研究表明,吸入类固醇在每天15:00~17:30 的时段内使用,可能是最佳的时间窗[66]。时辰化疗是一种新型的药物治疗手段。它在一天中特定的时段内使用抗癌药物,以避开正常组织的放射敏感期,从而获得最大的疗效和最小的副作用。这种治疗方式基于生物钟节律的原理,针对肿瘤组织的药物选择是根据正常组织、肿瘤组织及药物代谢的昼夜节律来进行的。此外,研究表明内毒素和抗肿瘤药物环磷酰胺的毒性也呈现昼夜节律模式[67]。
CRC 临床上常用5-氟尿嘧啶、奥沙利铂及伊立替康等药物,并采用多线化疗和应用一些新药来延长患者的生存时间。时辰化疗对CRC的治疗同样有效,5-氟尿嘧啶、亚叶酸钙和奥沙利铂的时辰化疗(chronoFLO4)与常规化疗患者的体内用药时间不同,昼夜节律紊乱后带来的疾病预后情况的严重程度对时辰疗法的影响会更大[68]。在伊立替康、5-氟尿嘧啶-亚叶酸和奥沙利铂3种药物联合的时辰治疗方案(chronoIFLO)中,伊立替康的毒性与耐受性与时间有关,并通过伊立替康的给药时间数学模型结合患者的药理学模型验证了时间疗法的低毒副作用[69],小鼠实验中奥沙利铂的毒副作用在时间和性别因素上存在差异[70]。基于昼夜节律调节下的伊立替康-奥沙利铂-5-氟尿嘧啶联合治疗方案(chronoIFLO5)中,每3 周给予患者5 d 给药,通过3~4 级毒性率、最佳客观反应率、无进展生存时间和总生存期等指标来验证疗效,此疗法具有良好的抗肿瘤疗效和良好的安全性[71]。表明在肿瘤患者中个体化应用时辰化疗法有效增加药物疗效及延长患者生存期。
调节生物钟基因对于化疗的疗效同样有一定的影响。例如,CRC 的慢性化疗常使用5-氟尿嘧啶,其嘧啶代谢途径中涉及的UPP2、UCK2和UMPS等基因的紊乱会影响CRC 细胞中5-氟尿嘧啶的疗效。生物钟基因BMAL1可以通过占用E-box 启动子区域干扰嘧啶代谢基因的表达和关键酶活性,从而维持5-氟尿嘧啶在CRC 治疗中的疗效[72]。PER3在CRC 中的过表达增强了CRC 细胞中氟尿嘧啶的敏感性,表明生物钟基因可能作为肿瘤时间疗法的靶点之一[46]。因此,现有证据初步显示相比于常规化疗时辰化疗具有提高疗效,延长患者生存时间的潜力。鉴于CRC 晚期患者生物钟节律异常等情况,根据不同患者制定个体化的时辰治疗方案有助于充分发挥药效并降低不良反应发生率。
5 总结与展望
作为一种发病率和致死率较高的消化道实体瘤,CRC 的发病机制相对复杂,目前确切的分子机制尚不十分清楚。越来越多研究表明,生物钟基因在CRC 中发挥着重要作用(如图1 所示)。生物钟节律信号分子的变化可能与CRC 的发生有关,同时影响肿瘤细胞的表型、转移、患者的化疗反应和生存期等。因此,明确生物钟基因在CRC中的作用和机制,通过调节昼夜节律提高CRC的防治效果并延长患者生存时间具有重要意义。
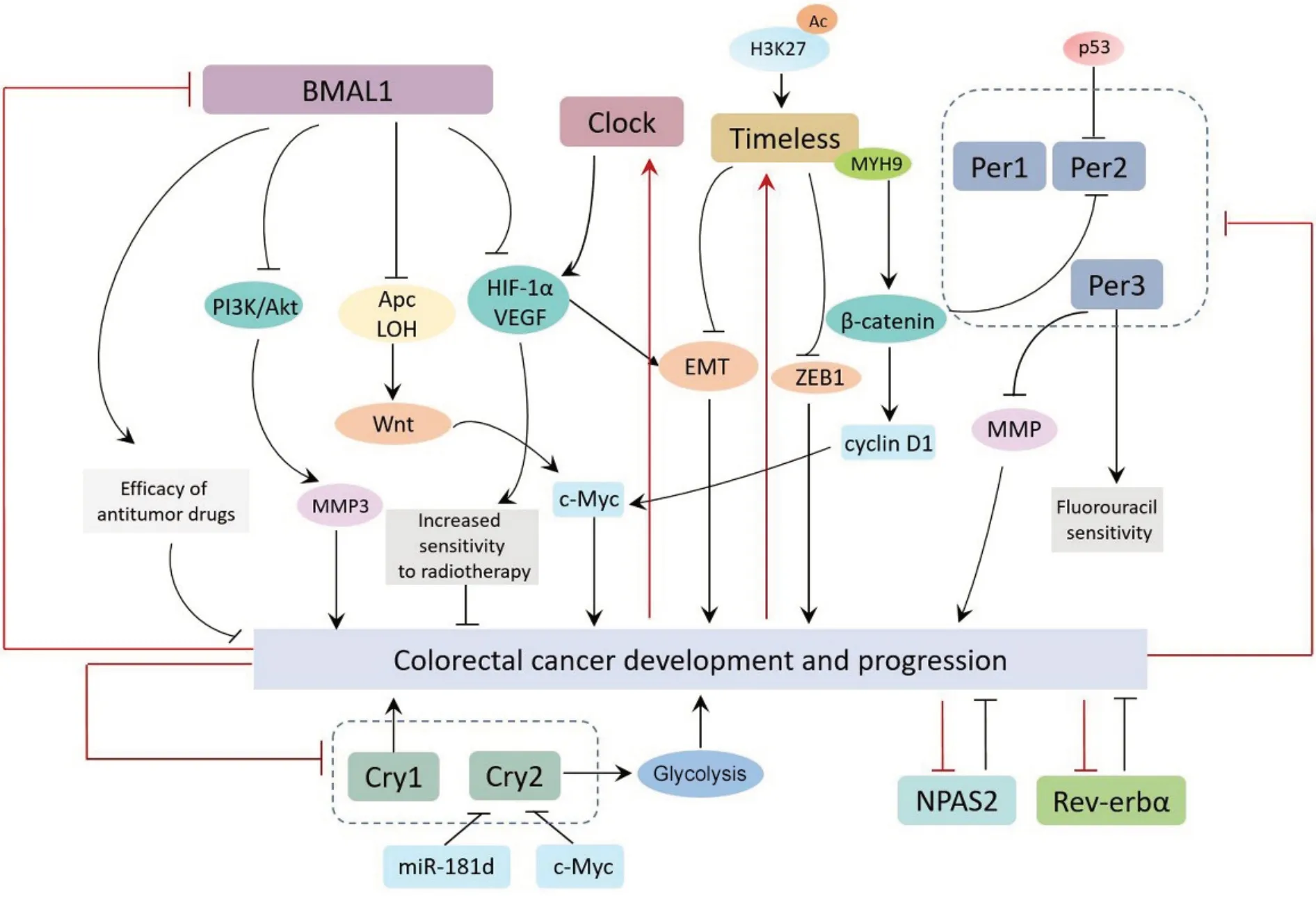
Figure 1. The correlation between genes involved in circadian rhythm and colorectalcancer (CRC). The red arrow indicates the impact of CRC on clock genes. Meanwhile,the black arrow illustrates the regulatory effect of clock genes on CRC and their mechanism.图1 昼夜节律基因与结直肠癌的关系
时辰化疗是调节昼夜节律和生物钟基因在CRC 治疗中的一种新型应用方法,为传统肿瘤治疗研究开辟了新的方向。现有证据显示时辰化疗可在一定程度上减轻化疗药物引起的毒副反应,提高化疗效果。然而,时辰化疗在临床应用中也存在一些问题和局限性。首先,时辰化疗需要严格的服药时间安排和血药浓度监测,需要患者配合度高,一些患者可能无法保证严格按时服药,从而影响疗效。其次,时辰化疗对于不同类型的肿瘤和化疗药物的效果和安全性尚不清楚,需要进一步研究筛选适合时辰化疗的患者和药物类型。此外,时辰化疗也需要考虑到个体化治疗的影响,不同患者的生理时钟和代谢特点可能会影响药物的代谢和毒性表现,因此需要建立个体化的时辰化疗管理方案。总之,时辰化疗作为一种有潜力的肿瘤治疗方法,需要深入研究。
